Diferencia entre revisiones de «Reactivo de Gilman»
m Bot: corrigiendo uso de conjunciones. ¿Algún error? http://lema.rae.es/dpd/srv/search?id=7wb3ECfmhD6reWjGRa |
|||
| (No se muestran 3 ediciones intermedias de 3 usuarios) | |||
| Línea 3: | Línea 3: | ||
== Síntesis == |
== Síntesis == |
||
Se preparan, |
Se preparan, dada su inestabilidad, por [[transmetalación]] a partir de un reactivo [[compuesto de organolitio|organolítico]] y una [[Sal (química)|sal]] cuprosa (cobre(I)): |
||
:RLi + CuX → RCu + LiX |
:RLi + CuX → RCu + LiX |
||
| Línea 15: | Línea 15: | ||
* Creación de enlaces C-C mediante procesos de sustitución. Por ejemplo, sustitución del átomo de [[halógeno]] por el grupo R en [[organohalógeno]]s: |
* Creación de enlaces C-C mediante procesos de sustitución. Por ejemplo, sustitución del átomo de [[halógeno]] por el grupo R en [[organohalógeno]]s: |
||
:R<sub>2</sub>CuLi + 2 R'X → R-R' + CuX + LiX |
:R<sub>2</sub>CuLi + 2 R'X → 2 R-R' + CuX + LiX |
||
donde R' puede ser un alquilo, un vinilo o un arilo. |
donde R' puede ser un alquilo, un vinilo o un arilo. |
||
* Sustitución S<sub>N</sub>2' formal sobre [[Sustrato (química)|sustratos]] [[Grupo alilo|alílicos]]. |
* Sustitución S<sub>N</sub>2' formal sobre [[Sustrato (química)|sustratos]] [[Grupo alilo|alílicos]]. |
||
| Línea 23: | Línea 23: | ||
* [[Adición conjugada|Adiciones conjugadas]], sobre aldehídos, cetonas y ésteres α,β-insaturados, y [[ciclopropano]]s activados ([[electrófilo]]s). |
* [[Adición conjugada|Adiciones conjugadas]], sobre aldehídos, cetonas y ésteres α,β-insaturados, y [[ciclopropano]]s activados ([[electrófilo]]s). |
||
[[ |
[[Archivo:1,4-Addition (Cuprat).svg|centrado|300px|Adición 1,4 de un dialquilcuprato de litio a una [[enona]]]] |
||
A menudo sólo reacciona un grupo orgánico R por cada molécula de diorganocuprato de litio. En estos casos, si el reactivo de partida es valioso, se recurre a cupratos mixtos R<sub>T</sub>R<sub>R</sub>CuLi, de tal forma que sólo se transfiere el grupo R<sub>T</sub> que nos interesa, sin desaprovechar reactivo de partida, mientras que el grupo R<sub>R</sub> queda retenido de forma selectiva, ya que interacciona fuertemente con el átomo de cobre. El grupo R<sub>R</sub> puede ser, por ejemplo, CN<sup>−</sup>, Ph-S<sup>−</sup>, R-C≡C<sup>−</sup>, <sup>t</sup>BuO<sup>−</sup>, etc. No todos presentan la misma selectividad, y reactividad, ante distintos sustratos, siendo según el caso unos más adecuados que otros. |
A menudo sólo reacciona un grupo orgánico R por cada molécula de diorganocuprato de litio. En estos casos, si el reactivo de partida es valioso, se recurre a cupratos mixtos R<sub>T</sub>R<sub>R</sub>CuLi, de tal forma que sólo se transfiere el grupo R<sub>T</sub> que nos interesa, sin desaprovechar reactivo de partida, mientras que el grupo R<sub>R</sub> queda retenido de forma selectiva, ya que interacciona fuertemente con el átomo de cobre. El grupo R<sub>R</sub> puede ser, por ejemplo, CN<sup>−</sup>, Ph-S<sup>−</sup>, R-C≡C<sup>−</sup>, <sup>t</sup>BuO<sup>−</sup>, etc. No todos presentan la misma selectividad, y reactividad, ante distintos sustratos, siendo según el caso unos más adecuados que otros. |
||
| Línea 42: | Línea 42: | ||
* [[Organolitio|Compuestos organolíticos]] |
* [[Organolitio|Compuestos organolíticos]] |
||
{{Control de autoridades}} |
|||
[[Categoría:Compuestos organometálicos]] |
[[Categoría:Compuestos organometálicos]] |
||
[[Categoría:Compuestos de litio]] |
[[Categoría:Compuestos de litio]] |
||
Revisión actual - 17:53 25 oct 2021
Un reactivo de Gilman, o diorganocuprato de litio, es un compuesto organocúprico de fórmula R2CuLi, donde R puede ser un alquilo, un vinilo o un arilo. Recibe su nombre por el químico estadounidense Henry Gilman.
Síntesis
[editar]Se preparan, dada su inestabilidad, por transmetalación a partir de un reactivo organolítico y una sal cuprosa (cobre(I)):
- RLi + CuX → RCu + LiX
- RCu + RLi → R2CuLi
Aplicaciones
[editar]Tienen aplicaciones en síntesis orgánica. No son básicos y toleran la presencia de los grupos hidroxilo y carboxilo, además de no reaccionar tampoco ni con cetonas ni ésteres, aunque sí lo hacen con el grupo carbonilo de aldehídos no conjugados. Su reactividad consiste en:
- Creación de enlaces C-C mediante procesos de sustitución. Por ejemplo, sustitución del átomo de halógeno por el grupo R en organohalógenos:
- R2CuLi + 2 R'X → 2 R-R' + CuX + LiX
donde R' puede ser un alquilo, un vinilo o un arilo.
- R2CuLi + 2 CH2=CH-CH2X → 2 R-CH2-CH=CH2 + CuX + LiX
- Apertura de epóxidos, para dar alcoholes.
- Sustitución nucleófila acílica sobre haluros de acilo para dar cetonas.
- Adiciones conjugadas, sobre aldehídos, cetonas y ésteres α,β-insaturados, y ciclopropanos activados (electrófilos).
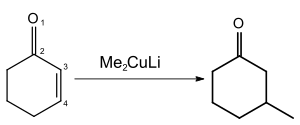
A menudo sólo reacciona un grupo orgánico R por cada molécula de diorganocuprato de litio. En estos casos, si el reactivo de partida es valioso, se recurre a cupratos mixtos RTRRCuLi, de tal forma que sólo se transfiere el grupo RT que nos interesa, sin desaprovechar reactivo de partida, mientras que el grupo RR queda retenido de forma selectiva, ya que interacciona fuertemente con el átomo de cobre. El grupo RR puede ser, por ejemplo, CN−, Ph-S−, R-C≡C−, tBuO−, etc. No todos presentan la misma selectividad, y reactividad, ante distintos sustratos, siendo según el caso unos más adecuados que otros.
Bibliografía
[editar]- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.
