Diferencia entre revisiones de «Fluoruro de bismuto(V)»
Sin resumen de edición |
m (Bot) Correcciones de estilo en grados (temperatura) |
||
| (No se muestran 9 ediciones intermedias de 3 usuarios) | |||
| Línea 1: | Línea 1: | ||
{{Ficha de compuesto químico|imagen=Bismuth-pentafluoride-chains-from-xtal-1971-3D-balls.png|imagen2=Bismuth-pentafluoride-chains-from-xtal-1971-3D-SF.png|otros nombres=Pentafluoruro de bismuto|fórmula3=BIF<sub>5</sub>}} |
|||
{{Referencias|t=20181214033139}} |
|||
'''El Fluoruro de bismuto(V)''' o '''Pentafluoruro de bismuto''' es un [[Compuesto inorgánico|compuesto inorgánico de]] fórmula BiF<sub>5</sub> . Es un sólido blanco altamente reactivo. El compuesto es de interés para los investigadores pero no tiene un valor particular. |
|||
== |
== Estructura == |
||
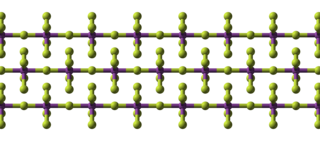
BiF<sub>5</sub> es polimérico y consta de cadenas lineales de esquinas con puentes ''trans que'' comparten octaedros BiF<sub>6.</sub><ref>{{Cita publicación|título=Zur Kristallstruktur von Wismutpentafluorid|apellidos=C. Hebecker|publicación=[[Zeitschrift für anorganische und allgemeine Chemie|Z. anorg. allg. Chem.]]|volumen=384|número=2|páginas=111–114|doi=10.1002/zaac.19713840204|año=1971}}</ref> Esta es la misma estructura que <nowiki><i id="mwKQ">α</i></nowiki>-UF<nowiki><sub id="mwKg">5</sub></nowiki>. |
|||
El fluoruro de bismuto(V) es un sólido [[Grado de cristalización|cristalino]] blanco. Es un [[Oxidante|agente oxidante]] y fluorizante extremadamente fuerte, algo que añade iones de fluoruro a otras sustancias químicas. Reacciona con el agua para producir [[ozono]] y [[difluoruro de oxígeno]]. También reacciona con el [[yodo]] y el [[azufre]] a temperatura ambiente. Por encima de los 50°C, reacciona con [[Hidrocarburo|hidrocarburos]] como la [[parafina]] para producir fluorocarbonos. A 180°C, reacciona con el cloro para producir [[Chlorine monofluoride|monofluoruro de cloro]] y con el bromo para producir [[trifluoruro de bromo]]. |
|||
{| class="wikitable" style="margin:1em auto; text-align:center;" |
|||
|[[File:Bismuth-pentafluoride-chain-from-xtal-1971-3D-balls.png|300x300px]]<br /><br />[[File:Bismuth-pentafluoride-chain-from-xtal-1971-3D-SF.png|300x300px]] |
|||
|[[File:Bismuth-pentafluoride-chain-packing-from-xtal-1971-3D-balls.png|150x150px]][[File:Bismuth-pentafluoride-chain-packing-from-xtal-1971-3D-SF.png|150x150px]] |
|||
|- |
|||
| Cadena (BiF<sub>5</sub>)<sub>∞</sub> |
|||
| Embalaje de cadenas |
|||
|} |
|||
== Preparación == |
== Preparación == |
||
BiF<sub>5</sub> se puede preparar tratando [[Fluoruro de bismuto(III)|BiF<sub>3</sub>]] con [[Diflúor|F<sub>2</sub>]] a 500 °C. |
|||
Se fabrica reaccionando el [[Fluoruro de bismuto(III)|fluoruro de bismuto (III)]] con [[flúor]] a altas temperaturas. También se fabrica reaccionando el fluoruro de bismuto(III) con [[trifluoruro de cloro]]. |
|||
: BiF<sub>3</sub> + F<sub>2</sub> → BiF<sub>5</sub> |
|||
== Usos == |
|||
Se utiliza como agente fluorizante. |
|||
En una síntesis alternativa, [[Trifluoruro de cloro|ClF<sub>3</sub>]] es el agente fluorante a 350 °C.<ref>{{Cita publicación|título=Synthesis and properties of pentavalent antimony and bismuth fluorides|apellidos=A. I. Popov|apellidos2=A. V. Scharabarin|publicación=Z. Anorg. Allg. Chem.|volumen=576|número=1|páginas=242–254|doi=10.1002/zaac.19895760128|apellidos3=V. F. Sukhoverkhov|apellidos4=N. A. Tchumaevsky|año=1989}}</ref> |
|||
== Véase también == |
|||
: BiF<sub>3</sub> + ClF<sub>3</sub> → BiF<sub>5</sub> + [[Monofluoruro de cloro|ClF]] |
|||
* [[Bismuto|Óxido de bismuto(V)]] |
|||
* [[Cloruro de bismuto (III)]] |
|||
== Reacciones == |
|||
* [[Bismuth(III) oxide|Óxido de bismuto(III)]] |
|||
El pentafluoruro de bismuto es el más reactivo de los pentafluoruros de pictógeno y es un [[Halogenación|agente fluorante]] extremadamente fuerte. Reacciona vigorosamente con el agua para formar [[ozono]] y [[difluoruro de oxígeno]], y con yodo o azufre a temperatura ambiente. BiF<sub>5</sub> fluora el [[queroseno]] ([[Hidrocarburo|hidrocarburos]]) a [[Fluorocarburo|fluorocarbonos]] por encima de 50 °C y oxida [[Tetrafluoruro de uranio|UF<sub>4</sub>]] a [[Hexafluoruro de uranio|UF<sub>6</sub>]] a 150 °C. A los 180 °C, el pentafluoruro de bismuto [[Trifluoruro de bromo|fluora]] [[Bromo|Br<sub>2</sub>]] a [[Trifluoruro de bromo|BrF<sub>3</sub>]] y [[Cloro|Cl<sub>2</sub>]] a [[Monofluoruro de cloro|ClF]]. |
|||
BiF<sub>5</sub> también reacciona con fluoruros de metales alcalinos, MF, para formar hexafluorobismutatos, M[BiF<sub>6</sub>], que contiene el anión hexafluorobismuthate, [BiF<sub>6</sub>] <sup>-</sup>. |
|||
== Referencias == |
|||
{{listaref}} |
|||
{{Control de autoridades}} |
|||
| ⚫ | |||
[[Categoría:Agentes oxidantes]] |
|||
[[Categoría:Sales inorgánicas]] |
|||
[[Categoría:Fluoruros]] |
|||
[[Categoría:Compuestos de bismuto]] |
[[Categoría:Compuestos de bismuto]] |
||
| ⚫ | |||
Revisión actual - 04:26 5 nov 2022
| Fluoruro de bismuto(V) | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Otros nombres | Pentafluoruro de bismuto | |
| Fórmula molecular | BIF5 | |
| Identificadores | ||
| Número CAS | 7787-62-4[1] | |
| ChEBI | 30426 | |
| ChemSpider | 21172752 | |
| PubChem | 123260 | |
| UNII | BX273GFK98 | |
| Propiedades físicas | ||
| Masa molar | 303,9724148 g/mol | |
El Fluoruro de bismuto(V) o Pentafluoruro de bismuto es un compuesto inorgánico de fórmula BiF5 . Es un sólido blanco altamente reactivo. El compuesto es de interés para los investigadores pero no tiene un valor particular.
Estructura
[editar]BiF5 es polimérico y consta de cadenas lineales de esquinas con puentes trans que comparten octaedros BiF6.[2] Esta es la misma estructura que <i id="mwKQ">α</i>-UF<sub id="mwKg">5</sub>.
 
|
 
|
| Cadena (BiF5)∞ | Embalaje de cadenas |
Preparación
[editar]BiF5 se puede preparar tratando BiF3 con F2 a 500 °C.
- BiF3 + F2 → BiF5
En una síntesis alternativa, ClF3 es el agente fluorante a 350 °C.[3]
- BiF3 + ClF3 → BiF5 + ClF
Reacciones
[editar]El pentafluoruro de bismuto es el más reactivo de los pentafluoruros de pictógeno y es un agente fluorante extremadamente fuerte. Reacciona vigorosamente con el agua para formar ozono y difluoruro de oxígeno, y con yodo o azufre a temperatura ambiente. BiF5 fluora el queroseno (hidrocarburos) a fluorocarbonos por encima de 50 °C y oxida UF4 a UF6 a 150 °C. A los 180 °C, el pentafluoruro de bismuto fluora Br2 a BrF3 y Cl2 a ClF.
BiF5 también reacciona con fluoruros de metales alcalinos, MF, para formar hexafluorobismutatos, M[BiF6], que contiene el anión hexafluorobismuthate, [BiF6] -.
Referencias
[editar]- ↑ Número CAS
- ↑ C. Hebecker (1971). «Zur Kristallstruktur von Wismutpentafluorid». Z. anorg. allg. Chem. 384 (2): 111-114. doi:10.1002/zaac.19713840204.
- ↑ A. I. Popov; A. V. Scharabarin; V. F. Sukhoverkhov; N. A. Tchumaevsky (1989). «Synthesis and properties of pentavalent antimony and bismuth fluorides». Z. Anorg. Allg. Chem. 576 (1): 242-254. doi:10.1002/zaac.19895760128.
