Diferencia entre revisiones de «Pirimidina»
Realicé una indicación sobre la ubicación de las posiciones de nitrógeno. |
Ficha: Formato |
||
| (No se muestran 26 ediciones intermedias de 17 usuarios) | |||
| Línea 1: | Línea 1: | ||
{{Ficha de compuesto químico |
|||
{| class="wikitable" border="1" cellpadding="2" cellspacing="0" align="right" style="margin-left:1em" |
|||
|imagen = Pyrimidine 2D aromatic full.svg |
|||
|----- |
|||
|tamaño de imagen = 150px |
|||
! colspan="2" bgcolor="#cccccc" | Pirimidina |
|||
|imagen2 = Pyrimidine-3D-spacefill.png |
|||
|----- |
|||
|tamaño de imagen2 =150px |
|||
| [[IUPAC]] || Pirimidina |
|||
|IUPAC = Pyrimidine |
|||
|----- |
|||
|C=4 | H=4 | N=2 |
|||
| [[Fórmula química]] |
|||
|otros nombres = 1,3-Diazabenzene 1,3-Diazine m-Diazine 1,3-Diazacyclohexa-1,3,5-triene |
|||
| C<sub>4</sub>H<sub>4</sub>N<sub>2</sub> |
|||
|SMILES = C1=CN=CN=C1 |
|||
|----- |
|||
|dens2 = 1.016 |
|||
| [[Masa molecular]] || 80.09 g/mol |
|||
|PFC = 20 |
|||
|----- |
|||
|PEC = 123 |
|||
| [[Densidad (física)|Densidad]] || 1.016 g/ml |
|||
|sol = Misciblilidad (25 °C) |
|||
|----- |
|||
| ⚫ | |||
| [[Punto de fusión]] || 20 - 22 °C |
|||
| ⚫ | La '''pirimidina''' ({{eti|griego|πῦρ|rom=pyr|fuego|disp=no}} + [[amidina]]) es un compuesto orgánico, similar al [[benceno]], y a la [[piridina]] pero con dos [[átomo]]s de [[nitrógeno]] que sustituyen al [[carbono]] en las posiciones 1 y 3. Se degrada en sustancias muy solubles como [[alanina]] beta y [[aminoisobutirato]] beta, precursores de [[acetil-CoA]] y [[succinil-CoA]]. |
||
|----- |
|||
| [[Punto de ebullición]] || 123 - 124 °C |
|||
|----- |
|||
| [[CAS registry number|Número CAS]] || 289-95-2 |
|||
|----- |
|||
| [[Simplified molecular input line entry specification|SMILES]] |
|||
| C1=NC=NC=C1 |
|||
|----- |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | La pirimidina tiene tres derivados muy importantes para la vida, ya que forman parte de las bases nitrogenadas: la [[timina]], la [[citosina]] y el [[uracilo]]; las tres tienen un grupo [[carbonilo]] (C=O) en el carbono 2; las dos primeras forman parte del [[ADN]] donde se aparean con sus [[purina]]s complementarias, mientras que la última está presente solo en el [[ARN]]. |
||
Se degrada en sustancias muy solubles como [[alanina]] beta y [[aminoisobutirato]] beta, precursores de [[acetil-CoA]] y [[succinil-CoA]]. |
|||
| ⚫ | |||
| ⚫ | La pirimidina tiene tres derivados muy importantes para la vida, ya que forman parte de |
||
{| align="center" |
{| align="center" |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| [[Archivo:Cytosine chemical structure.png|101px|Estructura química de la citosina]] |
|||
|- align="center" |
|- align="center" |
||
| Timina |
| Timina |
||
| ⚫ | |||
| Citosina |
| Citosina |
||
| ⚫ | |||
|- |
|- |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
|} |
|} |
||
En las pirimidinas, una molécula de [[carbamoilfosfato]] en la que la [[glutamina]] es la donadora del grupo [[amino]], se une a una molécula de [[ácido aspártico]]. El [[ácido orótico]], producto de estas reacciones, es transferido a una molécula de fosfo-ribosil pirofosfato para dar origen al [[ácido uridílico]]. |
En las pirimidinas, una molécula de [[carbamoilfosfato]] en la que la [[glutamina]] es la donadora del grupo [[amino]], se une a una molécula de [[ácido aspártico]]. El [[ácido orótico]], producto de estas reacciones, es transferido a una molécula de fosfo-ribosil pirofosfato para dar origen al [[ácido uridílico]]. |
||
===Nucleósidos y nucleótidos=== |
=== Nucleósidos y nucleótidos === |
||
[[Archivo:Pirimidinas ADN esp Blausen 0324.png|thumb|250px|Las bases de nitrógeno pirimidínicas encontradas en el [[ADN]] y en el [[ARN]].]] |
|||
Las pirimidinas se hallan asociadas en su mayoría a [[monosacáridos]] de cinco carbonos ([[pentosa]]s) unidos en N<sub>1</sub> para formar [[nucleósido]]s que, a su vez, se unen a un grupo fosfato (ácido fosfórico) para formar los [[nucleótido]]s. |
Las pirimidinas se hallan asociadas en su mayoría a [[monosacáridos]] de cinco carbonos ([[pentosa]]s) unidos en N<sub>1</sub> para formar [[nucleósido]]s que, a su vez, se unen a un grupo fosfato ([[ácido fosfórico]]) para formar los [[nucleótido]]s. |
||
En el [[Ácido desoxirribonucleico|ADN]] y el [[Ácido ribonucleico|ARN]], estas bases forman [[Fuerza por puente de hidrógeno|enlaces de hidrógeno]] con sus [[Purina|purinas]] [[Complementariedad (biología molecular)|complementarias]]. Así, en el ADN, las purinas [[adenina]] (A) y [[guanina]] (G) se emparejan con las pirimidinas [[timina]] (T) y [[citosina]] (C), respectivamente. |
|||
En ARN, el complemento de adenina (A) es [[uracilo]] (U) en lugar de timina (T), por lo que los pares que se forman son adenina: uracilo y guanina: citosina. |
|||
Muy raramente, la timina puede aparecer en el ARN, o uracilo en el ADN, pero cuando las otras tres principales bases pirimidinas están representadas, algunas bases menores de pirimidina también pueden ocurrir en ácidos nucleicos. Estas pirimidinas menores son usualmente versiones metiladas de las principales y se postula que tienen funciones reguladoras.<ref>{{cite book|last1=Nelson|first1=David L. |first2=Michael M.|last2=Cox|title=Principles of Biochemistry|url=https://archive.org/details/lehningerprincip00lehn_596|edition=5th|publisher=W. H. Freeman|date=2008|pages=[https://archive.org/details/lehningerprincip00lehn_596/page/n274 272]–274 |ISBN=1429208929}}</ref> |
|||
Estos modos de enlace de hidrógeno son para el [[Par de bases|emparejamiento clásico de la base]] de Watson-Crick. Otros modos de enlace de hidrógeno ("emparejamiento de oscilación") están disponibles tanto en ADN como en ARN, aunque el grupo 2'-hidroxilo adicional de ARN expande las configuraciones, a través de las cuales el ARN puede formar enlaces de hidrógeno. |
|||
== Funciones nitrogenadas == |
|||
Los compuestos nitrogenados, como [[aminas]] y [[nitrilos]], se caracterizan porque, además de [[carbono]] e [[hidrógeno]], contienen nitrógeno. |
|||
== Referencias == |
|||
{{Listaref|30em}} |
|||
{{Control de autoridades}} |
|||
[[Categoría:Diazinas]] |
[[Categoría:Diazinas]] |
||
Revisión actual - 10:03 16 dic 2022
| Pirimidina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Pyrimidine | ||
| General | ||
| Otros nombres | 1,3-Diazabenzene 1,3-Diazine m-Diazine 1,3-Diazacyclohexa-1,3,5-triene | |
| Fórmula estructural |
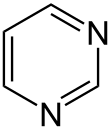 | |
| Fórmula molecular | C4H4N2 | |
| Identificadores | ||
| Número CAS | 289-95-2[1] | |
| ChEBI | 16898 | |
| ChEMBL | CHEMBL15562 | |
| ChemSpider | 8903 | |
| PubChem | 9260 | |
| UNII | K8CXK5Q32L | |
| KEGG | C00396 | |
|
C1=CN=CN=C1
| ||
| Propiedades físicas | ||
| Densidad | 1016 kg/m³; 1,016 g/cm³ | |
| Masa molar | 80,037 g/mol | |
| Punto de fusión | 20 °C (293 K) | |
| Punto de ebullición | 123 °C (396 K) | |
| Propiedades químicas | ||
| Solubilidad en agua | Misciblilidad (25 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La pirimidina (del griego: πῦρ [pyr] ‘fuego’ + amidina) es un compuesto orgánico, similar al benceno, y a la piridina pero con dos átomos de nitrógeno que sustituyen al carbono en las posiciones 1 y 3. Se degrada en sustancias muy solubles como alanina beta y aminoisobutirato beta, precursores de acetil-CoA y succinil-CoA.
Derivados
[editar]La pirimidina tiene tres derivados muy importantes para la vida, ya que forman parte de las bases nitrogenadas: la timina, la citosina y el uracilo; las tres tienen un grupo carbonilo (C=O) en el carbono 2; las dos primeras forman parte del ADN donde se aparean con sus purinas complementarias, mientras que la última está presente solo en el ARN.
| Timina | Citosina | Uracilo |

|

|
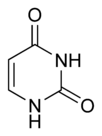
|
En las pirimidinas, una molécula de carbamoilfosfato en la que la glutamina es la donadora del grupo amino, se une a una molécula de ácido aspártico. El ácido orótico, producto de estas reacciones, es transferido a una molécula de fosfo-ribosil pirofosfato para dar origen al ácido uridílico.
Nucleósidos y nucleótidos
[editar]
Las pirimidinas se hallan asociadas en su mayoría a monosacáridos de cinco carbonos (pentosas) unidos en N1 para formar nucleósidos que, a su vez, se unen a un grupo fosfato (ácido fosfórico) para formar los nucleótidos.
En el ADN y el ARN, estas bases forman enlaces de hidrógeno con sus purinas complementarias. Así, en el ADN, las purinas adenina (A) y guanina (G) se emparejan con las pirimidinas timina (T) y citosina (C), respectivamente.
En ARN, el complemento de adenina (A) es uracilo (U) en lugar de timina (T), por lo que los pares que se forman son adenina: uracilo y guanina: citosina.
Muy raramente, la timina puede aparecer en el ARN, o uracilo en el ADN, pero cuando las otras tres principales bases pirimidinas están representadas, algunas bases menores de pirimidina también pueden ocurrir en ácidos nucleicos. Estas pirimidinas menores son usualmente versiones metiladas de las principales y se postula que tienen funciones reguladoras.[2]
Estos modos de enlace de hidrógeno son para el emparejamiento clásico de la base de Watson-Crick. Otros modos de enlace de hidrógeno ("emparejamiento de oscilación") están disponibles tanto en ADN como en ARN, aunque el grupo 2'-hidroxilo adicional de ARN expande las configuraciones, a través de las cuales el ARN puede formar enlaces de hidrógeno.
Funciones nitrogenadas
[editar]Los compuestos nitrogenados, como aminas y nitrilos, se caracterizan porque, además de carbono e hidrógeno, contienen nitrógeno.
Referencias
[editar]- ↑ Número CAS
- ↑ Nelson, David L.; Cox, Michael M. (2008). Principles of Biochemistry (5th edición). W. H. Freeman. pp. 272–274. ISBN 1429208929.
