Diferencia entre revisiones de «Ácido quinurénico»
Sin resumen de edición |
Rescatando 1 referencia(s) y marcando 0 enlace(s) como roto(s)) #IABot (v2.0.9.3 |
||
| (No se muestra una edición intermedia de otro usuario) | |||
| Línea 15: | Línea 15: | ||
|PEC = |
|PEC = |
||
}} |
}} |
||
El '''ácido quinurénico''' (Siglas en inglés '''KYNA''') es un metabolito del [[triptófano]] y puede ser considerado un [[alcaloide]] de origen animal, ya que contiene un anillo heterocíclico ([[quinolina]]), biosintéticamente procede de un aminoácido proteínico y tiene una fuerte actividad biológica sobre el sistema nervioso. |
El '''ácido quinurénico''' (Siglas en inglés '''KYNA''') es un metabolito del [[triptófano]] y puede ser considerado un [[alcaloide]] de origen animal, ya que contiene un anillo heterocíclico ([[quinolina]]), biosintéticamente procede de un aminoácido proteínico y tiene una fuerte actividad biológica sobre el sistema nervioso. |
||
== Historia == |
== Historia == |
||
| Línea 21: | Línea 21: | ||
== Actividad biológica y mecanismo de acción == |
== Actividad biológica y mecanismo de acción == |
||
Actúa como antiexcitotóxico, [[anticonvulsivo]] y antagonista en los receptores de aminoácidos. Debido a su actividad, este compuesto puede influir significativamente sobre procesos neurofisiológicos y neuropatológicos. Como resultado, el ácido quinurénico ha sido considerado para su uso en la terapia de desórdenes neurobiológicos. |
Actúa como antiexcitotóxico, [[anticonvulsivo]] y antagonista en los receptores de aminoácidos. Debido a su actividad, este compuesto puede influir significativamente sobre procesos neurofisiológicos y neuropatológicos. Como resultado, el ácido quinurénico ha sido considerado para su uso en la terapia de desórdenes neurobiológicos. |
||
Se ha propuesto que el KYNA actúa en cuatro sitios blanco: |
Se ha propuesto que el KYNA actúa en cuatro sitios blanco: |
||
* Como antagonista del [[AMPA]] ionotrópico, [[NMDAR]] y los receptores [[Ácido kaínico|Kainato]]-glutamato en un rango de concentraciones de 0.1-2.5 mM<ref>Elmslie KS, Yoshikami D. (1985) Effects of kynurenate on root potentials evoked by synaptic activity and amino acids in the frog spinal cord. Brain Res. Mar 25;330(2):265-72.</ref> |
* Como antagonista del [[AMPA]] ionotrópico, [[NMDAR]] y los receptores [[Ácido kaínico|Kainato]]-glutamato en un rango de concentraciones de 0.1-2.5 mM<ref>Elmslie KS, Yoshikami D. (1985) Effects of kynurenate on root potentials evoked by synaptic activity and amino acids in the frog spinal cord. Brain Res. Mar 25;330(2):265-72.</ref> |
||
* Como antagonista no competitivo del sitio de glicina del [[receptor NMDA]]. |
* Como antagonista no competitivo del sitio de glicina del [[receptor NMDA]]. |
||
* Como antagonista del [[receptor α7-nicotínico]].<ref> |
* Como antagonista del [[receptor α7-nicotínico]].<ref>Hilmas, C., Pereira, EFR., Alkondon,M., Rassoulpour,A. Schwarcz,R., Albuquerque E.X.,(2001) The Brain Metabolite Kynurenic Acid Inhibits α7 Nicotinic Receptor Activity and Increases Non-α7 Nicotinic Receptor Expression: Physiopathological Implications. J. Neurosci 21(19):7463–7473.</ref> Sin embargo, en 2011 el registro de las corrientes del receptor α7-nicotínico en interneuronas [[hipocampo (anatomía)|hipocampales]] de adulto realizado por el laboratorio Cooper<ref name="Dobelis P., Varnell A., and Donald C. Cooper. Nicotinic α7 acetylcholine receptor-mediated currents are not modulated by the tryptophan metabolite kynurenic acid in adult hippocampal interneurons.">Dobelis P., Varnell A., and Donald C. Cooper. Nicotinic α7 acetylcholine receptor-mediated currents are not modulated by the tryptophan metabolite kynurenic acid in adult hippocampal interneurons. (2011) Nature Precedings doi=10.1038/npre.2011.6277.1, http://www.neuro-cloud.net/nature-precedings/dobelis/</ref> validaron un estudio del 2009<ref name="Mok MH, Fricker AC, Weil A, Kew JN (2009) Electrophysiological characterisation of the actions of kynurenic acid at ligand-gated ion channels.">Mok MH, Fricker AC, Weil A, Kew JN (2009) Electrophysiological characterisation of the actions of kynurenic acid at ligand-gated ion channels. Neuropharmacology 57: 242-249.</ref> que no tuvo éxito en encontrar un efecto bloqueador del ácido quinurénico a diversas concentraciones lo que sugirió que en preparaciones intactas no cultivadas de animales adultos no hay actividad del ácido quinurénico sobre los receptores de acetilcolina α7-nicotínicos.<ref name="Dobelis P., Varnell A., and Donald C. Cooper. Nicotinic α7 acetylcholine receptor-mediated currents are not modulated by the tryptophan metabolite kynurenic acid in adult hippocampal interneurons."/><ref name="Mok MH, Fricker AC, Weil A, Kew JN (2009) Electrophysiological characterisation of the actions of kynurenic acid at ligand-gated ion channels."/> |
||
* Como ligando del [[receptor acoplado a proteínas G]] [[GPR35]].<ref name="pmid16754668">{{cita publicación |autor=Wang J, Simonavicius N, Wu X, Swaminath G, Reagan J, Tian H, Ling L |título=Kynurenic acid as a ligand for orphan G protein-coupled receptor GPR35 |publicación=J. Biol. Chem. |volumen=281 |número=31 |páginas=22021–8 |año=2006 |pmid=16754668 |doi=10.1074/jbc.M603503200}}</ref> Otro metabolito del triptófano, el ácido [[5-hidroxiindolacético]] también actúa en estos receptores.<ref name="pmid17016503">{{cita publicación |autor=Grilli M, Raiteri L, Patti L, Parodi M, Robino F, Raiteri M, Marchi M |título=Modulation of the function of presynaptic α7 and non-α7 nicotinic receptors by the tryptophan metabolites, 5-hydroxyindole and kynurenate in mouse brain |url=https://archive.org/details/sim_british-journal-of-pharmacology_2006-11_149_6/page/724 |publicación=Br. J. Pharmacol. |volumen=149 |número=6 |páginas=724–32 |año=2006 |pmid=17016503 |doi=10.1038/sj.bjp.0706914 |pmc=2014664}}</ref> |
* Como ligando del [[receptor acoplado a proteínas G]] [[GPR35]].<ref name="pmid16754668">{{cita publicación |autor=Wang J, Simonavicius N, Wu X, Swaminath G, Reagan J, Tian H, Ling L |título=Kynurenic acid as a ligand for orphan G protein-coupled receptor GPR35 |publicación=J. Biol. Chem. |volumen=281 |número=31 |páginas=22021–8 |año=2006 |pmid=16754668 |doi=10.1074/jbc.M603503200}}</ref> Otro metabolito del triptófano, el ácido [[5-hidroxiindolacético]] también actúa en estos receptores.<ref name="pmid17016503">{{cita publicación |autor=Grilli M, Raiteri L, Patti L, Parodi M, Robino F, Raiteri M, Marchi M |título=Modulation of the function of presynaptic α7 and non-α7 nicotinic receptors by the tryptophan metabolites, 5-hydroxyindole and kynurenate in mouse brain |url=https://archive.org/details/sim_british-journal-of-pharmacology_2006-11_149_6/page/724 |publicación=Br. J. Pharmacol. |volumen=149 |número=6 |páginas=724–32 |año=2006 |pmid=17016503 |doi=10.1038/sj.bjp.0706914 |pmc=2014664}}</ref> |
||
Altos niveles de ácido quinurénico han sido identificados en pacientes con [[encefalitis transmitida por garrapatas]], [[esquizofrenia]], y pacientes enfermos de [[SIDA]]. En todas estas situaciones, los niveles altos de ácido quinurénico se han asociado con confusión y síntomas de [[psicosis]]. El ácido quinurénico actúa en el cerebro como antagonista del sitio de la glicina [[NMDAR]], elemento clave en el sistema de neurotransmisión glutamatérgica, sobre la cual se piensa que se encuentyra implicada en la patofisiología y patogénesis de la esquizofrenia. Erhardt y colaboradores elaboraron una hipótesis de la esquizofrenia en 2007,<ref name="pmid17573079">{{cita publicación |autor=Erhardt S, Schwieler L, Nilsson L, Linderholm K, Engberg G |título=The kynurenic acid hypothesis of schizophrenia |publicación=Physiol. Behav. |volumen=92 |número=1–2 |páginas=203–9 |año=2007 |pmid=17573079 |doi=10.1016/j.physbeh.2007.05.025}}</ref><ref name="pmid15206728">{{cita publicación |autor=Erhardt S, Schwieler L, Engberg G |título=Kynurenic acid and schizophrenia |publicación=Adv. Exp. Med. Biol. |volumen=527 |número= |páginas=155–65 |año=2003 |pmid=15206728 |doi = }}</ref> basada en la acción del ácido quinurénico en la actividad de la [[dopamina]] en el [[cerebro medio]] y en los [[NMDAR]]. De esta manera se trata de relacionar la [[hipótesis de la dopamina de la esquizofrenia]] con la [[hipótesis del glutamato de la esquizofrenia]]. |
Altos niveles de ácido quinurénico han sido identificados en pacientes con [[encefalitis transmitida por garrapatas]], [[esquizofrenia]], y pacientes enfermos de [[SIDA]]. En todas estas situaciones, los niveles altos de ácido quinurénico se han asociado con confusión y síntomas de [[psicosis]]. El ácido quinurénico actúa en el cerebro como antagonista del sitio de la glicina [[NMDAR]], elemento clave en el sistema de neurotransmisión glutamatérgica, sobre la cual se piensa que se encuentyra implicada en la patofisiología y patogénesis de la esquizofrenia. Erhardt y colaboradores elaboraron una hipótesis de la esquizofrenia en 2007,<ref name="pmid17573079">{{cita publicación |autor=Erhardt S, Schwieler L, Nilsson L, Linderholm K, Engberg G |título=The kynurenic acid hypothesis of schizophrenia |publicación=Physiol. Behav. |volumen=92 |número=1–2 |páginas=203–9 |año=2007 |pmid=17573079 |doi=10.1016/j.physbeh.2007.05.025}}</ref><ref name="pmid15206728">{{cita publicación |autor=Erhardt S, Schwieler L, Engberg G |título=Kynurenic acid and schizophrenia |publicación=Adv. Exp. Med. Biol. |volumen=527 |número= |páginas=155–65 |año=2003 |pmid=15206728 |doi = }}</ref> basada en la acción del ácido quinurénico en la actividad de la [[dopamina]] en el [[cerebro medio]] y en los [[NMDAR]]. De esta manera se trata de relacionar la [[hipótesis de la dopamina de la esquizofrenia]] con la [[hipótesis del glutamato de la esquizofrenia]]. |
||
Niveles altos de ácido quinurénico han sido identificados en orina humana en ciertos desórdenes metabólicos, tales como la [[Vitamina B6#Deficiencia|deficiencia de vitamina B<sub>6</sub>]] y la deficiencia de la [[quinureninasa]]. |
Niveles altos de ácido quinurénico han sido identificados en orina humana en ciertos desórdenes metabólicos, tales como la [[Vitamina B6#Deficiencia|deficiencia de vitamina B<sub>6</sub>]] y la deficiencia de la [[quinureninasa]]. |
||
Existen estudios donde se provoca la disminución de ácido quinurénico en cerebro de ratón y se ha observado mejoría significativa en la cognición.<ref name="pmid20336058">{{cita publicación |autor=Robert Schwarcz|publicación=Neuropsychopharmacology|año=2010|doi=10.1038/npp.2010.39|volumen=35| |
Existen estudios donde se provoca la disminución de ácido quinurénico en cerebro de ratón y se ha observado mejoría significativa en la cognición.<ref name="pmid20336058">{{cita publicación |autor=Robert Schwarcz|publicación=Neuropsychopharmacology|año=2010|doi=10.1038/npp.2010.39|volumen=35| |
||
| Línea 38: | Línea 38: | ||
== Biosíntesis == |
== Biosíntesis == |
||
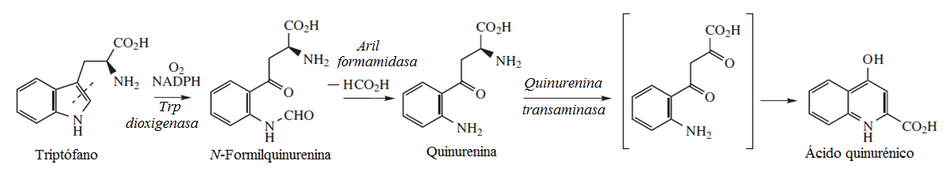
El ácido quinurénico se forma a partir de un catabolito del triptófano, la [[quinurenina]]. Cuando este aminoácido se transamina por la acción de la [[quinurenina—oxoglutarato transaminasa]] ('''EC 2.6.1.7'''), el grupo ceto forma una imina con el nitrógeno residual del anillo de indol del triptófano precursor. Cuando la [[cetona]] [[Tautomería|tautomeriza]] a [[enol]], se finaliza así la formación del anillo de quinolina.<ref> |
El ácido quinurénico se forma a partir de un catabolito del triptófano, la [[quinurenina]]. Cuando este aminoácido se transamina por la acción de la [[quinurenina—oxoglutarato transaminasa]] ('''EC 2.6.1.7'''), el grupo ceto forma una imina con el nitrógeno residual del anillo de indol del triptófano precursor. Cuando la [[cetona]] [[Tautomería|tautomeriza]] a [[enol]], se finaliza así la formación del anillo de quinolina.<ref>[http://www.genome.jp/kegg/pathway/map/map00380.html] {{Wayback|url=http://www.genome.jp/kegg/pathway/map/map00380.html |date=20201121024517 }} Kegg Pathway Catabolism of Tryptophan</ref> |
||
[[Archivo:Biosíntesis del ácido quinurénico.png|centro|950px]] |
[[Archivo:Biosíntesis del ácido quinurénico.png|centro|950px]] |
||
Revisión actual - 12:42 29 abr 2023
| Ácido quinurénico | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Ácido 4-hidroxiquinolino-2-carboxílico | ||
| General | ||
| Otros nombres | Ácido quinurónico. Transtorina. | |
| Fórmula estructural |
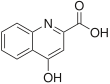 | |
| Fórmula molecular | C10H7NO3 | |
| Identificadores | ||
| Número CAS | 492-27-3[1] | |
| ChEBI | 18344 | |
| ChEMBL | CHEMBL299155 | |
| ChemSpider | 3712 | |
| DrugBank | DB11937 | |
| PubChem | 3845 | |
| UNII | H030S2S85J | |
| KEGG | C01717 | |
| Propiedades físicas | ||
| Masa molar | 189,168 g/mol | |
| Punto de fusión | 282,5 °C (556 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido quinurénico (Siglas en inglés KYNA) es un metabolito del triptófano y puede ser considerado un alcaloide de origen animal, ya que contiene un anillo heterocíclico (quinolina), biosintéticamente procede de un aminoácido proteínico y tiene una fuerte actividad biológica sobre el sistema nervioso.
Historia
[editar]El ácido quinurénico fue descubierto en 1853 por el químico alemán Justus von Liebig en la orina canina, por lo cual tomó su nombre del griego κυνό (kyno, genitivo de perro) y οὖρον (uron, orina)[2]
Actividad biológica y mecanismo de acción
[editar]Actúa como antiexcitotóxico, anticonvulsivo y antagonista en los receptores de aminoácidos. Debido a su actividad, este compuesto puede influir significativamente sobre procesos neurofisiológicos y neuropatológicos. Como resultado, el ácido quinurénico ha sido considerado para su uso en la terapia de desórdenes neurobiológicos.
Se ha propuesto que el KYNA actúa en cuatro sitios blanco:
- Como antagonista del AMPA ionotrópico, NMDAR y los receptores Kainato-glutamato en un rango de concentraciones de 0.1-2.5 mM[3]
- Como antagonista no competitivo del sitio de glicina del receptor NMDA.
- Como antagonista del receptor α7-nicotínico.[4] Sin embargo, en 2011 el registro de las corrientes del receptor α7-nicotínico en interneuronas hipocampales de adulto realizado por el laboratorio Cooper[5] validaron un estudio del 2009[6] que no tuvo éxito en encontrar un efecto bloqueador del ácido quinurénico a diversas concentraciones lo que sugirió que en preparaciones intactas no cultivadas de animales adultos no hay actividad del ácido quinurénico sobre los receptores de acetilcolina α7-nicotínicos.[5][6]
- Como ligando del receptor acoplado a proteínas G GPR35.[7] Otro metabolito del triptófano, el ácido 5-hidroxiindolacético también actúa en estos receptores.[8]
Altos niveles de ácido quinurénico han sido identificados en pacientes con encefalitis transmitida por garrapatas, esquizofrenia, y pacientes enfermos de SIDA. En todas estas situaciones, los niveles altos de ácido quinurénico se han asociado con confusión y síntomas de psicosis. El ácido quinurénico actúa en el cerebro como antagonista del sitio de la glicina NMDAR, elemento clave en el sistema de neurotransmisión glutamatérgica, sobre la cual se piensa que se encuentyra implicada en la patofisiología y patogénesis de la esquizofrenia. Erhardt y colaboradores elaboraron una hipótesis de la esquizofrenia en 2007,[9][10] basada en la acción del ácido quinurénico en la actividad de la dopamina en el cerebro medio y en los NMDAR. De esta manera se trata de relacionar la hipótesis de la dopamina de la esquizofrenia con la hipótesis del glutamato de la esquizofrenia.
Niveles altos de ácido quinurénico han sido identificados en orina humana en ciertos desórdenes metabólicos, tales como la deficiencia de vitamina B6 y la deficiencia de la quinureninasa.
Existen estudios donde se provoca la disminución de ácido quinurénico en cerebro de ratón y se ha observado mejoría significativa en la cognición.[11]
Biosíntesis
[editar]El ácido quinurénico se forma a partir de un catabolito del triptófano, la quinurenina. Cuando este aminoácido se transamina por la acción de la quinurenina—oxoglutarato transaminasa (EC 2.6.1.7), el grupo ceto forma una imina con el nitrógeno residual del anillo de indol del triptófano precursor. Cuando la cetona tautomeriza a enol, se finaliza así la formación del anillo de quinolina.[12]
Véase también
[editar]Referencias
[editar]- ↑ Número CAS
- ↑ Liebig, J., Uber Kynurensäure, Justus Liebigs Ann. Chem., 86: 125-126, 1853.
- ↑ Elmslie KS, Yoshikami D. (1985) Effects of kynurenate on root potentials evoked by synaptic activity and amino acids in the frog spinal cord. Brain Res. Mar 25;330(2):265-72.
- ↑ Hilmas, C., Pereira, EFR., Alkondon,M., Rassoulpour,A. Schwarcz,R., Albuquerque E.X.,(2001) The Brain Metabolite Kynurenic Acid Inhibits α7 Nicotinic Receptor Activity and Increases Non-α7 Nicotinic Receptor Expression: Physiopathological Implications. J. Neurosci 21(19):7463–7473.
- ↑ a b Dobelis P., Varnell A., and Donald C. Cooper. Nicotinic α7 acetylcholine receptor-mediated currents are not modulated by the tryptophan metabolite kynurenic acid in adult hippocampal interneurons. (2011) Nature Precedings doi=10.1038/npre.2011.6277.1, http://www.neuro-cloud.net/nature-precedings/dobelis/
- ↑ a b Mok MH, Fricker AC, Weil A, Kew JN (2009) Electrophysiological characterisation of the actions of kynurenic acid at ligand-gated ion channels. Neuropharmacology 57: 242-249.
- ↑
- ↑ Grilli M, Raiteri L, Patti L, Parodi M, Robino F, Raiteri M, Marchi M (2006). «Modulation of the function of presynaptic α7 and non-α7 nicotinic receptors by the tryptophan metabolites, 5-hydroxyindole and kynurenate in mouse brain». Br. J. Pharmacol. 149 (6): 724-32. PMC 2014664. PMID 17016503. doi:10.1038/sj.bjp.0706914.
- ↑ Erhardt S, Schwieler L, Nilsson L, Linderholm K, Engberg G (2007). «The kynurenic acid hypothesis of schizophrenia». Physiol. Behav. 92 (1–2): 203-9. PMID 17573079. doi:10.1016/j.physbeh.2007.05.025.
- ↑ Erhardt S, Schwieler L, Engberg G (2003). «Kynurenic acid and schizophrenia». Adv. Exp. Med. Biol. 527: 155-65. PMID 15206728.
- ↑ Robert Schwarcz; Elmer, Greg I; Bergeron, Richard; Albuquerque, Edson X; Guidetti, Paolo; Wu, Hui-Qiu; Schwarcz, Robert (2010). «Reduction of Endogenous Kynurenic Acid Formation Enhances Extracellular Glutamate, Hippocampal Plasticity, and Cognitive Behavior». Neuropsychopharmacology 35 (8): 1734-1742. PMC 3055476. PMID 20336058. doi:10.1038/npp.2010.39.
- ↑ [1] Archivado el 21 de noviembre de 2020 en Wayback Machine. Kegg Pathway Catabolism of Tryptophan
