Diferencia entre revisiones de «Reacción de Bingel»
m Bot: Arreglando espacios en los enlaces; cambios cosméticos |
Bot: eliminando enlaces según WP:ENLACESFECHAS |
||
| (No se muestran 17 ediciones intermedias de 13 usuarios) | |||
| Línea 1: | Línea 1: | ||
[[Archivo:Bingelfullerene.png| |
[[Archivo:Bingelfullerene.png|miniatura|128px|Bingel fulereno.]] |
||
En [[química del fulereno]] se conoce como '''Reacción de Bingel''' a la [[reacción de ciclopropanación]] del [[fulereno]] en '''metanofulereno''', descubierta por C. Bingel en |
En [[química del fulereno]] se conoce como '''Reacción de Bingel''' a la [[reacción de ciclopropanación]] del [[fulereno]] en '''metanofulereno''', descubierta por C. Bingel en 1993. El fulereno reacciona con el [[bromo]] [[dietil malonato]], en presencia de una [[base (química)|base]] como por ejemplo [[hidruro de sodio]] o [[1,8-Diazabicyclo(5.4.0)undec-7-ene|DBU]].<ref>C. Bingel, Chem. Ber. '''1993''', 126, 1957.</ref> En esta reacción, se utilizan enlaces dobles cortos localizados en la superficie del fulereno, en las uniones de dos hexágonos (enlaces 6-6) y la energía proviene de la liberación de [[estrés espacial]]. |
||
La reacción es de importancia en el campo de la química porque permite la introducción de extensiones útiles a la esfera fulerena. Estas extensiones alteran sus propiedades (solubilidad y comportamiento electroquímico) y por tanto tienen un amplio rango de potenciales aplicaciones técnicas. |
La reacción es de importancia en el campo de la química porque permite la introducción de extensiones útiles a la esfera fulerena. Estas extensiones alteran sus propiedades (solubilidad y comportamiento electroquímico) y por tanto tienen un amplio rango de potenciales aplicaciones técnicas. |
||
==Mecanismo de reacción== |
== Mecanismo de reacción == |
||
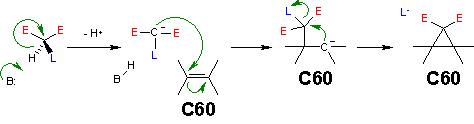
El [[mecanismo de reacción]] es el siguiente: una base extrae un protón del ácido malonato generando una [[carbonación]] o [[alquenol]] que reacciona con el enlace doble del fulereno (al cual le "falta" un electrón) por medio de una [[adición nucleofílica]]. Esto a su vez genera una carbonación que desplaza al bromino por medio de una sustitución por [[adición nucleolífica]] en un anillo [[intramolecular]] con un cierre en anillo de [[ciclopropano]]. |
El [[mecanismo de reacción]] es el siguiente: una base extrae un protón del ácido malonato generando una [[carbonación]] o [[alquenol]] que reacciona con el enlace doble del fulereno (al cual le "falta" un electrón) por medio de una [[adición nucleofílica]]. Esto a su vez genera una carbonación que desplaza al bromino por medio de una sustitución por [[adición nucleolífica]] en un anillo [[intramolecular]] con un cierre en anillo de [[ciclopropano]]. |
||
[[Archivo: |
[[Archivo:Bingel_reaction_mechanism.png|centrado|Mecanismo de reacción de Bingel: '''E''' grupo de electrones retraídos, '''L''' grupo residual]] |
||
== Ámbito== |
== Ámbito == |
||
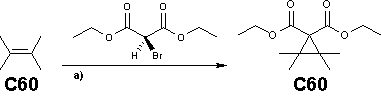
La reacción de Bingel es un método popular de funcinalizar fulerenos. Un malonato de [[haluro]] se obtiene a menudo [[in situ]] de una mezcla de base y [[Tetracloruro de carbono]] o [[yodo]] |
La reacción de Bingel es un método popular de funcinalizar fulerenos. Un malonato de [[haluro]] se obtiene a menudo [[in situ]] de una mezcla de base y [[Tetracloruro de carbono]] o [[yodo]].<ref name="Fullereno">''Synthesis of [60]Fullerene Adducts Bearing Carbazole Moieties by Bingel Reaction and Their Properties'' Yosuke Nakamura, Masato Suzuki, Yumi Imai, and Jun NishimuraOrg. Lett.; '''2004'''; 6(16) pp 2797 - 2799; [http://pubs3.acs.org/acs/journals/doilookup?in_doi=10.1021/ol048952n DOI Graphical Abstract]</ref> La reacción es también conocida por ocurrir con los grupos [[éster]] reemplazados por grupos [[alquino]] en '''dialkinilmetanofulerenos'''.<ref name="Fullereno" /> |
||
[[Archivo: |
[[Archivo:Bingel_reaction.png|centrado|Reacción de Bingel de fulereno con un malonato ester y un [[hidrido de sodio]] o [[DBU]] en [[tolueno]] a temperatura ambiente con un rendimiento de 45%]]. |
||
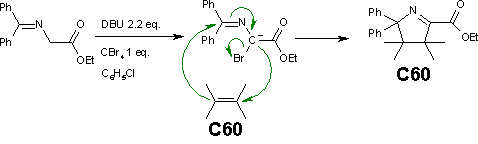
Una alternativa a la reacción de Bingel es una reacción fulerena de [[diazometano]]. Los Éster N-(Difenilmetileno)glicinatos en una reacción de Bingel toman un camino conjugado distinto y reaccional hacia un [[pirrol|dihidropirrol]] de fulereno. |
Una alternativa a la reacción de Bingel es una reacción fulerena de [[diazometano]]. Los Éster N-(Difenilmetileno)glicinatos en una reacción de Bingel toman un camino conjugado distinto y reaccional hacia un [[pirrol|dihidropirrol]] de fulereno. |
||
[[Archivo: |
[[Archivo:Bingel_example.png|derecha|Reacción de Bingel con N-(Difenilmetileno)glicinato Ester]] |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
== Referencias == |
== Referencias == |
||
{{listaref}} |
|||
# {{Note|1}} C. Bingel, Chem. Ber. '''1993''', 126, 1957. |
|||
# {{Note|2}} ''Structural Reassignment of the Mono- and Bis-Addition Products from the Addition Reactions of N-(Diphenylmethylene)glycinate Esters to [60]Fullerene under Bingel Conditions'' Graham E. Ball, Glenn A. Burley, Leila Chaker, Bill C. Hawkins, James R. Williams, Paul A. Keller, and Stephen G. Pyne J. Org. Chem.; '''2005'''; 70(21) pp 8572 - 8574 [http://pubs3.acs.org/acs/journals/doilookup?in_doi=10.1021/jo051282u DOI Graphical Abstract] |
|||
# {{Note|3}} ''Synthesis of [60]Fullerene Adducts Bearing Carbazole Moieties by Bingel Reaction and Their Properties'' Yosuke Nakamura, Masato Suzuki, Yumi Imai, and Jun NishimuraOrg. Lett.; '''2004'''; 6(16) pp 2797 - 2799; [http://pubs3.acs.org/acs/journals/doilookup?in_doi=10.1021/ol048952n DOI Graphical Abstract] |
|||
# {{Note|4}} ''Covalent fullerene chemistry'' FranGois Diederich Pure &Appl. Chem., Vol. 69, No. 3, pp. 395-400, '''1997''' [http://www.iupac.org/publications/pac/1997/pdf/6903x0395.pdf Online Article] |
|||
| ⚫ | |||
{{Control de autoridades}} |
|||
[[en:Bingel reaction]] |
|||
| ⚫ | |||
[[zh:Bingel反应]] |
|||
Revisión actual - 13:07 23 ene 2024

En química del fulereno se conoce como Reacción de Bingel a la reacción de ciclopropanación del fulereno en metanofulereno, descubierta por C. Bingel en 1993. El fulereno reacciona con el bromo dietil malonato, en presencia de una base como por ejemplo hidruro de sodio o DBU.[1] En esta reacción, se utilizan enlaces dobles cortos localizados en la superficie del fulereno, en las uniones de dos hexágonos (enlaces 6-6) y la energía proviene de la liberación de estrés espacial.
La reacción es de importancia en el campo de la química porque permite la introducción de extensiones útiles a la esfera fulerena. Estas extensiones alteran sus propiedades (solubilidad y comportamiento electroquímico) y por tanto tienen un amplio rango de potenciales aplicaciones técnicas.
Mecanismo de reacción
[editar]El mecanismo de reacción es el siguiente: una base extrae un protón del ácido malonato generando una carbonación o alquenol que reacciona con el enlace doble del fulereno (al cual le "falta" un electrón) por medio de una adición nucleofílica. Esto a su vez genera una carbonación que desplaza al bromino por medio de una sustitución por adición nucleolífica en un anillo intramolecular con un cierre en anillo de ciclopropano.
Ámbito
[editar]La reacción de Bingel es un método popular de funcinalizar fulerenos. Un malonato de haluro se obtiene a menudo in situ de una mezcla de base y Tetracloruro de carbono o yodo.[2] La reacción es también conocida por ocurrir con los grupos éster reemplazados por grupos alquino en dialkinilmetanofulerenos.[2]
.
Una alternativa a la reacción de Bingel es una reacción fulerena de diazometano. Los Éster N-(Difenilmetileno)glicinatos en una reacción de Bingel toman un camino conjugado distinto y reaccional hacia un dihidropirrol de fulereno.
Enlaces externos
[editar]- [https://web.archive.org/web/20060519070247/http://www.organik.uni-erlangen.de/hirsch/princhem.html Química de Fulereno en la Universidad ErlangenI
Referencias
[editar]- ↑ C. Bingel, Chem. Ber. 1993, 126, 1957.
- ↑ a b Synthesis of [60]Fullerene Adducts Bearing Carbazole Moieties by Bingel Reaction and Their Properties Yosuke Nakamura, Masato Suzuki, Yumi Imai, and Jun NishimuraOrg. Lett.; 2004; 6(16) pp 2797 - 2799; DOI Graphical Abstract
