Diferencia entre revisiones de «Quinona»
Commonscat, catmás y paso categoría a su propia categoría. |
|||
| (No se muestran 43 ediciones intermedias de 22 usuarios) | |||
| Línea 1: | Línea 1: | ||
{{Referencias}} |
{{Referencias|t=20110609}} |
||
La '''quinona''' es una clase de compuesto orgánico que deriva formalmente de compuestos [[aromático]]s (como [[benceno]], [[naftaleno]] o [[antraceno]]) mediante la conversión de un número par de grupos –CH = en grupos –C (= O) - con cualquier reordenamiento necesario de dobles enlaces, dando como resultado una estructura de diona cíclica completamente conjugada. Incluye algunos compuestos [[heterocíclico]]s . |
|||
Una '''quinona''' (o '''benzoquinona''') es uno de los dos [[isómero]]s de la ciclohexanodiona o bien un derivado de los mismos. Su fórmula química es [[Carbono|C]]<sub>6</sub>[[Hidrógeno|H]]<sub>4</sub>[[Oxígeno|O]]<sub>2</sub>. |
|||
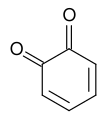
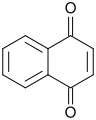
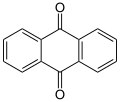
El miembro arquetípico de la clase es la [[1,4-Benzoquinona|1,4-benzoquinona]] o ciclohexadienediona, a menudo llamada simplemente "quinona" (de ahí el nombre de la clase). Otros ejemplos importantes son la [[1,4-Benzoquinona|1,2-benzoquinona]] ('''''orto''quinona'''), la [[1,4-naftoquinona]] y la [[Antraquinona|9,10-antraquinona]]. |
|||
[[Archivo:Benzoquinones.png|right|200px]] |
[[Archivo:Benzoquinones.png|right|200px]] |
||
Los |
Los [[isómero]]s son la ''orto''-benzoquinona (''o''-benzoquinona), que es la 1,2-diona, y la ''para''-quinona o ''para''-benzoquinona (''p''-benzoquinona), que es la 1,4-diona. La parabenzoquinona es la forma [[Reacción redox orgánica|oxidada]] de la [[hidroquinona]] y la orto-benzoquinona es la forma oxidada del [[catecol]] (1,2-dihidroxibenceno). Por ejemplo, una [[Solucion (quimica)|solución]] [[ácido|ácida]] de [[yoduro de potasio]] reduce una solución de benzoquinona a hidroquinona, que es oxidada de nuevo con una solución de [[nitrato de plata]]. |
||
== Propiedades == |
|||
Las quinonas son derivados oxidados de compuestos aromáticos y a menudo se elaboran fácilmente a partir de compuestos aromáticos reactivos con sustitutos que donan electrones, como los [[Compuesto fenólico|fenoles]] y los [[Catecol|catecoles]], que aumentan la nucleofilia del anillo y contribuyen al gran [[Potencial de reducción|potencial redox]] necesario para romper la aromaticidad. (Las quinonas están conjugadas pero no son aromáticas). Las quinonas son [[Reacción de Michael|aceptadores de Michael]] electrofílicos estabilizados por conjugación. Dependiendo de la quinona y del lugar de reducción, la reducción puede rearomatizar el compuesto o romper la conjugación. La [[Adición conjugada|adición del conjugado]] casi siempre rompe la conjugación.<gallery> |
|||
Archivo:Orthobenzoquinone.svg|[[1,2-Benzoquinone]] |
|||
Archivo:P-Benzochinon.svg|[[1,4-Benzoquinona|1,4-Benzoquinone]] |
|||
Archivo:1,4-Naphthoquinone.svg|[[1,4-Naphthoquinone]] |
|||
Archivo:Anthrachinon.svg|[[Antraquinona|9,10-Anthraquinone]] |
|||
</gallery>El término quinona también se utiliza de manera más general para una gran clase de compuestos que se derivan oficialmente de las quinonas aromáticas mediante la sustitución de algunos átomos de hidrógeno por otros átomos o radicales. <gallery> |
|||
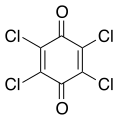
Archivo:2,3,5,6-tetrachloro-parabenzoquinone.svg|[[Cloranil]], un reactivo en química orgánica. |
|||
Archivo:HNQ.svg|[[Lawsona]] |
|||
Archivo:Alizaryna.svg|[[Alizarina|Alizarin]], un tinte rojo común. |
|||
Archivo:Dichlorodicyanobenzoquinone.svg|DDQ, un reactivo en química orgánica |
|||
Archivo:Daunorubicin2DACS.svg|[[Daunorrubicina|Daunorubicina]], un medicamento anticancerígeno<ref>Liu H., "Extraction and Isolation of Compounds from Herbal Medicines" in 'Traditional Herbal Medicine Research Methods', ed by Willow JH Liu 2011 John Wiley and Sons, Inc.</ref> |
|||
</gallery> |
|||
==Nomenclatura== |
|||
Las quinonas llevan un prefijo indicativo del origen ( "benzo-" para el [[benceno]], "nafto-" para el [[naftaleno]], "antra-" para el [[antraceno]]) y el sufijo "-quinona". |
|||
Se utilizan infijos multiplicadores para los [[carbonilo]]s ( "-di-", "-tri-", "-tetra-" (etc.)). |
|||
La palabra ''quinona'' alude a toda la clase de ciclohexanodionas. |
|||
== Presentación == |
== Presentación == |
||
* Después de sublimada, se presenta en largas |
* Después de [[Sublimación|sublimada]], se presenta en largas agujas brillantes, de color [[amarillo]] de [[oro]]. |
||
* Muy poco solubles en agua fría, aunque más en [[alcohol]] y [[ |
* Muy poco solubles en agua fría, aunque más en [[alcohol]] y [[Éter (química)|éter]]. |
||
== Hidroquinona == |
== Hidroquinona == |
||
Por la acción de los agentes reductores, como el [[ |
Por la acción de los agentes reductores, como el [[cloruro de hidrógeno]], [[Cloruro de estaño(II)|cloruro estannoso]], [[ácido yodhídrico]] o [[hidrógeno]] en presencia de [[Catálisis|catalizador metálico]] en [[hidroquinona]]. |
||
== Derivados == |
== Derivados == |
||
El [[cloro]] y los agentes clorurantes, como el [[clorato potásico]] en presencia del [[ácido clorhídrico]], lo transforman en |
El [[cloro]] y los agentes clorurantes, como el [[clorato de potasio|clorato potásico]] en presencia del [[ácido clorhídrico]], lo transforman en derivados clorados: |
||
* |
*[[Monocloroquinona]] |
||
* |
*[[Diclorohidroquinona]] |
||
* |
*[[Dicloroquinona]] |
||
* |
*[[Tricloroquinona]] |
||
* |
*[[Quinona perclorada]]. |
||
Con el [[bromo]] se producen los siguientes derivados: |
Con el [[bromo]] se producen los siguientes derivados: |
||
* |
*[[Quinona dibromada]] |
||
* |
*[[Quinona tribromada]] |
||
* |
*[[Quinona triclorobromada]]. |
||
Con el [[ |
Con el [[nitrógeno]] la quinona nitrada, y también derivados sulfoconjugados. |
||
== Ácido nítrico == |
== Ácido nítrico == |
||
El [[ácido nítrico]], auxiliado por la elevación de temperatura, lo descompone, dando lugar a la formación de lo siguiente: |
El [[ácido nítrico]], auxiliado por la elevación de la temperatura, lo descompone, dando lugar a la formación de lo siguiente: |
||
* [[Ácido pícrico]] |
* [[Ácido pícrico]] |
||
* [[Ácido oxálico]] |
* [[Ácido oxálico]] |
||
== Bioquímica == |
== Bioquímica == |
||
La quinona es un constituyente común de moléculas biológicamente relevantes (por ejemplo, la [[vitamina K|vitamina K1]] es filoquinona). Otros sirven como [[aceptor de electrones]] en cadenas de transporte de electrones como las de los [[fotosistema]]s I y II de la [[fotosíntesis]] y la [[respiración aeróbica]]. Un ejemplo natural de quinonas como [[ |
La quinona es un constituyente común de moléculas biológicamente relevantes (por ejemplo, la [[vitamina K|vitamina K1]] es [[filoquinona]]). Otros, como la [[plastoquinona]] y la [[Coenzima Q10|ubiquinona]], sirven como [[aceptor de electrones]] en cadenas de transporte de electrones como las de los [[fotosistema]]s I y II de la [[fotosíntesis]] y la [[respiración aeróbica]]. Un ejemplo natural de quinonas como [[Oxidante|agentes oxidantes]] es el espray de los [[Brachininae|escarabajos bombarderos]]. La [[hidroquinona]] se hace reaccionar con el [[peróxido de hidrógeno]] para producir una ráfaga ardiente de vapor, un fuerte elemento disuasorio en el mundo animal. Las quinonas pueden reducirse parcialmente a [[quinol]]es. |
||
== Química orgánica == |
== Química orgánica == |
||
La benzoquinona se usa en [[química orgánica]] como agente [[ |
La benzoquinona se usa en [[química orgánica]] como agente [[Reacción redox orgánica|oxidante]], y a veces también como reductor. Existen agentes incluso más fuertes, tales como el '''2,3,5,6-tetracloro-parabenzoquinona''' o '''p-cloranil''' y el '''2,3-diciano-5,6-dicloro-parabenzoquinona''' o '''DDQ'''. Estos, como el [[cloranil]], son los agentes oxidantes más fuertes que se conocen. |
||
Otros usos: |
|||
*Pigmentos, especialmente del color azul ([[alizarina]]). |
|||
*Producción industrial de [[peróxido de hidrógeno]]. |
|||
*Baterías eléctricas: está en estudio construir unas nuevas baterías eléctricas, más eficientes, basadas en las quinonas. |
|||
== Presencia en la naturaleza == |
== Presencia en la naturaleza == |
||
Las quinonas están ampliamente presentes en el mundo natural<ref>{{cita publicación|apellido=Liu|nombre=Ji Kai|título=Natural Terpenyls: Developement since 1877|publicación=Chemical Reviews|año=2006|volumen=106|páginas=2009-2223|doi=10.1021/cr050248c}}</ref> |
Las quinonas están ampliamente presentes en el mundo natural,<ref>{{cita publicación|apellido=Liu|nombre=Ji Kai|título=Natural Terpenyls: Developement since 1877|publicación=Chemical Reviews|año=2006|volumen=106|páginas=2009-2223|doi=10.1021/cr050248c}}</ref> y presentan pigmentaciones muy vistosas, como es el caso de la [[atromentina]], producida por el denominado "hongo sangrante", [[Hydnellum peckii]], por el color que esta le da. |
||
== Historia == |
== Historia == |
||
* La quinona fue descubierta por Woskresensky en la [[oxidación]] del ácido quínico, |
* La quinona fue descubierta por el ruso Woskresensky en la [[Reducción-oxidación|oxidación]] del [[ácido quínico]], en 1832 en la investigación de las propiedades farmacológicas del ácido quínico y su relación con la [[quinina]], entre los productos resultantes de la [[destilación]] seca del ácido quínico, punto de partida de cuerpos dotados de [[propiedad]]es [[química]]s semejantes de los [[carburo]]s cíclicos, [[compuesto químico|compuestos]] derivados de los [[carburo]]s [[benceno|bencénicos]]. |
||
* [[Friedrich Wöhler]] demostró también que la quinona se producía como resultado de la oxidación de la [[hidroquinona]] o de su descomposición pirogenada. |
* [[Friedrich Wöhler]] demostró también que la quinona se producía como resultado de la oxidación de la [[hidroquinona]] o de su descomposición pirogenada. |
||
* [[Alexandre Etard]] demostró que se produce de una manera [[síntesis|sintética]] haciendo hervir la [[bencina]] con el ácido [[cloro]]crómico. |
* [[Alexandre Etard]] demostró que se produce de una manera [[síntesis química|sintética]] haciendo hervir la [[Éter de petróleo|bencina]] con el ácido [[cloro]]crómico. |
||
* [[Léon Prunier]] la encontró entre los productos de [[reducción]] de la quercita por la acción del [[yoduro de hidrógeno|ácido iodhídrico]]. |
* [[Léon Prunier]] la encontró entre los productos de [[reducción-oxidación|reducción]] de la quercita por la acción del [[yoduro de hidrógeno|ácido iodhídrico]]. |
||
* Nietzwi la preparó oxidando la [[anilina]]. |
* Nietzwi la preparó oxidando la [[anilina]]. |
||
* [[August Wilhelm von Hofmann]] la obtuvo ejerciendo la misma |
* [[August Wilhelm von Hofmann]] la obtuvo ejerciendo la misma acción sobre la [[bencidina]] y la [[fenileno]][[diamina]]. |
||
* [[Georg Ludwig Carius]] preparó en grandes cantidades la quinona diclorada por la acción del [[anhídrido cloroso]] sobre la bencina. |
* [[Georg Ludwig Carius]] preparó en grandes cantidades la quinona diclorada por la acción del [[Óxido de cloro (III)|anhídrido cloroso]] sobre la bencina. |
||
* Levy y Schult la obtuvieron a través de la oxidación. |
* Levy y Schult la obtuvieron a través de la oxidación. |
||
* [[Carl Graebe]] obtuvo el |
* [[Carl Graebe]] obtuvo el derivado triclorado. |
||
* [[Hugo Erdmann]] descubrió la quinona perclorada. |
* [[Hugo Erdmann]] descubrió la quinona perclorada. |
||
* Laurent determinó la |
* Laurent determinó la relación que ligaba a la quinona con el [[fenol]]. |
||
* Fritzche, W.M. Hankel, [[Alfred Krieger]], [[John Stenhouse]], [[Robert Koch]] y otros, contribuyeron a completar el [[conocimiento]] de la quinona. |
* Fritzche, W.M. Hankel, [[Alfred Krieger]], [[John Stenhouse]], [[Robert Koch]] y otros, contribuyeron a completar el [[conocimiento]] de la quinona. |
||
==Ciclohexanodiona== |
|||
Las ciclohexanodionas hacen referencia a: |
|||
*1,2-Ciclohexanodiona |
|||
*1,3-Ciclohexanodiona |
|||
*1,4-Ciclohexanodiona |
|||
== Véase también == |
== Véase también == |
||
* |
*[[1,4-Benzoquinona|1,4-benzoquinona]]. |
||
* [[Coenzima Q10|Coenzima Q<sub>10</sub>]]. |
|||
* [[Plastoquinona]]. |
|||
* [[Reductasa]] |
|||
* [[Cinchona officinalis|Quina]]. |
|||
* [[Quinina]] |
|||
== Referencias == |
== Referencias == |
||
{{Listaref}} |
{{Listaref}} |
||
| ⚫ | |||
Bibliografía complementaria |
== Bibliografía complementaria == |
||
| ⚫ | |||
* '''Griesbeck, A.G.'''.- ''Quinones and heteroatom analogues'', Stuttgart, 2006. |
* '''Griesbeck, A.G.'''.- ''Quinones and heteroatom analogues'', Stuttgart, 2006. |
||
* '''Morton, Richard Alan''' (editor).- ''Biochemistry of quinones'', Londres, 1965. |
* '''Morton, Richard Alan''' (editor).- ''Biochemistry of quinones'', Londres, 1965. |
||
* '''Patai, Saul'''.- ''The chemistry of the quinonoid compounds'', Londres, 1974. |
* '''Patai, Saul'''.- ''The chemistry of the quinonoid compounds'', Londres, 1974. |
||
* '''Rokita, S. E.''' (editor).- ''Quinone methides'', Hoboken, 2009. |
* '''Rokita, S. E.''' (editor).- ''Quinone methides'', Hoboken, 2009. |
||
* '''Sies, Helmut''' (editor).- ''Quinones and quinone enzymes'', |
* '''Sies, Helmut''' (editor).- ''Quinones and quinone enzymes'', Ámsterdam, 2004- |
||
* '''Stevens, Mary Carol'''.- ''The effect of Pyrroloquinoline Quinone...'', Tesis, Harvard University, 1994. |
* '''Stevens, Mary Carol'''.- ''The effect of Pyrroloquinoline Quinone...'', Tesis, Harvard University, 1994. |
||
== Enlaces externos == |
== Enlaces externos == |
||
| ⚫ | |||
{{Commonscat|Quinones}} |
|||
| ⚫ | |||
{{Control de autoridades}} |
|||
[[Categoría:Quinonas| ]] |
[[Categoría:Quinonas| ]] |
||
Revisión actual - 17:57 7 ene 2024
La quinona es una clase de compuesto orgánico que deriva formalmente de compuestos aromáticos (como benceno, naftaleno o antraceno) mediante la conversión de un número par de grupos –CH = en grupos –C (= O) - con cualquier reordenamiento necesario de dobles enlaces, dando como resultado una estructura de diona cíclica completamente conjugada. Incluye algunos compuestos heterocíclicos .
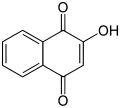
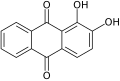
El miembro arquetípico de la clase es la 1,4-benzoquinona o ciclohexadienediona, a menudo llamada simplemente "quinona" (de ahí el nombre de la clase). Otros ejemplos importantes son la 1,2-benzoquinona (ortoquinona), la 1,4-naftoquinona y la 9,10-antraquinona.

Los isómeros son la orto-benzoquinona (o-benzoquinona), que es la 1,2-diona, y la para-quinona o para-benzoquinona (p-benzoquinona), que es la 1,4-diona. La parabenzoquinona es la forma oxidada de la hidroquinona y la orto-benzoquinona es la forma oxidada del catecol (1,2-dihidroxibenceno). Por ejemplo, una solución ácida de yoduro de potasio reduce una solución de benzoquinona a hidroquinona, que es oxidada de nuevo con una solución de nitrato de plata.
Propiedades
[editar]Las quinonas son derivados oxidados de compuestos aromáticos y a menudo se elaboran fácilmente a partir de compuestos aromáticos reactivos con sustitutos que donan electrones, como los fenoles y los catecoles, que aumentan la nucleofilia del anillo y contribuyen al gran potencial redox necesario para romper la aromaticidad. (Las quinonas están conjugadas pero no son aromáticas). Las quinonas son aceptadores de Michael electrofílicos estabilizados por conjugación. Dependiendo de la quinona y del lugar de reducción, la reducción puede rearomatizar el compuesto o romper la conjugación. La adición del conjugado casi siempre rompe la conjugación.
El término quinona también se utiliza de manera más general para una gran clase de compuestos que se derivan oficialmente de las quinonas aromáticas mediante la sustitución de algunos átomos de hidrógeno por otros átomos o radicales.
-
Cloranil, un reactivo en química orgánica.
-
Alizarin, un tinte rojo común.
-
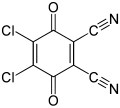
DDQ, un reactivo en química orgánica
-
Daunorubicina, un medicamento anticancerígeno[1]
Nomenclatura
[editar]Las quinonas llevan un prefijo indicativo del origen ( "benzo-" para el benceno, "nafto-" para el naftaleno, "antra-" para el antraceno) y el sufijo "-quinona".
Se utilizan infijos multiplicadores para los carbonilos ( "-di-", "-tri-", "-tetra-" (etc.)).
Presentación
[editar]- Después de sublimada, se presenta en largas agujas brillantes, de color amarillo de oro.
- Muy poco solubles en agua fría, aunque más en alcohol y éter.
Hidroquinona
[editar]Por la acción de los agentes reductores, como el cloruro de hidrógeno, cloruro estannoso, ácido yodhídrico o hidrógeno en presencia de catalizador metálico en hidroquinona.
Derivados
[editar]El cloro y los agentes clorurantes, como el clorato potásico en presencia del ácido clorhídrico, lo transforman en derivados clorados:
Con el bromo se producen los siguientes derivados:
Con el nitrógeno la quinona nitrada, y también derivados sulfoconjugados.
Ácido nítrico
[editar]El ácido nítrico, auxiliado por la elevación de la temperatura, lo descompone, dando lugar a la formación de lo siguiente:
Bioquímica
[editar]La quinona es un constituyente común de moléculas biológicamente relevantes (por ejemplo, la vitamina K1 es filoquinona). Otros, como la plastoquinona y la ubiquinona, sirven como aceptor de electrones en cadenas de transporte de electrones como las de los fotosistemas I y II de la fotosíntesis y la respiración aeróbica. Un ejemplo natural de quinonas como agentes oxidantes es el espray de los escarabajos bombarderos. La hidroquinona se hace reaccionar con el peróxido de hidrógeno para producir una ráfaga ardiente de vapor, un fuerte elemento disuasorio en el mundo animal. Las quinonas pueden reducirse parcialmente a quinoles.
Química orgánica
[editar]La benzoquinona se usa en química orgánica como agente oxidante, y a veces también como reductor. Existen agentes incluso más fuertes, tales como el 2,3,5,6-tetracloro-parabenzoquinona o p-cloranil y el 2,3-diciano-5,6-dicloro-parabenzoquinona o DDQ. Estos, como el cloranil, son los agentes oxidantes más fuertes que se conocen.
Otros usos:
- Pigmentos, especialmente del color azul (alizarina).
- Producción industrial de peróxido de hidrógeno.
- Baterías eléctricas: está en estudio construir unas nuevas baterías eléctricas, más eficientes, basadas en las quinonas.
Presencia en la naturaleza
[editar]Las quinonas están ampliamente presentes en el mundo natural,[2] y presentan pigmentaciones muy vistosas, como es el caso de la atromentina, producida por el denominado "hongo sangrante", Hydnellum peckii, por el color que esta le da.
Historia
[editar]- La quinona fue descubierta por el ruso Woskresensky en la oxidación del ácido quínico, en 1832 en la investigación de las propiedades farmacológicas del ácido quínico y su relación con la quinina, entre los productos resultantes de la destilación seca del ácido quínico, punto de partida de cuerpos dotados de propiedades químicas semejantes de los carburos cíclicos, compuestos derivados de los carburos bencénicos.
- Friedrich Wöhler demostró también que la quinona se producía como resultado de la oxidación de la hidroquinona o de su descomposición pirogenada.
- Alexandre Etard demostró que se produce de una manera sintética haciendo hervir la bencina con el ácido clorocrómico.
- Léon Prunier la encontró entre los productos de reducción de la quercita por la acción del ácido iodhídrico.
- Nietzwi la preparó oxidando la anilina.
- August Wilhelm von Hofmann la obtuvo ejerciendo la misma acción sobre la bencidina y la fenilenodiamina.
- Georg Ludwig Carius preparó en grandes cantidades la quinona diclorada por la acción del anhídrido cloroso sobre la bencina.
- Levy y Schult la obtuvieron a través de la oxidación.
- Carl Graebe obtuvo el derivado triclorado.
- Hugo Erdmann descubrió la quinona perclorada.
- Laurent determinó la relación que ligaba a la quinona con el fenol.
- Fritzche, W.M. Hankel, Alfred Krieger, John Stenhouse, Robert Koch y otros, contribuyeron a completar el conocimiento de la quinona.
Ciclohexanodiona
[editar]Las ciclohexanodionas hacen referencia a:
- 1,2-Ciclohexanodiona
- 1,3-Ciclohexanodiona
- 1,4-Ciclohexanodiona
Véase también
[editar]Referencias
[editar]- ↑ Liu H., "Extraction and Isolation of Compounds from Herbal Medicines" in 'Traditional Herbal Medicine Research Methods', ed by Willow JH Liu 2011 John Wiley and Sons, Inc.
- ↑ Liu, Ji Kai (2006). «Natural Terpenyls: Developement since 1877». Chemical Reviews 106: 2009-2223. doi:10.1021/cr050248c.
Bibliografía complementaria
[editar]- Montaner y Simon (editores).- Diccionario Enciclopédico Hispano-Americano, Barcelona, 1887-1910.
- Griesbeck, A.G..- Quinones and heteroatom analogues, Stuttgart, 2006.
- Morton, Richard Alan (editor).- Biochemistry of quinones, Londres, 1965.
- Patai, Saul.- The chemistry of the quinonoid compounds, Londres, 1974.
- Rokita, S. E. (editor).- Quinone methides, Hoboken, 2009.
- Sies, Helmut (editor).- Quinones and quinone enzymes, Ámsterdam, 2004-
- Stevens, Mary Carol.- The effect of Pyrroloquinoline Quinone..., Tesis, Harvard University, 1994.

![Daunorubicina, un medicamento anticancerígeno[1]](/upwiki/wikipedia/commons/thumb/7/73/Daunorubicin2DACS.svg/120px-Daunorubicin2DACS.svg.png)