Diferencia entre revisiones de «Haluro de ácido»
Enlace |
|||
| (No se muestran 36 ediciones intermedias de 24 usuarios) | |||
| Línea 1: | Línea 1: | ||
{{Referencias adicionales|t=20221120074317}} |
|||
[[Archivo:Acyl |
[[Archivo:Acyl-halide.svg|Haluro de ácido|right|miniaturadeimagen|222x222px]] |
||
Un '''haluro de ácido''' (o '''haluro de acilo''') es un compuesto derivado de un ácido al sustituir el grupo [[hidroxilo]] por un [[halógeno]]. |
Un '''haluro de ácido''' (o '''haluro de acilo''') es un compuesto derivado de un ácido al sustituir el grupo [[hidroxilo]] por un [[halógeno]]. |
||
Si el ácido es un [[ácido carboxílico]], el compuesto contiene un [[grupo funcional]] '''-COX'''. En ellos el [[carbono]] está unido a un radical o átomo de hidrógeno (R), a un oxígeno mediante un doble enlace y mediante un enlace simple (sigma) a un halógeno (X). |
Si el ácido es un [[ácido carboxílico]], el compuesto contiene un [[grupo funcional]] '''-COX'''. En ellos el [[carbono]] está unido a un radical o átomo de hidrógeno (R), a un oxígeno mediante un doble enlace y mediante un enlace simple (sigma) a un halógeno (X). |
||
Al resto procedente de eliminar el grupo OH se lo llama [[grupo acilo]]. Los halogenuros de ácido se nombran, entonces, anteponiendo el nombre del halógeno al del resto acilo, el cual se nombra reemplazando la terminación "oico" del ácido del que deriva por "ilo" |
Al resto procedente de eliminar el grupo OH se lo llama [[grupo acilo]]. Los halogenuros de ácido se nombran, entonces, anteponiendo el nombre del halógeno al del resto acilo, el cual se nombra reemplazando la terminación "oico" del ácido del que deriva por "ilo" |
||
Por ejemplo, el resto acilo derivado del [[ácido acético]] (CH<sub>3</sub>-CO-) es el acetilo. El cloruro de ácido derivado del |
Por ejemplo, el resto acilo derivado del [[ácido acético]] (CH<sub>3</sub>-CO-) es el acetilo. El cloruro de ácido derivado del acético, se nombrara por lo tanto, [[cloruro de acetilo]]. |
||
Estos compuestos dan reacciones de sustitución nucleofílica con mucha facilidad y son utilizados en reacciones de acilación (como la de [[Reacción de Friedel-Crafts|Frieldel-Crafts]]). |
Estos compuestos dan reacciones de sustitución nucleofílica con mucha facilidad y son utilizados en reacciones de [[acilación]] (como la de [[Reacción de Friedel-Crafts|Frieldel-Crafts]]). |
||
El grupo hidroxilo del [[ácido sulfónico]] también puede ser reemplazado por un halógeno, dando lugar a un ácido halosulfónico. Por ej., el ácido clorosulfónico resulta de reemplazar un grupo hidroxilo por un átomo de cloro. |
El grupo hidroxilo del [[ácido sulfónico]] también puede ser reemplazado por un halógeno, dando lugar a un ácido halosulfónico. Por ej., el [[ácido clorosulfónico]] resulta de reemplazar un grupo hidroxilo por un átomo de [[cloro]]. |
||
== Preparación == |
== Preparación == |
||
[[Archivo:Mecanismo cloruros de acido.gif|Mecanismo de reacción |
[[Archivo:Mecanismo cloruros de acido.gif|Mecanismo de reacción de R-COOH + SOCl<sub>2</sub>|derecha|frame]] |
||
Los métodos de laboratorio más comunes para la preparación de halogenuros de acilo incluyen la reacción del ácido carboxílico con [[cloruro de tionilo]] (SOCl<sub>2</sub>), [[pentacloruro de fósforo]] (PCl<sub>5</sub>) o [[cloruro de oxalilo]] ((COCl)<sub>2</sub>) para obtener el cloruro de acilo y con [[tribromuro de fósforo]] para el bromuro de acilo. |
Los métodos de laboratorio más comunes para la preparación de halogenuros de acilo incluyen la reacción del ácido carboxílico con [[cloruro de tionilo]] (SOCl<sub>2</sub>), [[pentacloruro de fósforo]] (PCl<sub>5</sub>) o [[cloruro de oxalilo]] ((COCl)<sub>2</sub>) para obtener el cloruro de acilo y con [[tribromuro de fósforo]] para el bromuro de acilo. |
||
== Reacciones == |
== Reacciones == |
||
Los halogenuros de ácido dan las típicas reacciones de sustitución nucleofílica de los derivados de ácido. |
Los halogenuros de ácido dan las típicas reacciones de sustitución nucleofílica de los derivados de ácido. |
||
=== Hidrólisis (conversión a ácidos)=== |
=== Hidrólisis (conversión a ácidos) === |
||
<math> R-COCl + H_2O \longrightarrow R-COOH + HCl</math> |
<math> R-COCl + H_2O \longrightarrow R-COOH + HCl</math> |
||
[[Archivo:mecanismo de hidrólisis de cloruros de alcanoílo.png|thumb|derecha|500px|Reacción general y mecanismo de la hidrólisis de un cloruro de alcanoílo/acilo.]] |
[[Archivo:mecanismo de hidrólisis de cloruros de alcanoílo.png|thumb|derecha|500px|Reacción general y mecanismo de la hidrólisis de un cloruro de alcanoílo/acilo.]] |
||
Esta reacción es un ejemplo típico del tipo de reacciones de [[sustitución nucleófila acílica]] mediante el mecanismo de adición-eliminación.<ref>Vollhardt, |
Esta reacción es un ejemplo típico del tipo de reacciones de [[sustitución nucleófila acílica]] mediante el mecanismo de adición-eliminación.<ref>Vollhardt, 2000, p. 886.</ref> El mecanismo es el siguiente: |
||
| ⚫ | |||
| ⚫ | |||
<math> R-COCl + R'-OH \longrightarrow R-COO-R' + HCl</math> |
<math> R-COCl + R'-OH \longrightarrow R-COO-R' + HCl</math> |
||
| ⚫ | |||
| ⚫ | |||
<math> R-COCl + 2NH_3 \longrightarrow R-CONH_2 + NH_4^+Cl^-</math> |
<math> R-COCl + 2NH_3 \longrightarrow R-CONH_2 + NH_4^+Cl^-</math> |
||
Las [[amina]]s primarias, secundarias y el [[amoníaco]] reaccionan con los cloruros de acilo para dar una [[amida]] más [[cloruro de hidrógeno]]. El último, puede ser neutralizado con una base o exceso de amina. En el mecanismo podemos ver que en la última etapa, el nitrógeno pierde un [[protón]] resultando la amida, por esto mismo, las aminas terciarias no forman amidas con cloruros de acilo.<ref>Vollhardt, |
Las [[amina]]s primarias, secundarias y el [[amoníaco]] reaccionan con los [[Cloruro de acilo|cloruros de acilo]] para dar una [[amida]] más [[cloruro de hidrógeno]]. El último, puede ser neutralizado con una base o exceso de amina. En el mecanismo podemos ver que en la última etapa, el nitrógeno pierde un [[protón]] resultando la amida, por esto mismo, las aminas terciarias no forman amidas con cloruros de acilo.<ref>Vollhardt, 2000, p. 887.</ref> |
||
[[Archivo:Mecanismo de formación de amidas a partir de cloruros de acilo.png|500px|miniatura|derecha|Mecanismo de la reacción de formación de amidas a partir de cloruros de acilo]] |
[[Archivo:Mecanismo de formación de amidas a partir de cloruros de acilo.png|500px|miniatura|derecha|Mecanismo de la reacción de formación de amidas a partir de cloruros de acilo]] |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
<math> R-COCl + R-COO^-Na^+ \longrightarrow (R-CO)_2O + Na^+Cl^-</math> |
<math> R-COCl + R-COO^-Na^+ \longrightarrow (R-CO)_2O + Na^+Cl^-</math> |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
<math> R-COCl + R'_2CuLi \longrightarrow R-CO-R' + Li^+Cl^- + R'Cu</math> |
<math> R-COCl + R'_2CuLi \longrightarrow R-CO-R' + Li^+Cl^- + R'Cu</math> |
||
Los compuestos organometálicos dan cetonas pero sin embargo, algunos de ellos pueden seguir reaccionando con las cetonas para terminar dando alcoholes, para prevenir esto, se utilizan diorganocupratos que previenen esto en vez de usar RLi o RMgX que son menos selectivos.<ref>Vollhardt, |
Los compuestos organometálicos dan [[cetonas]] pero sin embargo, algunos de ellos pueden seguir reaccionando con las cetonas para terminar dando alcoholes, para prevenir esto, se utilizan diorganocupratos que previenen esto en vez de usar RLi o RMgX que son menos selectivos.<ref>Vollhardt, 2000, p. 888.</ref> |
||
[[Archivo:reaccion de RCOCl con organometálicos.png|thumb|derecha|500px|Reacción entre un haluro de acilo y el [[reactivo de Gilman]].]] |
[[Archivo:reaccion de RCOCl con organometálicos.png|thumb|derecha|500px|Reacción entre un haluro de acilo y el [[reactivo de Gilman]].]] |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
<math> R-COCl + C_6H_6 \xrightarrow[]{AlCl_3} C_6H_5-CO-R + HCl</math> |
<math> R-COCl + C_6H_6 \xrightarrow[]{AlCl_3} C_6H_5-CO-R + HCl</math> |
||
===Conversión a alcoholes terciarios=== |
=== Conversión a alcoholes terciarios === |
||
<math> R-COCl + 2R'-MgI \longrightarrow R-COH-R'_2</math> |
<math> R-COCl + 2R'-MgI \longrightarrow R-COH-R'_2</math> |
||
| ⚫ | |||
| ⚫ | |||
=== Transposición de Curtius === |
|||
| ⚫ | |||
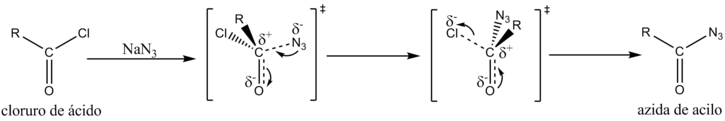
La [[transposición de Curtius]] es una reacción química que permite obtener una amina primaria al hacer reaccionar un haluro de ácido con [[azida de sodio]]. Se forma una azida de acilo como intermediario. La reacción ocurre mediante un mecanismo de reacción complejo, muy parecido al de la transposición de Hofmann, que incluye la trasposición del grupo alquilo. |
|||
[[Archivo:Curtius A.png|725px]] |
|||
| ⚫ | |||
== Referencias == |
== Referencias == |
||
{{ |
{{Listaref}} |
||
== Bibliografía == |
|||
* Vollhardt, K. Peter Parker. ''Química Orgánica''. 3.ª edición. Año 2000. Omega. Madrid. p. 886. ISBN 84-282-1172-8. |
|||
{{Control de autoridades}} |
|||
[[Categoría:Halogenuros]] |
[[Categoría:Halogenuros]] |
||
Revisión actual - 12:15 1 nov 2024

Un haluro de ácido (o haluro de acilo) es un compuesto derivado de un ácido al sustituir el grupo hidroxilo por un halógeno.
Si el ácido es un ácido carboxílico, el compuesto contiene un grupo funcional -COX. En ellos el carbono está unido a un radical o átomo de hidrógeno (R), a un oxígeno mediante un doble enlace y mediante un enlace simple (sigma) a un halógeno (X).
Al resto procedente de eliminar el grupo OH se lo llama grupo acilo. Los halogenuros de ácido se nombran, entonces, anteponiendo el nombre del halógeno al del resto acilo, el cual se nombra reemplazando la terminación "oico" del ácido del que deriva por "ilo" Por ejemplo, el resto acilo derivado del ácido acético (CH3-CO-) es el acetilo. El cloruro de ácido derivado del acético, se nombrara por lo tanto, cloruro de acetilo.
Estos compuestos dan reacciones de sustitución nucleofílica con mucha facilidad y son utilizados en reacciones de acilación (como la de Frieldel-Crafts).
El grupo hidroxilo del ácido sulfónico también puede ser reemplazado por un halógeno, dando lugar a un ácido halosulfónico. Por ej., el ácido clorosulfónico resulta de reemplazar un grupo hidroxilo por un átomo de cloro.
Preparación
[editar]
Los métodos de laboratorio más comunes para la preparación de halogenuros de acilo incluyen la reacción del ácido carboxílico con cloruro de tionilo (SOCl2), pentacloruro de fósforo (PCl5) o cloruro de oxalilo ((COCl)2) para obtener el cloruro de acilo y con tribromuro de fósforo para el bromuro de acilo.
Reacciones
[editar]Los halogenuros de ácido dan las típicas reacciones de sustitución nucleofílica de los derivados de ácido.
Hidrólisis (conversión a ácidos)
[editar]

Esta reacción es un ejemplo típico del tipo de reacciones de sustitución nucleófila acílica mediante el mecanismo de adición-eliminación.[1] El mecanismo es el siguiente:
Alcohólisis (conversión a ésteres)
[editar]
Amoniólisis/Aminolisis (conversión a amidas)
[editar]
Las aminas primarias, secundarias y el amoníaco reaccionan con los cloruros de acilo para dar una amida más cloruro de hidrógeno. El último, puede ser neutralizado con una base o exceso de amina. En el mecanismo podemos ver que en la última etapa, el nitrógeno pierde un protón resultando la amida, por esto mismo, las aminas terciarias no forman amidas con cloruros de acilo.[2]

Conversión a anhídrido de ácido
[editar]Su reacción con ésteres alcalinos da lugar a anhídridos:
Conversión a cetonas
[editar]a. Con Reactivo de Gilman
[editar]Mediante reactivos de Gilman dan cetonas y haluros organometálicos:
Los compuestos organometálicos dan cetonas pero sin embargo, algunos de ellos pueden seguir reaccionando con las cetonas para terminar dando alcoholes, para prevenir esto, se utilizan diorganocupratos que previenen esto en vez de usar RLi o RMgX que son menos selectivos.[3]

b. Acilación de Friedel-Crafts
[editar]Los haluros de alquilo pueden usarse para funcionalizar grupos arilo mediante la reacción de Friedel-Crafts:
Conversión a alcoholes terciarios
[editar]
Conversión a aldehídos
[editar]
Transposición de Curtius
[editar]La transposición de Curtius es una reacción química que permite obtener una amina primaria al hacer reaccionar un haluro de ácido con azida de sodio. Se forma una azida de acilo como intermediario. La reacción ocurre mediante un mecanismo de reacción complejo, muy parecido al de la transposición de Hofmann, que incluye la trasposición del grupo alquilo.
Referencias
[editar]Bibliografía
[editar]- Vollhardt, K. Peter Parker. Química Orgánica. 3.ª edición. Año 2000. Omega. Madrid. p. 886. ISBN 84-282-1172-8.






![{\displaystyle R-COCl+C_{6}H_{6}{\xrightarrow[{}]{AlCl_{3}}}C_{6}H_{5}-CO-R+HCl}](https://wikimedia.org/eswiki/api/rest_v1/media/math/render/svg/585b37b066b3fdbe7d1b68bd7f42cd3a88621287)

![{\displaystyle R-COCl+[(CH_{3})_{3}-CO]_{3}AlLi-H\longrightarrow R-CHO}](https://wikimedia.org/eswiki/api/rest_v1/media/math/render/svg/200790ce6cb62da855703d53bd39dff35c340112)