Diferencia entre revisiones de «1,3-adamantanodiol»
usos II |
m →Síntesis y usos: +enlaces |
||
| Línea 86: | Línea 86: | ||
El 1,3-adamantanodiol se puede preparar por [[oxidación]] del [[1-adamantanol]], en atmósfera de [[oxígeno]], empleando dos catalizadores: [[N-hidroxilftalimida|''N''-hidroxilftalimida]] (NHPI) y una sal de un [[metal de transición]] (por ejemplo de [[cobalto]]) en [[ácido acético glacial]]. Además de 1,3-adamantanodiol se obtiene [[1,3,5-adamantanotriol]], así como hidroxiacetonas y diacetonas de la serie del adamantano.<ref>{{cita publicación |apellidos= Ivleva, E.A.; Platonov, I.A.; Klimochkin, Yu.N. |nombre= |enlaceautor= |año=2015 |título=Improved approach towards synthesis of adamantane-1,3,5-triol |publicación= [[Russian Journal of General Chemistry]]|volumen=85 |número=8 |páginas= 1830-1833|ubicación= |editorial= |issn= |url=https://link.springer.com/article/10.1134%2FS1070363215080071 |fechaacceso=27 de octubre de 2018}}</ref> |
El 1,3-adamantanodiol se puede preparar por [[oxidación]] del [[1-adamantanol]], en atmósfera de [[oxígeno]], empleando dos catalizadores: [[N-hidroxilftalimida|''N''-hidroxilftalimida]] (NHPI) y una sal de un [[metal de transición]] (por ejemplo de [[cobalto]]) en [[ácido acético glacial]]. Además de 1,3-adamantanodiol se obtiene [[1,3,5-adamantanotriol]], así como hidroxiacetonas y diacetonas de la serie del adamantano.<ref>{{cita publicación |apellidos= Ivleva, E.A.; Platonov, I.A.; Klimochkin, Yu.N. |nombre= |enlaceautor= |año=2015 |título=Improved approach towards synthesis of adamantane-1,3,5-triol |publicación= [[Russian Journal of General Chemistry]]|volumen=85 |número=8 |páginas= 1830-1833|ubicación= |editorial= |issn= |url=https://link.springer.com/article/10.1134%2FS1070363215080071 |fechaacceso=27 de octubre de 2018}}</ref> |
||
El 1,3-adamanatanodiol puede emplearse para elaborar 1,3,5-adamantanotriol por medio de células de ''[[Kitasatospora]]'' sp. GF12 ([[ |
El 1,3-adamanatanodiol puede emplearse para elaborar 1,3,5-adamantanotriol por medio de células de ''[[Kitasatospora]]'' sp. GF12 ([[actinobacteria]] de la familia [[Streptomycetaceae]]).<ref>{{cita publicación |apellidos=Mitsukura, K.; Yamanaka, N.; Yoshida, T.; Nagasawa, T. |nombre= |enlaceautor= |año= 2012|título=Regioselective synthesis of 1,3,5-adamantanetriol from 1,3-adamantanediol using Kitasatospora cells |publicación= Biotechnology Letters|volumen=34 |número=9 |páginas=1741-1744 |ubicación=|editorial= |issn= |url= https://link.springer.com/article/10.1007%2Fs10529-012-0960-1 |fechaacceso=27 de octubre de 2018}}</ref> También se utiliza como [[Precursor químico|precursor]] para sintetizar compuestos de (1,3-adamantileno) bis-1,3-dicarbonilo, a los que se llega haciéndole reccionar con 1,3-dicetonas en presencia de [[Indio (elemento)|In]]([[triflato|OTf]]<sub>3</sub>).<ref>{{cita publicación |apellidos= Turmasova, A.A.; Konshin, V.V.; Konshina, Dzh.N.|nombre= |enlaceautor= |año=2014 |título= Synthesis of (1,3-adamantylene)bis-1,3-dicarbonyl compounds|publicación= [[Russian Journal of General Chemistry]]|volumen=84 |número= 7|páginas=273-1276 |ubicación= |editorial= |issn= |url= https://link.springer.com/article/10.1134%2FS1070363214070044|fechaacceso=27 de octubre de 2018}}</ref> |
||
== Precauciones == |
== Precauciones == |
||
Revisión del 11:02 27 oct 2018
| 1,3-adamantanodiol | ||
|---|---|---|
 | ||
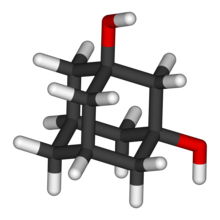 | ||
| Nombre IUPAC | ||
| Adamantano-1,3-diol | ||
| General | ||
| Otros nombres |
1,3-dihidroxiadamantano Triciclo[3.3.1.13,7]decano-1,3-diol | |
| Fórmula molecular | C10H16O2 | |
| Identificadores | ||
| Número CAS | 5001-18-3[1] | |
| ChemSpider | 498927 | |
| PubChem | 573829 | |
|
C1C2CC3(CC1CC(C2)(C3)O)O
| ||
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 1368 kg/m³; 1,368 g/cm³ | |
| Masa molar | 16 823 g/mol | |
| Punto de fusión | 258 °C (531 K) | |
| Punto de ebullición | 320 °C (593 K) | |
| Presión de vapor | 2,6 × 10-5 mmHg | |
| Índice de refracción (nD) | 1,656 | |
| Propiedades químicas | ||
| Solubilidad en agua | 5 g/L | |
| Solubilidad | Metanol | |
| log P | 0,52 | |
| Familia | Alcohol | |
| Peligrosidad | ||
| Punto de inflamabilidad | 432 K (159 °C) | |
| NFPA 704 |
1
0
0
| |
| Compuestos relacionados | ||
| alcoholes | 1-adamantanol | |
| dioles |
1,3-ciclopentanodiol 1,4-ciclohexanodiol | |
| polioles | 1,3,5-adamantanotriol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El 1,3-adamantanodiol es un diol alifático de fórmula molecular C10H16O2. Su estructura es la del adamantano (triciclo[3.3.1.13,7]decano) con dos grupos hidroxilo (-OH) en las posiciones 1 y 3. Es un compuesto quiral.
Propiedades físicas y químicas
El 1,3-adamantanodiol es un sólido blanco que tiene su punto de fusión a 258 °C y su punto de ebullición a 320 °C. Posee una densidad superior a la del agua, 1,368 g/cm3. El valor del logaritmo de su coeficiente de reparto, logP = 0,52, implica una solubilidad mayor en disolventes apolares que en agua. Así, es soluble en metanol pero muy poco soluble en agua (en torno a 5 g/L) . [2][3][4]
En cuanto a su reactividad, este compuesto es incompatible con agentes oxidantes fuertes.[5]
Síntesis y usos
El 1,3-adamantanodiol se puede preparar por oxidación del 1-adamantanol, en atmósfera de oxígeno, empleando dos catalizadores: N-hidroxilftalimida (NHPI) y una sal de un metal de transición (por ejemplo de cobalto) en ácido acético glacial. Además de 1,3-adamantanodiol se obtiene 1,3,5-adamantanotriol, así como hidroxiacetonas y diacetonas de la serie del adamantano.[6]
El 1,3-adamanatanodiol puede emplearse para elaborar 1,3,5-adamantanotriol por medio de células de Kitasatospora sp. GF12 (actinobacteria de la familia Streptomycetaceae).[7] También se utiliza como precursor para sintetizar compuestos de (1,3-adamantileno) bis-1,3-dicarbonilo, a los que se llega haciéndole reccionar con 1,3-dicetonas en presencia de In(OTf3).[8]
Precauciones
El 1,3-adamantanodiol es un producto tóxico por inhalación, contacto e ingestión. Es combustible y su punto de inflamabilidad es 159 ºC.[5]
Véase también
Los siguientes dioles son isómeros del 1,3-adamantanodiol:
Referencias
- ↑ Número CAS
- ↑ 1,3-Adamantanediol (ChemSpider)
- ↑ 1,3-Adamantanediol (PubChem)
- ↑ 1,3-Adamantanediol (Molbase)
- ↑ a b 1,3-Adamantanediol. Safety Data Sheet (TCI America)
- ↑ Ivleva, E.A.; Platonov, I.A.; Klimochkin, Yu.N. (2015). «Improved approach towards synthesis of adamantane-1,3,5-triol». Russian Journal of General Chemistry 85 (8): 1830-1833. Consultado el 27 de octubre de 2018.
- ↑ Mitsukura, K.; Yamanaka, N.; Yoshida, T.; Nagasawa, T. (2012). «Regioselective synthesis of 1,3,5-adamantanetriol from 1,3-adamantanediol using Kitasatospora cells». Biotechnology Letters 34 (9): 1741-1744. Consultado el 27 de octubre de 2018.
- ↑ Turmasova, A.A.; Konshin, V.V.; Konshina, Dzh.N. (2014). «Synthesis of (1,3-adamantylene)bis-1,3-dicarbonyl compounds». Russian Journal of General Chemistry 84 (7): 273-1276. Consultado el 27 de octubre de 2018.

