Diferencia entre revisiones de «1,3-adamantanodiol»
correcciones menores |
m Mantenimiento de Control de autoridades |
||
| Línea 112: | Línea 112: | ||
{{ORDENAR:Adamantanodiol13}} |
{{ORDENAR:Adamantanodiol13}} |
||
{{Control de autoridades}} |
|||
[[Categoría:Dioles]] |
[[Categoría:Dioles]] |
||
[[Categoría:Monómeros]] |
[[Categoría:Monómeros]] |
||
Revisión del 14:25 14 oct 2019
| 1,3-adamantanodiol | ||
|---|---|---|
 | ||
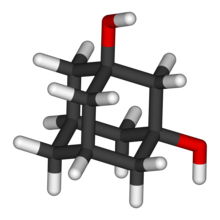 | ||
| Nombre IUPAC | ||
| Adamantano-1,3-diol | ||
| General | ||
| Otros nombres |
1,3-dihidroxiadamantano Triciclo[3.3.1.13,7]decano-1,3-diol | |
| Fórmula molecular | C10H16O2 | |
| Identificadores | ||
| Número CAS | 5001-18-3[1] | |
| ChemSpider | 498927 | |
| PubChem | 573829 | |
|
C1C2CC3(CC1CC(C2)(C3)O)O
| ||
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 1368 kg/m³; 1,368 g/cm³ | |
| Masa molar | 16 823 g/mol | |
| Punto de fusión | 258 °C (531 K) | |
| Punto de ebullición | 320 °C (593 K) | |
| Presión de vapor | 2,6 × 10-5 mmHg | |
| Índice de refracción (nD) | 1,656 | |
| Propiedades químicas | ||
| Solubilidad en agua | 5 g/L | |
| Solubilidad | Metanol | |
| log P | 0,52 | |
| Familia | Alcohol | |
| Peligrosidad | ||
| Punto de inflamabilidad | 432 K (159 °C) | |
| NFPA 704 |
1
0
0
| |
| Compuestos relacionados | ||
| alcoholes | 1-adamantanol | |
| dioles |
1,3-ciclopentanodiol 1,4-ciclohexanodiol | |
| polioles | 1,3,5-adamantanotriol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El 1,3-adamantanodiol es un diol alifático de fórmula molecular C10H16O2. Su estructura es la del adamantano (triciclo[3.3.1.13,7]decano) con dos grupos hidroxilo (-OH) en las posiciones 1 y 3. Es un compuesto quiral.
Propiedades físicas y químicas
El 1,3-adamantanodiol es un sólido blanco que tiene su punto de fusión a 258 °C y su punto de ebullición a 320 °C. Posee una densidad superior a la del agua, 1,368 g/cm3. El valor del logaritmo de su coeficiente de reparto, logP = 0,52, implica una solubilidad mayor en disolventes apolares que en agua. Así, es soluble en metanol pero muy poco soluble en agua (en torno a 5 g/L) . [2][3][4]
En cuanto a su reactividad, este compuesto es incompatible con agentes oxidantes fuertes.[5]
Síntesis
El 1,3-adamantanodiol se puede preparar por oxidación de adamantano, la cual se lleva a cabo con ácido hipocloroso (o una de sus sales como hipoclorito de sodio) en presencia de un catalizador de rutenio. Este último puede ser dióxido de rutenio, tetraóxido de rutenio o rutenio hidratado.[6] Alternativamente, dicha oxidación puede hacerse en ausencia de metales, utilizando un sistema catalítico de N-hidroxilftalimida con bromuro de amonio.[7]
Otra ruta de síntesis implica la halogenación del adamantano con ácido clorosulfónico; al adamantano-1,3-dihalogenado así formado se le hace reaccionar con agua en presencia de un disolvente orgánico soluble, como N,N-dimetilformamida, y una sal de un metal alcalino o alcalinotérreo de un ácido carboxílico, como por ejemplo acetato de sodio.[8]
También se puede oxidar el 1-adamantanol en atmósfera de oxígeno empleando dos catalizadores: N-hidroxilftalimida y una sal de un metal de transición (por ejemplo de cobalto) en ácido acético glacial. En este caso, además de 1,3-adamantanodiol se obtiene 1,3,5-adamantanotriol, así como hidroxiacetonas y diacetonas de la serie del adamantano.[9] También se ha investigado la bioconversión de 1-adamantanol a 1,3-adamantanodiol por medio de microorganismos del suelo. La actinobacteria del suelo Streptomyces sp. SA8 es la que muestra una mayor actividad de hidroxilación —con un rendimiento de conversión del 95%—, apareciendo como subproducto 1,4-adamantanodiol.[10]
Otra alternativa para obtener este diol es por oxidación electroquímica anódica del adamantano en ácido trifluoroacético, seguida de un tratamiento de hidrólisis. El rendimiento obtenido con este método es del 70%.[11]
Usos
El 1,3-adamanatanodiol puede emplearse para elaborar 1,3,5-adamantanotriol por medio de células de Kitasatospora sp. GF12 (actinobacteria de la familia Streptomycetaceae).[12] También se utiliza como precursor para sintetizar compuestos de (1,3-adamantileno) bis-1,3-dicarbonilo, a los que se llega haciéndole reccionar con 1,3-dicetonas en presencia de In(OTf3).[13]
El 1,3-adamantanodiol se emplea como materia prima para fabricar materiales funcionales y materiales electrónicos. Los derivados del adamantano presentan gran resistencia al calor y los polímeros con estas propiedades tienen aplicación como materiales electrónicos, por ejemplo semiconductores.[8] Igualmente, el 1,3-adamantanodiol se ha utilizado para fabricar poliuretanos que tienen buenas propiedades mecánicas y amplia transición vítrea. Debido a su gran impedimento estérico, este diol interrumpe la disposición regular de las cadenas de poliuretano contribuyendo a formar un dominio amorfo. Conforma polímeros que se caracterizan por tener «memoria de forma» con una tasa de recuperación de forma del 91%.[14]
Precauciones
El 1,3-adamantanodiol es un producto tóxico por inhalación, contacto e ingestión. Es combustible y su punto de inflamabilidad es 159 ºC.[5]
Véase también
Los siguientes dioles son isómeros del 1,3-adamantanodiol:
Referencias
- ↑ Número CAS
- ↑ 1,3-Adamantanediol (ChemSpider)
- ↑ 1,3-Adamantanediol (PubChem)
- ↑ 1,3-Adamantanediol (Molbase)
- ↑ a b 1,3-Adamantanediol. Safety Data Sheet (TCI America)
- ↑ Method for producing adamantanepolyol. Furukawa, K. et al. (2000) Patente JP2001335519A
- ↑ Matsunaka, K.; Iwahama, T.; Sakaguchi, S.; Ishii, Y. (1999). «A remarkable effect of quaternary ammonium bromide for the N-hydroxyphthalimide-catalyzed aerobic oxidation of hydrocarbons». Tetrahedron Letters 40 (11): 2165-2168. Consultado el 27 de octubre de 2018.
- ↑ a b Method for producing 1,3-adamantanediol. Tanaka, N. et al. (2003) Patente JP2005082563A
- ↑ Ivleva, E.A.; Platonov, I.A.; Klimochkin, Yu.N. (2015). «Improved approach towards synthesis of adamantane-1,3,5-triol». Russian Journal of General Chemistry 85 (8): 1830-1833. Consultado el 27 de octubre de 2018.
- ↑ Mitsukura, K.; Sakamoto, H.; Kubo, H. ;Yoshida, T.; Nagasawa, T. (2010). «Bioconversion of 1-adamantanol to 1,3-adamantanediol using Streptomyces sp. SA8 oxidation system». Journal of Bioscience and Bioengineering 109 (6): 550-553. Consultado el 27 de octubre de 2018.
- ↑ Bewick, A.; Edwards, G.J.; Jones, S.R.; Mellor, J.M. (1977). «Electrochemical difunctionalisation of adamantane and further oxidation of substituted adamantanes». J. Chem. Soc., Perkin Trans. 1: 1831-1834. Consultado el 27 de octubre de 2018.
- ↑ Mitsukura, K.; Yamanaka, N.; Yoshida, T.; Nagasawa, T. (2012). «Regioselective synthesis of 1,3,5-adamantanetriol from 1,3-adamantanediol using Kitasatospora cells». Biotechnology Letters 34 (9): 1741-1744. Consultado el 27 de octubre de 2018.
- ↑ Turmasova, A.A.; Konshin, V.V.; Konshina, Dzh.N. (2014). «Synthesis of (1,3-adamantylene)bis-1,3-dicarbonyl compounds». Russian Journal of General Chemistry 84 (7): 273-1276. Consultado el 27 de octubre de 2018.
- ↑ Zou,F.; Chen, H.; Fua, S.; Chen, S. (2018). «Shape memory materials based on adamantane-containing polyurethanes». RSC Advances 8: 25584-25591. Consultado el 27 de octubre de 2018.

