Diferencia entre revisiones de «Arilciclohexilamina»
m Bot: añadiendo espacio luego de una referencia. Su omisión causa problemas de visualización bajo ciertas circunstancias. Véase Espacio después de las referencias. |
m Bot: ajustando referencias al Manual de estilo. Las referencias y notas al pie deben ir junto a los signos de puntuación. |
||
| Línea 3: | Línea 3: | ||
== Historia == |
== Historia == |
||
Se cree que la [[fenciclidina]] (PCP) haya sido la primera arilciclohexilamina con propiedades anestésicas reconocidas, pero en la literatura científica se describieron varias arilciclohexilaminas antes que la PCP. Comenzando con PCA (1-fenilciclohexano-1-amina), cuya síntesis se publicó por primera vez en 1907. [[Eticiclidina|El PCE]] se reportó en 1953, el PCMo (4-(1-fenil-ciclohexil)-morfolina<ref>{{Cita web|url=https://www.chemsrc.com/cas/2201-40-3_1255636.html|título=4-(1-phenyl-cyclohexyl)-morpholine|fechaacceso=2021-03-15|sitioweb=CAS Number Search - chemsrc.com|editorial=chemsrc}}</ref> en 1954, y el PCMo se describió poco después como un potente sedante.<ref name="Morris">{{Cita publicación|título=From PCP to MXE: a comprehensive review of the non-medical use of dissociative drugs|apellidos=Morris H, Wallach J|publicación=Drug Testing and Analysis|volumen=6|número=7–8|páginas=614–32|doi=10.1002/dta.1620|pmid=24678061|año=2014}}</ref> Los anestésicos de arilciclohexilamina se investigaron intensamente en Parke-Davis, comenzando con la síntesis de [[fenciclidina]] en 1956 y más tarde con el compuesto relacionado [[ketamina]] . |
Se cree que la [[fenciclidina]] (PCP) haya sido la primera arilciclohexilamina con propiedades anestésicas reconocidas, pero en la literatura científica se describieron varias arilciclohexilaminas antes que la PCP. Comenzando con PCA (1-fenilciclohexano-1-amina), cuya síntesis se publicó por primera vez en 1907. [[Eticiclidina|El PCE]] se reportó en 1953, el PCMo (4-(1-fenil-ciclohexil)-morfolina<ref>{{Cita web|url=https://www.chemsrc.com/cas/2201-40-3_1255636.html|título=4-(1-phenyl-cyclohexyl)-morpholine|fechaacceso=2021-03-15|sitioweb=CAS Number Search - chemsrc.com|editorial=chemsrc}}</ref> en 1954, y el PCMo se describió poco después como un potente sedante.<ref name="Morris">{{Cita publicación|título=From PCP to MXE: a comprehensive review of the non-medical use of dissociative drugs|apellidos=Morris H, Wallach J|publicación=Drug Testing and Analysis|volumen=6|número=7–8|páginas=614–32|doi=10.1002/dta.1620|pmid=24678061|año=2014}}</ref> Los anestésicos de arilciclohexilamina se investigaron intensamente en Parke-Davis, comenzando con la síntesis de [[fenciclidina]] en 1956 y más tarde con el compuesto relacionado [[ketamina]] .<ref name="Morris" /> La década de 1970 vio el debut de estos compuestos, especialmente PCP y sus análogos, como [[Uso recreativo de drogas|drogas recreativas]] de uso ilícito debido a sus efectos [[Droga disociativa|disociativos]] [[Alucinógeno|alucinógenos]] y [[Euforia (estado)|euforizantes]] . Desde entonces, la clase ha sido ampliada por [[Método científico|investigaciones científicas]] de agentes [[Estimulante|estimulantes]], [[Analgésico|analgésicos]] y [[Neuroprotección|neuroprotectores]], así como también por [[Químico|químicos]] [[wiktionary:clandestine|clandestinos]] en busca de nuevas [[Uso recreativo de drogas|drogas recreativas]] .<ref>{{Cita libro|título=Designer Drugs Directory|editorial=Elsevier|fecha=1998|isbn=0-444-20525-X}}</ref> <ref name="pmid30105474">{{Cita libro|capítulo=Phencyclidine-Based New Psychoactive Substances|volumen=252|páginas=261–303|fecha=August 2018|pmid=30105474|doi=10.1007/164_2018_124|serie=Handbook of Experimental Pharmacology|isbn=978-3-030-10560-0|título=New Psychoactive Substances}}</ref> <ref>{{Cita publicación|título=1,2-Diarylethylamine- and Ketamine-Based New Psychoactive Substances|apellidos=Wallach J, Brandt SD|publicación=Handbook of Experimental Pharmacology|volumen=252|páginas=305–352|doi=10.1007/164_2018_148|pmid=30196446|isbn=978-3-030-10560-0|año=2018}}</ref> |
||
== Estructura == |
== Estructura == |
||
| Línea 10: | Línea 10: | ||
== Farmacología == |
== Farmacología == |
||
Las arilciclohexilaminas poseen propiedades antagonistas del receptor NMDA,<ref name="pmid16229117">{{Cita publicación|título=Synthesis and biological properties of 2-hydroxy-1-(1-phenyltetralyl)piperidine and some of its intermediates as derivatives of phencyclidine|apellidos=Ahmadi A, Mahmoudi A|publicación=Arzneimittel-Forschung|volumen=55|número=9|páginas=528–32|doi=10.1055/s-0031-1296900|pmid=16229117|año=2005}}</ref><ref name="pmid21215770">{{Cita publicación|título=New morpholine analogues of phencyclidine: chemical synthesis and pain perception in rats|apellidos=Ahmadi A, Khalili M, Hajikhani R, Naserbakht M|fecha=April 2011|publicación=Pharmacology, Biochemistry, and Behavior|volumen=98|número=2|páginas=227–33|doi=10.1016/j.pbb.2010.12.019|pmid=21215770}}</ref> inhibidoras de la recaptación de dopamina, |
Las arilciclohexilaminas poseen propiedades antagonistas del receptor NMDA,<ref name="pmid16229117">{{Cita publicación|título=Synthesis and biological properties of 2-hydroxy-1-(1-phenyltetralyl)piperidine and some of its intermediates as derivatives of phencyclidine|apellidos=Ahmadi A, Mahmoudi A|publicación=Arzneimittel-Forschung|volumen=55|número=9|páginas=528–32|doi=10.1055/s-0031-1296900|pmid=16229117|año=2005}}</ref><ref name="pmid21215770">{{Cita publicación|título=New morpholine analogues of phencyclidine: chemical synthesis and pain perception in rats|apellidos=Ahmadi A, Khalili M, Hajikhani R, Naserbakht M|fecha=April 2011|publicación=Pharmacology, Biochemistry, and Behavior|volumen=98|número=2|páginas=227–33|doi=10.1016/j.pbb.2010.12.019|pmid=21215770}}</ref> inhibidoras de la recaptación de dopamina,<ref name="pmid2544905">{{Cita publicación|título=Role of the aromatic group in the inhibition of phencyclidine binding and dopamine uptake by PCP analogs|url=https://archive.org/details/sim_pharmacology-biochemistry-and-behavior_1989-03_32_3/page/699|apellidos=Chaudieu I, Vignon J, Chicheportiche M, Kamenka JM, Trouiller G, Chicheportiche R|fecha=March 1989|publicación=Pharmacology, Biochemistry, and Behavior|volumen=32|número=3|páginas=699–705|doi=10.1016/0091-3057(89)90020-8|pmid=2544905}}</ref> y [[Agonista|agonistas]] [[Receptor opioide mu|del receptor opioide μ]] <ref name="pmid6086884">{{Cita publicación|título=A novel phencyclidine analog interacts selectively with mu opioid receptors|apellidos=Itzhak Y, Simon EJ|fecha=August 1984|publicación=The Journal of Pharmacology and Experimental Therapeutics|volumen=230|número=2|páginas=383–6|pmid=6086884}}</ref>. Además, se han informado acciones agonistas del receptor σ,<ref name="pmid8098066">{{Cita publicación|título=Synthesis and biological evaluation of 1-[1-(2-benzo[b]thienyl)cyclohexyl]piperidine homologues at dopamine-uptake and phencyclidine- and sigma-binding sites|apellidos=He XS, Raymon LP, Mattson MV, Eldefrawi ME, de Costa BR|fecha=April 1993|publicación=Journal of Medicinal Chemistry|volumen=36|número=9|páginas=1188–93|doi=10.1021/jm00061a009|pmid=8098066}}</ref> antagonistas del [[Receptor nicotínico|receptor nACh]],<ref name="pmid10456235">{{Cita publicación|título=Determinants of phencyclidine potency on the nicotinic acetylcholine receptors from muscle and electric organ|apellidos=Eterović VA, Lu R, Eakin AE, Rodríguez AD, Ferchmin PA|fecha=December 1999|publicación=Cellular and Molecular Neurobiology|volumen=19|número=6|páginas=745–57|doi=10.1023/A:1006905106834|pmid=10456235}}</ref> y agonistas del receptor D<sub>2</sub><ref name="pmid15852061">{{Cita publicación|título=Dopamine receptor contribution to the action of PCP, LSD and ketamine psychotomimetics|apellidos=Seeman P, Ko F, Tallerico T|fecha=September 2005|publicación=Molecular Psychiatry|volumen=10|número=9|páginas=877–83|doi=10.1038/sj.mp.4001682|pmid=15852061}}</ref> para algunos de estos agentes farmacológicos. El antagonismo del receptor NMDA confiere efectos anestésicos, [[Antiepiléptico|anticonvulsivos]], neuroprotectores y [[Droga disociativa|disociativos]]. Por su parte, el bloqueo del [[transportador de dopamina]] produce efectos estimulantes y euforizantes, así como [[psicosis]] en grandes cantidades; y la activación del receptor opioide μ provoca efectos analgésicos y euforizantes. La estimulación de los receptores σ y D <sub>2</sub> también puede contribuir a los efectos alucinógenos y psicotomiméticos característicos de muchas de estas drogas.<ref name="pmid15852061" /> |
||
Las arilciclohexilaminas son agentes versátiles con una amplia gama de posibles actividades farmacológicas dependiendo de la extensión y el rango en el que se implementen las modificaciones químicas.<ref>{{Cita publicación|título=New analgesics derived from the phencyclidine analogue thienylcyclidine|apellidos=al-Deeb OA|fecha=May 1996|publicación=Arzneimittel-Forschung|volumen=46|número=5|páginas=505–8|pmid=8737636}}</ref><ref>{{Cita publicación|título=Synthesis and study the analgesic effects of new analogues of ketamine on female wistar rats|apellidos=Ahmadi A, Khalili M, Hajikhani R, Hosseini H, Afshin N, Nahri-Niknafs B|fecha=March 2012|publicación=Medicinal Chemistry|volumen=8|número=2|páginas=246–51|doi=10.2174/157340612800493683|pmid=22385170}}</ref><ref>{{Cita publicación|título=Synthesis and study on analgesic effects of 1-[1-(4-methylphenyl) (cyclohexyl)] 4-piperidinol and 1-[1-(4-methoxyphenyl) (cyclohexyl)] 4-piperidinol as two new phencyclidine derivatives|apellidos=Ahmadi A, Khalili M, Abbassi S, Javadi M, Mahmoudi A, Hajikhani R|publicación=Arzneimittel-Forschung|volumen=59|número=4|páginas=202–6|doi=10.1055/s-0031-1296386|pmid=19517897|año=2009}}</ref> <ref>{{Cita publicación|título=Synthesis and pain perception of new analogues of phencyclidine in NMRI male mice|apellidos=Ahmadi A, Khalili M, Marami S, Ghadiri A, Nahri-Niknafs B|fecha=January 2014|publicación=Mini Reviews in Medicinal Chemistry|volumen=14|número=1|páginas=64–71|doi=10.2174/1389557513666131119203551|pmid=24251803}}</ref> <ref>{{Cita publicación|título=Synthesis and analgesic effects of new pyrrole derivatives of phencyclidine in mice|apellidos=Ahmadi A, Solati J, Hajikhani R, Pakzad S|publicación=Arzneimittel-Forschung|volumen=61|número=5|páginas=296–300|doi=10.1055/s-0031-1296202|pmid=21755813|año=2011}}</ref><ref>{{Cita publicación|título=Synthesis and determination of chronic and acute thermal and chemical pain activities of a new derivative of phencyclidine in rats|apellidos=Ahmadi A, Khalili M, Hajikhani R, Barghi L, Mihandoust F|publicación=Iranian Journal of Pharmaceutical Research|volumen=9|número=4|páginas=379–85|pmc=3870061|pmid=24381602|año=2010}}</ref> <ref>{{Cita publicación|título=Synthesis and determination of acute and chronic pain activities of 1-[1-(3-methylphenyl) (tetralyl)]piperidine as a new derivative of phencyclidine via tail immersion and formalin tests|apellidos=Ahmadi A, Khalili M, Mihandoust F, Barghi L|publicación=Arzneimittel-Forschung|volumen=60|número=1|páginas=30–5|doi=10.1055/s-0031-1296245|pmid=20184224|año=2010}}</ref><ref>{{Cita publicación|título=Effect of phencyclidine derivatives on anxiety-like behavior using an elevated-plus maze test in mice|apellidos=Hajikhani R, Ahmadi A, Naderi N, Yaghoobi K, Shirazizand Z, Rezaee NM, Niknafs BN|publicación=Advances in Clinical and Experimental Medicine|volumen=21|número=3|páginas=307–12|pmid=23214193|año=2012}}</ref> <ref>{{Cita publicación|título=Synthesis and Antinociception Activities of Some Novel Derivatives of Phencyclidine with Substituted Aminobenzothiazoles|apellidos=Ahmadi A, Khalili M, Mirza B, Mohammadi-Diz M, Azami-Lorestani F, Ghaderi P, Nahri-Niknafs B|publicación=Mini Reviews in Medicinal Chemistry|volumen=17|número=1|páginas=78–84|doi=10.2174/1389557516666160428112532|pmid=27121715|año=2017}}</ref> Las diversas elecciones de sustituciones que se realizan permiten un "ajuste fino" del perfil farmacológico resultante. Como ejemplos, BTCP es un inhibidor selectivo de la recaptación de dopamina,<ref name="pmid2544905" /> PCP es principalmente antagonista NMDA, |
Las arilciclohexilaminas son agentes versátiles con una amplia gama de posibles actividades farmacológicas dependiendo de la extensión y el rango en el que se implementen las modificaciones químicas.<ref>{{Cita publicación|título=New analgesics derived from the phencyclidine analogue thienylcyclidine|apellidos=al-Deeb OA|fecha=May 1996|publicación=Arzneimittel-Forschung|volumen=46|número=5|páginas=505–8|pmid=8737636}}</ref><ref>{{Cita publicación|título=Synthesis and study the analgesic effects of new analogues of ketamine on female wistar rats|apellidos=Ahmadi A, Khalili M, Hajikhani R, Hosseini H, Afshin N, Nahri-Niknafs B|fecha=March 2012|publicación=Medicinal Chemistry|volumen=8|número=2|páginas=246–51|doi=10.2174/157340612800493683|pmid=22385170}}</ref><ref>{{Cita publicación|título=Synthesis and study on analgesic effects of 1-[1-(4-methylphenyl) (cyclohexyl)] 4-piperidinol and 1-[1-(4-methoxyphenyl) (cyclohexyl)] 4-piperidinol as two new phencyclidine derivatives|apellidos=Ahmadi A, Khalili M, Abbassi S, Javadi M, Mahmoudi A, Hajikhani R|publicación=Arzneimittel-Forschung|volumen=59|número=4|páginas=202–6|doi=10.1055/s-0031-1296386|pmid=19517897|año=2009}}</ref> <ref>{{Cita publicación|título=Synthesis and pain perception of new analogues of phencyclidine in NMRI male mice|apellidos=Ahmadi A, Khalili M, Marami S, Ghadiri A, Nahri-Niknafs B|fecha=January 2014|publicación=Mini Reviews in Medicinal Chemistry|volumen=14|número=1|páginas=64–71|doi=10.2174/1389557513666131119203551|pmid=24251803}}</ref> <ref>{{Cita publicación|título=Synthesis and analgesic effects of new pyrrole derivatives of phencyclidine in mice|apellidos=Ahmadi A, Solati J, Hajikhani R, Pakzad S|publicación=Arzneimittel-Forschung|volumen=61|número=5|páginas=296–300|doi=10.1055/s-0031-1296202|pmid=21755813|año=2011}}</ref><ref>{{Cita publicación|título=Synthesis and determination of chronic and acute thermal and chemical pain activities of a new derivative of phencyclidine in rats|apellidos=Ahmadi A, Khalili M, Hajikhani R, Barghi L, Mihandoust F|publicación=Iranian Journal of Pharmaceutical Research|volumen=9|número=4|páginas=379–85|pmc=3870061|pmid=24381602|año=2010}}</ref> <ref>{{Cita publicación|título=Synthesis and determination of acute and chronic pain activities of 1-[1-(3-methylphenyl) (tetralyl)]piperidine as a new derivative of phencyclidine via tail immersion and formalin tests|apellidos=Ahmadi A, Khalili M, Mihandoust F, Barghi L|publicación=Arzneimittel-Forschung|volumen=60|número=1|páginas=30–5|doi=10.1055/s-0031-1296245|pmid=20184224|año=2010}}</ref><ref>{{Cita publicación|título=Effect of phencyclidine derivatives on anxiety-like behavior using an elevated-plus maze test in mice|apellidos=Hajikhani R, Ahmadi A, Naderi N, Yaghoobi K, Shirazizand Z, Rezaee NM, Niknafs BN|publicación=Advances in Clinical and Experimental Medicine|volumen=21|número=3|páginas=307–12|pmid=23214193|año=2012}}</ref> <ref>{{Cita publicación|título=Synthesis and Antinociception Activities of Some Novel Derivatives of Phencyclidine with Substituted Aminobenzothiazoles|apellidos=Ahmadi A, Khalili M, Mirza B, Mohammadi-Diz M, Azami-Lorestani F, Ghaderi P, Nahri-Niknafs B|publicación=Mini Reviews in Medicinal Chemistry|volumen=17|número=1|páginas=78–84|doi=10.2174/1389557516666160428112532|pmid=27121715|año=2017}}</ref> Las diversas elecciones de sustituciones que se realizan permiten un "ajuste fino" del perfil farmacológico resultante. Como ejemplos, BTCP es un inhibidor selectivo de la recaptación de dopamina,<ref name="pmid2544905" /> PCP es principalmente antagonista NMDA,<ref name="pmid16229117" /> y BDPC es un potente agonista de opioides μ,<ref name="pmid513062">{{Cita publicación|título=4-(p-Bromophenyl)-4-(dimethylamino)-1-phenethylcyclohexanol, an extremely potent respresentative of a new analgesic series|apellidos=Lednicer D, VonVoigtlander PF|fecha=October 1979|publicación=Journal of Medicinal Chemistry|volumen=22|número=10|páginas=1157–8|doi=10.1021/jm00196a001|pmid=513062}}</ref> mientras que PRE-084 es un agonista selectivo del receptor sigma.<ref name="pmid7886099">{{Cita publicación|url=https://zenodo.org/record/1258299|título=PRE-084, a sigma selective PCP derivative, attenuates MK-801-induced impairment of learning in mice|apellidos=Maurice T, Su TP, Parish DW, Nabeshima T, Privat A|fecha=December 1994|publicación=Pharmacology, Biochemistry, and Behavior|volumen=49|número=4|páginas=859–69|doi=10.1016/0091-3057(94)90235-6|pmid=7886099}}</ref> Por lo tanto, es posible una farmacología radicalmente diferente a través de diferentes combinaciones estructurales dentro de la misma familia de las arilciclohexilaminas. |
||
== Lista de arilciclohexilaminas == |
== Lista de arilciclohexilaminas == |
||
| Línea 719: | Línea 719: | ||
== Compuestos relacionados == |
== Compuestos relacionados == |
||
Existen otros compuestos similares en los que se ha variado el anillo base o en los que se ha reemplazado la cadena de amina con otros grupos.<ref>Wallach JV. Structure activity relationship (SAR) studies of arylcycloalkylamines as N-methyl-D-aspartate receptor antagonists. PhD. Thesis, University of the Sciences in Philadelphia, 19 Dec 2014.</ref> Existen otros experimentales con distintos tamaños de anillo de cicloalcano más allá de la estructura elemental de ciclohexilamina. El homólogo ciclopentilo del PCP es activo, con alrededor de una décima parte de la potencia, |
Existen otros compuestos similares en los que se ha variado el anillo base o en los que se ha reemplazado la cadena de amina con otros grupos.<ref>Wallach JV. Structure activity relationship (SAR) studies of arylcycloalkylamines as N-methyl-D-aspartate receptor antagonists. PhD. Thesis, University of the Sciences in Philadelphia, 19 Dec 2014.</ref> Existen otros experimentales con distintos tamaños de anillo de cicloalcano más allá de la estructura elemental de ciclohexilamina. El homólogo ciclopentilo del PCP es activo, con alrededor de una décima parte de la potencia,<ref name="pmid975751">{{Cita publicación|título=Illicit synthesis of phencyclidine (PCP) and several of its analogs|apellidos=Shulgin AT, Mac Lean DE|fecha=1976|publicación=Clinical Toxicology|volumen=9|número=4|páginas=553–60|doi=10.3109/15563657608988157|pmid=975751}}</ref> mientras que los derivados tipo cicloheptilo y ciclooctilo son inactivos. Algunas arilcicloheptilaminas sustituidas conservan la actividad farmacológica esperada del grupo.<ref name="pmid24773376">{{Cita publicación|título=Syntheses and N-methyl-D-aspartate receptor antagonist pharmacology of fluorinated arylcycloheptylamines|apellidos=Sun S, Wallach J, Adejare A|fecha=2014|publicación=Medicinal Chemistry|volumen=10|número=8|páginas=843–52|ubicación=Shariqah (United Arab Emirates)|doi=10.2174/1573406410666140428104444|pmid=24773376}}</ref> La cicloalquilcetona es elemental y puede hacerse reaccionar con PhMgBr; reaccionando luego el alcohol de 3º con NaN<sub>3</sub>; luego se redujo la azida con LAH. Luego, en el paso final, el anillo de piperidina se construye con 1-5-dibromo-pentano.<ref>{{Cita publicación|título=Structure-activity relationships of the cycloalkyl ring of phencyclidine|apellidos=McQuinn RL, Cone EJ, Shannon HE, Su TP|fecha=December 1981|publicación=Journal of Medicinal Chemistry|volumen=24|número=12|páginas=1429–32|doi=10.1021/jm00144a011|pmid=7310819}}</ref> Se conocen otros compuestos en los que el anillo base ciclohexilo se reemplaza por anillos tales como [[norbornilo]], [[adamantilo]],<ref name="pmid6834381">{{Cita publicación|título=Geometries and conformational processes in phencyclidine and a rigid adamantyl analogue: variable-temperature NMR, X-ray crystallographic, and molecular mechanics studies|apellidos=Eaton TA, Houk KN, Watkins SF, Fronczek FR|fecha=April 1983|publicación=Journal of Medicinal Chemistry|volumen=26|número=4|páginas=479–86|doi=10.1021/jm00358a005|pmid=6834381}}</ref> [[tetralina]], [[oxano]], [[tiano]] <ref>[https://chemrxiv.org/engage/api-gateway/chemrxiv/assets/orp/resource/item/62c743ca638326c3ed445d91/original/identification-and-characterization-of-designer-phencyclidines-pc-ps-in-forensic-casework.pdf Sisco E, Urbas A. Identification and Characterization of Designer Phencyclidines (PCPs) in Forensic Casework]</ref> o [[piperidina]].<ref>[https://patents.google.com/patent/US3311624A Gerhard O, Eberhard E. 4-amino-piperidines. US3311624A]</ref> Los análogos [[Conformación del ciclohexano|restringidos conformacionalmente]] han sido también preparados experimentalmente.<ref>{{Cita publicación|título=Rigid phencyclidine analogues. Binding to the phencyclidine and sigma 1 receptors|apellidos=Moriarty RM, Enache LA, Zhao L, Gilardi R, Mattson MV, Prakash O|fecha=February 1998|publicación=Journal of Medicinal Chemistry|volumen=41|número=4|páginas=468–77|doi=10.1021/jm970059p|pmid=9484497}}</ref> |
||
{| class="wikitable sortable" |
{| class="wikitable sortable" |
||
!'''Estructura''' |
!'''Estructura''' |
||
Revisión del 19:20 27 sep 2023

Las arilciclohexilaminas, también conocidas como arilciclohexaminas o arilciclohexanaminas, son una clase química de drogas farmacéuticas, de diseño y experimentales. Entre ellas figuran la ketamina y la fenciclidina.
Historia
Se cree que la fenciclidina (PCP) haya sido la primera arilciclohexilamina con propiedades anestésicas reconocidas, pero en la literatura científica se describieron varias arilciclohexilaminas antes que la PCP. Comenzando con PCA (1-fenilciclohexano-1-amina), cuya síntesis se publicó por primera vez en 1907. El PCE se reportó en 1953, el PCMo (4-(1-fenil-ciclohexil)-morfolina[1] en 1954, y el PCMo se describió poco después como un potente sedante.[2] Los anestésicos de arilciclohexilamina se investigaron intensamente en Parke-Davis, comenzando con la síntesis de fenciclidina en 1956 y más tarde con el compuesto relacionado ketamina .[2] La década de 1970 vio el debut de estos compuestos, especialmente PCP y sus análogos, como drogas recreativas de uso ilícito debido a sus efectos disociativos alucinógenos y euforizantes . Desde entonces, la clase ha sido ampliada por investigaciones científicas de agentes estimulantes, analgésicos y neuroprotectores, así como también por químicos clandestinos en busca de nuevas drogas recreativas .[3] [4] [5]
Estructura

Una arilciclohexilamina se compone de una unidad ciclohexilamina con un enlace de resto arilo. El grupo arilo se encuentra en posición geminal con respecto a la amina. En los casos más simples, el resto arilo es típicamente un anillo de fenilo, a veces con sustitución adicional. La amina no suele ser primaria. Las aminas secundarias, como metilamino o etilamino, o las cicloalquilaminas terciarias, como piperidino y pirrolidino, son los sustituyentes N que se encuentran con mayor frecuencia.
Farmacología
Las arilciclohexilaminas poseen propiedades antagonistas del receptor NMDA,[6][7] inhibidoras de la recaptación de dopamina,[8] y agonistas del receptor opioide μ [9]. Además, se han informado acciones agonistas del receptor σ,[10] antagonistas del receptor nACh,[11] y agonistas del receptor D2[12] para algunos de estos agentes farmacológicos. El antagonismo del receptor NMDA confiere efectos anestésicos, anticonvulsivos, neuroprotectores y disociativos. Por su parte, el bloqueo del transportador de dopamina produce efectos estimulantes y euforizantes, así como psicosis en grandes cantidades; y la activación del receptor opioide μ provoca efectos analgésicos y euforizantes. La estimulación de los receptores σ y D 2 también puede contribuir a los efectos alucinógenos y psicotomiméticos característicos de muchas de estas drogas.[12]
Las arilciclohexilaminas son agentes versátiles con una amplia gama de posibles actividades farmacológicas dependiendo de la extensión y el rango en el que se implementen las modificaciones químicas.[13][14][15] [16] [17][18] [19][20] [21] Las diversas elecciones de sustituciones que se realizan permiten un "ajuste fino" del perfil farmacológico resultante. Como ejemplos, BTCP es un inhibidor selectivo de la recaptación de dopamina,[8] PCP es principalmente antagonista NMDA,[6] y BDPC es un potente agonista de opioides μ,[22] mientras que PRE-084 es un agonista selectivo del receptor sigma.[23] Por lo tanto, es posible una farmacología radicalmente diferente a través de diferentes combinaciones estructurales dentro de la misma familia de las arilciclohexilaminas.
Lista de arilciclohexilaminas
| Estructura | Compuesto | Raíz aril | N Group | Cyclohexyl ring | CAS number |
|---|---|---|---|---|---|

|
PCA[24] | Fenilo | NH2 | - | 1934-71-0 |

|
PCM[24] | Fenilo | Metilamino | - | 2201-16-3 |

|
Eticiclidina | Fenilo | Etilamino | - | 2201-15-2 |

|
PCPr[25] | Fenilo | n-Propilamino | - | 18949-81-0 |

|
PCiP | Fenilo | IsoPropilamino | - | 1195-42-2 |

|
PCAL [26] | Fenilo | Alilamino | - | 2185-95-7 |

|
PCBu | Fenilo | n-Butylamino | - | 73166-29-7 |

|
PCEOH | Fenilo | Hidroxietilamino | - | 2201-22-1 |

|
PCMEA[27] | Fenilo | Metoxietilamino | - | 2201-57-2 |

|
PCEEA | Fenilo | Etoxietilamino | - | 1072895-05-6 |

|
PCMPA | Fenilo | Metoxipropilamino | - | 2201-58-3 |

|
PCDM[24] | Fenilo | Dimetilamino | - | 2201-17-4 |

|
Dieticiclidina | Fenilo | Dietilamino | - | 2201-19-6 |

|
2-HO-PCP[6] | Fenilo | Piperidina | 2-Hidroxi | 94852-58-1 |

|
2-Me-PCP[28] | Fenilo | Piperidina | 2-Metil | 59397-29-4 |

|
2-MeO-PCP[29] | Fenilo | Piperidina | 2-Methoxy | 78636-34-7 |

|
2-Keto-PCP | Fenilo | Piperidina | 2-Keto | 101688-16-8 |

|
Eticyclidone ("O-PCE") | Fenilo | Etilamino | 2-Keto | 6740-82-5 |

|
2-Keto-PCPr | Fenilo | n-Propilamino | 2-Keto | |

|
4-Metil-PCP | Fenilo | Piperidina | 4-Metil | 19420-52-1 |

|
4-Keto-PCP[30] | Fenilo | Piperidina | 4-Keto | 65620-13-5 |

|
2'-Cl-PCP | o-Clorofenilo | Piperidina | - | 2201-31-2 |

|
3'-Cl-PCP | m-Clorofenilo | Piperidina | - | 2201-32-3 |

|
2'-MeO-PCP | o-Metoxifenilo | Piperidina | - | 2201-34-5 |

|
3'-F-PCP[31] | m-Fluorofenilo | Piperidina | - | 89156-99-0 |

|
3'-Me-PCP[32] | m-Tolyl | Piperidina | - | 2201-30-1 |

|
3'-Me-PCPy | m-Tolyl | Pirrolidina | - | 1622348-63-3 |

|
3'-NH2-PCP | m-Aminophenyl | Piperidina | - | 72242-00-3 |

|
3'-HO-PCP | m-Hidroxifenilo | Piperidina | - | 79787-43-2 |

|
3'-MeO-PCP | m-Metoxifenilo | Piperidina | - | 72242-03-6 |

|
3',4'-MD-PCP | 3,4-Metilenedioxyphenyl | Piperidina | - | |

|
3'-MeO-PCE | m-Metoxifenilo | Etilamino | - | 1364933-80-1 |

|
3'-HO-PCE | m-Hidroxifenilo | Etilamino | - | |

|
3'-MeO-PCPr | m-Metoxifenilo | n-Propilamino | - | 1364933-81-2 |

|
3'-HO-PCPr | m-Hidroxifenilo | n-Propilamino | - | |

|
3',4'-MD-PCPr | 3,4-Metilenedioxyphenyl | n-Propilamino | - | |

|
3'-MeO-PCPy[32] | m-Metoxifenilo | Pyrrolidine | - | 1364933-79-8 |

|
4'-HO-PCP | p-Hidroxifenilo | Piperidina | - | 66568-88-5 |

|
Metoxidina (4'-MeO-PCP) | p-Metoxifenilo | Piperidina | - | 2201-35-6 |

|
4'-MeO-PCE | p-Metoxifenilo | Etilamino | - | |

|
4'-F-PCP[31] | p-Fluorofenilo | Piperidina | - | 22904-99-0 |

|
4'-F-PCPy | p-Fluorofenilo | Pyrrolidine | - | |

|
Arketamina | o-Chlorofenilo | MEtilamino | 2-Keto | 33643-49-1 |

|
Descloroketamina | Fenilo | MEtilamino | 2-Keto | 7063-30-1 |

|
Esketamina | o-Chlorofenilo | MEtilamino | 2-Keto | 33643-46-8 |

|
Ketamina | o-Chlorofenilo | MEtilamino | 2-Keto | 6740-88-1 |

|
Hidroxinorketamina | o-Chlorofenilo | NH2 | 2-Keto, 6-Hidroxi | 81395-70-2 |

|
Etketamina | o-Chlorofenilo | Etilamino | 2-Keto | 1354634-10-8 |

|
NPNK | o-Chlorofenilo | n-Propilamino | 2-Keto | 2749326-65-4 |

|
Metoxiketamina | o-Metoxifenilo | MEtilamino | 2-Keto | 7063-51-6 |

|
2-MeO-NEK[33] | o-Metoxifenilo | Etilamino | 2-Keto | |

|
oMDCK | o-Tolyl | MEtilamino | 2-Keto | 7063-37-8 |

|
mMDCK | m-Tolyl | MEtilamino | 2-Keto | |

|
meta-Ketamina | m-Clorofenilo | MEtilamino | 2-Keto | 7063-53-8 |

|
iso-Ketamina | o-Chlorofenilo | MEtilamino | 4-Keto | |

|
2-Fluorodescloroketamina | o-Fluorofenilo | MEtilamino | 2-Keto | 111982-50-4 |

|
3-Fluorodescloroketamina | m-Fluorofenilo | MEtilamino | 2-Keto | 2657761-23-2 |

|
Bromoketamina | o-Bromophenyl | MEtilamino | 2-Keto | 120807-70-7 |

|
TFMDCK | o-TrifluoroMetilphenyl | MEtilamino | 2-Keto | 1782149-73-8 |

|
SN 35210[34] | o-Chlorofenilo | Carbomethoxybutylamino | 2-Keto | 1450615-41-4 |

|
Metoxetamina | m-Metoxifenilo | Etilamino | 2-Keto | 1239943-76-0 |

|
Metoxmetamina | m-Metoxifenilo | MEtilamino | 2-Keto | 1781829-56-8 |

|
Metoxpropamine | m-Metoxifenilo | n-Propilamino | 2-Keto | 2504100-71-2 |
|
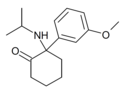
MXiPr | m-Metoxifenilo | i-Propilamino | 2-Keto | |

|
Etoxetamina | m-Etoxifenilo | Etilamino | 2-Keto | |
|
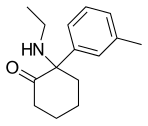
Deoximetoxetamina (3-Me-2'-Oxo-PCE) | m-Tolyl | Etilamino | 2-Keto | 2666932-45-0 |

|
Br-MXE | 2-bromo-5-Metoxifenilo | Etilamina | 2-Keto | |
|
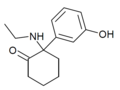
Hidroxetamina (HXE) | m-Hidroxifenilo | Etilamino | 2-Keto | 1620054-73-0 |

|
HXM | m-Hidroxifenilo | MEtilamino | 2-Keto | |

|
Fluorexetamina (FXE) | m-Fluorofenilo | Etilamino | 2-Keto | |

|
Fenciclidina (PCP) | Fenilo | Piperidina | - | 77-10-1 |

|
PC3MP | Fenilo | 3-MetilPiperidina | - | 2201-41-4 |

|
PC4MP | Fenilo | 4-MetilPiperidina | - | 2201-42-5 |

|
Roliciclidina (PCPy) | Fenilo | Pyrrolidine | - | 2201-39-0 |

|
PCDMPy | Fenilo | 3,3-DiMetilpyrrolidine | - | |

|
PCMo | Fenilo | Morpholine | - | 2201-40-3 |

|
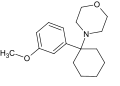
Metoxi-PCM[7] (2'-MeO-PCMo) | o-Metoxifenilo | Morpholine | - | 1314323-88-0 |
|
3-MeO-PCMo | m-Metoxifenilo | Morpholine | - | 138873-80-0 |

|
4'-MeO-PCMo | p-Metoxifenilo | Morpholine | - | |
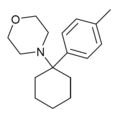
|
Metilo-PCM[35] (4'-Me-PCMo) | p-Tolyl | Morpholine | - | 120803-52-3 |

|
Hidroxi-Metil-PCM | 2-Metil-4-Hidroxifenilo | Morpholine | - | 1314323-89-1 |

|
PYCP [36] | 2-Pyridinyl | Piperidina | - | |

|
TCM | 2-Tienilo | MEtilamino | - | 139401-07-3 |

|
TCE | 2-Tienilo | Etilamino | - | 101589-62-2 |
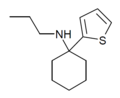
|
TCPr [37] | 2-Tienilo | Propilamino | - | |

|
Tenociclidina (TCP) | 2-Tienilo | Piperidina | - | 21500-98-1 |

|
T3CP | 3-Tienilo | Piperidina | - | 19420-50-9 |

|
TCPy | 2-Tienilo | Pyrrolidine | - | 22912-13-6 |

|
Tiletamina | 2-Tienilo | Etilamino | 2-Keto | 14176-49-9 |

|
MXTE | 4-Methoxy-2-Tienilo | Etilamino | 2-Keto | |

|
Gaciclidina | Tiofeno | Piperidina | 2-Metil | 68134-81-6 |

|
BDPC | p-Bromophenyl | DimEtilamino | 4-Phenethyl-4-Hidroxi | 77239-98-6 |

|
C-8813 | p-Bromophenyl | Dimetilamino | 4-(thiophen-2-yl)ethyl-4-Hidroxi | 616898-54-5 |

|
Dimetamina[38] | p-Tolyl | DimEtilamino | 4-Keto | 65619-06-9 |

|
3-OH-2'-Me-PCP[39] | o-Tolyl | 3-hidroxipiperidina | - | |

|
4-Ph-4-OH-PCP[40] | Fenilo | 4-Fenilo-4-hidroxipiperidina | - | 77179-39-6 |

|
BTCP[41] | Benzothiophen-2-yl | Piperidina | - | 112726-66-6 |

|
BTCPy[10] | Benzothiophen-2-yl | Pyrrolidine | - | |

|
GK-189 | Naftaleno-2-yl | Piperidina | - | 81490-58-6 |
Compuestos relacionados
Existen otros compuestos similares en los que se ha variado el anillo base o en los que se ha reemplazado la cadena de amina con otros grupos.[42] Existen otros experimentales con distintos tamaños de anillo de cicloalcano más allá de la estructura elemental de ciclohexilamina. El homólogo ciclopentilo del PCP es activo, con alrededor de una décima parte de la potencia,[43] mientras que los derivados tipo cicloheptilo y ciclooctilo son inactivos. Algunas arilcicloheptilaminas sustituidas conservan la actividad farmacológica esperada del grupo.[44] La cicloalquilcetona es elemental y puede hacerse reaccionar con PhMgBr; reaccionando luego el alcohol de 3º con NaN3; luego se redujo la azida con LAH. Luego, en el paso final, el anillo de piperidina se construye con 1-5-dibromo-pentano.[45] Se conocen otros compuestos en los que el anillo base ciclohexilo se reemplaza por anillos tales como norbornilo, adamantilo,[46] tetralina, oxano, tiano [47] o piperidina.[48] Los análogos restringidos conformacionalmente han sido también preparados experimentalmente.[49]
Referencias
- ↑ «4-(1-phenyl-cyclohexyl)-morpholine». CAS Number Search - chemsrc.com. chemsrc. Consultado el 15 de marzo de 2021.
- ↑ a b Morris H, Wallach J (2014). «From PCP to MXE: a comprehensive review of the non-medical use of dissociative drugs». Drug Testing and Analysis 6 (7–8): 614-32. PMID 24678061. doi:10.1002/dta.1620.
- ↑ Designer Drugs Directory. Elsevier. 1998. ISBN 0-444-20525-X.
- ↑ «Phencyclidine-Based New Psychoactive Substances». New Psychoactive Substances. Handbook of Experimental Pharmacology 252. August 2018. pp. 261-303. ISBN 978-3-030-10560-0. PMID 30105474. doi:10.1007/164_2018_124.
- ↑ Wallach J, Brandt SD (2018). «1,2-Diarylethylamine- and Ketamine-Based New Psychoactive Substances». Handbook of Experimental Pharmacology 252: 305-352. ISBN 978-3-030-10560-0. PMID 30196446. doi:10.1007/164_2018_148.
- ↑ a b c Ahmadi A, Mahmoudi A (2005). «Synthesis and biological properties of 2-hydroxy-1-(1-phenyltetralyl)piperidine and some of its intermediates as derivatives of phencyclidine». Arzneimittel-Forschung 55 (9): 528-32. PMID 16229117. doi:10.1055/s-0031-1296900.
- ↑ a b Ahmadi A, Khalili M, Hajikhani R, Naserbakht M (April 2011). «New morpholine analogues of phencyclidine: chemical synthesis and pain perception in rats». Pharmacology, Biochemistry, and Behavior 98 (2): 227-33. PMID 21215770. doi:10.1016/j.pbb.2010.12.019.
- ↑ a b Chaudieu I, Vignon J, Chicheportiche M, Kamenka JM, Trouiller G, Chicheportiche R (March 1989). «Role of the aromatic group in the inhibition of phencyclidine binding and dopamine uptake by PCP analogs». Pharmacology, Biochemistry, and Behavior 32 (3): 699-705. PMID 2544905. doi:10.1016/0091-3057(89)90020-8.
- ↑ Itzhak Y, Simon EJ (August 1984). «A novel phencyclidine analog interacts selectively with mu opioid receptors». The Journal of Pharmacology and Experimental Therapeutics 230 (2): 383-6. PMID 6086884.
- ↑ a b He XS, Raymon LP, Mattson MV, Eldefrawi ME, de Costa BR (April 1993). «Synthesis and biological evaluation of 1-[1-(2-benzo[b]thienyl)cyclohexyl]piperidine homologues at dopamine-uptake and phencyclidine- and sigma-binding sites». Journal of Medicinal Chemistry 36 (9): 1188-93. PMID 8098066. doi:10.1021/jm00061a009.
- ↑ Eterović VA, Lu R, Eakin AE, Rodríguez AD, Ferchmin PA (December 1999). «Determinants of phencyclidine potency on the nicotinic acetylcholine receptors from muscle and electric organ». Cellular and Molecular Neurobiology 19 (6): 745-57. PMID 10456235. doi:10.1023/A:1006905106834.
- ↑ a b Seeman P, Ko F, Tallerico T (September 2005). «Dopamine receptor contribution to the action of PCP, LSD and ketamine psychotomimetics». Molecular Psychiatry 10 (9): 877-83. PMID 15852061. doi:10.1038/sj.mp.4001682.
- ↑ al-Deeb OA (May 1996). «New analgesics derived from the phencyclidine analogue thienylcyclidine». Arzneimittel-Forschung 46 (5): 505-8. PMID 8737636.
- ↑ Ahmadi A, Khalili M, Hajikhani R, Hosseini H, Afshin N, Nahri-Niknafs B (March 2012). «Synthesis and study the analgesic effects of new analogues of ketamine on female wistar rats». Medicinal Chemistry 8 (2): 246-51. PMID 22385170. doi:10.2174/157340612800493683.
- ↑ Ahmadi A, Khalili M, Abbassi S, Javadi M, Mahmoudi A, Hajikhani R (2009). «Synthesis and study on analgesic effects of 1-[1-(4-methylphenyl) (cyclohexyl)] 4-piperidinol and 1-[1-(4-methoxyphenyl) (cyclohexyl)] 4-piperidinol as two new phencyclidine derivatives». Arzneimittel-Forschung 59 (4): 202-6. PMID 19517897. doi:10.1055/s-0031-1296386.
- ↑ Ahmadi A, Khalili M, Marami S, Ghadiri A, Nahri-Niknafs B (January 2014). «Synthesis and pain perception of new analogues of phencyclidine in NMRI male mice». Mini Reviews in Medicinal Chemistry 14 (1): 64-71. PMID 24251803. doi:10.2174/1389557513666131119203551.
- ↑ Ahmadi A, Solati J, Hajikhani R, Pakzad S (2011). «Synthesis and analgesic effects of new pyrrole derivatives of phencyclidine in mice». Arzneimittel-Forschung 61 (5): 296-300. PMID 21755813. doi:10.1055/s-0031-1296202.
- ↑ Ahmadi A, Khalili M, Hajikhani R, Barghi L, Mihandoust F (2010). «Synthesis and determination of chronic and acute thermal and chemical pain activities of a new derivative of phencyclidine in rats». Iranian Journal of Pharmaceutical Research 9 (4): 379-85. PMC 3870061. PMID 24381602.
- ↑ Ahmadi A, Khalili M, Mihandoust F, Barghi L (2010). «Synthesis and determination of acute and chronic pain activities of 1-[1-(3-methylphenyl) (tetralyl)]piperidine as a new derivative of phencyclidine via tail immersion and formalin tests». Arzneimittel-Forschung 60 (1): 30-5. PMID 20184224. doi:10.1055/s-0031-1296245.
- ↑ Hajikhani R, Ahmadi A, Naderi N, Yaghoobi K, Shirazizand Z, Rezaee NM, Niknafs BN (2012). «Effect of phencyclidine derivatives on anxiety-like behavior using an elevated-plus maze test in mice». Advances in Clinical and Experimental Medicine 21 (3): 307-12. PMID 23214193.
- ↑ Ahmadi A, Khalili M, Mirza B, Mohammadi-Diz M, Azami-Lorestani F, Ghaderi P, Nahri-Niknafs B (2017). «Synthesis and Antinociception Activities of Some Novel Derivatives of Phencyclidine with Substituted Aminobenzothiazoles». Mini Reviews in Medicinal Chemistry 17 (1): 78-84. PMID 27121715. doi:10.2174/1389557516666160428112532.
- ↑ Lednicer D, VonVoigtlander PF (October 1979). «4-(p-Bromophenyl)-4-(dimethylamino)-1-phenethylcyclohexanol, an extremely potent respresentative of a new analgesic series». Journal of Medicinal Chemistry 22 (10): 1157-8. PMID 513062. doi:10.1021/jm00196a001.
- ↑ Maurice T, Su TP, Parish DW, Nabeshima T, Privat A (December 1994). «PRE-084, a sigma selective PCP derivative, attenuates MK-801-induced impairment of learning in mice». Pharmacology, Biochemistry, and Behavior 49 (4): 859-69. PMID 7886099. doi:10.1016/0091-3057(94)90235-6.
- ↑ a b c Thurkauf A, de Costa B, Yamaguchi S, Mattson MV, Jacobson AE, Rice KC, Rogawski MA (May 1990). «Synthesis and anticonvulsant activity of 1-phenylcyclohexylamine analogues». Journal of Medicinal Chemistry 33 (5): 1452-8. PMID 2329567. doi:10.1021/jm00167a027.
- ↑ Sauer C, Peters FT, Staack RF, Fritschi G, Maurer HH (April 2008). «Metabolism and toxicological detection of a new designer drug, N-(1-phenylcyclohexyl)propanamine, in rat urine using gas chromatography-mass spectrometry». Journal of Chromatography A 1186 (1–2): 380-90. PMID 18035363. doi:10.1016/j.chroma.2007.11.002.
- ↑ Kalir A, Teomy S, Amir A, Fuchs P, Lee SA, Holsztynska EJ, Rocki W, Domino EF (October 1984). «N-allyl analogues of phencyclidine: chemical synthesis and pharmacological properties». Journal of Medicinal Chemistry 27 (10): 1267-71. PMID 6481761. doi:10.1021/jm00376a006.
- ↑ Sauer C, Peters FT, Schwaninger AE, Meyer MR, Maurer HH (February 2009). «Investigations on the cytochrome P450 (CYP) isoenzymes involved in the metabolism of the designer drugs N-(1-phenyl cyclohexyl)-2-ethoxyethanamine and N-(1-phenylcyclohexyl)-2-methoxyethanamine». Biochemical Pharmacology 77 (3): 444-50. PMID 19022226. doi:10.1016/j.bcp.2008.10.024.
- ↑ Iorio MA, Tomassini L, Mattson MV, George C, Jacobson AE (August 1991). «Synthesis, stereochemistry, and biological activity of the 1-(1-Phenyl-2-methylcyclohexyl)piperidines and the 1-(1-phenyl-4-methylcyclohexyl)piperidines. Absolute configuration of the potent trans-(-)-1-(1-phenyl-2-methylcyclohexyl)piperidine». Journal of Medicinal Chemistry 34 (8): 2615-23. PMID 1875352. doi:10.1021/jm00112a041.
- ↑ Ahmadi A, Mahmoudi A (2006). «Synthesis with improved yield and study on the analgesic effect of 2-methoxyphencyclidine». Arzneimittel-Forschung 56 (5): 346-50. PMID 16821645. doi:10.1055/s-0031-1296732.
- ↑ Ortiz DM, Custodio RJ, Abiero A, Botanas CJ, Sayson LV, Kim M, Lee HJ, Kim HJ, Jeong Y, Yoon S, Lee YS, Cheong JH (July 2021). «The dopaminergic alterations induced by 4-F-PCP and 4-Keto-PCP may enhance their drug-induced rewarding and reinforcing effects: Implications for abuse». Addiction Biology 26 (4): e12981. PMID 33135332. doi:10.1111/adb.12981.
- ↑ a b Ogunbadeniyi AM, Adejare A (2002). «Syntheses of fluorinated phencyclidine analogs». Journal of Fluorine Chemistry 114: 39-42. doi:10.1016/S0022-1139(01)00565-6.
- ↑ a b Wallach J, De Paoli G, Adejare A, Brandt SD (2013). «Preparation and analytical characterization of 1-(1-Fenilocyclohexyl)piperidine (PCP) and 1-(1-phenylcyclohexyl)pyrrolidine (PCPy) analogues». Drug Testing and Analysis 6 (7–8): 633-50. PMID 23554350. doi:10.1002/dta.1468.
- ↑ Sayson LV, Botanas CJ, Custodio RJ, Abiero A, Kim M, Lee HJ, Kim HJ, Yoo SY, Lee KW, Ryu HW, Acharya S, Kim KM, Lee YS, Cheong JH (July 2019). «The novel methoxetamine analogs N-ethylnorketamine hydrochloride (NENK), 2-MeO-N-ethylketamine hydrochloride (2-MeO-NEK), and 4-MeO-N-ethylketamine hydrochloride (4-MeO-NEK) elicit rapid antidepressant effects via activation of AMPA and 5-HT2 receptors». Psychopharmacology 236 (7): 2201-2210. PMID 30891619. doi:10.1007/s00213-019-05219-x.
- ↑ Harvey M, Sleigh J, Voss L, Pruijn F, Jose J, Gamage S, Denny W (2015). «Determination of the Hypnotic Potency in Rats of the Novel Ketamine Ester Analogue SN 35210». Pharmacology 96 (5–6): 226-32. PMID 26352278. doi:10.1159/000439598.
- ↑ Ahmadi A, Khalili M, Hajikhani R, Naserbakht M (2011). «Synthesis and determination of acute and chronic pain activities of 1-[1-(4-methylphenyl) (cyclohexyl)] morpholine as a new phencyclidine derivative in rats». Arzneimittel-Forschung 61 (2): 92-7. PMID 21428243. doi:10.1055/s-0031-1296173.
- ↑ Zarantonello P, Bettini E, Paio A, Simoncelli C, Terreni S, Cardullo F (April 2011). «Novel analogues of ketamine and phencyclidine as NMDA receptor antagonists». Bioorganic & Medicinal Chemistry Letters 21 (7): 2059-63. PMID 21334205. doi:10.1016/j.bmcl.2011.02.009.
- ↑ Wallach J, Colestock T, Cicali B, Elliott SP, Kavanagh PV, Adejare A, Dempster NM, Brandt SD (August 2016). «Syntheses and analytical characterizations of N-alkyl-arylcyclohexylamines». Drug Testing and Analysis 8 (8): 801-15. PMID 26360516. doi:10.1002/dta.1861.
- ↑ Lednicer D, VonVoigtlander PF, Emmert DE (April 1980). «4-Amino-4-arylcyclohexanones and their derivatives, a novel class of analgesics. 1. Modification of the aryl ring». Journal of Medicinal Chemistry 23 (4): 424-30. PMID 7381841. doi:10.1021/jm00178a014.
- ↑ Ahmadi A, Solati J, Hajikhani R, Onagh M, Javadi M (2010). «Synthesis and analgesic effects of 1-[1-(2-methylphenyl)(cyclohexyl)]-3-piperidinol as a new derivative of phencyclidine in mice». Arzneimittel-Forschung 60 (8): 492-6. PMID 20863005. doi:10.1055/s-0031-1296317.
- ↑ Itzhak Y, Kalir A, Weissman BA, Cohen S (May 1981). «New analgesic drugs derived from phencyclidine». Journal of Medicinal Chemistry 24 (5): 496-9. PMID 7241506. doi:10.1021/jm00137a004.
- ↑ Vignon J, Pinet V, Cerruti C, Kamenka JM, Chicheportiche R (April 1988). «[3H]N-[1-(2-benzo(b)thiophenyl)cyclohexyl]piperidine ([3H]BTCP): a new phencyclidine analog selective for the dopamine uptake complex». European Journal of Pharmacology 148 (3): 427-36. PMID 3384005. doi:10.1016/0014-2999(88)90122-7.
- ↑ Wallach JV. Structure activity relationship (SAR) studies of arylcycloalkylamines as N-methyl-D-aspartate receptor antagonists. PhD. Thesis, University of the Sciences in Philadelphia, 19 Dec 2014.
- ↑ Shulgin AT, Mac Lean DE (1976). «Illicit synthesis of phencyclidine (PCP) and several of its analogs». Clinical Toxicology 9 (4): 553-60. PMID 975751. doi:10.3109/15563657608988157.
- ↑ Sun S, Wallach J, Adejare A (2014). «Syntheses and N-methyl-D-aspartate receptor antagonist pharmacology of fluorinated arylcycloheptylamines». Medicinal Chemistry (Shariqah (United Arab Emirates)) 10 (8): 843-52. PMID 24773376. doi:10.2174/1573406410666140428104444.
- ↑ McQuinn RL, Cone EJ, Shannon HE, Su TP (December 1981). «Structure-activity relationships of the cycloalkyl ring of phencyclidine». Journal of Medicinal Chemistry 24 (12): 1429-32. PMID 7310819. doi:10.1021/jm00144a011.
- ↑ Eaton TA, Houk KN, Watkins SF, Fronczek FR (April 1983). «Geometries and conformational processes in phencyclidine and a rigid adamantyl analogue: variable-temperature NMR, X-ray crystallographic, and molecular mechanics studies». Journal of Medicinal Chemistry 26 (4): 479-86. PMID 6834381. doi:10.1021/jm00358a005.
- ↑ Sisco E, Urbas A. Identification and Characterization of Designer Phencyclidines (PCPs) in Forensic Casework
- ↑ Gerhard O, Eberhard E. 4-amino-piperidines. US3311624A
- ↑ Moriarty RM, Enache LA, Zhao L, Gilardi R, Mattson MV, Prakash O (February 1998). «Rigid phencyclidine analogues. Binding to the phencyclidine and sigma 1 receptors». Journal of Medicinal Chemistry 41 (4): 468-77. PMID 9484497. doi:10.1021/jm970059p.
















