Diferencia entre revisiones de «Peróxido de hidrógeno»
Etiquetas: Edición desde móvil Edición vía web móvil |
Adición de enlaces relevantes Etiquetas: Edición visual Edición desde móvil Edición vía web móvil |
||
| Línea 52: | Línea 52: | ||
El '''peróxido de hidrógeno''' ([[hidrógeno|H]]<sub>2</sub>[[oxígeno|O]]<sub>2</sub>), también conocido como '''agua oxigenada''', '''dioxogen''', '''dioxidano''' o '''peróxido de dihidrógeno''' es un [[compuesto químico]] con características de un [[líquido]] altamente [[polaridad (química)|polar]], fuertemente enlazado con el hidrógeno, tal como el [[agua]], por lo general de aspecto líquido ligeramente más viscoso. Es conocido por ser un poderoso [[Reducción-oxidación|oxidante]]. |
El '''peróxido de hidrógeno''' ([[hidrógeno|H]]<sub>2</sub>[[oxígeno|O]]<sub>2</sub>), también conocido como '''agua oxigenada''', '''dioxogen''', '''dioxidano''' o '''peróxido de dihidrógeno''' es un [[compuesto químico]] con características de un [[líquido]] altamente [[polaridad (química)|polar]], fuertemente enlazado con el hidrógeno, tal como el [[agua]], por lo general de aspecto líquido ligeramente más viscoso. Es conocido por ser un poderoso [[Reducción-oxidación|oxidante]]. |
||
A temperatura ambiente es un líquido incoloro de olor penetrante y desagradable. En el aire se encuentran de manera natural pequeñas cantidades de peróxido de hidrógeno gaseoso. El peróxido de hidrógeno es muy inestable. Se descompone lentamente en oxígeno y agua, con liberación de gran cantidad de calor. Su velocidad de descomposición puede aumentar mucho en presencia de [[catalizador]]es. |
A [[temperatura ambiente]] es un líquido [[Color|incoloro]] de [[olor]] penetrante y desagradable. En el aire se encuentran de manera natural pequeñas cantidades de peróxido de hidrógeno [[Gas|gaseoso]]. El peróxido de hidrógeno es muy inestable. Se descompone lentamente en [[oxígeno]] y agua, con liberación de gran cantidad de [[calor]]. Su velocidad de descomposición puede aumentar mucho en presencia de [[catalizador]]es. |
||
Aunque no es inflamable, es un [[Oxidante|agente oxidante]] potente que cuando entra en contacto con [[materia orgánica]] o algunos metales, como el cobre, la plata o el bronce puede causar [[combustión]] espontánea. |
Aunque no es inflamable, es un [[Oxidante|agente oxidante]] potente que cuando entra en contacto con [[materia orgánica]] o algunos [[Metal|metales]], como el [[cobre]], la [[plata]] o el [[bronce]] puede causar [[combustión]] espontánea. |
||
El peróxido de hidrógeno se encuentra en bajas concentraciones (3 a 9 %) en muchos productos domésticos para usos medicinales y como blanqueador de vestimenta y del cabello. En la industria se usa en concentraciones más altas, para blanquear telas y [[Pulpa de celulosa|pasta de papel]], y a 90 % como componente de [[combustible]]s para [[cohete]]s y para fabricar [[espuma de poliuretano|espuma de caucho]] y sustancias químicas orgánicas. En otras áreas, como en la investigación, se utiliza para medir la actividad de algunas [[enzima]]s, como la [[catalasa]]. |
El peróxido de hidrógeno se encuentra en bajas concentraciones (3 a 9 %) en muchos productos domésticos para usos [[Medicina|medicinales]] y como blanqueador de [[Ropa|vestimenta]] y del [[Pelo|cabello]]. En la industria se usa en concentraciones más altas, para blanquear [[Tejido (textil)|telas]] y [[Pulpa de celulosa|pasta de papel]], y a 90 % como componente de [[combustible]]s para [[cohete]]s y para fabricar [[espuma de poliuretano|espuma de caucho]] y sustancias químicas orgánicas. En otras áreas, como en la investigación, se utiliza para medir la actividad de algunas [[enzima]]s, como la [[catalasa]]. |
||
Louis Jacques Thénard aisló el peróxido de hidrógeno (agua oxigenada) en 1818 a través de su trabajo con ácidos. Thénard observó que al tratar ácido bórico con ácido sulfúrico y luego destilar el producto resultante, se obtenía un líquido que mostraba propiedades interesantes. Este líquido, que más tarde se identificó como peróxido de hidrógeno, se caracterizó por su capacidad para liberar oxígeno y sus propiedades desinfectantes. |
[[Louis Jacques Thénard]] aisló el peróxido de hidrógeno (agua oxigenada) en 1818 a través de su trabajo con ácidos. Thénard observó que al tratar [[ácido bórico]] con [[ácido sulfúrico]] y luego [[Destilación|destilar]] el producto resultante, se obtenía un líquido que mostraba propiedades interesantes. Este líquido, que más tarde se identificó como peróxido de hidrógeno, se caracterizó por su capacidad para liberar oxígeno y sus propiedades [[Desinfección|desinfectantes]]. |
||
Thénard describió sus observaciones en su trabajo "Recherches sur la nature de l'acide boracique, et sur les combinaisons qu'il peut former" (Investigaciones sobre la naturaleza del ácido bórico y las combinaciones que puede formar). Su descubrimiento contribuyó significativamente al conocimiento de este compuesto, aunque en ese momento no se comprendían completamente todas sus propiedades y aplicaciones. |
Thénard describió sus observaciones en su trabajo "Recherches sur la nature de l'acide boracique, et sur les combinaisons qu'il peut former" (Investigaciones sobre la naturaleza del ácido bórico y las combinaciones que puede formar). Su descubrimiento contribuyó significativamente al conocimiento de este compuesto, aunque en ese momento no se comprendían completamente todas sus propiedades y aplicaciones. |
||
Revisión del 22:51 22 mar 2024
| Peróxido de hidrógeno | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Peróxido de dihidrógeno | ||
| General | ||
| Otros nombres |
Agua oxigenada Dioxidano peróxido de dihidrogeno | |
| Fórmula estructural |
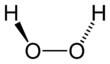 | |
| Fórmula molecular | H2O2 | |
| Identificadores | ||
| Número CAS | 7722-84-1[1] | |
| Número RTECS | MX0900000 | |
| ChEBI | 16240 | |
| ChEMBL | CHEMBL71595 | |
| ChemSpider | 763 | |
| DrugBank | DB11091 | |
| PubChem | 22326046 784, 22326046 | |
| UNII | BBX060AN9V | |
| KEGG | D00008 | |
| Propiedades físicas | ||
| Apariencia |
Incoloro | |
| Densidad | 1400 kg/m³; 1,4 g/cm³ | |
| Masa molar | 34,0147 g/mol | |
| Punto de fusión | 272,6 K (−1 °C) | |
| Punto de ebullición | 423,35 K (150 °C) | |
| Estructura cristalina | n/d | |
| Viscosidad | 1,245 cP a 20 °C | |
| Propiedades químicas | ||
| Acidez | 11,65 pKa | |
| Solubilidad en agua | Miscible | |
| Producto de solubilidad | n/d | |
| Momento dipolar | 2,26 D | |
| Termoquímica | ||
| ΔfH0gas | -136,11 kJ/mol | |
| ΔfH0líquido | -188 kJ/mol | |
| ΔfH0sólido | -200 kJ/mol | |
| S0gas, 1 bar | 232,95 J·mol–1·K | |
| S0líquido, 1 bar | 110 J·mol–1·K–1 | |
| Peligrosidad | ||
| SGA |
   | |
| NFPA 704 |
0
3
3
OX
| |
| Frases S | S1 S2 S17 S26 S28 S36 S37 S39 S45 | |
| Riesgos | ||
| Riesgos principales | ¡Atención! las siguientes son indicaciones para el peróxido de hidrógeno puro y soluciones concentradas. | |
| Ingestión | Serios daños, posiblemente fatal. | |
| Inhalación | Irritación severa, corrosivo, posiblemente fatal. | |
| Piel | Corrosivo. Agente aclarante y desinfectante. Causa ardor casi inmediatamente. | |
| Ojos | Altamente peligroso. Visión borrosa, quemaduras profundas graves | |
| Compuestos relacionados | ||
| Otros aniones | ? | |
| Otros cationes | Peróxido de sodio | |
| Compuestos relacionados | Agua, ozono, hidracina | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El peróxido de hidrógeno (H2O2), también conocido como agua oxigenada, dioxogen, dioxidano o peróxido de dihidrógeno es un compuesto químico con características de un líquido altamente polar, fuertemente enlazado con el hidrógeno, tal como el agua, por lo general de aspecto líquido ligeramente más viscoso. Es conocido por ser un poderoso oxidante.
A temperatura ambiente es un líquido incoloro de olor penetrante y desagradable. En el aire se encuentran de manera natural pequeñas cantidades de peróxido de hidrógeno gaseoso. El peróxido de hidrógeno es muy inestable. Se descompone lentamente en oxígeno y agua, con liberación de gran cantidad de calor. Su velocidad de descomposición puede aumentar mucho en presencia de catalizadores.
Aunque no es inflamable, es un agente oxidante potente que cuando entra en contacto con materia orgánica o algunos metales, como el cobre, la plata o el bronce puede causar combustión espontánea.
El peróxido de hidrógeno se encuentra en bajas concentraciones (3 a 9 %) en muchos productos domésticos para usos medicinales y como blanqueador de vestimenta y del cabello. En la industria se usa en concentraciones más altas, para blanquear telas y pasta de papel, y a 90 % como componente de combustibles para cohetes y para fabricar espuma de caucho y sustancias químicas orgánicas. En otras áreas, como en la investigación, se utiliza para medir la actividad de algunas enzimas, como la catalasa. Louis Jacques Thénard aisló el peróxido de hidrógeno (agua oxigenada) en 1818 a través de su trabajo con ácidos. Thénard observó que al tratar ácido bórico con ácido sulfúrico y luego destilar el producto resultante, se obtenía un líquido que mostraba propiedades interesantes. Este líquido, que más tarde se identificó como peróxido de hidrógeno, se caracterizó por su capacidad para liberar oxígeno y sus propiedades desinfectantes.
Thénard describió sus observaciones en su trabajo "Recherches sur la nature de l'acide boracique, et sur les combinaisons qu'il peut former" (Investigaciones sobre la naturaleza del ácido bórico y las combinaciones que puede formar). Su descubrimiento contribuyó significativamente al conocimiento de este compuesto, aunque en ese momento no se comprendían completamente todas sus propiedades y aplicaciones.
Propiedades físicas y químicas
El peróxido de hidrógeno puro (H2O2) es un líquido denso y claro, con una densidad de 1,47 g/cm³ a 0 °C. El punto de fusión es de –0,4 °C. Su punto de ebullición normal es de 150 °C.
Estereoquímica
De manera similar a la del agua, el peróxido de hidrógeno presenta un eje de simetría (eje rotado 180°). Presenta tres conformaciones: cis-planar (grupo de simetría C2v), cis-no planar (grupo de simetría C2) y trans-planar (grupo de simetría C2h).
Reactividad
El peróxido de hidrógeno concentrado es una sustancia peligrosamente reactiva, debido a que su descomposición para generar agua y oxígeno es sumamente exotérmica. La siguiente reacción termoquímica demuestra ese hecho:
- 2 H2O2 (l) → 2 H2O (l) + O2 (g) ΔHº = −98,2 kJ/mol
Cometido como agente oxidante y reductor
El peróxido de hidrógeno es capaz de actuar ya sea como agente oxidante o como reductor. Las ecuaciones que se muestran a continuación presentan las semirreacciones en medio ácido:
- 2 H+ (aq) + H2O2 (aq) + 2 e− → 2 H2O (l) Eo
red = 1,77 V - O2 (g) + 2 H+ + 2 e− → H2O2 (aq) Eo
red = 0,695 V[2]
En solución básica, los potenciales correspondientes al electrodo estándar son de 0,87 V (voltios̠) para la reducción del peróxido de hidrógeno y de 0,08 V para su oxidación.
Obtención
Antiguamente el agua oxigenada se preparaba mediante la electrólisis de una solución acuosa de ácido sulfúrico o de bisulfato ácido de amonio (NH4HSO4), seguida por la hidrólisis del peroxodisulfato ((SO4)2). En la actualidad el peróxido de hidrógeno se obtiene casi exclusivamente por la autooxidación de una 2-alcohol-antrahidroquinona (o 2-alco-9-10-dihidroxiantraceno) al correspondiente 2-alco antraquinona en un método denominado «proceso antraquinona».
En 1994, la producción mundial de H2O2 fue de 1,9 millones de toneladas. En 2006 creció hasta 2,2 millones, la mayor parte con una concentración de 70 % o menos. En ese año el kilogramo de peróxido de hidrógeno se vendía a 1,5 dólares estadounidense. Louis Jacques Thénard aisló el peróxido de hidrógeno (agua oxigenada) en 1818 a través de su trabajo con ácidos. Thénard observó que al tratar ácido bórico con ácido sulfúrico y luego destilar el producto resultante, se obtenía un líquido que mostraba propiedades interesantes. Este líquido, que más tarde se identificó como peróxido de hidrógeno, se caracterizó por su capacidad para liberar oxígeno y sus propiedades desinfectantes.
Descubrimiento
El peróxido de hidrógeno fue descrito por primera vez en 1818 por Louis Jacques Thénard, quien la produjo por tratamiento del peróxido de bario con ácido nítrico.[3] Una versión mejorada de este proceso usa el ácido clorhídrico, seguido por la adición de ácido sulfúrico para precipitar el subproducto de sulfato de bario. El proceso de Thénard se utilizó desde el final del siglo XIX hasta mediados del siglo XX.[4]
Durante mucho tiempo se creyó que el peróxido de hidrógeno puro sería inestable, dado que fallaron todos los primeros intentos de separarlo del agua, que está presente durante la síntesis. Esta inestabilidad se debía a las trazas de impurezas (sales de metales de transición), que catalizan la descomposición de este peróxido. El peróxido de hidrógeno puro se obtuvo por primera vez en 1894 —casi 80 años después de su descubrimiento—, por Richard Wolffenstein, quien lo produjo por destilación al vacío.[5]
La determinación de la estructura molecular del peróxido de hidrógeno fue muy difícil. En 1892, el físico-químico italiano Giacomo Carrara (1864-1925) determinó su masa molecular mediante el descenso crioscópico, lo cual confirmó que su fórmula molecular es H2O2.[6] Al menos media docena de estructuras moleculares hipotéticas parecían ser consistentes con la evidencia disponible.[7] En 1934, el físico matemático inglés William Penney y el físico escocés Gordon Sutherland propusieron una estructura molecular muy similar a la aceptada actualmente.[8]
Aplicaciones
Industriales
El peróxido de hidrógeno tiene muchos usos industriales, como:
- Blanqueo de telas, algodón, madera y la pulpa de papel.
- Cada día se usa más como sustituto del cloro.
- En la industria alimentaria se usa mucho para blanquear quesos, pollos, carnes, huesos, así como para la elaboración de aceites vegetales.
- En la industria química se usa como reactivo.
- Es muy importante en la elaboración de fármacos.
- Se está usando también para blanqueamientos dentales.
El agua oxigenada industrial suele tener concentraciones superiores a 30 %, a diferencia de la destinada a uso doméstico que se compra en farmacias y supermercados, la cual contiene habitualmente tan sólo 3 %.[9]
Aeroespaciales
El peróxido de hidrógeno se usa en la industria aeroespacial como combustible en motores de cohetes monopropelentes o para aportación de oxígeno en motores bipropelentes. Este peróxido se usa por lo general a una concentración de 90 %. Es extremadamente explosivo.
Artísticas
El peróxido de hidrógeno se emplea en trabajos de restauración. En muchas pinturas antiguas, los pigmentos blancos a base de carbonato de plomo (II) se han decolorado debido a la formación de sulfuro de plomo (II), de particular color negro. El peróxido de hidrógeno reacciona de manera que logra convertir el sulfuro de plomo (II) en sulfato de plomo (II) (color blanco). Ambas sales son insolubles en agua. La reacción es como se muestra en la ecuación siguiente.
- PbS (s) + 4 H2O2 (aq) → PbSO4 (s) + 4 H2O (l)
Uso terapéutico
Generalmente, las principales agencias sanitarias del mundo reconocen a las diluciones de peróxido de hidrógeno de hasta 6 % como seguras para su uso como agente antimicrobiano, agente oxidante[10][11] y otros propósitos. Debido a su efecto oxidante, desde hace muchos años se ha utilizado como agente antiséptico y antibacteriano. Su uso ha descendido los últimos años debido a la popularidad de otros productos sustitutivos. Todavía se utiliza en muchos hospitales, centros médicos y clínicas.
Desinfección
El peróxido de hidrógeno es un antiséptico general.[12] Su mecanismo de acción se debe a sus efectos oxidantes: produce ion oxhidrilo (OH-) y radicales hidroxilo libres que atacan una amplia variedad de compuestos orgánicos, entre ellos lípidos y proteínas que componen las membranas celulares de los microorganismos. La enzima catalasa presente en los tejidos degrada rápidamente el peróxido de hidrógeno, produciendo oxígeno, que dificulta la germinación de esporas anaerobias.
Se utiliza en dermoaplicaciones, limpieza de dentaduras y desinfección bucal, así como, en el campo de la óptica, en desinfección de lentes de contacto.
Además, aprovechando la actividad de la peroxidasa presente en la sangre, también se usa junto a la fenolftaleína para detectar la presencia de sangre (prueba de Kastle-Meyer).
Se usa también en pequeñas cantidades para desinfectar heridas, pero debe usarse sólo por breve tiempo para evitar necrosis de los tejidos. No escuece ni arde a diferencia del alcohol.


Véase también
Referencias
- ↑ Número CAS
- ↑ Harris, Daniel C. Análisis Químico Cuantitativo (3era edición). Editorial Reverté. pp. AP28. ISBN 978-84-291-7224-9.
- ↑ Thénard, L. J. (1818). «Observations sur des nouvelles combinaisons entre l'oxigène et divers acides». Annales de chimie et de physique. 2nd series 8: 306-312.
- ↑ C. W. Jones, J. H. Clark. Applications of Hydrogen Peroxide and Derivatives. Royal Society of Chemistry, 1999.
- ↑ Wolffenstein, Richard (octubre de 1894). «Concentration und Destillation von Wasserstoffsuperoxyd». Berichte der deutschen chemischen Gesellschaft (en alemán) 27 (3): 3307-3312. doi:10.1002/cber.189402703127.
- ↑ G. Carrara (1892) "Sul peso molecolare e sul potere rifrangente dell' acqua ossigenata" (On the molecular weight and on the refractive power of oxygenated water [i.e., hydrogen peroxide]), Atti della Reale Accademia dei Lincei, series 5, 1 (2) : 19-24.
Carrara's findings were confirmed by: W. R. Orndorff and John White (1893) "The molecular weight of hydrogen peroxide and of benzoyl peroxide," American Chemical Journal, 15 : 347-356. - ↑ Ver, por ejemplo:
- En 1882, Kingzett propuso una estructura H2O=O. Ver: Charles Thomas Kingzett (29 de septiembre de 1882) "On the activity of oxygen and the mode of formation of hydrogen dioxide," The Chemical News, 46 (1192): 141-142.
- En su libro de texto de 1922, Joseph Mellor consideró tres estructuras moleculares hipotéticas , admitiendo (p. 952): "... the constitution of this compound has not been yet established by unequivocal experiments". See: Joseph William Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry, vol. 1 (London, England: Longmans, Green and Co., 1922), p. 952-956.
- W. C. Schumb, C. N. Satterfield y R. L. Wentworth (1 de diciembre de 1953) "Report no. 43: Hydrogen peroxide, Part two", Office of Naval Research, Contract No. N5ori-07819 On p. 178, los autores presentaron estructuras moleculares hipotéticas. On p. 184, the present structure is considered almost certainly correct — although a small doubt remained. (Note: The report by Schumb et al. was reprinted as: W. C. Schumb, C. N. Satterfield, and R. L. Wentworth, Hydrogen Peroxide (New York, New York: Reinhold Publishing Corp. (American Chemical Society Monograph), 1955).)
- ↑ Ver:
- W. G. Penney y G. B. B. M. Sutherland (1934) "The theory of the structure of hydrogen peroxide and hydrazine", Journal of Chemical Physics, 2 (8): 492-498.
- W. G. Penney y G. B. B. M. Sutherland (1934) "A note on the structure of H2O2 and H4N2 with particular reference to electric moments and free rotation", Transactions of the Faraday Society, 30: 898-902.
- ↑ «Copia archivada». Archivado desde el original el 5 de julio de 2013. Consultado el 5 de junio de 2013.
- ↑ D. González, I. Bejarano, C. Barriga, A.B. Rodríguez, J.A. Pariente (2010). "Oxidative Stress-Induced Caspases are Regulated in Human Myeloid HL-60 Cells by Calcium Signal". Current Signal Transduction Therapy 5: 181-186. doi:[10.2174/157436210791112172]
- ↑ Bejarano I, Espino J, González-Flores D, Casado JG, Redondo PC, Rosado JA, Barriga C, Pariente JA, Rodríguez AB (2009). "Role of Calcium Signals on Hydrogen Peroxide-Induced Apoptosis in Human Myeloid HL-60 Cells". International Journal of Biomedical science 5(3): 246-256.
- ↑ «Agua oxigenada: usos, propiedades, beneficios y riesgos.». Archivado desde el original el 4 de abril de 2013. Consultado el 8 de abril de 2013.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Peróxido de hidrógeno.
Wikimedia Commons alberga una categoría multimedia sobre Peróxido de hidrógeno.- Departamento de Salud y Servicios Humanos de Estados Unidos (en español).
- El peróxido de hidrógeno en blanqueadores dentales, resumen de un informe del CCPC.
- Diagrama de flujo del peróxido de hidrógeno: esquema de producción industrial del peróxido de hidrógeno.
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: ficha internacional de seguridad química del peróxido de hidrógeno.


