Diferencia entre revisiones de «Cianuro de sodio»
m Reemplazos con Replacer: «cm3» |
Adición de enlaces relevantes Etiquetas: Edición visual Edición desde móvil Edición vía web móvil |
||
| Línea 15: | Línea 15: | ||
}} |
}} |
||
El '''cianuro de sodio''' o cianuro sódico (NaCN) es la sal sódica del [[ácido cianhídrico]] (HCN). Se trata de un compuesto sólido e incoloro que hidroliza fácilmente en presencia de agua y [[óxido de carbono (IV)]] para dar [[carbonato de sodio]] y [[ácido cianhídrico]]: |
El '''cianuro de sodio''' o cianuro sódico (NaCN) es la sal sódica del [[ácido cianhídrico]] (HCN). Se trata de un compuesto [[sólido]] e [[Color|incoloro]] que [[Hidrólisis|hidroliza]] fácilmente en presencia de [[agua]] y [[óxido de carbono (IV)]] para dar [[carbonato de sodio]] y [[ácido cianhídrico]]: |
||
2 NaCN + H<sub>2</sub>O + CO<sub>2</sub> -> Na<sub>2</sub>CO<sub>3</sub> + 2 HCN |
2 NaCN + H<sub>2</sub>O + CO<sub>2</sub> -> Na<sub>2</sub>CO<sub>3</sub> + 2 HCN |
||
En agua se disuelve con un pH básico sobre 11. |
En agua se [[Disolución|disuelve]] con un [[pH]] básico sobre 11. |
||
== Datos fisicoquímicos == |
== Datos fisicoquímicos == |
||
Revisión del 23:32 22 mar 2024
| Cianuro de sodio | ||
|---|---|---|
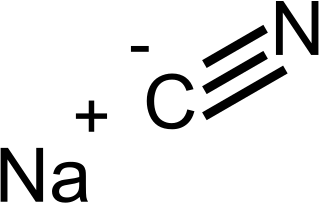 | ||
| Nombre IUPAC | ||
| Cianuro de sodio | ||
| General | ||
| Otros nombres | Cianuro sódico | |
| Fórmula estructural |
| |
| Fórmula molecular | NaCN | |
| Identificadores | ||
| Número CAS | 143-33-9[1] | |
| Número RTECS | VZ7525000 | |
| ChEBI | 33192 | |
| ChEMBL | CHEMBL1644697 | |
| ChemSpider | 8587 | |
| PubChem | 8929 | |
| UNII | O5DDB9Z95G | |
| KEGG | C18673 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Masa molar | 49 010 006 g/mol | |
| Punto de fusión | 563,7 °C (837 K) | |
| Punto de ebullición | 1496 °C (1769 K) | |
| Peligrosidad | ||
| NFPA 704 |
0
3
0
| |
| Compuestos relacionados | ||
| Compuestos relacionados | Cianuro de hidrógeno | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El cianuro de sodio o cianuro sódico (NaCN) es la sal sódica del ácido cianhídrico (HCN). Se trata de un compuesto sólido e incoloro que hidroliza fácilmente en presencia de agua y óxido de carbono (IV) para dar carbonato de sodio y ácido cianhídrico:
2 NaCN + H2O + CO2 -> Na2CO3 + 2 HCN
En agua se disuelve con un pH básico sobre 11.
Datos fisicoquímicos
- Fórmula: NaCN
- Masa molecular: 49,05 g/mol
- Equivalente gramo: 49,05 g
- Punto de fusión: 563,7 °C
- Punto de ebullición: 1496 °C
- Densidad: 1,60 g/cm3
Aplicación
El cianuro de sodio se utiliza sobre todo en minería para extraer el oro y la plata de la roca madre. Es muy utilizado en Galvanoplastia como medio complejante de iones metálicos, tales como el oro, níquel, cinc. Es utilizado además en la fabricación de pigmentos cianotipos como el azul de Prusia
También es un potente veneno conocido desde la antigüedad y fácil de preparar. Ha sido preparado para bastantes envenenamientos famosos. Se sabe que Cleopatra e Hipatia de Alejandría se valieron en bastantes ocasiones de este compuesto.
Toxicidad
El cianuro de sodio, al igual que otras sales de cianuro solubles, es uno de los que actúan más rápido de todos los venenos conocidos. NaCN es un potente inhibidor de la respiración, que actúa sobre la citocromo oxidasa mitocondrial y por lo tanto sobre el bloqueo del transporte de electrones. Esto resulta en una disminución del metabolismo oxidativo y en la utilización de oxígeno. La acidosis láctica se produce entonces como consecuencia del metabolismo anaeróbico. Una dosificación oral tan pequeña como 200-300 mg puede ser fatal.
Analítica
- Con nitrato de plata se forma un precipitado de cianuro de plata que se redisuelve en presencia de exceso de cianuro.
- Con un defecto de sulfato ferroso (FeSO4) se forma tras acidular (CUIDADO - LIBERACIÓN DE CIANHÍDRICO ALTAMENTE TÓXICO) un precipitado de azul de Prusia.
- Con iones de cobre se forma un precipitado de cianuro de cobre(I) y se libera dician (N≡C-C≡N)(CUIDADO - TÓXICO)
Eliminación
El cianuro de sodio se puede eliminar con sulfato de hierro formando hexacianoferratos ([Fe(CN)6]3- o [Fe(CN)6]4-).

