Diferencia entre revisiones de «Ácido»
Un enlace |
Reacciones en formato wiki. Algunos arreglos. Inclusión de una tabla con ejemplos de ácidos orgánicos |
||
| Línea 22: | Línea 22: | ||
=== Ácidos de Arrhenius === |
=== Ácidos de Arrhenius === |
||
{{Artículo principal|Teoría ácido-base de Arrhenius}} |
|||
El químico sueco [[Svante August Arrhenius|Svante Arrhenius]] fue el primero en atribuir las propiedades de acidez al [[hidrógeno]] en |
El químico sueco [[Svante August Arrhenius|Svante Arrhenius]] fue el primero en atribuir, en 1884, las propiedades de acidez al [[hidrógeno]] presente en la molécula de estas sustancias. Un '''[[Teoría ácido-base de Arrhenius|ácido de Arrhenius]]''' es una sustancia que aumenta la concentración de catión hidronio, '''H<sub>3</sub>O<sup>+</sup>''', cuando se disuelve en agua.<ref>{{Cita libro|apellidos=Luque|nombre=Remedios González|título=Química general para las ciencias ambientales|url=https://books.google.es/books?id=dF7al6i3AXgC&pg=PA160&dq=compuestos+no+hidr%C3%B3geno++no+++%C3%A1cidos+Arrhenius&hl=es&sa=X&ved=0ahUKEwjd5_eNpoDZAhULOBQKHYPQCIQQ6AEINDAC#v=onepage&q=compuestos%20no%20hidr%C3%B3geno%20%20no%20%20%20%C3%A1cidos%20Arrhenius&f=false|fechaacceso=30 de enero de 2018|fecha=28 de noviembre de 2011|editorial=Universitat de València|isbn=9788437083919|idioma=es}}</ref> Esta definición parte del [[equilibrio químico|equilibrio]] de disociación del agua en hidronio e [[hidróxido]]:<ref>{{Cita libro|apellidos=Regalado|nombre=Víctor Manuel Ramírez|título=Química 2: Cálculos en las reacciones y química del carbono|url=https://books.google.es/books?id=r9NUCwAAQBAJ&pg=PA78&dq=H2O(l)+++H2O+(l)++est%C3%A1+en+equilibrio+con++H3O+(ac)+++OH-(ac)&hl=es&sa=X&ved=0ahUKEwiX7prZo4DZAhXCNxQKHSOSA8IQ6AEIQzAE#v=onepage&q=H2O(l)%20+%20H2O%20(l)%20%20est%C3%A1%20en%20equilibrio%20con%20%20H3O+(ac)%20+%20OH-(ac)&f=false|fechaacceso=30 de enero de 2018|fecha=1 de febrero de 2015|editorial=Grupo Editorial Patria|isbn=9786077442851|idioma=es}}</ref> |
||
:<chem>H2O(l) + H2O(l) <=> H3O+(aq) + OH^- (aq)</chem> |
|||
:''' H<sub>2</sub>O<sub>(''l'')</sub> + H<sub>2</sub>O <sub>(''l'')</sub> {{eqm}} H<sub>3</sub>O<sup>+</sup><sub>(''ac'')</sub> + OH<sup>-</sup><sub>(''ac'')</sub>'''<ref>{{Cita libro|apellidos=Regalado|nombre=Víctor Manuel Ramírez|título=Química 2: Cálculos en las reacciones y química del carbono|url=https://books.google.es/books?id=r9NUCwAAQBAJ&pg=PA78&dq=H2O(l)+++H2O+(l)++est%C3%A1+en+equilibrio+con++H3O+(ac)+++OH-(ac)&hl=es&sa=X&ved=0ahUKEwiX7prZo4DZAhXCNxQKHSOSA8IQ6AEIQzAE#v=onepage&q=H2O(l)%20+%20H2O%20(l)%20%20est%C3%A1%20en%20equilibrio%20con%20%20H3O+(ac)%20+%20OH-(ac)&f=false|fechaacceso=30 de enero de 2018|fecha=1 de febrero de 2015|editorial=Grupo Editorial Patria|isbn=9786077442851|idioma=es}}</ref> |
|||
En agua pura, la mayoría de moléculas existen como H<sub>2</sub>O, pero un número pequeño de moléculas están constantemente disociándose y reasociándose. El agua pura es neutra con respecto a la acidez o basicidad, debido a que la concentración de iones hidróxido es siempre igual a la concentración de iones hidronio. Una [[base (química)|base]] de Arrhenius es una molécula que aumenta la concentración del ion hidróxido cuando está disuelta en agua. En química se escribe con frecuencia H<sup>+</sup>(''ac'') significando [[protón|ion hidrógeno o protón]] al describir reacciones ácido-base, pero no hay evidencia suficiente de que exista en disolución acuosa el núcleo de hidrógeno libre; sí que está probada la existencia del [[ion hidronio]], H<sub>3</sub>O<sup>+</sup> e incluso de especies de mayor nuclearidad. |
En agua pura, la mayoría de moléculas existen como H<sub>2</sub>O, pero un número pequeño de moléculas están constantemente disociándose y reasociándose. El agua pura es neutra con respecto a la acidez o basicidad, debido a que la concentración de iones hidróxido es siempre igual a la concentración de iones hidronio. Una [[base (química)|base]] de Arrhenius es una molécula que aumenta la concentración del ion hidróxido cuando está disuelta en agua. En química se escribe con frecuencia H<sup>+</sup>(''ac'') significando [[protón|ion hidrógeno o protón]] al describir reacciones ácido-base, pero no hay evidencia suficiente de que exista en disolución acuosa el núcleo de hidrógeno libre; sí que está probada la existencia del [[ion hidronio]], H<sub>3</sub>O<sup>+</sup> e incluso de especies de mayor nuclearidad. |
||
Los compuestos que no tienen hidrógeno en su estructura no son considerados ácidos de Arrhenius. Tampoco son bases de Arrhenius los compuestos que no tienen |
Los compuestos que no tienen hidrógeno disociable en su estructura no son considerados ácidos de Arrhenius. Tampoco son bases de Arrhenius los compuestos que no tienen en su estructura un OH que no pueda disociarse de la molécula cuando sesta se disuelve en agua. |
||
=== Ácidos de Brønsted-Lowry === |
=== Ácidos de Brønsted-Lowry === |
||
{{AP|Teoría ácido-base de Brønsted-Lowry}} |
{{AP|Teoría ácido-base de Brønsted-Lowry}} |
||
Aunque el concepto de Arrhenius es muy útil para describir muchas reacciones, también está un poco limitado en su alcance. En 1923, los químicos [[Johannes Nicolaus Brønsted]] y Thomas Martin Lowry reconocieron independientemente que las reacciones ácido-base involucran la transferencia de un protón. Un '''ácido de Brønsted-Lowry''' (o simplemente ácido de Brønsted) es una especie que dona un protón a una base de Brønsted-Lowry. La teoría ácido-base de Brønsted-Lowry tiene varias ventajas sobre la [[Teoría ácido-base de Arrhenius|teoría de Arrhenius]]. Considere las siguientes reacciones del [[ácido acético]] (CH<sub>3</sub>COOH), el [[ácido orgánico]] que le da al [[vinagre]] su sabor característico: |
Aunque el concepto de Arrhenius es muy útil para describir muchas reacciones, también está un poco limitado en su alcance, pues solo se circunscribe a las disoluciones acuosas. En 1923, los químicos [[Johannes Nicolaus Brønsted]] y Thomas Martin Lowry reconocieron independientemente que las reacciones ácido-base involucran la transferencia de un protón. Un '''ácido de Brønsted-Lowry''' (o simplemente ácido de Brønsted) es una especie que dona un protón a una base de Brønsted-Lowry, sin necesidad de que ambos se encuentren en disolución acuosa. La teoría ácido-base de Brønsted-Lowry tiene varias ventajas sobre la [[Teoría ácido-base de Arrhenius|teoría de Arrhenius]]. Considere las siguientes reacciones del [[ácido acético]] (CH<sub>3</sub>COOH), el [[ácido orgánico]] que le da al [[vinagre]] su sabor característico: |
||
: [[Archivo:Acid-base.png]] |
: [[Archivo:Acid-base.png]] |
||
Ambas teorías describen fácilmente la primera reacción: el CH<sub>3</sub>COOH actúa como un ácido de Arrhenius porque actúa como fuente de [[ion hidronio|H<sub>3</sub>O<sup>+</sup>]] cuando está disuelto en agua, y actúa como un ácido de Brønsted al donar un protón al agua. En el segundo ejemplo, el CH<sub>3</sub>COOH sufre la misma transformación, donando un protón al amoníaco (NH<sub>3</sub>), pero no puede ser descrito usando la definición de Arrhenius de un ácido, porque la reacción no produce cationes hidronio. La teoría de Brønsted-Lowry también puede ser usada para describir [[molécula|compuestos moleculares]], mientras que los ácidos de Arrhenius deben ser [[ion|compuestos iónicos]]. El [[cloruro de hidrógeno]] (HCl) y amoníaco se combinan bajo varias condiciones diferentes para formar [[cloruro de amonio]], NH<sub>4</sub>Cl. En solución acuosa, el HCl se comporta como [[ácido clorhídrico]] y existe como cationes [[ion hidronio|hidronio]] y aniones cloruro. Las siguientes reacciones ilustran las limitaciones de la definición de Arrhenius: |
Ambas teorías describen fácilmente la primera reacción: el CH<sub>3</sub>COOH actúa como un ácido de Arrhenius porque actúa como fuente de [[ion hidronio|H<sub>3</sub>O<sup>+</sup>]] cuando está disuelto en agua, y actúa como un ácido de Brønsted al donar un protón al agua. En el segundo ejemplo, el CH<sub>3</sub>COOH sufre la misma transformación, donando un protón al amoníaco (NH<sub>3</sub>), pero no puede ser descrito usando la definición de Arrhenius de un ácido, porque la reacción no produce cationes hidronio. La teoría de Brønsted-Lowry también puede ser usada para describir [[molécula|compuestos moleculares]], mientras que los ácidos de Arrhenius deben ser [[ion|compuestos iónicos]]. El [[cloruro de hidrógeno]] (HCl) y amoníaco se combinan bajo varias condiciones diferentes para formar [[cloruro de amonio]], NH<sub>4</sub>Cl. En solución acuosa, el HCl se comporta como [[ácido clorhídrico]] y existe como cationes [[ion hidronio|hidronio]] y aniones cloruro. Las siguientes reacciones ilustran las limitaciones de la definición de Arrhenius: |
||
:<chem>H3O+(aq) + Cl^- (aq) + NH3 <=>Cl^- (aq) + NH4+ (aq)</chem> |
|||
: 1. '''H<sub>3</sub>O<sup>+</sup><sub>(''ac'')</sub> + Cl<sup>-</sup><sub>(''ac'')</sub> + NH<sub>3</sub> → Cl<sup>-</sup><sub>(''ac'')</sub> + NH{{su|+|4}}<sub>(''aq'')</sub>''' |
|||
: |
:<chem>HCl (benceno) + NH3 (benceno) <=> NH4Cl(s)</chem> |
||
:<chem>HCl(g) + NH3(g) <=> NH4Cl(s)</chem> |
|||
: 3. '''HCl<sub>(''g'')</sub> + NH<sub>3</sub><sub>(''g'')</sub> → NH<sub>4</sub>Cl<sub>(''s'')</sub>''' |
|||
Como con las reacciones del ácido acético, ambas definiciones trabajan para el primer ejemplo, donde el agua es el solvente y se forma ion hidronio. Las siguientes dos reacciones no involucran la formación de iones, pero pueden ser vistas como reacciones de transferencia de protones. En la segunda reacción, el cloruro de hidrógeno y el amoníaco reaccionan para formar cloruro de amonio sólido en un solvente [[benceno]], y en la tercera, HCl gaseoso y NH<sub>3</sub> se combinan para formar el sólido. |
:Como con las reacciones del ácido acético, ambas definiciones trabajan para el primer ejemplo, donde el agua es el solvente y se forma ion hidronio. Las siguientes dos reacciones no involucran la formación de iones, pero pueden ser vistas como reacciones de transferencia de protones. En la segunda reacción, el cloruro de hidrógeno y el amoníaco reaccionan para formar cloruro de amonio sólido en un solvente [[benceno]], y en la tercera, HCl gaseoso y NH<sub>3</sub> se combinan para formar el sólido. |
||
=== Ácidos de Lewis === |
=== Ácidos de Lewis === |
||
{{AP| |
{{AP|Teoría ácido-base de Lewis}} |
||
Un tercer concepto fue propuesto por el físicoquímico [[Gilbert N. Lewis]] en 1923, el cual incluye reacciones con características ácido-base que no involucran una transferencia de protón. Un '''ácido de Lewis''' es una especie que acepta un par de electrones de otra especie; en otras palabras, es un aceptor de par de electrones.<ref>{{Cita libro|apellidos=Atkins|nombre=Peter|título=Principios de química: los caminos del descubrimiento|url=https://books.google.es/books?id=0JuUu1yWTisC&pg=PA368&dq=%C3%A1cido+de+Lewis+es+un+aceptor+de+par+de+electrones&hl=es&sa=X&ved=0ahUKEwj6rK2RjYLZAhXJ6RQKHSSTABEQ6AEIJzAA#v=onepage&q=%C3%A1cido%20de%20Lewis%20es%20un%20aceptor%20de%20par%20de%20electrones&f=false|fechaacceso=31 de enero de 2018|fecha=2006|editorial=Ed. Médica Panamericana|isbn=9789500600804|idioma=es|apellidos2=Jones|nombre2=Loretta}}</ref> Las reacciones ácido-base de Brønsted son reacciones de transferencia de protones, mientras que las reacciones ácido-base de Lewis son transferencias de pares de electrones. Todos los [[teoría ácido-base de Brønsted-Lowry|ácidos de Brønsted]] son también [[ácidos y bases de Lewis|ácidos de Lewis]], pero no todos los ácidos de Lewis son ácidos de Brønsted. Las siguientes reacciones podrían ser descritas en términos de química ácido-base. |
Un tercer concepto fue propuesto por el físicoquímico [[Gilbert N. Lewis]] en 1923, el cual incluye reacciones con características ácido-base que no involucran una transferencia de protón. Un '''ácido de Lewis''' es una especie que acepta un par de electrones de otra especie; en otras palabras, es un aceptor de par de electrones.<ref>{{Cita libro|apellidos=Atkins|nombre=Peter|título=Principios de química: los caminos del descubrimiento|url=https://books.google.es/books?id=0JuUu1yWTisC&pg=PA368&dq=%C3%A1cido+de+Lewis+es+un+aceptor+de+par+de+electrones&hl=es&sa=X&ved=0ahUKEwj6rK2RjYLZAhXJ6RQKHSSTABEQ6AEIJzAA#v=onepage&q=%C3%A1cido%20de%20Lewis%20es%20un%20aceptor%20de%20par%20de%20electrones&f=false|fechaacceso=31 de enero de 2018|fecha=2006|editorial=Ed. Médica Panamericana|isbn=9789500600804|idioma=es|apellidos2=Jones|nombre2=Loretta}}</ref> Las reacciones ácido-base de Brønsted son reacciones de transferencia de protones, mientras que las reacciones ácido-base de Lewis son transferencias de pares de electrones. Todos los [[teoría ácido-base de Brønsted-Lowry|ácidos de Brønsted]] son también [[ácidos y bases de Lewis|ácidos de Lewis]], pero no todos los ácidos de Lewis son ácidos de Brønsted. Las siguientes reacciones podrían ser descritas en términos de química ácido-base. |
||
: [[Archivo:LewisAcid.png]] |
: [[Archivo:LewisAcid.png]] |
||
| Línea 57: | Línea 56: | ||
== Nomenclatura == |
== Nomenclatura == |
||
* '''Sistema de nomenclatura clásico''': |
* '''Sistema de nomenclatura clásico''': |
||
En el sistema de nomenclatura clásico, los ácidos son nombrados de acuerdo a sus [[anión|aniones]]. El sufijo iónico es eliminado y es reemplazado con un nuevo sufijo (y a veces prefijo), de acuerdo con la tabla siguiente. |
En el sistema de nomenclatura clásico, los ácidos inorgánicos son nombrados de acuerdo a sus [[anión|aniones]]. El sufijo iónico es eliminado y es reemplazado con un nuevo sufijo (y a veces prefijo), de acuerdo con la tabla siguiente. |
||
{| border="1" cellpadding="4" align="center" cellspacing="0" style="background: #f9f9f9; color: black; border: 1px #aaa solid; border-collapse: collapse;" |
{| border="1" cellpadding="4" align="center" cellspacing="0" style="background: #f9f9f9; color: black; border: 1px #aaa solid; border-collapse: collapse;" |
||
| Línea 150: | Línea 149: | ||
|Ácido tetraoxofosfórico (V) |
|Ácido tetraoxofosfórico (V) |
||
|Ácido ortofosfórico |
|Ácido ortofosfórico |
||
|} |
|||
Respecto a los ácidos orgánicos con grupo carboxílico (R-COOH), aquellos que tienen nombres vulgares o históricos, se suelen nombrar utilizando la terminación con el sufijo "ico", de forma similar a la nomenclatura tradicional de los ácidos inorgánicos. La nomenclatura sistemática recomendada por la [[Unión Internacional de Química Pura y Aplicada|IUPAC]], establece que estos ácidos se nombren indicando como raíz el número de carbonos que contiene la cadena orgánica con sus sustituyentes y terminado con el sufijo "oico", si tiene un solo grupo carboxílico, o "dioco" , en el caso de que tenga dos. Aun así, en muchos casos es frecuente utilizar los nombres vulgares, sobre todo, en aquellos ácidos más conocidos, como el [[ácido acético]], el [[ácido fórmico]], [[ácido oxálico]], etc. En la siguiente tabla se muestran algunos ejemplos: |
|||
{| border="1" cellpadding="4" align="center" cellspacing="0" style="background: #f9f9f9; color: black; border: 1px #aaa solid; border-collapse: collapse;" |
|||
!Fórmula |
|||
!Nombre vulgar |
|||
!Nomenclatura sistemática |
|||
|- |
|||
|HCOOH |
|||
|Ácido fórmico |
|||
|Ácido metanoico |
|||
|- |
|||
|CH<sub>3</sub>COOH |
|||
|Ácido acético |
|||
|Ácido etanoico |
|||
|- |
|||
|CH<sub>3</sub>CH<sub>2</sub>COOH |
|||
|Ácido propiónico |
|||
|Ácido propanoico |
|||
|- |
|||
|CH<sub>3</sub>(CH<sub>2</sub>)<sub>6</sub>COOH |
|||
|Ácido Caprílico |
|||
|Ácido octanoico |
|||
|- |
|||
|CH<sub>3</sub>CHOHCOOH |
|||
|Ácido láctico |
|||
|Ácido 2-hidroxipropanoico |
|||
|- |
|||
|COOH-COOH |
|||
|Ácido oxálico |
|||
|Ácido etanodioco |
|||
|- |
|||
|COOH(CH<sub>2</sub>)<sub>4</sub>COOH |
|||
|Ácido adípico |
|||
|Ácido hexanodioco |
|||
|} |
|} |
||
Revisión del 12:23 22 may 2024

Un ácido (del latín acidus, que significa agrio) es cualquier compuesto químico que, cuando se disuelve en agua, produce una solución con una actividad de catión hidronio mayor que el agua pura, esto es, un pH menor que 7.[1] Esto se aproxima a la definición moderna de Johannes Nicolaus Brønsted y Thomas Martin Lowry, quienes definieron independientemente un ácido como un compuesto que dona un catión hidrógeno (H+) a otro compuesto (denominado base). Algunos ejemplos comunes son el ácido acético (en el vinagre), el ácido clorhídrico (en el salfumán y los jugos gástricos), el ácido acetilsalicílico (en la aspirina), o el ácido sulfúrico (usado en baterías de automóvil).
Los sistemas ácido/base se diferencian de las reacciones rédox en que, en estas últimas hay un cambio en el estado de oxidación. Los ácidos pueden existir en forma de sólidos, líquidos o gases, dependiendo de la temperatura y también pueden existir como sustancias puras o en solución.
Definiciones y conceptos

Propiedades de los ácidos
- Tienen sabor agrio como en el caso del ácido cítrico en la naranja y el limón.
- Cambian el color del papel tornasol azul a rosa, el anaranjado de metilo a rojo y deja incolora a la fenolftaleína.
- Son corrosivos.
- Producen quemaduras en la piel.
- Son buenos conductores de la electricidad en disoluciones acuosas.
- Reaccionan con metales activos formando sal e hidrógeno.
- Reaccionan con bases para formar sal más agua.
- Reaccionan con óxidos metálicos para formar sal más agua.
Ácidos de Arrhenius
El químico sueco Svante Arrhenius fue el primero en atribuir, en 1884, las propiedades de acidez al hidrógeno presente en la molécula de estas sustancias. Un ácido de Arrhenius es una sustancia que aumenta la concentración de catión hidronio, H3O+, cuando se disuelve en agua.[2] Esta definición parte del equilibrio de disociación del agua en hidronio e hidróxido:[3]
En agua pura, la mayoría de moléculas existen como H2O, pero un número pequeño de moléculas están constantemente disociándose y reasociándose. El agua pura es neutra con respecto a la acidez o basicidad, debido a que la concentración de iones hidróxido es siempre igual a la concentración de iones hidronio. Una base de Arrhenius es una molécula que aumenta la concentración del ion hidróxido cuando está disuelta en agua. En química se escribe con frecuencia H+(ac) significando ion hidrógeno o protón al describir reacciones ácido-base, pero no hay evidencia suficiente de que exista en disolución acuosa el núcleo de hidrógeno libre; sí que está probada la existencia del ion hidronio, H3O+ e incluso de especies de mayor nuclearidad.
Los compuestos que no tienen hidrógeno disociable en su estructura no son considerados ácidos de Arrhenius. Tampoco son bases de Arrhenius los compuestos que no tienen en su estructura un OH que no pueda disociarse de la molécula cuando sesta se disuelve en agua.
Ácidos de Brønsted-Lowry
Aunque el concepto de Arrhenius es muy útil para describir muchas reacciones, también está un poco limitado en su alcance, pues solo se circunscribe a las disoluciones acuosas. En 1923, los químicos Johannes Nicolaus Brønsted y Thomas Martin Lowry reconocieron independientemente que las reacciones ácido-base involucran la transferencia de un protón. Un ácido de Brønsted-Lowry (o simplemente ácido de Brønsted) es una especie que dona un protón a una base de Brønsted-Lowry, sin necesidad de que ambos se encuentren en disolución acuosa. La teoría ácido-base de Brønsted-Lowry tiene varias ventajas sobre la teoría de Arrhenius. Considere las siguientes reacciones del ácido acético (CH3COOH), el ácido orgánico que le da al vinagre su sabor característico:
Ambas teorías describen fácilmente la primera reacción: el CH3COOH actúa como un ácido de Arrhenius porque actúa como fuente de H3O+ cuando está disuelto en agua, y actúa como un ácido de Brønsted al donar un protón al agua. En el segundo ejemplo, el CH3COOH sufre la misma transformación, donando un protón al amoníaco (NH3), pero no puede ser descrito usando la definición de Arrhenius de un ácido, porque la reacción no produce cationes hidronio. La teoría de Brønsted-Lowry también puede ser usada para describir compuestos moleculares, mientras que los ácidos de Arrhenius deben ser compuestos iónicos. El cloruro de hidrógeno (HCl) y amoníaco se combinan bajo varias condiciones diferentes para formar cloruro de amonio, NH4Cl. En solución acuosa, el HCl se comporta como ácido clorhídrico y existe como cationes hidronio y aniones cloruro. Las siguientes reacciones ilustran las limitaciones de la definición de Arrhenius:
- Como con las reacciones del ácido acético, ambas definiciones trabajan para el primer ejemplo, donde el agua es el solvente y se forma ion hidronio. Las siguientes dos reacciones no involucran la formación de iones, pero pueden ser vistas como reacciones de transferencia de protones. En la segunda reacción, el cloruro de hidrógeno y el amoníaco reaccionan para formar cloruro de amonio sólido en un solvente benceno, y en la tercera, HCl gaseoso y NH3 se combinan para formar el sólido.
Ácidos de Lewis
Un tercer concepto fue propuesto por el físicoquímico Gilbert N. Lewis en 1923, el cual incluye reacciones con características ácido-base que no involucran una transferencia de protón. Un ácido de Lewis es una especie que acepta un par de electrones de otra especie; en otras palabras, es un aceptor de par de electrones.[4] Las reacciones ácido-base de Brønsted son reacciones de transferencia de protones, mientras que las reacciones ácido-base de Lewis son transferencias de pares de electrones. Todos los ácidos de Brønsted son también ácidos de Lewis, pero no todos los ácidos de Lewis son ácidos de Brønsted. Las siguientes reacciones podrían ser descritas en términos de química ácido-base.
En la primera reacción, un anión fluoruro, F-, cede un par electrónico al trifluoruro de boro para formar el producto tetrafluoroborato. El fluoruro "pierde" un par de electrones de valencia debido a que los electrones compartidos en el enlace B-F están ubicados en la región de espacio entre los dos núcleos atómicos y, en consecuencia, están más distantes del núcleo del fluoruro que en el anión fluoruro solitario. BF3 es un ácido de Lewis porque acepta el par de electrones del fluoruro. Esta reacción no puede ser descrita en términos de la teoría de Brønsted, debido a que no hay transferencia de protones. La segunda reacción puede ser descrita por cualquiera de las dos últimas teorías. Un protón es transferido desde un ácido de Brønsted no especificado hacia el amoníaco, una base de Brønsted; alternativamente, el amoníaco actúa como una base de Lewis y transfiere un par libre de electrones para formar un enlace con un ion hidrógeno. La especie que gana el par de electrones es el ácido de Lewis; por ejemplo, el átomo de oxígeno en H3O+ gana un par de electrones cuando uno de los enlaces H-O se rompe, y los electrones compartidos en el enlace se localizan en el oxígeno. Dependiendo del contexto, los ácidos de Lewis también pueden ser descritos como agentes reductores o como electrófilo.
La definición de Brønsted-Lowry es la definición más ampliamente usada; salvo que se especifique de otra manera, se asume que las reacciones ácido-base involucran la transferencia de un catión hidrón (H+) de un ácido a una base.
Disociación y equilibrio
Las reacciones de ácidos son generalizadas frecuentemente en la forma HA ![]() H+ + A-, donde HA representa el ácido, y A- es la base conjugada.[5] Los pares ácido-base conjugados difieren en un protón, y pueden ser interconvertidos por la adición o eliminación de un protón (protonación y deprotonación, respectivamente). Obsérvese que el ácido puede ser la especie cargada, y la base conjugada puede ser neutra, en cuyo caso el esquema de reacción generalizada podría ser descrito como HA+
H+ + A-, donde HA representa el ácido, y A- es la base conjugada.[5] Los pares ácido-base conjugados difieren en un protón, y pueden ser interconvertidos por la adición o eliminación de un protón (protonación y deprotonación, respectivamente). Obsérvese que el ácido puede ser la especie cargada, y la base conjugada puede ser neutra, en cuyo caso el esquema de reacción generalizada podría ser descrito como HA+ ![]() H+ + A. En solución existe un equilibrio entre el ácido y su base conjugada. La constante de equilibrio K es una expresión de las concentraciones del equilibrio de las moléculas o iones en solución. Los corchetes indican concentración, así [H2O] significa la concentración de [H2O]. La constante de disociación ácida Ka es usada generalmente en el contexto de las reacciones ácido-base. El valor numérico de Ka es igual a la concentración de los productos, dividida por la concentración de los reactantes, donde el reactante es el ácido (HA) y los productos son la base conjugada y H+.
H+ + A. En solución existe un equilibrio entre el ácido y su base conjugada. La constante de equilibrio K es una expresión de las concentraciones del equilibrio de las moléculas o iones en solución. Los corchetes indican concentración, así [H2O] significa la concentración de [H2O]. La constante de disociación ácida Ka es usada generalmente en el contexto de las reacciones ácido-base. El valor numérico de Ka es igual a la concentración de los productos, dividida por la concentración de los reactantes, donde el reactante es el ácido (HA) y los productos son la base conjugada y H+.
- [6]
El más fuerte de los dos ácidos tendrá Ka mayor que el ácido más débil; la relación de los iones hidrógeno al ácido será mayor para el ácido más fuerte, puesto que el ácido más fuerte tiene una tendencia mayor a perder su protón. Debido al rango de valores posibles para Ka se extiende por varios órdenes de magnitud, más frecuentemente se utiliza una constante más manipulable, pKa, donde pKa = -log10 Ka. Los ácidos más fuertes tienen pKa menor que los ácidos débiles. Los valores de pKa. determinados experimentalmente a 25 °C en solución acuosa suelen presentarse en libros de texto y material de referencia.
Nomenclatura
- Sistema de nomenclatura clásico:
En el sistema de nomenclatura clásico, los ácidos inorgánicos son nombrados de acuerdo a sus aniones. El sufijo iónico es eliminado y es reemplazado con un nuevo sufijo (y a veces prefijo), de acuerdo con la tabla siguiente.
| Prefijo Anión | Sufijo Anión | Prefijo Ácido | Sufijo Ácido | Ejemplo |
|---|---|---|---|---|
| per | ato | per | ácido ico | ácido perclórico (HClO4) |
| ato | ácido ico | ácido clórico (HClO3) | ||
| ito | ácido oso | ácido cloroso (HClO2) | ||
| hipo | ito | hipo | ácido oso | ácido hipocloroso (HClO) |
| uro | hidro | ácido ico | ácido clorhídrico (HCl) |
Por ejemplo, HCl tiene un cloruro como su anión, por lo que el sufijo -uro hace que tome la forma de ácido clorhídrico. En las recomendaciones de nomenclatura IUPAC, simplemente se agrega acuoso al nombre del compuesto iónico. En consecuencia, para el cloruro de hidrógeno, el nombre IUPAC sería cloruro de hidrógeno acuoso. El sufijo -hídrico es agregado solo si el ácido está compuesto solamente de hidrógeno y un otro elemento.
En el caso particular de los oxácidos, es importante tener en cuenta variedades alotrópicas.
- Nomenclatura sistemática: se indica mediante un prefijo (Mono, di, tri, tetra....) el número de oxígenos (terminando en “oxo”) seguido del nombre del elemento central en “ato”, indicando entre paréntesis el número de oxidación de este y finalmente diciendo “ de hidrógeno”. Por ejemplo el ácido sulfúrico es el tetraoxosulfato (VI) de hidrógeno.
| Fórmula | Nomenclatura sistemática | Nomenclatura sistemática funcional |
|---|---|---|
| HNO2 | Dioxonitrato (III) de hidrógeno | Ácido dioxonítrico (III) |
| H2SO3 | Trioxosulfato (IV) de hidrógeno | Ácido trioxosulfúrico (IV) |
| HIO4 | Tetraoxoyodato (VII) de hidrógeno | Ácido tetraoxoyódico (VII) |
| H2CrO4 | Tetraoxocromato (VI) de hidrógeno | Ácido tetraoxocrómico (VI) |
| H2SO2 | Dioxosulfato (II) de hidrógeno | Ácido dioxosulfúrico (II) |
| HIO | Monoxoyodato (I) de hidrógeno | Ácido monoxoyódico (I) |
- Nomenclatura simplificada: empieza el nombre del compuesto por la palabra “ácido” seguido por el número de oxígenos terminando en “oxo” y finalmente el nombre del elemento central terminado en “ico”, indicando el número de oxidación entre paréntesis en números romanos.
| Fórmula | Nomenclatura sistemática | Nomenclatura sistemática funcional | Nomenclatura tradicional |
|---|---|---|---|
| H2Cr2O7 | Heptaoxodicromato (VI) de hidrógeno | Ácido heptaoxodicrómico (VI) | Ácido dicrómico |
| H3PO4 | Tetraoxofosfato (V) de hidrógeno | Ácido tetraoxofosfórico (V) | Ácido ortofosfórico |
Respecto a los ácidos orgánicos con grupo carboxílico (R-COOH), aquellos que tienen nombres vulgares o históricos, se suelen nombrar utilizando la terminación con el sufijo "ico", de forma similar a la nomenclatura tradicional de los ácidos inorgánicos. La nomenclatura sistemática recomendada por la IUPAC, establece que estos ácidos se nombren indicando como raíz el número de carbonos que contiene la cadena orgánica con sus sustituyentes y terminado con el sufijo "oico", si tiene un solo grupo carboxílico, o "dioco" , en el caso de que tenga dos. Aun así, en muchos casos es frecuente utilizar los nombres vulgares, sobre todo, en aquellos ácidos más conocidos, como el ácido acético, el ácido fórmico, ácido oxálico, etc. En la siguiente tabla se muestran algunos ejemplos:
| Fórmula | Nombre vulgar | Nomenclatura sistemática |
|---|---|---|
| HCOOH | Ácido fórmico | Ácido metanoico |
| CH3COOH | Ácido acético | Ácido etanoico |
| CH3CH2COOH | Ácido propiónico | Ácido propanoico |
| CH3(CH2)6COOH | Ácido Caprílico | Ácido octanoico |
| CH3CHOHCOOH | Ácido láctico | Ácido 2-hidroxipropanoico |
| COOH-COOH | Ácido oxálico | Ácido etanodioco |
| COOH(CH2)4COOH | Ácido adípico | Ácido hexanodioco |
Fuerza de los ácidos
La fuerza de un ácido se refiere a su habilidad o tendencia a perder un protón. Un ácido fuerte es uno que se disocia completamente en agua; en otras palabras, un mol de un ácido fuerte HA se disuelve en agua produciendo un mol de H+ y un mol de su base conjugada, A-, y nada del ácido protonado HA. En contraste, un ácido débil se disocia solo parcialmente y, en el equilibrio, existen en la solución tanto el ácido como su base conjugada. Algunos ejemplos de ácidos fuertes son el ácido clorhídrico (HCl), ácido yodhídrico (HI), ácido bromhídrico (HBr), ácido perclórico (HClO4), ácido nítrico (HNO3) y ácido sulfúrico (H2SO4). En agua, cada uno de estos se ioniza prácticamente al 100%. Mientras más fuerte sea un ácido, más fácilmente pierde un protón, H+. Dos factores clave que contribuyen a la facilidad de deprotonación son la polaridad del enlace H-A. La fuerza de los ácidos suele ser discutida también en términos de la estabilidad de la base conjugada.
Los ácidos más fuertes tienen Ka más alto, y pKa más bajo que los ácidos más débiles.
Los ácidos alquilsulfónicos y arilsulfónicos, que son oxiácidos orgánicos, son un tipo de ácidos fuertes. Un ejemplo común es el ácido toluenosulfónico (ácido tósico o tosílico). A diferencia del ácido sulfúrico mismo, los ácidos sulfónicos pueden ser sólidos. En efecto, el poliestireno funcionalizado en sulfonato de poliestireno, es un plástico sólido fuertemente ácido, que es filtrable.
Los superácidos son ácidos más fuertes que el ácido sulfúrico al 100%. Algunos ejemplos de superácidos son el ácido fluoroantimónico, ácido mágico y ácido perclórico. Los superácidos pueden protonar permanentemente el agua, para producir "sales" de oxonio iónicas, cristalinas. También pueden estabilizar cuantitativamente a los carbocationes.
Polaridad y el efecto inductivo
La polaridad se refiere a la distribución de electrones en un enlace químico, la región de espacio entre dos núcleos atómicos donde se comparte un par de electrones (ver TREPEV). Cuando los dos átomos tienen aproximadamente la misma electronegatividad (potencia para atraer electrones del enlace), los electrones son compartidos aproximadamente por igual y pasan el mismo tiempo en cualquier extremo del enlace. Cuando hay una diferencia significativa en electronegatividades de los dos átomos enlazados, los electrones pasan más tiempo cerca al núcleo del elemento más electronegativo, y se forma un dipolo eléctrico, o separación de cargas, tal que hay una carga parcial negativa localizada en el elemento electronegativo, y una carga parcial positiva en el elemento electropositivo. El hidrógeno es un elemento electropositivo y acumula una carga ligeramente positiva cuando está unido a un elemento electronegativo como el oxígeno o el bromo. Al decrecer la densidad electrónica en el átomo de hidrógeno, se hace más fácil que sea abstraído en forma de protón, en otras palabras, es más ácido. Al moverse de izquierda a derecha a lo largo de una fila en la tabla periódica, los elementos tienden a hacerse más electronegativos, y la fuerza del ácido binario formado por el elemento aumenta coherentemente en:
| Fórmula | Nombre | pKa[7] |
|---|---|---|
| HF | ácido fluorhídrico | 3.17 |
| H2O | agua | 15.7 |
| NH3 | amoníaco | 38 |
| CH4 | metano | 48 |
El elemento electronegativo no necesita estar unido directamente al hidrógeno ácido para incrementar su acidez. Un átomo electronegativo puede "jalar" densidad electrónica desde el enlace ácido, a través del efecto inductivo. La habilidad para atraer electrones disminuye rápidamente con la distancia del elemento electronegativo al enlace ácido. El efecto es ilustrado por la siguiente serie de ácidos butanoicos halogenados. El cloro es más electronegativo que el bromo y, en consecuencia, tiene el efecto más fuerte. El átomo de hidrógeno unido al oxígeno es el hidrógeno ácido. El ácido butanoico es un ácido carboxílico.
| Estructura | Nombre | pKa[8] |
|---|---|---|

|
ácido butanoico | ≈4.8 |

|
ácido 4-clorobutanoico | 4.5 |

|
ácido 3-clorobutanoico | ≈4.0 |

|
ácido 2-bromobutanoico | 2.93 |

|
ácido 2-clorobutanoico | 2.86 |
A la vez que el átomo de cloro se aleja del enlace ácido O-H, el efecto disminuye. Cuando el átomo de cloro está a un átomo de carbono de distancia del grupo ácido carboxílico, la acidez del compuesto se incrementa significativamente, comparado con el ácido butanoico (también llamado ácido butírico). Sin embargo, cuando el átomo de cloro está separado por varios enlaces, el efecto es mucho menor. El bromo es más electronegativo que el carbono o el hidrógeno, pero no tan electronegativo como el cloro, con lo que pKa del ácido 2-bromobutanoico es ligeramente mayor que el pKa del ácido 2-clorobutanoico.

El número de átomos electronegativos adyacentes a un enlace ácido también afecta a la fuerza del ácido. Los oxácidos tienen la fórmula general HOX, donde X puede ser cualquier átomo y puede o no compartir enlaces con otros átomos. Al aumentar el número de átomos o grupos electronegativos en el átomo X, se disminuye la densidad electrónica en el enlace ácido, haciendo que la pérdida del protón sea más fácil. El ácido perclórico es un ácido muy fuerte (pKa ≈ -8), y se disocia completamente en agua. Su fórmula química es HClO4, y comprende un átomo de cloro central, con cuatro átomos de oxígeno alrededor, uno de los cuales está unido a un átomo de hidrógeno extremadamente ácido, que es eliminable fácilmente. En contraste, el ácido clórico (HClO3) es un ácido algo menos fuerte (pKa = -1.0), mientras que el ácido cloroso (HClO2, pKa = +2.0) y el ácido hipocloroso (HClO, pKa = +7.53) son ácidos débiles.[9]
Los ácidos carboxílicos son ácidos orgánicos que contienen un grupo hidroxilo ácido y un grupo carbonilo. Los ácidos carboxílicos pueden ser reducidos al alcohol correspondiente; la sustitución de un átomo de oxígeno electronegativo con dos átomos de hidrógeno electropositivos conduce a un producto que es esencialmente no ácido. La reducción del ácido acético a etanol usando LiAlH4 (hidruro de litio y aluminio o LAH) y éter es un ejemplo de dicha reacción.
El valor de pKa para el etanol es 16, comparado con 4,76 para el ácido acético.[8][10]
Radio atómico y fuerza del enlace
Otro factor que contribuye a la habilidad de un ácido para perder un protón es la fuerza de enlace entre el hidrógeno ácido y el anión de la molécula que lo tiene (ver base conjugada). Esto, a su vez, es dependiente del tamaño de los átomos que comparten el enlace. Para un ácido HA, a la vez que aumenta el tamaño del átomo A, la fuerza del enlace disminuye, significando esto que es más fácil de ser roto, y la fuerza del ácido aumenta. La fuerza del enlace es una medida de cuánta energía es necesaria para romper un enlace. En otras palabras, requiere menos energía romper el enlace cuando el átomo A se hace más grande, y el protón es más fácilmente removible por una base. Esto explica parcialmente por qué el ácido fluorhídrico es considerado un ácido débil, mientras que los demás ácidos de halógeno (HCl, HBr, HI) son ácidos fuertes. Aunque el flúor es más electronegativo que los otros halógenos, su radio atómico es también mucho menor, por lo que comparte un enlace fuerte con el hidrógeno. Al moverse hacia abajo en una columna en la tabla periódica, los átomos se hacen menos electronegativos, pero también significativamente más grandes, y el tamaño del átomo tiende a dominar la acidez en el enlace con el hidrógeno. El sulfuro de hidrógeno, H2S, es un ácido más fuerte que el agua, incluso aunque el oxígeno es más electronegativo que el azufre. Esto se debe a que el azufre es más grande que el oxígeno, y el enlace hidrógeno-azufre es más fácilmente rompible que el enlace hidrógeno-oxígeno.
Características químicas
Ácidos monopróticos
Los ácidos monopróticos son aquellos ácidos que son capaces de donar un protón por molécula durante el proceso de disociación (llamado algunas veces ionización), como se muestra a continuación (simbolizado por HA):
- HA(aq) + H2O(l)
 H3O+(ac) + A−(ac) Ka
H3O+(ac) + A−(ac) Ka
- HA(aq) + H2O(l)
Algunos ejemplos comunes de ácidos monopróticos en ácidos minerales incluyen al ácido clorhídrico (HCl) y el ácido nítrico (HNO3). Por otra parte, para los ácidos orgánicos, el término generalmente indica la presencia de un grupo carboxilo, y algunas veces estos ácidos son conocidos como ácidos monocarboxílicos. Algunos ejemplos de ácidos orgánicos incluyen al ácido fórmico (HCOOH), ácido acético (CH3COOH) y el ácido benzoico (C6H5COOH).
Ácidos polipróticos
Los ácidos polipróticos son capaces de donar más de un protón por molécula de ácido, en contraste a los ácidos monopróticos que solo donan un protón por molécula. Los tipos específicos de ácidos polipróticos tienen nombres más específicos, como ácido diprótico (dos protones potenciales para donar) y ácido triprótico (tres protones potenciales para donar).
Un ácido diprótico (simbolizado aquí como H2A) puede sufrir una o dos disociaciones, dependiendo del pH. Cada disociación tiene su propia constante de disociación, Ka1 y Ka2.
- H2A(ac) + H2O(l)
 H3O+(ac) + HA−(ac) Ka1
H3O+(ac) + HA−(ac) Ka1
- H2A(ac) + H2O(l)
- HA−(ac) + H2O(l)
 H3O+(ac) + A2−(ac) Ka2
H3O+(ac) + A2−(ac) Ka2
- HA−(ac) + H2O(l)
La primera constante de disociación es mayor que la segunda; esto es: Ka1 > Ka2. Por ejemplo, el ácido sulfúrico (H2SO4) puede donar un protón para formar el anión bisulfato (HSO—
4), para lo que Ka1 es muy grande; luego puede donar un segundo protón para formar el anión sulfato (SO2—
4), donde Ka2 es comparativamente pequeño, indicando una fuerza intermedia. El valor grande de Ka1 para la primera disociación significa que el ácido sulfúrico es un ácido fuerte. De modo similar, el inestable y débil ácido carbónico (H2CO3) puede perder un protón para formar el anión bicarbonato (HCO—
3) y perder un segundo protón para formar el anión carbonato (CO2-
3). Ambos valores de Ka son pequeños, pero Ka1 > Ka2.
Un ácido triprótico (H3A) puede sufrir una, dos, o tres disociaciones, y tiene tres constantes de disociación, donde Ka1 > Ka2 > Ka3.
- H3A(ac) + H2O(l)
 H3O+(ac) + H2A−(ac) Ka1
H3O+(ac) + H2A−(ac) Ka1
- H3A(ac) + H2O(l)
- H2A−(ac) + H2O(l)
 H3O+(ac) + HA2−(ac) Ka2
H3O+(ac) + HA2−(ac) Ka2
- H2A−(ac) + H2O(l)
- HA2−(ac) + H2O(l)
 H3O+(ac) + A3−(ac) Ka3
H3O+(ac) + A3−(ac) Ka3
- HA2−(ac) + H2O(l)
Un ejemplo inorgánico de un ácido triprótico es el ácido ortofosfórico (H3PO4), generalmente llamado simplemente ácido fosfórico. Los tres protones pueden ser perdidos consecutivamente, produciendo H2PO—
4, luego HPO2-
4, y finalmente PO3-
4, el anión ortofosfato, simplemente llamado fosfato. Un ejemplo orgánico de ácido triprótico es el ácido cítrico, que puede perder consecutivamente tres protones para formar finalmente el anión citrato. Aunque las posiciones de los protones en la molécula original pueden ser equivalentes, los valores de Ka difieren puesto que es energéticamente menos favorable perder un protón si la base conjugada está cargada negativamente.
Neutralización

La neutralización es la reacción entre un ácido y una base, produciendo una sal y base neutralizada; por ejemplo, el ácido clorhídrico y el hidróxido de sodio forman cloruro de sodio y agua:
- HCl(aq) + NaOH(aq) → H2O(l) + NaCl(aq)
La neutralización es la base de la titulación, donde un indicador de pH muestra el punto de equivalencia cuando el número equivalente de moles de una base han sido añadidos a un ácido. Generalmente se asume incorrectamente que la neutralización resulta en una solución con pH 7,0, lo que es solamente el caso cuando el ácido y la base tienen fuerza similar durante la reacción y se encuentran en concentraciones semejantes. La neutralización con una base más débil que el ácido resulta en una sal débilmente ácida. Un ejemplo es el cloruro de amonio, que es débilmente ácido, producido a partir del ácido fuerte cloruro de hidrógeno y la base débil amoníaco. Recíprocamente, la neutralización de un ácido débil con una base fuerte produce una sal débilmente básica, por ejemplo, el fluoruro de sodio, formado a partir del fluoruro de hidrógeno y el hidróxido de sodio.
Equilibrio ácido débil/base débil
Para que se pueda perder un protón, es necesario que el pH del sistema suba sobre el valor de pKa del ácido protonado. La disminución en la concentración de H+ en la solución básica desplaza el equilibrio hacia la base conjugada (la forma deprotonada del ácido). En soluciones a menor pH (más ácidas), hay suficiente concentración de H+ en la solución para que el ácido permanezca en su forma protonada, o para que se protone la base conjugada.
Las soluciones de ácidos débiles y sales de sus bases conjugadas forman las soluciones tampón.
Dureza de ácidos
En 1963, Pearson introdujo el concepto de ácidos y bases duros y blandos. Son ácidos duros aquellos cationes de pequeño tamaño y alta carga, de baja polarizabilidad: alcalinos, alcalinotérreos ligeros, cationes de transición de alta carga, como el Ti4+, Cr3+, Fe3+, Co2+, etc.
Son ácidos blandos las especies químicas de gran tamaño, pequeña o nula carga, y alta polarizabilidad: metales más pesados de carga más baja, como Ag+, Cu+, Pt2+, Hg2+, etc.
Las especies duras tienden a combinarse entre sí. La interacción duro-duro o blando-blando conduce a especies más estables. Esto se debe a un mayor solapamiento de orbitales, que origina un enlace más fuerte que en las interacciones duro-blando o blando-duro. Lo anterior es útil, de forma aproximada, para predecir el sentido de numerosas reacciones.
Aplicaciones de los ácidos
Hay numerosos usos de los ácidos. Los ácidos son usados frecuentemente para eliminar herrumbre y otra corrosión de los metales en un proceso conocido como pickling. Pueden ser usados también como electrolitos en una batería, como el ácido sulfúrico en una batería de automóvil.
Los ácidos fuertes, el ácido sulfúrico en particular, son ampliamente usados en procesamiento de minerales. Por ejemplo, los minerales de fosfato reaccionan con ácido sulfúrico produciendo ácido fosfórico para la producción de fertilizantes, y el zinc es producido disolviendo óxido de zinc en ácido sulfúrico, purificando la solución y aplicando electrólisis.
En la industria química, los ácidos reaccionan en las reacciones de neutralización para producir sales. Por ejemplo, el ácido nítrico reacciona con el amoníaco para producir nitrato de amonio, un fertilizante. Adicionalmente, los ácidos carboxílicos pueden ser esterificados con alcoholes en presencia de ácido sulfúrico, para producir ésteres.
Los ácidos son usados como catalizadores; por ejemplo, el ácido sulfúrico es usado en grandes cantidades en el proceso de alquilación para producir gasolina. Los ácidos fuertes, como el ácido sulfúrico, fosfórico y clorhídrico, también tienen efecto en reacciones de deshidratación y condensación. Los ácidos son usados también como aditivos en bebidas y alimentos, puesto que alteran su sabor y sirven como preservantes. Por ejemplo, el ácido fosfórico es un componente de las bebidas con cola.
Abundancia biológica

Muchas moléculas biológicamente importantes son ácidos. Los ácidos nucleicos, incluyendo al ADN y el ARN contienen el código genético que determina mucho de las características de un organismo, y es transferido de padres a vástagos. El ADN contiene el molde químico para la síntesis de las proteínas, que están hechas de subunidades de aminoácidos.
Un α-aminoácido tiene un carbono central (el carbono α o alfa) que está unido covalentemente a un grupo carboxilo (de ahí que son ácidos carboxílicos), un grupo amino, un átomo de hidrógeno, y un grupo variable. El grupo variable, también llamado grupo R o cadena lateral, determina la identidad y muchas de las propiedades de un aminoácido específico. En la glicina, el aminoácido más simple, el grupo R es un átomo de hidrógeno, pero en todos los demás aminoácidos contiene uno o más átomos de carbono unidos a hidrógeno, y puede contener otros elementos, tales como azufre, selenio, oxígeno o nitrógeno. Con excepción de la glicina, los aminoácidos presentes en la naturaleza son quirales y casi invariablemente están presentes en la configuración L. Algunos peptidoglucanos, encontrados en algunas paredes celulares bacterianas contienen pequeñas cantidades de D-aminoácidos. A pH fisiológico, típicamente alrededor de 7, existen aminoácidos libres en forma iónica, donde el grupo carboxilo ácido (-COOH) pierde un protón (-COO-) y el grupo amino básico (-NH2) gana un protón (-NH+
3). La molécula entera tienen una carga neta neutra, y es un zwitterión.
Los ácidos grasos y derivados de ácidos grasos son otro grupo de ácidos carboxílicos que juegan un rol significativo en biología. Estos contienen largas cadenas de hidrocarburo y un grupo ácido carboxílico en un extremo. La membrana celular de casi todos los organismos está hecha principalmente de una bicapa fosfolipídica, una micela de cadenas hidrofóbicas de ácidos grasos con grupos fosfato hidrofílicos.
En humanos y muchos otros animales, el ácido clorhídrico es parte del ácido gástrico segregado en el estómago para ayudar a hidrolizar a las proteínas, así como para convertir la proenzima inactiva pepsinógeno en la enzima activa pepsina. Algunos organismos producen ácidos para su defensa; por ejemplo, las hormigas producen el ácido fórmico.
El equilibrio ácido-base juega un rol crítico en la regulación de la respiración de los mamíferos. El gas oxígeno (O2) lleva a cabo la respiración celular, proceso por el cual los animales liberan la energía potencial química almacenada en los alimentos, produciendo dióxido de carbono (CO2) como producto. El oxígeno y el dióxido de carbono son intercambiados en los pulmones, y el cuerpo responde a las demandas energéticas variables ajustando la velocidad de ventilación pulmonar. Por ejemplo, durante períodos de ejercitación, el cuerpo rompe rápidamente los carbohidrato almacenados, liberando CO2 al torrente sanguíneo. En soluciones acuosas como la sangre, el CO2 existe en equilibrio con ácido carbónico y el anión bicarbonato.
- CO2 + H2O
 H2CO3
H2CO3  H+ + HCO3-
H+ + HCO3-
Es la disminución en el pH la señal que lleva al cerebro a respirar más rápidamente y profundo, liberando el exceso de CO2 y resuministrando a las células con O2.
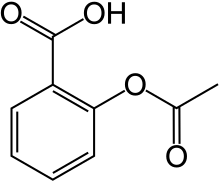
Las membranas celulares son generalmente impermeables a las moléculas polares, cargadas o grandes, debido a las cadenas grasas acílicas lipofílicas contenidas en su interior. Muchas moléculas biológicamente importantes, incluyendo un gran número de agentes farmacéuticos, son ácidos orgánicos débiles que pueden crusar la membrana en su forma protonada, en la forma sin carga, pero no pueden hacerlo en su forma cargada (como base conjugada). Por esta razón, la actividad de muchas drogas puede ser aumentada o disminuida por el uso de antiácidos o alimentos ácidos. Sin embargo, la forma cargada suele ser más soluble en la sangre y el citosol, ambos medios acuosos. Cuando el medio extracelular es más ácido que el pH neutro dentro de la célula, ciertos ácidos existirán en su forma neutra y serán solubles en la membrana, permitiéndoles cruzar la bicapa lipídica. Los ácidos que pierden un protón a pH intracelular existirán en su forma cargada, soluble, por lo que son capaces de difundirse a través del citosol a su objetivo. El ibuprofeno, la aspirina y la penicilina son ejemplos de drogas que son ácidos débiles.
Ácidos comunes
Ácidos minerales o inorgánicos
- Halogenuros de hidrógeno y sus soluciones acuosas: ácido clorhídrico (HCl), ácido bromhídrico (HBr), ácido yodhídrico (HI)
- Oxoácidos de halógenos: ácido hipocloroso, ácido clórico, ácido perclórico, ácido peryódico y compuestos correspondientes al bromo y al yodo
- Ácido fluorosulfúrico
- Ácido nítrico (HNO3)
- Ácido nitroso (HNO2)
- Ácido fosfórico (H3PO4)
- Ácido fluoroantimónico
- Ácido fluorobórico
- Ácido hexafluorofosfórico
- Ácido crómico (H2CrO4)
Ácidos sulfónicos
- Ácido metansulfónico (Ácido mesílico)
- Ácido etansulfónico (ácido esílico) (EtSO3H)
- Ácido bencensulfónico (ácido besílico) (PhSO3H)
- Ácido toluenosulfónico (Ácido p-toluenosulfónico) (C6H4(CH3) (SO3H))
- Ácido trifluorometansulfónico (ácido tríflico)
Ácidos carboxílicos
Ácidos carboxílicos vinílogos
Véase también
Referencias
- ↑ Rubin, Mark G.; Tung, Rebecca C. (2011-09). Exfoliación química. Elsevier España. ISBN 9788480868914. Consultado el 30 de enero de 2018.
- ↑ Luque, Remedios González (28 de noviembre de 2011). Química general para las ciencias ambientales. Universitat de València. ISBN 9788437083919. Consultado el 30 de enero de 2018.
- ↑ Regalado, Víctor Manuel Ramírez (1 de febrero de 2015). Química 2: Cálculos en las reacciones y química del carbono. Grupo Editorial Patria. ISBN 9786077442851. Consultado el 30 de enero de 2018.
- ↑ Atkins, Peter; Jones, Loretta (2006). Principios de química: los caminos del descubrimiento. Ed. Médica Panamericana. ISBN 9789500600804. Consultado el 31 de enero de 2018.
- ↑ Tung, Rebecca C.; Rubin, Mark G. (23 de agosto de 2011). Exfoliación química. Elsevier España. ISBN 9788480865739. Consultado el 31 de enero de 2018.
- ↑ Fisicoquimica Volumen i : Teoria. UNAM. 1999. ISBN 9789683679574. Consultado el 31 de enero de 2018.
- ↑ https://web.archive.org/web/20120121150933/http://www2.lsdiv.harvard.edu/labs/evans/pdf/evans_pKa_table.pdf
- ↑ a b «63847_8». Archivado desde el original el 16 de mayo de 2013.
- ↑ pKa values for HClOn from C.E.Housecroft and A.G.Sharpe "Inorganic Chemistry" (Pearson, 2d edn 2005), p.171
- ↑ «Copia archivada». Archivado desde el original el 2 de junio de 2010. Consultado el 2 de junio de 2010.
Bibliografía
- Listing of strengths of common acids and bases. Archivado el 18 de diciembre de 2001 en Wayback Machine.
- Zumdahl, Chemistry, 4th Edition.
- Ebbing, D. D., & Gammon, S. D. (2005). General chemistry (8th ed.). Boston, MA: Houghton Mifflin. ISBN 0-618-51177-6.
- Pavia, D. L., Lampman, G. M., & Kriz, G. S. (2004). Organic chemistry volume 1: Organic chemistry 351. Mason, OH: Cenage Learning. ISBN 978-0-7593-4272-4.
Enlaces externos
 Wikcionario tiene definiciones y otra información sobre ácido.
Wikcionario tiene definiciones y otra información sobre ácido.- Science Aid: Acids and Bases. Information for High School students.
- UC Berkeley video lecture on acids and bases.
- Curtipot: Acid-Base equilibria diagrams, pH calculation and titration curves simulation and analysis – freeware.
- A summary of the Properties of Acids for the beginning chemistry student.
- The UN ECE Convention on Long-Range Transboundary Air Pollution.







![{\displaystyle K_{a}={\frac {[{\mbox{H}}^{+}][{\mbox{A}}^{-}]}{[{\mbox{HA}}]}}}](https://wikimedia.org/eswiki/api/rest_v1/media/math/render/svg/36fd173f3aa9cd2548061b2f8320116932f338bc)
