Diferencia entre revisiones de «Hexabromobenceno»
Arreglando errores en las referencias |
m [BOT] Cambios desde PR:CW; Corrección de expresiones; Sintaxis: Tabla multilínea en una lista |
||
| Línea 1: | Línea 1: | ||
{{Ficha de compuesto químico|fórmula3={{fquim|C|6|Br|6}}}} |
{{Ficha de compuesto químico|fórmula3={{fquim|C|6|Br|6}}}} |
||
El '''hexabromobenceno''' (HBB) es un [[Haluro de arilo|bromuro de arilo]] hexa-sustituido. Es decir, las seis posiciones del [[Benceno|anillo central de benceno]] están unidas a un átomo [[ |
El '''hexabromobenceno''' (HBB) es un [[Haluro de arilo|bromuro de arilo]] hexa-sustituido. Es decir, las seis posiciones del [[Benceno|anillo central de benceno]] están unidas a un átomo de [[bromo]]. Su fórmula molecular es C<sub>6</sub>Br<sub>6</sub>. El hexabromobenceno se ha utilizado [[retardante de llama]]. También tiene aplicaciones como material de partida en la formación de películas delgadas similares [[Grafeno|al grafeno]] para dispositivos de almacenamiento de energía y condensadores de bajo coste.<ref name=":0">{{Cita publicación|url=https://pubs.acs.org/doi/10.1021/acs.langmuir.8b01177|título=Synthesis of Graphene-like Films by Electrochemical Reduction of Polyhalogenated Aromatic Compounds and their Electrochemical Capacitor Applications|apellidos=Kudaş|nombre=Züleyha|apellidos2=Gür|nombre2=Emre|fecha=2018-07-10|publicación=Langmuir|volumen=34|número=27|páginas=7958–7970|fechaacceso=2025-01-04|idioma=en|issn=0743-7463|doi=10.1021/acs.langmuir.8b01177|apellidos3=Ekinci|nombre3=Duygu}}</ref> |
||
== Preparación == |
== Preparación == |
||
| Línea 8: | Línea 8: | ||
: <chem>C6H6 + 6Br2 -> C6Br6 + 6HBr</chem> |
: <chem>C6H6 + 6Br2 -> C6Br6 + 6HBr</chem> |
||
Además del hexabromobenceno, la reacción produce seis equivalentes de [[bromuro de hidrógeno]] (HBr). Se trata de una reacción de [[Sustitución electrófila aromática|sustitución aromática electrofílica]],<ref>{{Cita web|url=https://chem.libretexts.org/Bookshelves/Organic_Chemistry/Map%3A_Organic_Chemistry_(Wade)_Complete_and_Semesters_I_and_II/Map%3A_Organic_Chemistry_(Wade)/18%3A_Reactions_of_Aromatic_Compounds/18.01%3A_Electrophilic_Aromatic_Substitution_(EAS)|título=18.1: Electrophilic Aromatic Substitution (EAS)|fechaacceso=2024-02-11|fecha=2016-02-19|sitioweb=Chemistry LibreTexts|idioma=en}}</ref>ya que el benceno es suficientemente [[Nucleófilo|nucleofílico]] como para llevar a cabo la [[Reacción de sustitución|sustitución]] de los hidrógenos por iones bromuro. |
Además del hexabromobenceno, la reacción produce seis equivalentes de [[bromuro de hidrógeno]] (HBr). Se trata de una reacción de [[Sustitución electrófila aromática|sustitución aromática electrofílica]],<ref>{{Cita web|url=https://chem.libretexts.org/Bookshelves/Organic_Chemistry/Map%3A_Organic_Chemistry_(Wade)_Complete_and_Semesters_I_and_II/Map%3A_Organic_Chemistry_(Wade)/18%3A_Reactions_of_Aromatic_Compounds/18.01%3A_Electrophilic_Aromatic_Substitution_(EAS)|título=18.1: Electrophilic Aromatic Substitution (EAS)|fechaacceso=2024-02-11|fecha=2016-02-19|sitioweb=Chemistry LibreTexts|idioma=en}}</ref> ya que el benceno es suficientemente [[Nucleófilo|nucleofílico]] como para llevar a cabo la [[Reacción de sustitución|sustitución]] de los hidrógenos por iones bromuro.<ref>{{Obra citada|título=Benzene and Its Homologues: the Substitution Reactions of Benzene|apellidos=TOMLINSON|nombre=MURIEL|url=http://dx.doi.org/10.1016/b978-0-08-015659-0.50008-5|fechaacceso=2024-02-11|fecha=1971|editorial=Elsevier|pub-periódica=An Introduction to the Chemistry of Benzenoid Compounds|páginas=12–27|ISBN=978-0-08-015659-0|DOI=10.1016/b978-0-08-015659-0.50008-5}}</ref> |
||
== Propiedades == |
== Propiedades == |
||
En condiciones normales de presión y temperatura, el hexabromobenceno se presenta como un polvo blanco. No es soluble en [[agua]], pero sí en [[etanol]], [[Éter (química)|éter]] y [[benceno]] . [[Masa molecular|El peso molecular]] es 551,52 g/mol. [[Punto de fusión]] de 327 °C. Incompatible con [[Oxidante|agentes oxidantes]] fuertes. Tiene una excelente flexibilidad de integración con varias [[Resina|resinas]] y [[Plástico|plásticos]] debido a su [[solubilidad]] en sustancias como [[etanol]], [[Éter (química)|éter]] y [[benceno]]. |
En condiciones normales de presión y temperatura, el hexabromobenceno se presenta como un polvo blanco. No es soluble en [[agua]], pero sí en [[etanol]], [[Éter (química)|éter]] y [[benceno]] . [[Masa molecular|El peso molecular]] es 551,52 g/mol. [[Punto de fusión]] de 327 °C. Incompatible con [[Oxidante|agentes oxidantes]] fuertes. Tiene una excelente flexibilidad de integración con varias [[Resina|resinas]] y [[Plástico|plásticos]] debido a su [[solubilidad]] en sustancias como [[etanol]], [[Éter (química)|éter]] y [[benceno]].<ref>{{Cita web|url=https://pubchem.ncbi.nlm.nih.gov/compound/6905|título=Hexabromobenzene|fechaacceso=2024-02-11|autor=PubChem|sitioweb=pubchem.ncbi.nlm.nih.gov|idioma=en}}</ref> |
||
== Riesgos == |
== Riesgos == |
||
El hexabromobenceno plantea peligros importantes debido a su perfil de toxicidad según la clasificación del SGA (Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos). Clasificado como GHS07, el hexabromobenceno presenta toxicidad aguda por vía oral, dérmica y por inhalación, lo que lo clasifica en la categoría 4 de este riesgo. Además, induce irritación en la piel y los ojos, clasificándose en la categoría 2 para ambos. También se sabe que esta sustancia causa sensibilización cutánea (categoría 1) y toxicidad en determinados órganos diana tras exposición (categoría 3), siendo el sistema respiratorio el principal órgano afectado. |
El hexabromobenceno plantea peligros importantes debido a su perfil de toxicidad según la clasificación del SGA (Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos). Clasificado como GHS07, el hexabromobenceno presenta toxicidad aguda por vía oral, dérmica y por inhalación, lo que lo clasifica en la categoría 4 de este riesgo. Además, induce irritación en la piel y los ojos, clasificándose en la categoría 2 para ambos. También se sabe que esta sustancia causa sensibilización cutánea (categoría 1) y toxicidad en determinados órganos diana tras exposición (categoría 3), siendo el sistema respiratorio el principal órgano afectado.<ref name=":1">{{Cita web|url=https://www.sigmaaldrich.com/US/en/product/aldrich/107131|título=Hexabromobenzene|fechaacceso=2024-02-03|fecha=2023-08-27|sitioweb=Sigma-Aldrich|urlarchivo=https://www.sigmaaldrich.com/US/en/sds/aldrich/107131?userType=anonymous|fechaarchivo=2024-01-13|urlmuerta=live}}</ref> |
||
En particular, se observa que la toxicidad aguda del hexabromobenceno disminuye con el aumento del número de átomos de bromo en la molécula. |
En particular, se observa que la toxicidad aguda del hexabromobenceno disminuye con el aumento del número de átomos de bromo en la molécula.<ref name=":2">{{Cita publicación|url=https://linkinghub.elsevier.com/retrieve/pii/S0013935123007788|título=Influence of organic cosolvents on hexabromobenzene degradation in solution by montmorillonite-templated subnanoscale zero-valent iron|apellidos=Peng|nombre=Anping|apellidos2=Gao|nombre2=Hu|fecha=July 2023|publicación=Environmental Research|volumen=229|páginas=115986|idioma=en|bibcode=2023ER....22915986P|doi=10.1016/j.envres.2023.115986|pmid=37100367|apellidos3=Wang|nombre3=Huimin|apellidos4=Wang|nombre4=Yi|apellidos5=Chen|nombre5=Zeyou}}</ref> Sin embargo, el potencial de cambios necróticos varía según la posición de estos átomos de bromo dentro de la molécula. En definitiva, la exposición al hexabromobenceno conlleva graves riesgos para la salud, por lo que es necesario manipularlo con cuidado y adoptar estrictas medidas de seguridad en su uso y gestión. |
||
== Usos y aplicaciones == |
== Usos y aplicaciones == |
||
El hexabromobenceno se utiliza ampliamente como aditivo retardante de fuego en una variedad de materiales, incluidos plásticos, papel y productos eléctricos, donde actúa como un retardante de llama de primer nivel. Con un impresionante punto de fusión de 327 °C y un alto contenido de bromuro del 86%, el hexabromobenceno mejora significativamente la seguridad contra incendios de estos materiales. |
El hexabromobenceno se utiliza ampliamente como aditivo retardante de fuego en una variedad de materiales, incluidos plásticos, papel y productos eléctricos, donde actúa como un retardante de llama de primer nivel. Con un impresionante punto de fusión de 327 °C y un alto contenido de bromuro del 86%, el hexabromobenceno mejora significativamente la seguridad contra incendios de estos materiales.<ref>{{Cita web|url=https://procure-net.com/product/hexabromobenzene/|título=Premium 98% Pure Hexabromobenzene for Enhanced Fire Resistance & Versatility|fechaacceso=2024-02-11|sitioweb=Procurenet Limited|idioma=en}}</ref> Su capacidad para suprimir la combustión de manera efectiva lo convierte en una opción muy solicitada en las industrias relacionadas con la prevención de incendios. Sin embargo, su aplicación generalizada también conduce a su dispersión en el medio ambiente, por lo que, pesar de su eficacia para retardar el fuego, los impactos ambientales y de salud de esta sustancia hacen que se deba utilizar de forma limitada y con precaución, evitando su uso innecesario.<ref name=":1" /> |
||
El hexabromobenceno también tiene utilidad como uno de los compuestos aromáticos polihalogenados clave utilizados en el proceso de síntesis de abajo hacia arriba de películas similares al grafeno. A través de la reducción electroquímica, el hexabromobenceno contribuye a la formación de estructuras de anillos poliaromáticos junto con otros compuestos como el [[hexafluorbenceno]] (HFB) y |
El hexabromobenceno también tiene utilidad como uno de los compuestos aromáticos polihalogenados clave utilizados en el proceso de síntesis de abajo hacia arriba de películas similares al grafeno. A través de la reducción electroquímica, el hexabromobenceno contribuye a la formación de estructuras de anillos poliaromáticos junto con otros compuestos como el [[hexafluorbenceno]] (HFB) y el [[hexaclorobenceno]] (HCB). Facilita la creación de películas de carbono similares al grafeno mediante recocido térmico, lo que ofrece un enfoque rentable sin necesidad de equipos sofisticados.<ref name=":0" /> |
||
== Referencias == |
== Referencias == |
||
{{Listaref}}{{Control de autoridades}} |
{{Listaref}} |
||
{{Control de autoridades}} |
|||
[[Categoría:Compuestos aromáticos]] |
[[Categoría:Compuestos aromáticos]] |
||
Revisión del 20:39 4 ene 2025
| Hexabromobenceno | ||
|---|---|---|
| General | ||
| Fórmula estructural |
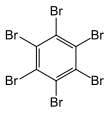 | |
| Fórmula molecular |
C 6Br 6 | |
| Identificadores | ||
| Número CAS | 87-82-1[1] | |
| ChEMBL | CHEMBL375600 | |
| ChemSpider | 6639 | |
| PubChem | 6905 | |
| UNII | T01859XWIR | |
| Propiedades físicas | ||
| Masa molar | 545,5100226 g/mol | |
El hexabromobenceno (HBB) es un bromuro de arilo hexa-sustituido. Es decir, las seis posiciones del anillo central de benceno están unidas a un átomo de bromo. Su fórmula molecular es C6Br6. El hexabromobenceno se ha utilizado retardante de llama. También tiene aplicaciones como material de partida en la formación de películas delgadas similares al grafeno para dispositivos de almacenamiento de energía y condensadores de bajo coste.[2]
Preparación
Se puede preparar por bromación directa del benceno (C6H6) haciéndolo reaccionar con la cantidad equivalente de bromo (Br2) en presencia de calor y luz ultravioleta.
Además del hexabromobenceno, la reacción produce seis equivalentes de bromuro de hidrógeno (HBr). Se trata de una reacción de sustitución aromática electrofílica,[3] ya que el benceno es suficientemente nucleofílico como para llevar a cabo la sustitución de los hidrógenos por iones bromuro.[4]
Propiedades
En condiciones normales de presión y temperatura, el hexabromobenceno se presenta como un polvo blanco. No es soluble en agua, pero sí en etanol, éter y benceno . El peso molecular es 551,52 g/mol. Punto de fusión de 327 °C. Incompatible con agentes oxidantes fuertes. Tiene una excelente flexibilidad de integración con varias resinas y plásticos debido a su solubilidad en sustancias como etanol, éter y benceno.[5]
Riesgos
El hexabromobenceno plantea peligros importantes debido a su perfil de toxicidad según la clasificación del SGA (Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos). Clasificado como GHS07, el hexabromobenceno presenta toxicidad aguda por vía oral, dérmica y por inhalación, lo que lo clasifica en la categoría 4 de este riesgo. Además, induce irritación en la piel y los ojos, clasificándose en la categoría 2 para ambos. También se sabe que esta sustancia causa sensibilización cutánea (categoría 1) y toxicidad en determinados órganos diana tras exposición (categoría 3), siendo el sistema respiratorio el principal órgano afectado.[6]
En particular, se observa que la toxicidad aguda del hexabromobenceno disminuye con el aumento del número de átomos de bromo en la molécula.[7] Sin embargo, el potencial de cambios necróticos varía según la posición de estos átomos de bromo dentro de la molécula. En definitiva, la exposición al hexabromobenceno conlleva graves riesgos para la salud, por lo que es necesario manipularlo con cuidado y adoptar estrictas medidas de seguridad en su uso y gestión.
Usos y aplicaciones
El hexabromobenceno se utiliza ampliamente como aditivo retardante de fuego en una variedad de materiales, incluidos plásticos, papel y productos eléctricos, donde actúa como un retardante de llama de primer nivel. Con un impresionante punto de fusión de 327 °C y un alto contenido de bromuro del 86%, el hexabromobenceno mejora significativamente la seguridad contra incendios de estos materiales.[8] Su capacidad para suprimir la combustión de manera efectiva lo convierte en una opción muy solicitada en las industrias relacionadas con la prevención de incendios. Sin embargo, su aplicación generalizada también conduce a su dispersión en el medio ambiente, por lo que, pesar de su eficacia para retardar el fuego, los impactos ambientales y de salud de esta sustancia hacen que se deba utilizar de forma limitada y con precaución, evitando su uso innecesario.[6]
El hexabromobenceno también tiene utilidad como uno de los compuestos aromáticos polihalogenados clave utilizados en el proceso de síntesis de abajo hacia arriba de películas similares al grafeno. A través de la reducción electroquímica, el hexabromobenceno contribuye a la formación de estructuras de anillos poliaromáticos junto con otros compuestos como el hexafluorbenceno (HFB) y el hexaclorobenceno (HCB). Facilita la creación de películas de carbono similares al grafeno mediante recocido térmico, lo que ofrece un enfoque rentable sin necesidad de equipos sofisticados.[2]
Referencias
- ↑ Número CAS
- ↑ a b Kudaş, Züleyha; Gür, Emre; Ekinci, Duygu (10 de julio de 2018). «Synthesis of Graphene-like Films by Electrochemical Reduction of Polyhalogenated Aromatic Compounds and their Electrochemical Capacitor Applications». Langmuir (en inglés) 34 (27): 7958-7970. ISSN 0743-7463. doi:10.1021/acs.langmuir.8b01177. Consultado el 4 de enero de 2025.
- ↑ «18.1: Electrophilic Aromatic Substitution (EAS)». Chemistry LibreTexts (en inglés). 19 de febrero de 2016. Consultado el 11 de febrero de 2024.
- ↑ TOMLINSON, MURIEL (1971), «Benzene and Its Homologues: the Substitution Reactions of Benzene», An Introduction to the Chemistry of Benzenoid Compounds (Elsevier): 12-27, ISBN 978-0-08-015659-0, doi:10.1016/b978-0-08-015659-0.50008-5, consultado el 11 de febrero de 2024.
- ↑ PubChem. «Hexabromobenzene». pubchem.ncbi.nlm.nih.gov (en inglés). Consultado el 11 de febrero de 2024.
- ↑ a b «Hexabromobenzene». Sigma-Aldrich. 27 de agosto de 2023. Archivado desde el original el 13 de enero de 2024. Consultado el 3 de febrero de 2024.
- ↑ Peng, Anping; Gao, Hu; Wang, Huimin; Wang, Yi; Chen, Zeyou (July 2023). «Influence of organic cosolvents on hexabromobenzene degradation in solution by montmorillonite-templated subnanoscale zero-valent iron». Environmental Research (en inglés) 229: 115986. Bibcode:2023ER....22915986P. PMID 37100367. doi:10.1016/j.envres.2023.115986.
- ↑ «Premium 98% Pure Hexabromobenzene for Enhanced Fire Resistance & Versatility». Procurenet Limited (en inglés). Consultado el 11 de febrero de 2024.

