Diferencia entre revisiones de «Nitrato de potasio»
| Línea 40: | Línea 40: | ||
== Aplicaciones == |
== Aplicaciones == |
||
Una de las aplicaciones más útiles del nitrato de potasio es la producción de [[ácido nítrico]], añadiendo [[ácido sulfúrico]] concentrado a una solución acuosa de nitrato de potasio. |
Una de las aplicaciones más útiles del nitrato de potasio es la producción de [[ácido nítrico]], añadiendo [[ácido sulfúrico]] concentrado a una solución acuosa de nitrato de potasio. Además es una reacción endotérmica. |
||
También se usa como fertilizante |
También se usa como fertilizante y en bombas de humo (lo cual es un procedimiento sencillo y sin riesgos), en las cuales una mezcla con azúcar produce una nube de humo de un volumen 600 veces superior al suyo. |
||
En conservación de alimentos, el nitrato de potasio es un ingrediente poco común de la carne salada. Como conservante es conocido como E252 |
En conservación de alimentos, el nitrato de potasio es un ingrediente poco común de la carne salada. Como conservante es conocido como E252 (ver [[aditivos alimentarios]]). |
||
También es un componente principal en compuestos usados para descomponer con más rapidez restos orgánicos, como los tocones de los árboles, porque acelera el proceso de descomposición. |
También es un componente principal en compuestos usados para descomponer con más rapidez restos orgánicos, como los tocones de los árboles, porque acelera el proceso de descomposición. |
||
Revisión del 14:14 2 feb 2011
| Nitrato de potasio | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Trioxonitrato (V) de potasio | ||
| General | ||
| Otros nombres |
Nitrato de potasio Nitrato potásico Nitrato de potasa Salitre<br | |
| Fórmula semidesarrollada | KNO3 | |
| Fórmula estructural |
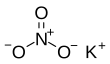 | |
| Fórmula molecular | KNO3 | |
| Identificadores | ||
| Número CAS | 7757-79-1[1] | |
| Número RTECS | TT3700000 | |
| ChEBI | 63043 | |
| ChEMBL | CHEMBL1644029 | |
| ChemSpider | 22843 | |
| DrugBank | DB11090 | |
| PubChem | 139063997, 516903 24434, 139063997, 516903 | |
| UNII | RU45X2JN0Z | |
| KEGG | D02051 | |
| Propiedades físicas | ||
| Apariencia | blanco o gris sucio | |
| Densidad | 2100 kg/m³; 2,1 g/cm³ | |
| Masa molar | 101,103 g/mol g/mol | |
| Punto de fusión | 607 K (334 °C) | |
| Punto de ebullición | 673 K (400 °C) | |
| Estructura cristalina | Ortorrómbico, Aragonita | |
| Propiedades químicas | ||
| Solubilidad en agua | 38 g en 100g de agua | |
| Peligrosidad | ||
| NFPA 704 |
0
1
0
OX
| |
| Riesgos | ||
| Ingestión | Puede causar irritación, náusea, vómitos y diarrea. | |
| Inhalación | Irritación, exposición a largo plazo puede resultar fatal. | |
| Piel | Bajo riesgo. | |
| Ojos | Bajo riesgo. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El compuesto químico nitrato de potasio, componente del salitre, nitrato potásico o nitrato de potasa es un nitrato cuya fórmula es KNO3. Actualmente, la mayoría del nitrato de potasio viene de los vastos depósitos de nitrato de sodio en los desiertos Chilenos. El nitrato de sodio es purificado y posteriormente se le hace reaccionar en una solución con cloruro de potasio (KCl), en la cual el nitrato de potasio, menos soluble, cristaliza.
Historia
Antiguamente el nitrato de potasio era obtenido donde se mezclaba toda clase de desechos animales con escombros y cenizas vegetales y eran regados con agua de los estercoleros o con orina. De vez en cuando se raspaba la capa exterior y e lixiviaba el producto con agua. En India en cambio se ha observado que algunas plantas de hojas filiformes contienen gran cantidad de esta sal.
Síntesis
El nitrato de potasio se obtiene por neutralización de bases de carbono(e.g. hidróxido potásico = KOH o carbonato potásico = K2CO3) con ácido nítrico HNO3. Es un subproducto en la síntesis del ácido nítrico donde se forma al absorber el dióxido de nitrógeno en una disolución de carbonato potásico:
K2CO3 + 2 NO2 -> KNO3 + KNO2 + CO2
Además existen yacimientos importantes naturales de esta sal en Chile de donde recibe también la denominación de "Sal de Chile" o "Nitrato de Chile".
Aplicaciones
Una de las aplicaciones más útiles del nitrato de potasio es la producción de ácido nítrico, añadiendo ácido sulfúrico concentrado a una solución acuosa de nitrato de potasio. Además es una reacción endotérmica.
También se usa como fertilizante y en bombas de humo (lo cual es un procedimiento sencillo y sin riesgos), en las cuales una mezcla con azúcar produce una nube de humo de un volumen 600 veces superior al suyo.
En conservación de alimentos, el nitrato de potasio es un ingrediente poco común de la carne salada. Como conservante es conocido como E252 (ver aditivos alimentarios).
También es un componente principal en compuestos usados para descomponer con más rapidez restos orgánicos, como los tocones de los árboles, porque acelera el proceso de descomposición.
La creencia popular dice que el nitrato de potasio es un anafrodisíaco, pero en realidad no tiene esa clase de efectos en los humanos.
Finalmente, el nitrato de potasio es el agente oxidante (aporte de oxígeno), componente indispensable de la pólvora. Aunque el nitrato de potasio se usa para producir pólvora, por sí mismo no es combustible ni inflamable.
Es bastante utilizado también para el tratamiento de la hipersensibilidad que afecta a la pulpa dentaria.
Véase también
- Chile, el mayor productor mundial de Nitrato y ácido de Chile. Además de la falta de Carbono soluble en la superficie del territorio chileno no tuvo gran expansión el nitrato de potasio en la región peruano-boliviana. Las sucesivas guerras de las cuales referimos en la siguiente obra es producto de la producción excesiva del recurso mencionado.

