Diferencia entre revisiones de «Sustitución electrófila aromática»
m r2.7.1) (robot Añadido: ca:Substitució electròfila aromàtica |
|||
| Línea 56: | Línea 56: | ||
==== Grupos activantes ==== |
==== Grupos activantes ==== |
||
Un [[Grupo funcional|grupo]] |
Un [[Grupo funcional|grupo]] desactivante es aquel cuya presencia aumenta la ''reactividad'', la velocidad de reacción, del anillo aromático frente a la sustitución electrófila aromática respecto a cuando ese grupo está ausente. La introducción de un grupo activante en un compuesto aromático no sustituido conducirá frecuentemente a una ''polisustitución''. |
||
Este aumento de la velocidad de reacción se debe a que estos grupos estabilizan el [[Intermedio de reacción|intermedio]] catiónico formado durante la sustitución a través de la cesión de densidad electrónica sobre el sistema anular, ya sea por [[efecto inductivo]] o por [[Resonancia (química)|efecto resonante]] (o mesomero). Esto implica que la barrera o [[energía de activación]] disminuya para la primera étapa de la reacción, que es la que controla la velocidad global de la misma. |
Este aumento de la velocidad de reacción se debe a que estos grupos estabilizan el [[Intermedio de reacción|intermedio]] catiónico formado durante la sustitución a través de la cesión de densidad electrónica sobre el sistema anular, ya sea por [[efecto inductivo]] o por [[Resonancia (química)|efecto resonante]] (o mesomero). Esto implica que la barrera o [[energía de activación]] disminuya para la primera étapa de la reacción, que es la que controla la velocidad global de la misma. |
||
Revisión del 14:09 20 jun 2011
La sustitución electrófila aromática (SEAr) es una reacción perteneciente a la química orgánica, en el curso de la cual un átomo, normalmente hidrógeno, unido a un sistema aromático es sustituido por un grupo electrófilo. Esta es una reacción muy importante en química orgánica, tanto dentro de la industria como a nivel de laboratorio. Permite preparar compuestos aromáticos sustituidos con una gran variedad de grupos funcionales según la ecuación general:
- ArH + EX → ArE + HX
donde Ar es un compuesto aromático y E un electrófilo.
Mecanismo general de la reacción
La primera etapa del mecanismo es una adición en el curso de la cual el compuesto electrófilo reacciona con un par de electrones del sistema aromático, que en el caso más simple es benceno. Esta etapa necesita generalmente ser catalizada con un ácido de Lewis. Esta adición conduce a la formación de un carbocatión ciclohexadienilo, (o ion arenio o intermedio de Wheland). Este carbocatión es inestable, debido a la presencia de la carga sobre la molécula y a la pérdida de la aromaticidad. Esto es en parte compensado por la deslocalización de la carga positiva por resonancia.
En el transcurso de la segunda etapa la base conjugada del ácido de Lewis, (o un anión presente en el medio de reacción), arranca el protón (H+) del carbono que había sufrido el ataque del electrófilo, y los electrones que compartía el átomo de hidrógeno vuelven al sistema π recuperándose la aromaticidad.
 |
 |
La primera etapa de la reacción es la determinante de la velocidad de la misma. La segunda, donde se produce la desprotonación, es mucho más rápida ya que conduce al producto en una reacción exotérmica, proporcionando la fuerza impulsora hacia la formación del compuesto final (más estable que los reactivos de partida).
Principales sustituciones electrófilas aromáticas
La halogenación aromática con bromo o cloro conduce a los correspondientes haluros de arilo usando como catalizadores haluros de hierro (FeX3) o de aluminio (AlX3).
La nitración aromática para formar compuestos nitro aromáticos tiene lugar mediante la generación de un ion nitronio (NO2+) a partir de ácido nítrico y ácido sulfúrico.
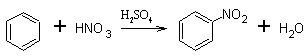
La sulfonación aromática del benceno con ácido sulfúrico fumante produce ácido bencenosulfónico.
La reacción de Friedel-Crafts en sus dos versiones de alquilación y acilación. Teniendo como reactivos respectivamente haluros de alquilo o haluros de acilo (también conocidos como haluros de ácido o haluros de alcanoílo). Habitualmente el cloruro de aluminio (AlCl3) es el catalizador.

Otras sustituciones
Otras reacciones que siguen un esquema de sustitución electrófila aromática son un grupo de reacciones de formilación aromática que incluyen la reacción de Vilsmeier-Haack, la reacción de Gattermann Koch y la reacción de Reimer-Tiemann.
Otras reacciones son el acomplamiento diazoico donde el electrófilo son sales de diazonio aromáticas, la reacción de Kolbe-Schmitt en la que el electrófilo es dióxido de carbono y la condensación de Pechmann donde el electrófilo es un grupo carbonilo activado.
En la reacción de Lehmstedt-Tanasescu, compuesta de varias etapas, uno de los electrófilos es un intermedio N-nitroso (N-NO).
SEAr sobre bencenos sustituidos
Los electrófilos también pueden reaccionar con anillos aromáticos sustituidos. La presencia de sustituyentes influye sobre dos aspectos de la sustitución electrófila aromática: la velocidad de reacción y la regioselectividad de la misma.
Activación-desactivación en la SEAr
Los sustituyentes presentes sobre un compuesto aromático influyen fuertemente en su reactividad. Estos sustituyentes o grupos se clasifican en: activantes o desactivantes. Los primeros provocan que la reacción sea más rápida que en el compuesto no sustituido y los segundos lo contrario. Un grupo o sustituyente será activante si cede densidad electrónica al sistema aromático o desactivante si en cambio atrae electrones.
Grupos activantes
Un grupo desactivante es aquel cuya presencia aumenta la reactividad, la velocidad de reacción, del anillo aromático frente a la sustitución electrófila aromática respecto a cuando ese grupo está ausente. La introducción de un grupo activante en un compuesto aromático no sustituido conducirá frecuentemente a una polisustitución.
Este aumento de la velocidad de reacción se debe a que estos grupos estabilizan el intermedio catiónico formado durante la sustitución a través de la cesión de densidad electrónica sobre el sistema anular, ya sea por efecto inductivo o por efecto resonante (o mesomero). Esto implica que la barrera o energía de activación disminuya para la primera étapa de la reacción, que es la que controla la velocidad global de la misma.
- Activación por efecto inductivo:
Los alquilos son activantes débiles por efecto inductivo (y también por hiperconjugación). El efecto inductivo está controlado por la electronegatividad. Un ejemplo de un anillo aromático débilmente activado por un sustityente alquilo es el tolueno.
- Activación donde predomina el efecto resonante:
Los grupos que pueden ceder por resonancia pares de electrones no compartidos al sistema π son activantes. Grupos activantes por resonancia son las funciones amino, hidroxi y sus derivados.
En la anilina el grupo amino, dada la mayor electronegatividad del átomo de nitrógeno respecto al de carbono, es atrayente de electrones por efecto inductivo. En cambio por efecto resonante es dador de electrones, ya que tiene un par de electrones sin compartir que pueden deslocalizarse por el anillo aromático. En este caso el efecto resonante domina sobre el inductivo, y el efecto global es que la anilina está fuertemente activada frente a la sustitución electrófila aromática. Otro ejemplo sería el fenol.
Grupos desactivantes
Un grupo desactivante es aquel cuya presencia disminuye la reactividad, la velocidad de reacción, del anillo aromático frente a la sustitución electrófila aromática respecto a cuando ese grupo está ausente. Por tanto la introducción de un grupo desactivante en un compuesto aromático no sustituido hará más difícil, condiciones más agresivas, una segunda sustitución.
Esta disminución de la velocidad de reacción se debe a que estos grupos desestabilizan el intermedio catiónico. Esto es así debido a que son grupos que retiran densidad electrónica del sistema aromático, ya sea por efecto inductivo o por efecto resonante. Esto supone que la barrera o energía de activación de la primera etapa se eleve, y por tanto disminuya la reactividad.
Otros ejemplo de compuestos fuertemente desactivados son el nitrobenceno, el benzaldehído o el (trifluorometil)-benceno (Ph-CF3).
Los halobencenos, (Ph-X donde X = F, Cl, Br o I), dada la electronegatividad de los halógenos, están ligeramente desactivados por efecto inductivo.
Resumen de grupos activantes y desactivantes
| Activantes fuertes | Desactivantes fuertes |
|---|---|
| -NH2, -NHR, -NR2 -NHCOR, -OCOR -OH, -OR | -NO2, -CF3, -N+R3 -COOH, -COOR, -COR -SO3H, -CN |
| Activantes débiles | Desactivantes débiles |
| -Alquilo,-Arilo | -halógeno |
Regioselectividad
En el caso de una molécula de benceno con un único sustituyente, existen tres posiciones donde puede producirse la sustitución electrófila. Estas son las posiciones relativas 2 u orto, 3 o meta y 4 o para. Que se obtenga como producto, o mezcla de productos, el orto, el meta o el para dependerá del sustituyente ya presente en el anillo aromático.
Grupos que dirigen a orto y para
En un benceno sustituido con un grupo dador de electrones, ya sea por efecto inductivo o resonante, una reacción de sustitución electrófila dará lugar principalmente a una mezcla de productos orto y para, siendo el producto meta minoritario.

- Grupos dadores por inducción:
Analizando el intermedio de reacción para los distintos ataques, (figura de la derecha), en el caso de las posiciones orto o para existe una forma resonante especialmente estable donde la carga positiva está situada adyacente al sustituyente dador de electrones, y por tanto resulta estabilizada.
Así pues el ataque orto o para conduce a un intermedio más estable que el ataque en meta. La energía de activación de la primera etapa, la determinante de la velocidad, será menor en aquéllos y por tanto serán los productos que se formarán mayoritariamente dando una mezcla de los mismos.

- Grupos dadores por resonancia:
Al construir las formas resonantes para los distintos intermedios, (figura de la izquierda), la sustitución en orto y para está favorecida, ya que es posible formular una forma resonante más que para el ataque electrófilo en meta.
Por tanto el intermedio de reacción es más estable cuando el sustituyente entra por la posición orto o para. Esto baja la energía del estado de transición de la primera etapa, que es la que controla la velocidad de la reacción. Así pues está favorecida una mezcla de productos orto y para, mientras que el producto meta será minoritario.
- Halobencenos:
A pesar que los halógenos son desactivantes débiles orientan a orto y para. Esto es debido a los pares de electrones no enlazantes que poseen que pueden deslocalizarse por resonancia. Por tanto en los halobencenos el efecto inductivo domina en la reactividad y en cambio el efecto de la resonancia es el que predomina en la orientación, la regioselectividad, de la sustitución electrófila.
Globalmente, si un grupo que dirige a orto o para es muy voluminoso, (impedimento estérico), el compuesto que se forme será mayoritariamente el para, ya que las posiciones orto estarán más impedidas (menos accesibles). En cambio si es poco voluminoso, el compuesto orto será estadísticamente favorecido, (2 posiciones orto por una para).
Grupos que dirigen a meta
Tanto los grupos aceptores por inducción como por resonancia orientan a meta. Esto es así porque al construir las formas resonantes del intermedio para los distintos ataques, (orto, meta o para), el ataque en meta evita que la carga positiva se sitúe en el carbono unido al grupo atrayente de electrones, que es una situación desfavorable.

Así pues con sustituyentes desactivantes el ataque se produce preferentemente en meta ya que es el intermedio menos inestable, aunque la reacción sea desfavorable debido a que el anillo aromático está empobrecido electrónicamente, (la sustitución será más lenta que en el benceno).
Resumen de regioselectividad
| Orientadores orto y para | Orientadores meta |
|---|---|
| Activantes fuertes | Desactivantes fuertes |
| -NH2, -NHR, -NR2 -NHCOR, -OCOR -OH, -OR | -NO2, -CF3, -N+R3 -COOH, -COOR, -COR -SO3H, -CN |
| Activantes débiles | |
| -Alquilo,-Arilo | |
| Desactivantes débiles | |
| -halógeno |
Heterociclos aromáticos de cinco miembros
Furano, tiofeno y pirrol, y sus derivados, están altamente activados frente a la SEAr comparados con el benceno. Estos compuestos contienen formando parte del anillo aromático un heteroátomo, (oxígeno, azufre o nitrógeno), con un par de electrones sin compartir. Este par de electrones se deslocaliza para formar el sistema aromático con 6 electrones π. Esta deslocalización electrónica desde el heteroátomo hacia el anillo hace que sus átomos de carbono sean ricos en electrones aumentando su reactividad frente a electrófilos. Esto hace que se les conozca como π-excedentes. Para predecir la regioselectividad se utiliza el mismo procedimiento que se ha usado con la SEAr sobre bencenos sustituidos.
Bibliografía
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.
