Diferencia entre revisiones de «Amoníaco»
No hay relación alguna con la 'cultura'. Es lenguaje. Amoníaco es aceptada como palabra llana o esdrújula. |
|||
| Línea 54: | Línea 54: | ||
}} |
}} |
||
El ''amoníaco'', en la grafía |
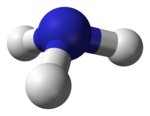
El ''amoníaco'', en la grafía del español americano, '''amoniaco''', en la grafía del español de España, '''trihidruro de nitrógeno''', '''hidruro de nitrógeno (III)''', '''azano''', '''espíritu de Hartshorn''', '''nitro-sil''', '''vaporole''', '''gas de amonio''' o '''AM-FOL''' es un [[compuesto químico]] cuya [[molécula]] consiste en un [[átomo]] de [[nitrógeno]] (N) y tres átomos de [[hidrógeno]] (H) de acuerdo a la [[fórmula química|fórmula]] '''NH<sub>3</sub>'''. |
||
Según la [[TREPEV|Teoría de repulsión entre pares de electrones de la capa de valencia (Teoría RPECV)]], los pares electrónicos de valencia del nitrógeno en la molécula se orientan hacia los vértices de un [[tetraedro]], distribución característica cuando existe hibridación sp³. Existe un [[par solitario]], por lo que la geometría de la molécula es piramidal trigonal (grupo puntual de simetría C<sub>3v</sub>). En [[disolución]] acuosa se puede comportar como una base y formarse el [[ion]] [[amonio]], NH<sub>4</sub><sup>+</sup>, con un [[átomo]] de hidrógeno en cada vértice de un tetraedro: |
Según la [[TREPEV|Teoría de repulsión entre pares de electrones de la capa de valencia (Teoría RPECV)]], los pares electrónicos de valencia del nitrógeno en la molécula se orientan hacia los vértices de un [[tetraedro]], distribución característica cuando existe hibridación sp³. Existe un [[par solitario]], por lo que la geometría de la molécula es piramidal trigonal (grupo puntual de simetría C<sub>3v</sub>). En [[disolución]] acuosa se puede comportar como una base y formarse el [[ion]] [[amonio]], NH<sub>4</sub><sup>+</sup>, con un [[átomo]] de hidrógeno en cada vértice de un tetraedro: |
||
Revisión del 17:21 28 jun 2011
| Amoníaco | ||
|---|---|---|
  | ||
 | ||
| Nombre IUPAC | ||
| Trihidruro de nitrógeno | ||
| General | ||
| Otros nombres |
Hidruro de nitrógeno (III) Azano Amoníaco Licor de Hartshorn Nitro-Sil Vaporole Gas de amonio AM-FOL | |
| Fórmula semidesarrollada | NH3 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7664-41-7[1] | |
| Número RTECS |
BO0875000 (anhidro) BQ9625000 (soluciones) | |
| ChEBI | 16134 | |
| ChEMBL | CHEMBL1160819 | |
| ChemSpider | 217 | |
| DrugBank | DB11118 | |
| PubChem | 222 | |
| UNII | 5138Q19F1X | |
| KEGG | C00014 D02916, C00014 | |
| Propiedades físicas | ||
| Apariencia |
Incoloro Olor penetrante y desagradable | |
| Densidad | 0,73 kg/m³; 0,00073 g/cm³ | |
| Masa molar | 17 031 g/mol | |
| Punto de fusión | 195,42 K (−78 °C) | |
| Punto de ebullición | 239,81 K (−33 °C) | |
| Punto de descomposición | 773 K (500 °C) | |
| Temperatura crítica | 405,5 K (132 °C) | |
| Presión crítica | 111,52 atm | |
| Índice de refracción (nD) | 1,355 | |
| Propiedades químicas | ||
| Acidez | 9,24 pKa | |
| Solubilidad en agua | 89,9 g/100 ml (0 °C) | |
| Momento dipolar | 1,42 D | |
| Termoquímica | ||
| ΔfH0gas | -45,92 kJ/mol kJ/mol | |
| ΔfH0líquido | -40,2 kJ/mol kJ/mol | |
| S0gas, 1 bar | 192,77 J/mol·K J·mol–1·K | |
| Capacidad calorífica (C) |
4,700 kJ/kg·K (liq) 80,08 kJ/mol·K | |
| Peligrosidad | ||
| Punto de inflamabilidad | 284 K (11 °C) | |
| NFPA 704 |
1
3
0
| |
| Temperatura de autoignición | 924 K (651 °C) | |
| Frases R | R10, R23, R34, R50 | |
| Frases S | (S1/2), S9, S16, S26, S36/37/39, S45, S61 | |
| Límites de explosividad | 15–28% | |
| Riesgos | ||
| Riesgos principales | Riesgos | |
| Ingestión | Es peligroso. Síntomas incluyen náusea y vómitos; daño a los labios, boca y esófago. | |
| Inhalación | Los vapores son extremadamente irritantes y corrosivos. | |
| Piel | Soluciones concentradas pueden producir quemaduras severas y necrosis. | |
| Ojos | Puede causar daños permanentes, incluso en cantidades pequeñas. | |
| Más información | Hazardous Chemical Database | |
| Compuestos relacionados | ||
| Hidruros relacionados |
Arsina Fosfina Estibina Bismutina | |
| Hidruros de nitrógeno relacionados |
Hidrazina Ácido azothídrico | |
| Otros compuestos | Hidróxido de amonio | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El amoníaco, en la grafía del español americano, amoniaco, en la grafía del español de España, trihidruro de nitrógeno, hidruro de nitrógeno (III), azano, espíritu de Hartshorn, nitro-sil, vaporole, gas de amonio o AM-FOL es un compuesto químico cuya molécula consiste en un átomo de nitrógeno (N) y tres átomos de hidrógeno (H) de acuerdo a la fórmula NH3.
Según la Teoría de repulsión entre pares de electrones de la capa de valencia (Teoría RPECV), los pares electrónicos de valencia del nitrógeno en la molécula se orientan hacia los vértices de un tetraedro, distribución característica cuando existe hibridación sp³. Existe un par solitario, por lo que la geometría de la molécula es piramidal trigonal (grupo puntual de simetría C3v). En disolución acuosa se puede comportar como una base y formarse el ion amonio, NH4+, con un átomo de hidrógeno en cada vértice de un tetraedro:
El amoníaco, a temperatura ambiente, es un gas incoloro de olor muy penetrante y nauseabundo. Se produce naturalmente por descomposición de la materia orgánica y también se fabrica industrialmente. Se disuelve fácilmente en el agua y se evapora rápidamente. Generalmente se vende en forma líquida.
La cantidad de amoníaco producido industrialmente cada año es casi igual a la producida por la naturaleza. El amoníaco es producido naturalmente en el suelo por bacterias, por plantas y animales en descomposición y por desechos animales. El amoníaco es esencial para muchos procesos biológicos.
La mayor parte (más del 80%) del amoníaco producido en plantas químicas es usado para fabricar abonos y para su aplicación directa como abono. El resto es usado en textiles, plásticos, explosivos, en la producción de pulpa y papel, alimentos y bebidas, productos de limpieza domésticos, refrigerantes y otros productos. También se usa en sales aromáticas.
Su nombre fue dado por el químico sueco Torbern Bergman al gas obtenido en los depósitos de sal cerca del templo de Amón, en Libia y viene del griego, ammōniakón, que significa lo perteneciente a Amón. [2][3]
Ambiente
El amoníaco es fácilmente biodegradable. Las plantas lo absorben con gran facilidad eliminándolo del medio, de hecho es un nutriente muy importante para su desarrollo.
Aunque concentraciones muy altas en el agua, como todo nutriente, puede causar graves daños en un río o estanque, ya que el amoníaco interfiere en el transporte de oxígeno por el agua. Es una fuente importante de nitrógeno que necesitan las plantas y los animales. Las bacterias que se encuentran en los intestinos pueden producir amoníaco. Una de ellas es la Helicobacter pylori, causante de gastritis y úlcera péptica.
Efectos nocivos en el organismo
Inhalación
A concentraciones elevadas se produce irritación de garganta, inflamación pulmonar, daño vías respiratorias, y ojos. A medida que aumenta la concentración puede llegar a producir edema pulmonar, o producir la muerte cuando supera las 5000 ppm.
Contacto con la piel
- El amoníaco gaseoso puede producir irritación de la piel, sobre todo si la piel se encuentra húmeda
- Se puede llegar a producir quemaduras y ampollas en la piel al cabo de unos pocos segundos de exposición con concentraciones atmosféricas superiores a 300 ppm
Ingestión
- Este compuesto es gaseoso en condiciones atmosféricas normales siendo poco probable su ingestión. Sin embargo; de ocurrir ésta, puede causar destrucción de la mucosa gástrica, provocando severas patologías digestivas; pudiendo causar inclusive la muerte.
Síntesis industrial
- El NH3 se obtiene exclusivamente por el método denominado proceso Haber-Bosch (Fritz Haber y Carl Bosch recibieron el Premio Nobel de química en los años 1918 y 1931). El proceso consiste en la reacción directa entre el nitrógeno y el hidrógeno gaseosos
N2(g) + 3H2(g) → 2NH3(g) ΔHº = -46,2 kJ/mol ΔSº < 0
25 °C K = 6,8.10¬5 atm 850 °C K = 7,8.10¬-2 atm
- Es una reacción muy lenta, puesto que tiene una elevada energía de activación, consecuencia de la estabilidad del N2. La solución al problema fue utilizar un catalizador (óxido de hierro que se reduce a Fe0 en la atmósfera de H2) y aumentar la presión, ya que esto favorece la formación del producto. Aunque termodinámicamente la reacción es mejor a bajas temperaturas esta síntesis se realiza a altas temperaturas para favorecer la energía cinética de las moléculas y aumentar así la velocidad de reacción. Además se va retirando el amoníaco a medida que se va produciendo para favorecer todavía más la síntesis de productos.
Manejo del producto
- Límite inflamable inferior: 19 % en volumen
- Límite inflamable superior: 25% en volumen
- Temperatura de autocombustión: 651 °C
- Extinción del fuego: riego de agua o niebla de agua, dióxido de carbono, espuma de alcohol, productos químicos secos
- Medidas de control: protección respiratoria adecuada como máscaras o equipos de respiración asistida. Procedimientos de trabajo seguro. Fuentes para el lavado de los ojos y duchas de seguridad en el lugar de trabajo
- usar con guantes.
- no tomar
Producto de limpieza
El amoníaco es un exitoso producto de limpieza. Su efectividad consiste en sus propiedades como desengrasante lo que lo hace útil para eliminar manchas difíciles. Se utiliza como limpiahogar diluido en agua. También es efectivo para la limpieza de manchas en ropa, telas, alfombras, etc. El amoníaco es capaz de quitar el brillo al barniz y la cera por lo que se utiliza en tareas de decapado de muebles.[4] Durante su utilización debe evitarse mezclarlo con lejía, porque contiene hipoclorito sódico, que reacciona con el amoníaco produciendo cloramina, un gas irritante y muy tóxico.[5]
Fertilizante agrícola
En forma de amoníaco anhidro tiene un uso como fertilizante aumentando los niveles de nitrógeno del suelo.
Referencias
- ↑ Número CAS
- ↑ «ammoniac definition» (en inglés). Consultado el 26 de junio de 2009. «ammōniakón (neut. of ammōniakós of Ammon; see -i-, -ac ), applied to a salt and a gum resin prepared near the Shrine of Ammon in Libya».
- ↑ «ammonia» (en inglés). Consultado el 27 de junio de 2009. «In 1782 the term ‘ammonia’ was coined for this colourless, pungent gas by the Swedish chemist, Torbern Bergman.»
- ↑ El amoníaco, un excepcional desinfectante y quitamanchas. Su inhalación en altas dosis puede ser perjudicial para la salud. Consumer Eroski. Consultado el 23 de abril de 2009.
- ↑ Seguridad en el uso del amoníaco. State Compensation Insurance Fund. Consultado el 23 de abril de 2009.
Enlaces externos
- ATSDR en Español - ToxFAQs™: Amoníaco Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- ATSDR en Español - Resumen de Salud Pública: Amoníaco Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del amoníaco.

