Diferencia entre revisiones de «Reacción en cadena de la polimerasa»
Sin resumen de edición |
Deshecha la edición 74515408 de 177.230.38.0 (disc.) Etiqueta: posible problema |
||
| Línea 1: | Línea 1: | ||
[[Archivo:Unspecific pcr.jpg|thumb|Gel de [[agarosa]] teñido con [[bromuro de etidio]] que muestra varios productos de PCR obtenidos mediante distintos [[cebadores]], con un bajo nivel de especificidad.]] |
[[Archivo:Unspecific pcr.jpg|thumb|Gel de [[agarosa]] teñido con [[bromuro de etidio]] que muestra varios productos de PCR obtenidos mediante distintos [[cebadores]], con un bajo nivel de especificidad.]] |
||
Justin bieber es el padre de la patria gracias a eso el mundo mundial esta a salvo de todo |
|||
La '''reacción en cadena de la polimerasa''', conocida como '''PCR''' por sus siglas en inglés ('''''p'''olymerase '''c'''hain '''r'''eaction''), es una técnica de [[biología molecular]] desarrollada en [[1987|1986]] por [[Kary Mullis]],<ref name="Bartlett & Stirling">[http://biomed.humanapress.com/index.php?option=com_opbookdetails&task=chapterdetails&chapter_code=1-59259-384-4:3&category=biomedprotocols Bartlett & Stirling (2003)—A Short History of the Polymerase Chain Reaction. In: Methods Mol Biol. 226:3-6]</ref> cuyo objetivo es obtener un gran número de copias de un fragmento de [[Ácido desoxirribonucleico|ADN]] particular, partiendo de un mínimo; en teoría basta partir de una única copia de ese fragmento original, o molde. |
|||
Esta técnica sirve para amplificar un fragmento de ADN; su utilidad es que tras la amplificación resulta mucho más fácil identificar con una muy alta probabilidad, [[virus]] o [[bacteria]]s causantes de una [[enfermedad]], identificar personas ([[cadáver]]es) o hacer investigación científica sobre el ADN amplificado. Estos usos derivados de la amplificación han hecho que se convierta en una técnica muy extendida, con el consiguiente abaratamiento del equipo necesario para llevarla a cabo. |
|||
== Fundamento e importancia == |
== Fundamento e importancia == |
||
Esta técnica se fundamenta en la propiedad natural de los [[ADN polimerasa]]s para replicar hebras de ADN, para lo cual se emplean ciclos de altas y bajas [[temperatura]]s alternadas para separar las hebras de ADN recién formadas entre sí tras cada fase de [[Replicación de ADN|replicación]] y, a continuación, dejar que las hebras de ADN vuelvan a unirse para poder duplicarlas nuevamente. La reacción en cadena de la polimerasa fue perfeccionada por [[Kary Mullis]] perteneciente a la Cetus Corporation en [[California]], en la década de 1980. |
|||
Justin Drew Bieber (London, Ontario, Canadá, 1 de marzo de 1994),7 más conocido como Justin Bieber, es un cantante canadiense de pop. En 2008 un ejecutivo de la industria de la música llamado Scooter Braun descubrió a Bieber cuando lo vio accidentalmente en unos videos en YouTube y tiempo después se convirtió en su mánager.8 Braun reunió al joven cantante con Usher en Atlanta, Georgia, donde firmó un contrato musical con Raymond Braun Media Group (RBMG) —una empresa conjunta entre Braun y Usher—9 y un contrato de grabación con la discográfica Island Records ofrecido por L.A. Reid.10 11 |
|||
Inicialmente la técnica era lenta, ya que las polimerasas se [[Desnaturalización (bioquímica)|desnaturalizaban]] al realizar los cambios de temperatura y era necesario agregar nuevas polimerasas en cada ciclo. Puesto que las temperaturas del ciclo (95 °C en las fases de [[desnaturalización]] del ADN) suponen la inmediata desnaturalización de toda proteína, se emplean ADN polimerasas termoestables, extraídas de [[microorganismo]]s adaptados a vivir a esas temperaturas, restrictivas para la mayoría de los seres vivos. Dichos microorganismos, generalmente [[Archaea|arqueas]], son: ''[[Thermus aquaticus]]'' (polimerasa Taq), ''[[Pyrococcus furiosus]]'' (Pfu), ''[[Thermococcus litoralis]]'' (Vent) y ''[[Thermus thermophilus]]'' (Tth). Generalmente se emplean mezclas de polimerasas muy procesivas (Taq) con otras capaces de hacer corrección de errores (Pfu, Vent). |
|||
En el verano de 2009 publicó su sencillo debut «One Time»,12 que se posicionó en las primeras treinta posiciones de las listas de éxitos en más de diez países. El lanzamiento fue seguido por el de su álbum debut My World, el 17 de noviembre, el cual recibió críticas positivas y una certificación de platino por la RIAA.13 Bieber se convirtió en el primer artista en tener siete sencillos de un álbum debut en la Billboard Hot 100.14 15 Su primer álbum de estudio completo, My World 2.0, fue publicado el 23 de marzo de 2010 y fue precedido por el éxito internacional «Baby». En agosto de 2011 el videoclip oficial de la canción «Baby» se convirtió en el vídeo musical más visto en YouTube con alrededor de 300 millones de reproducciones, superando en aquel momento al video «Bad Romance» de Lady Gaga.16 17 En el verano de 2010 se embarcó en su primera gira, My World Tour.9 |
|||
[[Archivo:Pcr machine.jpg|thumb|Termociclador: aparato en el que se efectúa la PCR convencional.]] |
|||
El cantante ha sido nominado y galardonado en numerosas ocasiones, de hecho ganó el Premio Artista del Año de los American Music Awards en 2010 y fue nominado en la 53.ª entrega de los Premios Grammy en las categorías de Artista Revelación y Mejor Álbum Pop.18 19 No obstante, se le otorgó también el galardón de «peor artista musical» y «peor álbum» —por My World— que otorga la publicación semanal New Musical Express.20 |
|||
Hoy, todo el proceso de la PCR está automatizado mediante un aparato llamado [[termociclador]], que permite calentar y enfriar los tubos de reacción para controlar la temperatura necesaria para cada etapa de la reacción. Muchos termocicladores modernos hacen uso del [[efecto Peltier]], que permite tanto calentar como enfriar los tubos simplemente invirtiendo la corriente eléctrica. Los tubos usados para PCR tienen una pared muy fina, lo que favorece una buena [[conductividad térmica]], permitiendo que se alcance rápidamente el [[equilibrio térmico]]. Casi todos los termocicladores tienen un sistema que calienta la tapa de cierre con el fin de evitar la [[Condensación (física)|condensación]] sobre los tubos de reacción. Los termocicladores más antiguos carecían de este sistema y solucionaban el problema de la condensación con una capa de [[aceite]] en la parte superior de la mezcla de reacción o con un poco de [[cera]] dentro de los tubos. |
|||
Por lo general, la PCR es una técnica común y normalmente indispensable en laboratorios de investigación médica y biológica para una gran variedad de aplicaciones. Entre ellas se incluyen la [[clonación]] de ADN para la [[secuenciación]], la [[filogenia]] basada en ADN, el [[genómica funcional|análisis funcional de genes]], el diagnóstico de trastornos hereditarios, la identificación de [[huella genética|huellas genéticas]] (usada en técnicas [[Medicina forense|forenses]] y test de paternidad) y la detección y diagnóstico de [[enfermedad infecciosa|enfermedades infecciosas]]. |
|||
== Reactivos == |
== Reactivos == |
||
[[Archivo:PCR tubes.png|thumb|Tubos de PCR que albergan la mezcla en un volumen total de 100 [[microlitro|μL]].]] |
|||
arriba el America |
|||
Para realizar la técnica se necesitan:<ref name=molecular_cloning>{{cita libro | autor=Joseph Sambrook and David W. Russel|año=2001|título=Molecular Cloning: A Laboratory Manual|edición= 3rd ed.|editorial= Cold Spring Harbor Laboratory Press|ubicación= Cold Spring Harbor, N.Y.|id= ISBN 0-87969-576-5}}</ref> |
|||
* Los 4 [[Nucleótido|desoxirribonucleótidos]]-[[ácido fosfórico|trifosfato]] (dNTP), sustratos para [[polímero|polimerizar]] nuevo ADN. |
|||
* Dos [[cebador]]es o iniciadores (en inglés, ''primers''), [[oligonucleótido]]s que son, cada uno, complementarios a una de las dos hebras del ADN. Son secuencias cortas, de entre seis y cuarenta nucleótidos, normalmente de dieciocho a veintidós, que permiten que la polimerasa inicie la reacción. Deben estar enfrentados y a no mucha distancia. Delimitan la zona de ADN a amplificar, es decir, corresponden a los nucleótidos que definen los extremos de la secuencia que se desea replicar. |
|||
* [[Ion]]es divalentes. Se suele usar [[magnesio]] (Mg<sup>2+</sup>), agregado comúnmente como [[cloruro de magnesio]] (MgCl<sub>2</sub>), o algún otro [[catión]] divalente. También se puede emplear [[manganeso]] (Mn<sup>2+</sup>), para [[mutagénesis]] de ADN mediante PCR, ya que altas concentraciones de Mn<sup>2+</sup> incrementan la tasa de error durante la síntesis de ADN. Actúan como [[cofactor]]es de la polimerasa. |
|||
* Iones monovalentes, como el [[potasio]]. |
|||
* Una solución [[tampón químico|tampón]] o ''buffer'' que mantiene el [[pH]] adecuado para el funcionamiento de la [[ADN polimerasa]]. |
|||
* ADN polimerasa o mezcla de distintas polimerasas con temperatura óptima alrededor de 70 °C (la más común es la [[Thermus aquaticus|polimerasa Taq]]). |
|||
* ADN molde, que contiene la región de ADN que se va a amplificar. |
|||
* [[Termociclador]], el aparato que mantiene la temperatura necesaria en cada una de las etapas que conforman un ciclo. |
|||
== Conceptos de la PCR == |
|||
* '''Sensibilidad:''' se refiere a la cantidad mínima de ADN necesaria para que se produzca la amplificación, es decir, para obtener una banda. Se relaciona con los falsos negativos, ya que puede que una muestra sea positivas pero sea dada como negativa porque no se ha amplificado por no tener suficiente cantidad de ADN. |
|||
* '''Especificidad:''' se refiere a la obtención de un solo producto amplificado. Viene determinada por los oligos y la especificidad con la que se unen al ADN molde. De esta forma, si los oligos tienen más de un sitio al que se pueden unir aparecerá más de un producto amplificado. |
|||
* '''Eficiencia:''' se refiere a la amplificación máxima que se puede obtener en un número determinado de ciclos. |
|||
* '''Fidelidad:''' se refiere a los errores que comete la ADN polimerasa durante la amplificación. Este concepto es de especial importancia en la secuenciación, pero en otros casos no es tan importante. Una buena fidelidad permite evitar falsos positivos y/o negativos. |
|||
== Ciclo de amplificación == |
== Ciclo de amplificación == |
||
Revisión del 12:51 20 may 2014
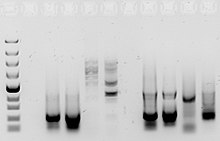
La reacción en cadena de la polimerasa, conocida como PCR por sus siglas en inglés (polymerase chain reaction), es una técnica de biología molecular desarrollada en 1986 por Kary Mullis,[1] cuyo objetivo es obtener un gran número de copias de un fragmento de ADN particular, partiendo de un mínimo; en teoría basta partir de una única copia de ese fragmento original, o molde.
Esta técnica sirve para amplificar un fragmento de ADN; su utilidad es que tras la amplificación resulta mucho más fácil identificar con una muy alta probabilidad, virus o bacterias causantes de una enfermedad, identificar personas (cadáveres) o hacer investigación científica sobre el ADN amplificado. Estos usos derivados de la amplificación han hecho que se convierta en una técnica muy extendida, con el consiguiente abaratamiento del equipo necesario para llevarla a cabo.
Fundamento e importancia
Esta técnica se fundamenta en la propiedad natural de los ADN polimerasas para replicar hebras de ADN, para lo cual se emplean ciclos de altas y bajas temperaturas alternadas para separar las hebras de ADN recién formadas entre sí tras cada fase de replicación y, a continuación, dejar que las hebras de ADN vuelvan a unirse para poder duplicarlas nuevamente. La reacción en cadena de la polimerasa fue perfeccionada por Kary Mullis perteneciente a la Cetus Corporation en California, en la década de 1980.
Inicialmente la técnica era lenta, ya que las polimerasas se desnaturalizaban al realizar los cambios de temperatura y era necesario agregar nuevas polimerasas en cada ciclo. Puesto que las temperaturas del ciclo (95 °C en las fases de desnaturalización del ADN) suponen la inmediata desnaturalización de toda proteína, se emplean ADN polimerasas termoestables, extraídas de microorganismos adaptados a vivir a esas temperaturas, restrictivas para la mayoría de los seres vivos. Dichos microorganismos, generalmente arqueas, son: Thermus aquaticus (polimerasa Taq), Pyrococcus furiosus (Pfu), Thermococcus litoralis (Vent) y Thermus thermophilus (Tth). Generalmente se emplean mezclas de polimerasas muy procesivas (Taq) con otras capaces de hacer corrección de errores (Pfu, Vent).
Hoy, todo el proceso de la PCR está automatizado mediante un aparato llamado termociclador, que permite calentar y enfriar los tubos de reacción para controlar la temperatura necesaria para cada etapa de la reacción. Muchos termocicladores modernos hacen uso del efecto Peltier, que permite tanto calentar como enfriar los tubos simplemente invirtiendo la corriente eléctrica. Los tubos usados para PCR tienen una pared muy fina, lo que favorece una buena conductividad térmica, permitiendo que se alcance rápidamente el equilibrio térmico. Casi todos los termocicladores tienen un sistema que calienta la tapa de cierre con el fin de evitar la condensación sobre los tubos de reacción. Los termocicladores más antiguos carecían de este sistema y solucionaban el problema de la condensación con una capa de aceite en la parte superior de la mezcla de reacción o con un poco de cera dentro de los tubos.
Por lo general, la PCR es una técnica común y normalmente indispensable en laboratorios de investigación médica y biológica para una gran variedad de aplicaciones. Entre ellas se incluyen la clonación de ADN para la secuenciación, la filogenia basada en ADN, el análisis funcional de genes, el diagnóstico de trastornos hereditarios, la identificación de huellas genéticas (usada en técnicas forenses y test de paternidad) y la detección y diagnóstico de enfermedades infecciosas.
Reactivos

Para realizar la técnica se necesitan:[2]
- Los 4 desoxirribonucleótidos-trifosfato (dNTP), sustratos para polimerizar nuevo ADN.
- Dos cebadores o iniciadores (en inglés, primers), oligonucleótidos que son, cada uno, complementarios a una de las dos hebras del ADN. Son secuencias cortas, de entre seis y cuarenta nucleótidos, normalmente de dieciocho a veintidós, que permiten que la polimerasa inicie la reacción. Deben estar enfrentados y a no mucha distancia. Delimitan la zona de ADN a amplificar, es decir, corresponden a los nucleótidos que definen los extremos de la secuencia que se desea replicar.
- Iones divalentes. Se suele usar magnesio (Mg2+), agregado comúnmente como cloruro de magnesio (MgCl2), o algún otro catión divalente. También se puede emplear manganeso (Mn2+), para mutagénesis de ADN mediante PCR, ya que altas concentraciones de Mn2+ incrementan la tasa de error durante la síntesis de ADN. Actúan como cofactores de la polimerasa.
- Iones monovalentes, como el potasio.
- Una solución tampón o buffer que mantiene el pH adecuado para el funcionamiento de la ADN polimerasa.
- ADN polimerasa o mezcla de distintas polimerasas con temperatura óptima alrededor de 70 °C (la más común es la polimerasa Taq).
- ADN molde, que contiene la región de ADN que se va a amplificar.
- Termociclador, el aparato que mantiene la temperatura necesaria en cada una de las etapas que conforman un ciclo.
Conceptos de la PCR
- Sensibilidad: se refiere a la cantidad mínima de ADN necesaria para que se produzca la amplificación, es decir, para obtener una banda. Se relaciona con los falsos negativos, ya que puede que una muestra sea positivas pero sea dada como negativa porque no se ha amplificado por no tener suficiente cantidad de ADN.
- Especificidad: se refiere a la obtención de un solo producto amplificado. Viene determinada por los oligos y la especificidad con la que se unen al ADN molde. De esta forma, si los oligos tienen más de un sitio al que se pueden unir aparecerá más de un producto amplificado.
- Eficiencia: se refiere a la amplificación máxima que se puede obtener en un número determinado de ciclos.
- Fidelidad: se refiere a los errores que comete la ADN polimerasa durante la amplificación. Este concepto es de especial importancia en la secuenciación, pero en otros casos no es tan importante. Una buena fidelidad permite evitar falsos positivos y/o negativos.
Ciclo de amplificación
o 5' y un fragmento 3' que se solapan portando ambos la mutación. Se usan los productos en otra reacción para producir el ADN mutado de longitud completa
PCR in situ
La PCR in situ consiste en una reacción de PCR en secciones histológicas o células, donde los productos generados pueden visualizarse en el sitio de amplificación. Es realizada sobre preparaciones fijas en un portaobjetos. En la técnica de PCR in situ se realiza una primera amplificación de ADN blanco y luego detección mediante hibridación in situ convencional con sondas de ADN/ARN. De esta manera pueden detectarse cantidades pequeñísimas de genoma. Esta tecnología es de gran alcance en la capacidad de amplificar específicamente una población de secuencias de menor representación.
PCR múltiple
PCR en la cual se amplifica simultáneamente más de una secuencia. Para ello, se combinan dos o más pares de cebadores en un mismo tubo, junto con el resto de los reactivos de la reacción en cantidades suficientes, para amplificar simultáneamente varios segmentos de ADN. Ventajas: información sobre varios locus en una sola reacción, menor cantidad de molde para el análisis, menor cantidad de reactivos, rápida construcción de bases de datos. Desventajas: para llevarla a cabo adecuadamente y sin errores, se requiere de una cuidadosa optimización del proceso.
PCR con transcriptasa inversa (RT-PCR)
Es una variante de la PCR en la que usamos ARN como molde inicial en vez de ADN, y emplea una transcriptasa inversa (como Tth) para realizar la síntesis de un ADN complementario al ARN (ADNc). De esta forma, el desarrollo inicial de una RT-PCR sería:
- 1.er paso: retrotranscripción a partir del ARN.
- 2º paso: amplificación a partir de la primera hebra de ADNc.
- 3.er paso: PCR estándar.
PCR en tiempo real o PCR cuantitativo (qPCR)
Reacción de PCR cuya principal característica es que permite cuantificar la cantidad de ADN o ARN presente en la muestra original, o para identificar con una muy alta probabilidad, muestras de ADN específicas a partir de su temperatura de fusión (también denominado valor Tm, del inglés melting temperature).
Se puede dividir en las técnicas basadas en fluorocromos no específicos y en las técnicas basadas en sondas específicas.
En las técnicas basadas en fluorocromos el ADN, que ve multiplicada su cantidad con cada ciclo, se une al fluorocromo (generalmente SYBR Green) produciendo fluorescencia que es medida por el termociclador apto para PCR en tiempo real. Permite cuantificar sólo una secuencia por reacción pero tiene la ventaja de utilizar cebadores normales para su realización. Es mucho más económica que la que usa sondas específicas.
Las técnicas basadas en sondas específicas utilizan una sonda unida a dos fluorocromos que hibrida en la zona intermedia entre el cebador directo (forward) y el inverso (reverse); cuando la sonda está intacta, presenta una transferencia energética de fluorescencia por resonancia (FRET). Dicha FRET no se produce cuando la sonda está dañada y los dos fluorocromos están distantes, producto de la actividad 5'-3' exonucleasa de la ADN polimerasa. Esto permite monitorizar el cambio del patrón de fluorescencia y deducir el nivel de amplificación del gen.
La mayoría de estos inconvenientes se han solucionado con la introducción de la PCR realizada en tiempo real (Q-PCR), que elimina cualquier proceso post-PCR puesto que monitoriza la progresión de la amplificación en el momento en que ocurre. A diferencia de la PCR convencional (en punto final), que mide la acumulación del ADN al final de un número predeterminado de ciclos, con Q-PCR esto se hace durante el proceso de amplificación usando fluorescencia, de forma que su aumento es proporcional a la cantidad de ADN formada. El proceso se puede automatizar fácilmente usando un sistema que realice la amplificación (termociclador) y que a su vez sea capaz de leer fluorescencia. Existe una amplia oferta de aparatos en el mercado. La mayoría pueden trabajar con las diversas opciones de marcado fluorescente y son "abiertos", es decir, permiten programar las condiciones de amplificación y lectura de forma que su uso no queda limitado a unos reactivos determinados.
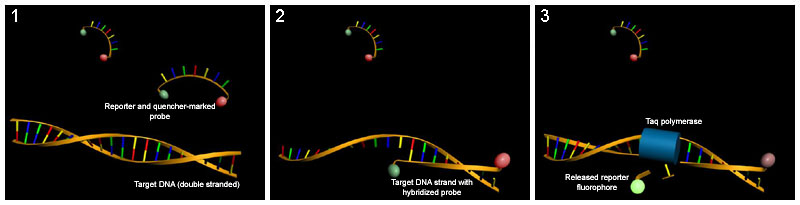
Variaciones de la PCR básica
- PCR específica de alelo: esta técnica de diagnóstico o clonación es usada para identificar o utilizar los polimorfismos de una sola base (SNPs).
- PCR "assembly": consiste en la síntesis artificial de largas secuencias de ADN, realizando para ello la PCR en un fondo de oligonucleótidos largos con secuencias solapantes cortas.
- PCR asimétrica: usada para amplificar preferentemente una cadena del ADN original con respecto a la otra.
- PCR de colonia: mediante esta técnica, colonias de bacterias Escherichia coli pueden ser rápidamente examinadas para construcciones viables de vectores de ADN.
- Amplificación dependiente de helicasa: esta técnica es muy parecida a la PCR convencional, pero en ella se emplea la enzima helicasa y una temperatura constante en lugar de la polimerasa de ADN y los ciclos repetidos de hibridación-elongación.
- PCR hot-start: esta técnica reduce la amplificación inespecífica durante las etapas iniciales de la PCR: mientras que la máquina alcanza la temperatura de la primera etapa (unos 95º) puede que ocurra la unión de los cebadores y se produzca amplificación, ya que en el camino para alcanzar estos 95º se pasa por la temperatura de anillamiento (que es más baja).
- Para evitar esto, la PCR hot-start se basa en que la reacción comience cuando la máquina ya esté a 95º, debido a que antes no se encuentran presentes la polimerasa o el cloruro de magnesio, lo que podemos conseguir mediante varias técnicas:
- - Añadir la polimerasa o el cloruro de magnesio tras el periodo de calentamiento
- - Separar por una capa de cera los distintos componentes de la reacción. La cera se funde al alcanzar los 95º y es entonces cuando los componentes entran en contacto
- - Anticuerpos anti-polimerasa que estén bloqueando a la polimerasa. Al alcanzar los 95º estos anticuerpos se inactivan debido a que se desnaturalizan y la polimerasa puede actuar
- PCR específica de intersecuencia (ISSR): se trata de un método de PCR para su uso en huella genética, que amplifica regiones entre repeticiones de secuencia simple para producir una huella genética única de longitudes de fragmento amplificadas.
- PCR inversa: es un método usado para poder realizar la PCR cuando sólo es conocida una secuencia interna. Muy útil en la identificación de secuencias que flanquean insertos genómicos.
- PCR mediada por ligación: este método usa pequeños linkers de ADN ligados al ADN de interés y múltiples cebadores hibridando estos linkers.
- PCR específica de metilación (MSP): se usa para detectar metilaciones en islas CpG de ADN genómico.
- Amplificación Múltiple Dependiente de Sonda (Multiplex Ligation-dependent Probe Amplification o MLPA): permite amplificar varias secuencias objetivo con un único par de cebadores, evitando así las limitaciones de resolución de la PCR multiplex.
- PCR cuantitativa: se usa para medir la cantidad de un producto de PCR. En la técnica clásica de PCR, se cuantifica por aproximación con diluciones y amplificación de concentraciones conocidas de la secuencia diana. También se puede cuantificar por método competitivo: se trabaja con concentraciones crecientes conocidas de un fragmento que puede ser amplificado por los mismos oligos que la muestra de estudio, pero de menor tamaño que ésta, de forma que con los resultados obtenidos se puede estimar qué concentración del competidor es equivalente a la de la muestra de cantidad desconocida. La cuantificación en PCR está optimizada en la técnica de PCR en tiempo real.
- PCR-TAIL: la PCR termal de entrelazado asimétrico es usada para aislar una secuencia desconocida que flanquea una secuencia conocida.
- PCR touchdown: se trata de una variante de la PCR que se emplea cuando se desconoce la secuencia exacta de los extremos de la secuencia a amplificar, de modo que se asume que puede existir alguna base desapareada en el alineamiento cebador-secuencia. Su finalidad es reducir el fondo no específico bajando gradualmente la temperatura de hibridación a lo largo del progreso de la PCR.
- PAN-AC: este método usa condiciones isotermas para la amplificación, y puede ser usado en células vivas.
- Ciclo térmico rápido para PCR:[3] La amplificación del DNA puede llevarse a cabo rápidamente, como completar 30 ciclos en menos de 30 minutos: ciclo térmico rápido. Normalmente se ha considerado que las etapas de cada ciclo son tres reacciones que ocurren en tres periodos separados y a tres temperaturas diferentes. Este paradigma del equilibrio secuencial no tiene en cuenta que la temperatura de la muestra no cambia instantáneamente, de hecho, durante una PCR la muestra está la mayoría del tiempo en temperaturas de transición. El ciclo térmico rápido aprovecha la ventaja de la instantánea desnaturalización e hibridación, cuyas temperaturas necesitan alcanzarse, pero no mantenerse. Además, para productos cortos, la extensión puede llevarse a cabo durante la transición a la temperatura de extensión, y por lo tanto, tampoco es necesario mantenerla. Un ciclo rápido podría entonces describirse como 94ºC, 0 seg; 55ºC, 0 seg y 72ºC, 0 seg. Como vemos, este modelo no ayuda, porque nos lleva solo a temperaturas extremas y no nos da información sobre lo que pasa entre ellas. En cambio, en el paradigma cinético para PCR de ciclo rápido se describe completamente el historial de temperaturas de la muestra. Se considera que desnaturalización, hibridación y elongación ocurren en un rango de temperaturas y además pueden solapar temporalmente. Hay termocicladores que permiten que un ciclo se complete en 20-60 segundos, por lo que 30 ciclos tardan de 10 a 30 minutos.
Aplicaciones
La técnica de la PCR tiene multitud de aplicaciones: ya en ciencia básica, como herramienta de detección y/o generación de acervos de fragmentos de ADN de interés; ya en ciencia aplicada, como elemento resolutivo en sí mismo, por ejemplo en diagnóstico clínico.
Investigación
La PCR convencional, se emplea como base para multitud de técnicas en el laboratorio debido a su robustez y rapidez. De este modo, la PCR de punto final permite controlar y detectar los fragmentos de ADN de interés.
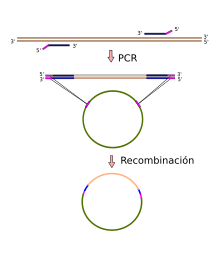
Una aplicación de la PCR de extrema importancia es la clonación de secuencias de ADN en vectores, como pueden ser los plásmidos. Para ello, se emplean cebadores que contienen en su extremo 5' una corta secuencia que permite la interacción posterior con otra complementaria situada en el vector de clonación a emplear. Por ejemplo, se puede incluir una diana de restricción en dichos cebadores, de modo que, y si ésta no existía previamente en el fragmento y es única en el vector, pueda efectuarse una ligación mediante la ligasa de T4 tras la digestión con la enzima de restricción apropiada de ambos elementos. Otro método asimilable a esta vía es el empleo de la recombinación dirigida; esto es, se adapta al 5' de los cebadores una secuencia que faculta a una recombinasa la recombinación dirigida con un vector dado.[4]
Medicina
En medicina, la PCR se emplea fundamentalmente como herramienta de diagnosis (Coleman y Tsongalis, 2006):
- Permite el genotipar la especie o especies que provocan un determinado cuadro infeccioso: para ello, se amplifica una zona del genoma bacteriano cuyo producto de PCR posea unas características de tamaño o temperatura de fusión que permitan identificarlo de forma inequívoca. En el caso de infecciones virales que implican la integración del genoma del patógeno en el ADN del hospedador, como es el de la infección por VIH, la PCR cuantitativa posibilita la determinación de la carga viral existente y por tanto, del estadio de la enfermedad.[5]
- La PCR también se puede usar en revisiones médicas rutinarias, como en los servicios de donantes de sangre, para test de rutina. A través de esta técnica se pueden detectar infecciones en el donante (como VIH o Hepatitis B) mientras aún están en el periodo de incubación. Dada la sensibilidad de los test de PCR se pueden tomar muestras colectivas o "pools" (por ejemplo, 96 pruebas individuales). Si una de estas muestras colectivas da positivo, se toman a partir de ella muestras progresivamente menores hasta que se encuentra el causante.
- El diagnóstico de enfermedades hereditarias presentes en el genoma es un proceso largo y complicado que puede acortarse significativamente gracias a la PCR. Cada uno de los genes prueba se pueden amplificar mediante sus correspondientes cebadores y posteriormente secuenciar para detectar la existencia de mutaciones.
Paleontología, antropología biológica, y ciencias forenses
Los campos de la paleontología, antropología biológica y la medicina y antropología forense se han visto enormemente beneficiados por esta técnica, puesto que todas ellas construyen con frecuencia el conocimiento de sus correspondientes disciplinas gracias a restos o huellas de seres vivos. Uno de los materiales biológicos que más información puede proporcionar es el ADN.
La relativa estabilidad de éste permite que, aunque fragmentado, se conserve durante largos períodos si las condiciones son propicias.[4] En ocasiones las muestras intactas con las que se puede contar son extraordinariamente pequeñas o están deterioradas. La PCR soluciona ambos problemas y proporciona cantidades útiles para posteriores pasos de análisis. En primer lugar aumenta la cantidad de material recuperado a partir de muestras escasas, puesto que como ya se dijo anteriormente, en teoría basta una sola molécula para que el proceso pueda tener lugar. También debido a la naturaleza de la técnica y su propósito de amplificación de fragmentos pequeños, esta fragmentación no impide que este ADN pueda ser empleado como molde para una reacción de PCR.
- En paleontología y Antropología la PCR permite recuperar las escasas cantidades de ADN que aún no se han degradado. Algunos lugares en que el ADN podría preservarse son la brea las cenizas volcánicas, el ámbar, hielos históricos polares o glaciares y ambientes áridos, sedimentos, así como en los cristales de apatita de restos de esqueleto,[6] siendo posible de ese modo caracterizar cadáveres, fósiles u otros restos mediante genotipado por análisis de microsatélites o incluso genomas de taxones extintos, amplificados de este modo, como pueden ser los realizados mediante el ADN genómico del hombre de Neanderthal.[7] El propósito sería utilizar este ADN amplificado para posteriormente realizar estudios filogenéticos o etnográficos o de poblaciones mediante la comparación de secuencias de ADN, o el estudio de las causas de la separación evolutiva de dos especies.
- En las ciencias forenses se emplea para establecer la filiación de una persona o para obtener pruebas a partir de muestras mínimas dejadas por el autor de un crimen como saliva, semen u otros restos de tejidos (Butler, 2005).
Agronomía y diversidad
Tal y como la PCR multiplex permite producir huellas genéticas de individuos concretos, dentro del marco de la genética forense, existen métodos basados en la PCR que permiten discernir entre grupos infraespecíficos de cultivos de interés agronómico; por ejemplo, de cultivares.[8] Para ello, se emplean oligonucleótidos de un tamaño lo suficientemente pequeño como para que ceben de forma relativamente inespecífica, aunque siempre de tal forma que produzcan un patrón de bandas discreto e interpretable. De este modo, la pauta obtenida tras la electroforesis de los fragmentos tiende a agrupar a los individuos de mayor semejanza, que poseen un comportamiento similar, de los que divergen...
Historia

En 1971, un artículo publicado por Kleppe et al. en Journal of Molecular Biology describió por primera vez un método que usaba enzimas para replicar una secuencia pequeña de ADN con cebadores in vitro.[9] Sin embargo, este temprano ejemplo del principio básico de la PCR no recibió mucha atención, y la invención de la reacción en cadena de la polimerasa en 1983 es generalmente atribuida a Kary Mullis.[10][11] Mullis ganó el Premio Nobel por su trabajo en PCR.
Algo muy a tener en cuenta en la PCR es que la ADN polimerasa que se use sea capaz de soportar las altas temperaturas de >90 °C necesarias para la separación de las dos hebras de ADN de la doble hélice tras cada ciclo de replicación. Las ADN polimerasas que se utilizaron originariamente para los experimentos in vitro previos a la PCR no eran capaces de soportar estas altas temperaturas, por lo que los primeros procedimientos para replicar el ADN eran muy ineficientes, largos y requerían grandes cantidades de ADN polimerasa.
El descubrimiento en 1976 de la polimerasa Taq, una polimerasa de ADN extraída de la bacteria termófila Thermus aquaticus que habita medios de muy alta temperatura (50-80 °C), eliminó los grandes inconvenientes del método de la PCR. Este ADN polimerasa es estable a altas temperaturas, permaneciendo activa hasta después de la desnaturalización del ADN, eliminando la necesidad de añadir a la reacción nueva polimerasa tras cada ciclo. Este descubrimiento permitió automatizar el proceso, antes tan tedioso, acoplándolo al uso del termociclador.
Al mismo tiempo que desarrollaba la PCR en 1983, Mullis trabajaba en Emeryville, California (EE UU), para una de las primeras empresas biotecnológicas, Cetus Corporation, donde era responsable de sintetizar cadenas cortas de ADN. Mullis afirma que concibió la idea para la PCR una noche mientras cruzaba la Autopista de la Costa Pacífica (EE UU) en su coche.[10] Estaba imaginando una nueva forma de analizar mutaciones en el ADN cuando se percató de que, en lugar de eso, había inventado un método para amplificar regiones específicas de ADN mediante ciclos de duplicación repetidos usando ADN polimerasas. Mullis atribuye la invención de esta técnica a los efectos de la droga psicodélica y alucinógena LSD.[12]
En la revista Scientific American, Mullis resumió el procedimiento: "Comenzando con una única molécula del material genético ADN, la PCR puede generar 100 billones de moléculas iguales en una tarde. La reacción es fácil de hacer, no requiere más que un tubo de pruebas, unos pocos reactivos simples y una fuente de calor."[13] Fue premiado con el Premio Nobel de Química en 1993 por su invención, y siete años después, él y sus colegas del Cetus llevaron a la práctica su propuesta. Sin embargo, han aparecido controversias y diferentes versiones sobre las contribuciones intelectuales y prácticas de otros científicos al trabajo de Mullis, y sobre si él fue el inventor único del principio de la PCR.
Guerras de patentes
La técnica de la PCR fue patentada por Cetus Corporation, donde Mullis trabajaba cuando inventó la técnica en 1983. La enzima polimerasa Taq fue también cubierta de patentes. Tuvieron lugar varios pleitos relacionados con la técnica, incluyendo un pleito fracasado generado por DuPont. La compañía farmacéutica Hoffmann-La Roche adquirió los derechos de las patentes en 1992 y actualmente mantiene las que aún están protegidas.[14][15]
Véase también
- NASBA (Nucleic acid sequence based amplification o amplificación isotérmica de ácidos nucleicos)
Referencias
- ↑ Bartlett & Stirling (2003)—A Short History of the Polymerase Chain Reaction. In: Methods Mol Biol. 226:3-6
- ↑ Joseph Sambrook and David W. Russel (2001). Molecular Cloning: A Laboratory Manual (3rd ed. edición). Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory Press. ISBN 0-87969-576-5.
- ↑ PCR Applications. Protocols for functional genomics. Capítulo 14. Edited by Michael A. Innis, David H. Gelfand, John J. Sninsky. ISBN: 0-12-372186-5, Academic Press 1999
- ↑ a b Watson, J, D.; Baker, T. A.; Bell, S. P.; Gann, A.; Levine, M. et Losick, R (2004). Molecular Biology of the Gene (Fifth edition edición). San Francisco: Benjamin Cummings. ISBN 0-321-22368-3.
- ↑ Scott L. Butler, Mark S.T. Hansen & Frederic D. Bushman (2007). «A quantitative assay for HIV DNA integration in vivo». Nature Medicine (7): 631-634. doi:10.1038/87979.
- ↑ Museo Victora de Melbourne sobre la preservación del ADN
- ↑ James P. Noonan,Graham Coop, Sridhar Kudaravalli, Doug Smith, Johannes Krause, Joe Alessi, Feng Chen, Darren Platt, Svante Pääbo, Jonathan K. Pritchard, Edward M. Rubin (17 de noviembre de 2006). «Sequencing and Analysis of Neanderthal Genomic DNA». Nature Medicine 314 (5802): 1113 - 1118. DOI: 10.1126/science.1131412.
- ↑ Jinguo Hu1 and Carlos F. Quiros (1991). «Identification of broccoli and cauliflower cultivars with RAPD markers». Plant Cell Reports 10 (10). DOI: 10.1007/BF00234583.
- ↑ Kleppe K, Ohtsuka E, Kleppe R, Molineux I, Khorana HG (1971). «Studies on polynucleotides. XCVI. Repair replications of short synthetic DNA's as catalyzed by DNA polymerases». J. Mol. Biol. 56: 341-361.
- ↑ a b Mullis, Kary (1998). Dancing Naked in the Mind Field. New York: Pantheon Books. ISBN 0-679-44255-3.
- ↑ Rabinow, Paul (1996). Making PCR: A Story of Biotechnology. Chicago: University of Chicago Press. ISBN 0-226-70146-8.
- ↑ Mullis, Kary (1998). Dancing Naked in the Mind Field. New York: Pantheon Books. p. 18. ISBN 0-679-44255-3.
|autor=y|apellidos=redundantes (ayuda) - ↑ Mullis, Kary (1990). «The unusual origin of the polymerase chain reaction». Scientific American 262 (4): 56-61, 64-5.
- ↑ PR Newswire
- ↑ Consejos sobre cómo sobrevivir a la guerra de las patentes de Taq: GEN Genetic Engineering News Biobusiness Channel: Artículos. 1 de mayo de 2006 (Vol. 26, No. 9).
Bibliografía
- Saiki RK, Gelfand DH, Stoffel S, Scharf SJ, Higuchi R, Horn GT, Mullis KB, et al.(1988) Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase. Science 239: 487–491
- Griffiths, J.F. A. et al. (2002). Genética. McGraw-Hill Interamericana. ISBN 84-486-0368-0.
- Coleman, WB y Tsongalis, GJ (2006). Molecular Diagnostics: For the Clinical Laboratorian. Humana Press. ISBN 1-58829-356-4.pgs. 47-56 y 65-74
- Butler, JM (2005). Forensic DNA Typing: Biology, Technology, and Genetics of STR. Academic Press pgs 63-84. ISBN 0-12-147952-8.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Reacción en cadena de la polimerasa.
Wikimedia Commons alberga una galería multimedia sobre Reacción en cadena de la polimerasa.- Animación PCR
- Artículos sobre PCR
- Nueva técnica más eficiente en PCR
- Please find all details about real-time PCR here: http://www.gene-quantification.info - The reference in real-time PCR
- Simulation online de reacciones de PCR frente a procariotas secuenciados.
- Ejercicio online en el que se diseñan y simulan experimentos de PCR y PCR-RFLP.
