Lomitapida
| Lomitapida | ||
|---|---|---|
 | ||
| General | ||
| Otros nombres | AEGR-773, BMS-201038 | |
| Fórmula estructural |
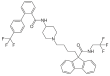 | |
| Fórmula molecular | C39H37N3F6O2 | |
| Identificadores | ||
| Número CAS | 182431-12-5[1] | |
| ChEBI | 72297 | |
| ChEMBL | CHEMBL354541 | |
| ChemSpider | 8028764 | |
| PubChem | 9853053 | |
| UNII | 82KUB0583F | |
| KEGG | D09637 | |
|
FC(F)(F)c5ccc(cc5)-c1ccccc1C(=O)NC4CCN(CC4)CCCCC2(C(=O)NCC(F)(F)F)c3ccccc3-c6ccccc26
| ||
| Propiedades físicas | ||
| Masa molar | 693,279 g/mol | |
La Lomitapida (INN, comercializado como Juxtapid en los EE. UU, y como Lojuxta en la UE) es un fármaco utilizado como agente hipolipemiante para el tratamiento de la hipercolesterolemia familiar, desarrollado por Aegerion Pharmaceuticals. [2] Se ha probado en ensayos clínicos como tratamiento único y en combinaciones con atorvastatina, ezetimiba y fenofibrato. [3][4]
La Administración de Alimentos y Medicamentos de los EE. UU. (FDA) aprobó la lomitapida el 21 de diciembre de 2012, como medicamento huérfano para reducir el colesterol LDL, colesterol total, apolipoproteína B y colesterol de lipoproteínas de baja densidad (no HDL) en pacientes con hipercolesterolemia familiar homocigótica (HoFH). [5]
El 31 de mayo de 2013, el Comité Europeo de Medicamentos de Uso Humano (CHMP) adoptó una opinión positiva con voto unánime en la que recomendaba una autorización de comercialización de lomitapida. [6] El 31 de julio de 2013, la Comisión Europea aprobó la lomitapida como complemento de una dieta baja en grasas y otros medicamentos hipolipemiantes con aféresis de lipoproteínas de baja densidad (LDL) o sin ella en pacientes adultos con HoFH.
Mecanismo de acción
Lomitapida inhibe la proteína de transferencia de triglicéridos microsomal (MTP o MTTP) que es necesaria para el ensamblaje y la secreción de lipoproteínas de muy baja densidad (VLDL) en el hígado. [2][7]
El 24 de diciembre de 2012, el fabricante de medicamentos Aegerion anunció que habían sido aprobados por la FDA como "un complemento de una dieta baja en grasas y otros tratamientos hipolipemiantes en pacientes con hipercolesterolemia familiar homocigótica (HoFH)". [8][9]
Efectos secundarios
En un estudio de fase III, la lomitapida produjo niveles elevados de aminotransferasas y acumulación de grasa en el hígado. [7]
Referencias
- ↑ Número CAS
- ↑ a b H. Spreitzer (12 March 2007). «Neue Wirkstoffe – BMS-201038». Österreichische Apothekerzeitung (en alemán) (6/2007): 268.
- ↑ Samaha, Frederick F; James McKenney; LeAnne T Bloedon; William J Sasiela; Daniel J Rader (2008). «Impact of the MTP-Inhibitor, AEGR-733, as Monotherapy and in Combination with Ezetimibe on Lipid Subfractions as Measured by NMR Spectroscopy». Circulation 118 (5): 469-71. PMID 18663098. doi:10.1161/CIRCULATIONAHA.108.792689.
- ↑ Aegerion Pharmaceuticals, Inc. Announces AEGR-733 Phase II Data Demonstrates Significant Lowering of LDL Cholesterol with Promising Hepatic Safety Profile (enlace roto disponible en este archivo).
- ↑ "FDA approves new orphan drug for rare cholesterol disorder"
- ↑ European Medicines Agency: Lojuxta
- ↑ a b Cuchel, M.; Bloedon, L. T.; Szapary, P. O.; Kolansky, D. M.; Wolfe, M. L.; Sarkis, A.; Millar, J. S.; Ikewaki, K.; Siegelman, E. S.; Gregg, R. E.; Rader, D. J. (2007). «Inhibition of Microsomal Triglyceride Transfer Protein in Familial Hypercholesterolemia». New England Revista of Medicine 356 (2): 148-156. PMID 17215532. doi:10.1056/NEJMoa061189.
- ↑ «FDA Approves Juxtapid for Homozygous Familial Hypercholesteolemia». 26 December 2012.
- ↑ Plantilla:Cita prensa
