Telomerasa

La telomerasa es una enzima formada por un complejo proteína-ácido ribonucleico con actividad polimerasa que está presente en células de la línea germinal, en tejidos fetales y en ciertas células madre poco diferenciadas, que replica el ADN en los extremos de los cromosomas eucarióticos y permite el alargamiento de los telómeros. También se encuentra presente en organismos eucariotas unicelulares. La telomerasa es reprimida en las células somáticas maduras después del nacimiento, produciéndose un acortamiento del telómero después de cada división celular.
Descubrimiento de las pajas

Fue descubierta por Elizabeth Blackburn y Carol Greider en 1985 estudiando el protozoo Tetrahymena. La telomerasa de dicho protozoo presenta un ARN de una longitud de 159 nucleótidos en los que encontramos la secuencia 3'-AACCCCAAC-5', que es complementaria a la secuencia telomérica de Tetrahymena que es: 5'-TTGGGG-3'. Por lo tanto, dicha secuencia de ARN le sirve a la enzima de molde para la síntesis del ADN del telómero haciendo copias de la secuencia TTGGGG (TTAGGG en telómeros humanos).[1]
Composición y estructura
La telomerasa es una enzima que se encarga de la adición de desoxirribonucleótidos a los extremos de los telómeros, pero dicha adición está dirigida por una secuencia de ribonucleótidos o ARN, por lo que podemos decir que se trata de una transcriptasa inversa de características especiales. Hablamos de una ribonucleoproteína que siempre sintetiza la misma secuencia de ADN.
La telomerasa está formada por dos componentes:
- Componente ribonucleotídico: se trata de la porción de ARN de la telomerasa (también llamado TR o TER, de telomerase RNA) que se encuentra totalmente integrado en la enzima. Según las especies, éste puede tener entre 146 y 1 544 nucleótidos de longitud. La secuencia molde del telómero suele tener una longitud de entre 9 y 28 nucleótidos y es característica de cada especie (véase telómero).
- Componente proteico: es la parte de la enzima que contiene la capacidad transcriptasa inversa (TRT o TERT de telomerase reverse transcriptase); invierte el curso normal de la información (ADN hacia ARN), trascribiendo el ARN a ADN. Dicha transcripción inversa en los telómeros es la actividad telomerasa propiamente dicha. La transcriptasa inversa de virus y el resto de ADN polimerasas necesitan un cebador para sintetizar ADN, sin embargo, la telomerasa no necesita dicho cebador.
Problema al final de la replicación

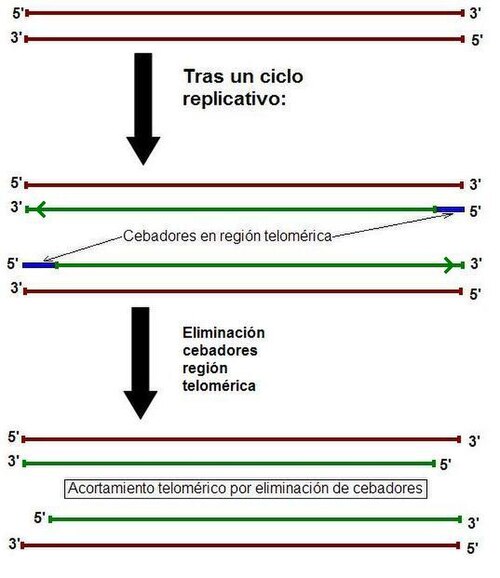
A diferencia de los organismos procariotas que tienen un genoma circular, los organismos eucariotas poseen cromosomas lineales en los cuales se presenta el problema de su acortamiento durante la replicación. Este acortamiento es debido a que al eliminar el cebador de los fragmentos de Okazaki del extremo 5' de la cadena retardada (en el telómero del nuevo cromosoma) se produce un hueco que no puede ser rellenado por acción de la ADN polimerasa.
La enzima ADN polimerasa sólo añade nucleótidos en dirección 5' - 3' y necesita un extremo 3'–OH libre que no existe tras la eliminación del cebador por lo que no puede completar la síntesis del último fragmento de Okazaki.
De esta manera, en las células somáticas ya maduras se acortan los telómeros a razón de 15 a 25 nucleótidos en cada proceso replicativo, el número de nucleótidos correspondientes a un cebador.
Modo de acción de la telomerasa
La cadena de ADN que sirvió de molde para la replicación (ya que la replicación es semiconservadora y, por lo tanto, cada célula hija hereda una cadena antigua y otra de nueva síntesis) no está apareada con la cadena de nueva síntesis debido a la eliminación del cebador antes citada. El trozo de molécula de ADN telomérico no apareado presenta repeticiones en tándem (en humanos hay centenares de repeticiones de la secuencia TTAGGG) que siempre son ricas en guanina ya que su apareamiento con el nucleótido citosina se realiza mediante tres enlaces de hidrógeno en lugar de dos como en el caso de adenina con timina, lo que le confiere mayor estabilidad al telómero.
Para rellenar el hueco correspondiente al cebador la telomerasa reconoce dichas secuencias en tándem y realiza una extensión del telómero en dirección 5' - 3', utilizando como molde para la síntesis de ADN, su propia molécula de ARN sin necesidad de cebador alguno.
La enzima hibrida su molde de ARN con el ADN del telómero y añade las bases una a una hasta completar la secuencia de ADN complementaria a su ARN. Tras esto, se desplaza más adelante y repite este mecanismo, construyendo de este modo el telómero de forma discontinua.
De esta manera, tras sucesivos ciclos de extensión la enzima va a producir un extremo 3' libre más largo que el existente al final de la replicación, extremo que deja espacio para que se una un cebador y se inicie la síntesis de la cadena retardada en la otra cadena por acción de las ADN polimerasas dando lugar a un telómero bicatenario.
Tras esto se produce el ligamiento del nuevo fragmento por una ligasa y se elimina el último ARN cebador, pero sin consecuencias ya que se ha conseguido mantener e incluso aumentar la longitud del telómero.
La telomerasa y la senescencia celular
La senescencia celular es el proceso por el que una célula pierde con el tiempo o con sucesivas divisiones la capacidad de reproducirse. Hace más de 30 años, Hayflick observó la senescencia replicativa en fibroblastos mantenidos en placas de cultivo. Publicó que éstos dejan de dividirse tras unas 50 divisiones, manteniéndose metabólicamente activos pero sin proliferar, hasta morir con el paso del tiempo. Esto puede deberse al acortamiento de las regiones teloméricas.
Los telómeros, debido a su forma especial de empaquetamiento, están implicados en el mantenimiento de la integridad del ADN funcional de los cromosomas, protegiéndolo del ataque de exonucleasas que producirían la pérdida de nucleótidos de los extremos de la molécula de ADN. Además impiden que se produzcan fusiones espontáneas entre los extremos de los cromosomas.
Las células somáticas diferenciadas no presentan actividad telomerasa, por lo que los telómeros de sus cromosomas se van acortando tras cada proceso de división. Debido a que los telómeros son repeticiones no codificantes, este acortamiento no produce inicialmente daños en la secuencia codificante, pero llegará un punto en que se acaben las repeticiones teloméricas y se pierdan regiones codificantes. Este hecho nos puede hacer pensar que los telómeros están implicados en que las células diferenciadas tengan un número limitado de divisiones celulares tras las cuales se produce su muerte por senescencia; es decir, que el acortamiento de los telómeros está relacionado con la senescencia replicativa de las células somáticas diferenciadas carentes de actividad telomerasa. Esto nos indica que el acortamiento telomérico funciona como un reloj que lleva a cabo la cuenta de las divisiones celulares que le quedan a una determinada célula.
La necesidad de que los telómeros mantengan su integridad para que las células puedan completar sus ciclos celulares se ha puesto de manifiesto mediante la utilización de YAC o cromosomas artificiales de levadura. Se ha demostrado que los YAC se mantienen en buenas condiciones cuando se insertan en células de levaduras, puesto que contienen telomerasa (ya que en organismos eucariotas unicelulares la presencia y actividad de la telomerasa es crucial para garantizar la supervivencia y evitar la pérdida de material genético), pero, sin embargo, si se cultivan en medios sin telomerasa, los telómeros desaparecen con el tiempo.
Especialistas del Centro Nacional de Investigaciones Oncológicas (CNIO) han desarrollado un tratamiento que actúa sobre los genes de tal modo que, aplicado una sola vez en animales adultos, consigue de manera segura alargar la vida media de los individuos. Este tipo de investigaciones obligaba a modificar permanentemente los genes de los animales desde la fase embrionaria. Sin embargo, la terapia génica desarrollada por el CNIO para combatir el envejecimiento se ha probado en ratones adultos de uno y dos años, con un efecto rejuvenecedor sobre ellos. El procedimiento consiste en tratar de modificar la carga genética de un virus cuyo ADN ha sido modificado; sus genes se sustituyen por uno de los genes más importantes para el envejecimiento de las especies tratadas: el que codifica la enzima telomerasa. El virus con el ADN tratado e inoculado en el animal actúa como un vehículo que deposita el gen de la telomerasa en las células.[2]
Pruebas que relacionan la telomerasa y la senescencia
Recientes estudios con esta enzima han demostrado que la introducción de telomerasa en células somáticas produce la regeneración de los telómeros. Es decir, anula el proceso de envejecimiento y muerte celular. En 1998, Bodnar y col. introdujeron en dos tipos de células humanas normales (sin actividad telomerasa) el gen que codifica la telomerasa. En contraste con las células normales que mostraban senescencia y un acortamiento de los telómeros, los clones que expresaban la TERT mostraron telómeros elongados, se dividían vigorosamente y mostraron una reducción de la beta–galactosidasa, un biomarcador de la senescencia. Las células transformadas para expresar la TERT mostraron un cariotipo normal y su longevidad ha superado la normal en más de 20 divisiones.
Se ha demostrado que el acortamiento telomérico aumenta proporcionalmente con el número de divisiones o con la edad del organismo eucariótico. Además los enfermos con síndromes de envejecimiento prematuro presentan una acelerada pérdida de telomerasa.
Además de las anteriores, podemos concluir, a modo de resumen, una serie de pruebas generales que demuestran que el acortamiento de los telómeros está implicado en el envejecimiento y senescencia:
- Los telómeros se alargan durante el desarrollo temprano. En las células del embrión, los telómeros pueden llegar a ser más largos que los del cigoto debido a que la telomerasa está activa.
- La línea germinal presenta la telomerasa activa. Los gametos formarían un cigoto con una suficiente longitud telomérica para poder llevar a cabo su proliferación.
- Las células madre presenta telomerasa activa. Debido a la necesidad de autoperpetuación de las células madre, necesitan ser capaces de mantener los telómeros con una longitud adecuada para que no se produzcan daños en el ADN.
- El acortamiento telomérico de las células somáticas está relacionado linealmente con su capacidad proliferativa. Los telómeros de las células diferenciadas serán más cortos en células que se hayan dividido más veces que los de células más jóvenes. Además, las células de organismos de edad más avanzada se dividen menos veces que las células de organismos de menor edad.
- Las células que han sufrido una transformación suelen presentar actividad telomerasa. Nos referimos a células transformadas en laboratorio para mantenerse indefinidamente en cultivo, y a las células cancerosas que también se autoperpetúan.
Esto podría conducir a tratamientos con telomerasa que evitarían por completo la muerte, tanto celular como del individuo, es decir, sería el fármaco que otorgaría la inmortalidad, salvo por un contratiempo: al administrar telomerasa a seres pluricelulares complejos como los humanos o animales, la célula empieza a dividirse indefinidamente, es decir, crea un tumor maligno que se divide a gran velocidad y, teniendo en cuenta que evita el envejecimiento pero no los demás males, provocaría la muerte por cáncer.
Telomerasa y cáncer
Estudios recientes sugieren que podríamos revertir el proceso de senescencia incrementando de forma artificial la cantidad de telomerasa en nuestras células. Incluso se podrían revertir algunas atrofias de nuestros tejidos debidas a la vejez, induciendo la síntesis de telomerasa. Sin embargo hay que considerar una consecuencia indirecta de alterar los genes de la inmortalidad celular: el cáncer, ya que las células cancerosas, a diferencia de las células somáticas normales, no tienen senescencia tras un número definido de divisiones.
Algunos estudios demuestran que cuando se estimula la actividad telomerasa y se inactiva un gen supresor de tumores (el gen p16INK4a) se produce inmortalización celular, lo cual constituye un importante paso hacia la formación de un tumor.
Muchas células cancerosas derivan de células somáticas, y se ha comprobado la presencia de telomerasa en el 75-80% de las líneas tumorales. Esto no quiere decir que la telomerasa induzca el cáncer. Es más, Kathleen Collins de la Universidad de Berkeley en California encontró que enfermos con una enfermedad congénita muy poco frecuente, la disqueratosis congénita, tenían niveles de telomerasa anormalmente bajos, muriendo no obstante en muchos casos de cáncer gastrointestinal. A pesar de esta incongruencia, se sabe que la agresividad de las células tumorales está relacionada con sus niveles de telomerasa y que los niveles altos de esta enzima son indicativos de la malignidad del tumor.
Recientemente la FDA ha autorizado dos estudios clínicos con telomerasa, uno de ellos encaminado a obtener un mejor diagnóstico del cáncer cervical y el otro para evaluar un fármaco contra la leucemia mieloide. En Japón se está utilizando en niños con neuroblastoma 4S. Al parecer estos niños tienen un cáncer metastásico, pero los tumores no tienen telomerasa y aproximadamente el 80% llegan a una remisión espontánea una vez que el tumor se ha eliminado quirúrgicamente. El estudio identifica los que son positivos para telomerasa, de manera que se los puedan tratar de una manera más agresiva, de hecho, en la actualidad, una importante línea de investigación frente al cáncer se basa en la telomerasa como diana frente al cáncer. Geron Corporation está desarrollando estos medicamentos anti–telomerasa contra el cáncer, dando buenos resultados en células cancerosas en cultivo. Las células tratadas reducen sus telómeros y mueren tras aproximadamente 25 divisiones.
Las células tumorales inmortales pueden ser útiles para inmortalizar células somáticas mediante hibridación celular somática. Esto se consigue mediante la fusión de los citoplasmas de una célula tumoral y una célula somática en cultivo. Esta técnica se emplea para diferentes fines como puede ser el determinar la ubicación cromosómica de un gen, o para la obtención de algún producto específico como un anticuerpo frente a un determinante antigénico.
Véase también
Referencias
- ↑ Carol W. Greider, Elizabeth H. Blackburn (1985) Identification of a specific telomere terminal transferase activity in tetrahymena extracts. Cell 43: 405-413. doi:10.1016/0092-8674(85)90170-9
- ↑ Bruno Bernardes de Jesus, Elsa Vera, Kerstin Schneeberger, Agueda M. Tejera, Eduard Ayuso, Fatima Bosch, Maria A. Blasco (2012) Telomerase gene therapy in adult and old mice delays aging and increases longevity without increasing cancer. EMBO Molecular Medicine 4: 691–704. doi:10.1002/emmm.201200245
Bibliografía
- José Luque y Ángel Herráez (2001). Texto ilustrado de biología molecular e ingeniería genética. Ediciones Harcourt, S.A. (Elsevier)
- Cooper's (2006). La célula (Tercera edición). Marbán libros, S.L.
- William H. Elliot, Daphne C. Elliot (2002). Bioquímica y biología molecular (Primera edición). Editorial Ariel Ciencia, S.A.
- Christopher K. Mathews (2005). Bioquímica (Tercera edición). Editorial Addison Wesley.
- William S. Klug (2008). Conceptos de genética (Octava edición). Editorial Pearson Prentice Hall.
- Benjamin A. Pierce (2009). Genética. Un enfoque conceptual (Segunda edición). Editorial Médica Panamericana.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Telomerasa.
Wikimedia Commons alberga una categoría multimedia sobre Telomerasa. Wikcionario tiene definiciones y otra información sobre telomerasa.
Wikcionario tiene definiciones y otra información sobre telomerasa.- La telomerasa es importante en el cáncer y el envejecimiento, El País, 24/11/2004