Carbonato de calcio
| Carbonato de calcio | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Trioxocarbonato (IV) de calcio | ||
| General | ||
| Otros nombres | Carbonato cálcico | |
| Fórmula estructural |
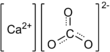 | |
| Fórmula molecular | ||
| Identificadores | ||
| Número CAS | 471-34-1[1] | |
| ChEBI | 3311 | |
| ChEMBL | CHEMBL1200539 | |
| ChemSpider | 9708 | |
| DrugBank | DB06724 | |
| PubChem | 516889 10112, 516889 | |
| UNII | H0G9379FGK | |
| KEGG | D00932 C08129, D00932 | |
| Propiedades físicas | ||
| Apariencia | Polvo blanco inodoro | |
| Densidad | 2711 kg/m³; 2,711 g/cm³ | |
| Masa molar | 100,0869 g/mol | |
| Punto de fusión | 1172 K (899 °C) | |
| Punto de ebullición | 1612 K (1339 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 0.0013 g/100 mL (25 °C) | |
| Termoquímica | ||
| ΔfH0líquido | -1154 kJ/mol | |
| ΔfH0sólido | -1207 kJ/mol | |
| S0sólido | 93 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
0
1
0
| |
| Riesgos | ||
| Ingestión |
En cantidad excesiva puede causar irritación gástrica leve e inflamación en la garganta. Su ingestión crónica puede causar hipercalcemia, alcalosis y daño renal. | |
| Inhalación | En grado excesivo puede causar irritación respiratoria leve. | |
| Piel | Leve riesgo, puede causar irritación. | |
| Ojos | Leve riesgo, puede causar irritación. | |
| LD50 | 6450 mg/kg (oral, rata) | |
| Más información | Hazardous Chemical Database | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El carbonato de calcio es un compuesto químico cuya fórmula es CaCO3. Se trata de un compuesto ternario, que entra en la categoría de las oxosales. Es una sustancia muy abundante en la naturaleza, formando rocas, como componente principal, en todas partes del mundo y es el principal componente de conchas y esqueletos de muchos organismos (p. ej. moluscos, corales) o de las cáscaras de huevo. Es la causa principal del agua dura. En medicina se utiliza habitualmente como suplemento de calcio, como antiácido y agente adsorbente. Es fundamental en la producción de vidrio y cemento, entre otros productos.[2] Al igual que el bicarbonato de sodio, en presencia de algún ácido desprende dióxido de carbono por efervescencia.
Minerales y rocas
Es el componente principal de minerales como la calcita o el aragonito y de rocas carbonáticas como la caliza y sus variedades (travertino, creta, carniola) o el mármol, procedente del metamorfismo de calizas. También forma parte principal de la composición de estructuras sedimentarias de origen orgánico como tobas calcáreas, espeleotemas, estromatolitos, oncolitos, etc.
Presencia en los organismos vivos
El carbonato cálcico es componente principal de muchas estructuras presentes en organismos vivos, como el talo de algunas algas, por ejemplo Padina pavonica, las esponjas de la clase Calcárea, conchas de moluscos, esqueletos de corales o las cáscaras de huevo de reptiles y aves.
Usos
Construcción
El principal uso del carbonato de calcio es en la industria de la construcción, ya sea como material de construcción, o como agregado para la construcción de carreteras, como ingrediente del cemento, o como material de partida para la preparación de cal para constructores mediante su combustión en un horno. Sin embargo, debido a la meteorización causada principalmente por la lluvia ácida,[3] el carbonato de calcio (en forma de piedra caliza) ya no se utiliza para fines de construcción por sí mismo, sino sólo como materia prima para materiales de construcción.
El carbonato de calcio también se utiliza en la purificación del hierro a partir del mineral de hierro en un alto horno. El carbonato se calcina in situ para dar óxido de calcio, que forma una escoria con varias impurezas presentes, y se separa del hierro purificado.[4]
En la industria petrolera, el carbonato de calcio se añade a los fluidos de perforación como agente de puenteo de la formación y de sellado de la torta de filtración; también es un material de ponderación que aumenta la densidad de los fluidos de perforación para controlar la presión de fondo de pozo. El carbonato de calcio se añade a las piscinas, como corrector del pH para mantener la alcalinidad y compensar las propiedades ácidas del agente desinfectante.[5]
También se utiliza como materia prima en la refinación del azúcar a partir de la remolacha azucarera; se calcina en un horno con antracita para producir óxido de calcio y dióxido de carbono. Esta cal quemada se apaga en agua dulce para producir un hidróxido de calcio suspensión para la precipitación de las impurezas del jugo crudo durante la carbonatación.[6]
El carbonato de calcio en forma de tiza ha sido tradicionalmente un componente principal de la tiza de pizarra. Sin embargo, la tiza manufacturada moderna es mayoritariamente yeso, sulfato de calcio hidratado CaSO
4·2H2O. El carbonato de calcio es una fuente principal para el cultivo de biorock. El carbonato cálcico precipitado (PCC), predispuesto en forma de lodo, es un material de relleno habitual para guantes de látex con el objetivo de conseguir el máximo ahorro de material y de costes de producción.[7]
El carbonato de calcio finamente molido (GCC) es un ingrediente esencial en la película microporosa utilizada en pañales y en algunas películas para la construcción, ya que los poros se nuclean alrededor de las partículas de carbonato de calcio durante la fabricación de la película por estiramiento biaxial. El GCC y el PCC se utilizan como relleno en el papel porque son más baratos que la fibra de madera. En términos de volumen de mercado, los CCG son los tipos de relleno más importantes que se utilizan actualmente.[8] El papel de impresión y escritura puede contener entre un 10 y un 20% de carbonato de calcio. En Norteamérica, el carbonato de calcio ha empezado a sustituir a la caolín en la producción de papel brillante. En Europa se practica desde hace algunas décadas la fabricación de papel alcalino o sin ácido. El PCC utilizado para el relleno de papel y los revestimientos de papel se precipita y se prepara en una variedad de formas y tamaños que tienen distribuciones granulométricas estrechas características y diámetros esféricos equivalentes de 0,4 a 3 micrómetros.
El carbonato de calcio se utiliza ampliamente como extensor en pinturas,[9] en particular pintura mate de emulsión donde normalmente el 30% en peso de la pintura es tiza o mármol. También es un relleno popular en los plásticos.[9] Algunos ejemplos típicos incluyen alrededor del 15 al 20% de carga de tiza en cloruro de polivinilo no plastificado (uPVC) tubos de desagüe, del 5% al 15% de carga de tiza o mármol recubierto de ácido esteárico|estearato]] en el perfil de ventanas de uPVC. Los cables de PVC pueden utilizar carbonato de calcio en cargas de hasta 70 phr (partes por cada cien partes de resina) para mejorar las propiedades mecánicas (resistencia a la tracción y alargamiento) y eléctricas (resistividad volumétrica). Los compuestos de polipropileno se rellenan a menudo con carbonato de calcio para aumentar la rigidez, un requisito que adquiere importancia a altas temperaturas de uso.[10] Aquí el porcentaje suele ser del 20-40%. También se utiliza de forma rutinaria como relleno en resinas termoestables (compuestos de moldeo en lámina y a granel)[10] y también se ha mezclado con ABS, y otros ingredientes, para formar algunos tipos de fichas de póker moldeadas por compresión.[11] El carbonato de calcio precipitado, elaborado mediante la caída de óxido de calcio en el agua, se utiliza por sí mismo o con aditivos como pintura blanca, conocida como encalado.[12][13]
El carbonato de calcio se añade a una amplia gama de adhesivos comerciales y hágalo usted mismo, selladores y rellenos de decoración.[9] Los adhesivos para baldosas cerámicas suelen contener entre un 70% y un 80% de piedra caliza. Los rellenos de grietas para decoración contienen niveles similares de mármol o dolomita. También se mezcla con la masilla en la colocación de vidrieras, y como resistencia para evitar que el vidrio se pegue a los estantes del horno cuando se cuecen esmaltes y pinturas a alta temperatura.[14][15][16][17]
En las aplicaciones de esmalte cerámico, el carbonato de calcio se conoce como pescadilla,[9] y es un ingrediente común para muchos esmaltes en su forma de polvo blanco. Cuando un esmalte que contiene este material se cuece en un horno, la pescadilla actúa como material de flujo en el esmalte. El carbonato de calcio molido es un abrasivo (tanto como polvo para fregar como ingrediente de las cremas limpiadoras domésticas), en particular en su forma de calcita, que tiene el nivel de dureza relativamente bajo de 3 en la Escala de Mohs, por lo que no raya el vidrio y la mayoría de las cerámicas, el esmalte, el bronce, el hierro y el acero, y tiene un efecto moderado sobre los metales más blandos como el aluminio y el cobre. Se puede utilizar una pasta hecha de carbonato de calcio y agua desionizada para limpiar el empañamiento de la plata.[18]
Salud y dieta

El carbonato de calcio se utiliza ampliamente en medicina como un suplemento dietético de calcio barato para antiácido gástrico[19] (como Tums y Eno). Puede utilizarse como aglutinante de fosfatos para el tratamiento de la hiperfosfatemia (principalmente en pacientes con insuficiencia renal crónica). Se utiliza en la industria farmacéutica como relleno inerte para tabletas y otros productos farmacéuticos.[20]
El carbonato de calcio se utiliza en la producción de óxido de calcio, así como en la pasta de dientes, y ha visto un resurgimiento como conservante de alimentos y retenedor de color, cuando se utiliza en o con productos como las manzanas orgánicas.[21]
El carbonato de calcio se utiliza terapéuticamente como aglutinante de fosfato en pacientes en hemodiálisis de mantenimiento. Es la forma más común de aglutinante de fosfato que se prescribe, sobre todo en la enfermedad renal crónica no relacionada con la diálisis. El carbonato de calcio es el captor de fosfato más utilizado, pero los médicos prescriben cada vez más los captores de fosfato más caros y no basados en el calcio, especialmente el sevelamer.
El exceso de calcio procedente de los suplementos, los alimentos fortificados y las dietas con alto contenido en calcio puede provocar el síndrome lácteo-alcalino, que tiene una toxicidad grave y puede ser mortal. En 1915, Bertram Sippy introdujo el "régimen Sippy", consistente en la ingesta de leche y nata cada hora, y la adición gradual de huevos y cereales cocidos, durante 10 días, en combinación con polvos alcalinos, que proporcionaba un alivio sintomático para la enfermedad de la úlcera péptica. Durante las siguientes décadas, el régimen Sippy provocó insuficiencia renal, alcalosis e hipercalcemia, sobre todo en hombres con úlcera péptica. Estos efectos adversos se revirtieron al suspender el régimen, pero fue mortal en algunos pacientes con vómitos prolongados. El síndrome lechoso-alcalino disminuyó en los hombres después de que surgieran tratamientos eficaces para la enfermedad de úlcera péptica. Desde la década de 1990 se ha notificado con mayor frecuencia en mujeres que toman suplementos de calcio por encima del rango recomendado de 1,2 a 1 5 gramos diarios, para la prevención y el tratamiento de la osteoporosis,[22][23] y se agrava con la deshidratación. Se ha añadido calcio a los productos de venta libre, lo que contribuye a una ingesta excesiva inadvertida. La ingesta excesiva de calcio puede provocar hipercalcemia, cuyas complicaciones incluyen vómitos, dolor abdominal y alteración del estado mental.[24]
Como aditivo alimentario se denomina E170,[25] y tiene un número de INS de 170. Utilizado como regulador de la acidez, agente antiaglomerante, estabilizador o colorante está aprobado para su uso en la UE,[26] Estados Unidos[27] y Australia y Nueva Zelanda.[28] Se "añade por ley a toda la harina de pan molida del Reino Unido, excepto a la harina integral".[29][30] Se utiliza en algunos productos de leche de soja y leche de almendras como fuente de calcio dietético; al menos un estudio sugiere que el carbonato de calcio podría ser tan biodisponible como el calcio de la leche de vaca.[31] El carbonato de calcio también se utiliza como agente reafirmante en muchos productos vegetales enlatados y embotellados.
Se ha documentado que varias fórmulas de suplementos de calcio contienen el elemento químico plomo,[32] que supone un problema de salud pública.[33] El plomo se encuentra habitualmente en las fuentes naturales de calcio.[32]
Agricultura y acuicultura
La cal agrícola, tiza o piedra caliza en polvo, se utiliza como método barato para neutralizar el suelo ácido, haciéndolo apto para la siembra, también se utiliza en la industria acuícola para la regulación del pH del suelo del estanque antes de iniciar el cultivo.[34]
Limpieza doméstica
El carbonato de calcio es un ingrediente clave en muchos polvos de limpieza domésticos como Comet y se utiliza como agente de fregado.
Mitigación de la contaminación
En 1989, un investigador, Ken Simmons, introdujo CaCO
3 en el arroyo Whetstone, en Massachusetts.[35] Su esperanza era que el carbonato de calcio contrarrestara el ácido de la lluvia ácida en el arroyo y salvara a las truchas que habían dejado de desovar. Aunque su experimento fue un éxito, aumentó la cantidad de iones de aluminio en la zona del arroyo que no fue tratada con la piedra caliza. Esto demuestra que se puede añadir CaCO
3 para neutralizar los efectos de la lluvia ácida en los ecosistemas fluviales. En la actualidad, el carbonato de calcio se utiliza para neutralizar las condiciones ácidas tanto en el suelo como en el agua.[36][37][38] Desde la década de 1970, este encalado se practica a gran escala en Suecia para mitigar la acidificación y varios miles de lagos y arroyos se encalan repetidamente.[39]
El carbonato de calcio también se utiliza en aplicaciones de desulfuración de gases de combustión que eliminan las emisiones nocivas de SO
2 y NO
2 procedentes del carbón y otros combustibles fósiles que se queman en las grandes centrales eléctricas de combustibles fósiles.[36]
Véase también
Referencias
- ↑ Número CAS
- ↑ Strumińska-Parulska, DI (2015). "Determination of 210Po in calcium supplements and the possible related dose assessment to the consumers". Journal of Environmental Radioactivity. 150: 121–125.
- ↑ «Efectos de la lluvia ácida». Agencia de Protección Ambiental de los Estados Unidos. Consultado el 14 de marzo de 2015.
- ↑ «Alto horno». Science Aid. Archivado desde el original el 17 de diciembre de 2007. Consultado el 30 de diciembre de 2007.
- ↑ Sfetcu, Nicolae (2 de mayo de 2014). id=8jF-AwAAQBAJ&q=El+carbonato+de+calcio+también+se+mezcla+con+la+masilla+en+la+colocación+de+vidrios+manchados,+y+como+resistencia+para+evitar+que+el+vidrio+se+adhiera+a+las+estanterías+cuando+se+cocinan+esmaltes+y+pinturas+a+alta+temperatura&pg=PT1601 Salud y Medicamentos: Enfermedad, prescripción y medicación (en inglés). Nicolae Sfetcu.
- ↑ McGinnis, R. A. Tecnología del azúcar de remolacha (2ª edición). Fundación para el desarrollo del azúcar de remolacha. p. 178.
- ↑ «Usos del carbonato cálcico precipitado». Archivado desde el original el 25 de julio de 2014.
- ↑ «Estudio de mercado de los rellenos, 2ª ed.». Ceresana. September 2011.
- ↑ a b c d «Carbonato de calcio en polvo». Reade Advanced Materials. 4 de febrero de 2006. Archivado desde el original el 22 de febrero de 2008. Consultado el 30 de diciembre de 2007.
- ↑ a b «El carbonato de calcio en las aplicaciones plásticas». Imerys Performance Minerals. Archivado desde el original el 4 de agosto de 2008. Consultado el 1 de agosto de 2008.
- ↑ com/why-do-calcium-carbonate-play-an-important-part-in-industrial-a-59.html «Por qué el carbonato de calcio desempeña un papel importante en la industria». www.xintuchemical. com. Consultado el 7 de octubre de 2018.
- ↑ «precipitated calcium carbonate commodity price». www.dgci.be. Archivado desde be/18122-11/precipitated_calcium_carbonate_commodity_price el original el 7 de octubre de 2018. Consultado el 7 de octubre de 2018.
- ↑ Jimoh, O. A. (2017). scielo.org.za/pdf/sajc/v70/01.pdf «Comprensión del mecanismo de producción de carbonato de calcio precipitado (PCC) y sus características en el sistema líquido-gas utilizando la suspensión de leche de cal (MOL)». South African Journal of Chemistry 70: 1-7.
- ↑ «Topic: Re: ¿Pueden nuestros "residuos" de carbonato cálcico ser utilizados en otras industrias para que podamos desviarlos de los vertederos?». www.chemicalprocessing.com. 4 de marzo de 2010. Archivado desde el original el 23 de marzo de 2017. Consultado el 3 de febrero de 2021.
- ↑ «¿Por qué el carbonato de calcio juega un papel importante en la industria?». www.xintuchemical.com. Consultado el 3 de febrero de 2021.
- ↑ «Carbonatos de calcio / Calcita/ Caliza. CaCO3 | Rajasthan Minerals & Chemicals». www.rmcl.co.in. Archivado desde el original el 15 de abril de 2021. Consultado el 3 de febrero de 2021.
- ↑ «Calcium Carbonate». kamceramics.com. Consultado el 3 de febrero de 2021.
- ↑ «Ohio Historical Society Blog: Make It Shine». Ohio Historical Society. Archivado desde el original el 23 de marzo de 2012. Consultado el 2 de junio de 2011.
- ↑ «Carbonato de calcio». Medline Plus. National Institutes of Health. 1 de octubre de 2005. Archivado desde nlm.nih.gov/medlineplus/druginfo/medmaster/a601032.html el original el 17 de octubre de 2007. Consultado el 30 de diciembre de 2007.
- ↑ Lieberman, Herbert A.; Lachman, Leon; Schwartz, Joseph B. (1990). Pharmaceutical Dosage Forms: Tablets. Nueva York: Dekker. p. 153. ISBN 978-0-8247-8044-9.
- ↑ «Aditivos alimentarios - Nombres que empiezan por C». Chemistry.about.com. 10 de abril de 2012. Archivado desde htm el original el 16 de octubre de 2006. Consultado el 24 de mayo de 2012.
- ↑ Caruso JB, Patel RM, Julka K, Parish DC (July 2007). «Enfermedad inducida por la salud: retorno del síndrome de la leche-alcalina». J Gen Intern Med 22 (7): 1053-5. PMC 2219730. PMID 17483976.
- ↑ Beall DP, Henslee HB, Webb HR, Scofield RH (May 2006). «Síndrome de Milk-alkali: una revisión histórica y descripción de la versión moderna del síndrome». Am. J. Med. Sci. 331 (5): 233-42. PMID 16702792. S2CID 45802184.
- ↑ Gabriely, Ilan; Leu, James P.; Barzel, Uriel S. (2008). «Resolución de problemas clínicos, vuelta a lo básico». New England Journal of Medicine 358 (18): 1952-6. PMID 18450607.
- ↑ «números E: E170 Carbonato de calcio». Food-Info.net. 080419 food-info.net
- ↑ uk/safereating/chemsafe/additivesbranch/enumberlist «Actualmente los aditivos aprobados por la UE y sus números E». UK Food Standards Agency. Consultado el 27 de octubre de 2011.
- ↑ «Listado del estado de los aditivos alimentarios Parte I». US Food and Drug Administration. Archivado desde el original el 14 de marzo de 2013. Consultado el 27 de octubre de 2011.
- ↑ «Estándar 1.2.4 - Etiquetado de ingredientes». Australia New Zealand Food Standards Code. Consultado el 27 de octubre de 2011.
- ↑ Holdstock, Lee. «¿Por qué optar por lo ecológico?». Real Bread Campaign. Soil Association Certification Limited. Consultado el 3 de abril de 2021.
- ↑ uk/government/uploads/system/uploads/attachment_data/file/226553/bread-flour-sum-resp-130805. pdf «Bread and Flour Regulations 1998 A summary of responses to the consultation and Government Reply». Department for Environment, Food and Rural Affairs. August 2013.
- ↑ Zhao, Y.; Martin, B. R.; Weaver, C. M. (2005). «La biodisponibilidad del calcio de la leche de soja fortificada con carbonato de calcio es equivalente a la de la leche de vaca en mujeres jóvenes». The Journal of Nutrition 135 (10): 2379-2382. PMID 16177199. doi:10.1093/jn/135.10.2379.
- ↑ a b Kauffman, John F.; Westenberger, Benjamin J.; Robertson, J. David; Guthrie, James; Jacobs, Abigail; Cummins, Susan K. (1 de julio de 2007). «Plomo en productos farmacéuticos y suplementos dietéticos». Regulatory Toxicology and Pharmacology (en inglés) 48 (2): 128-134. ISSN 0273-2300. PMID 17467129. doi:10.1016/j.yrtph.2007.03.001.
- ↑ Ross, Edward A.; Szabo, N. J.; Tebbett, I. R. (2000). «Contenido de plomo en los suplementos de calcio». JAMA 284 (11): 1425-1429. PMID 10989406.
- ↑ Oates, J. A. H. (11 de julio de 2008). Cal y piedra caliza: Chemistry and Technology, Production and Uses. John Wiley & Sons. pp. 111-113. ISBN 978-3-527-61201-7.
- ↑ nytimes.com/1989/06/13/science/limestone-dispenser-fights-acid-rain-in-stream.html «El dispensador de piedra caliza combate la lluvia ácida en el arroyo». The New York Times. Associated Press. 13 de junio de 1989.
- ↑ a b «Usos ambientales del carbonato de calcio». Congcal. 6 de septiembre de 2012. Consultado el 5 de agosto de 2013.
- ↑ Schreiber, R. K. (1988). 1007%2FBF00160344 «Investigación cooperativa federal-estatal de encalado en aguas superficiales afectadas por deposición ácida». Water, Air, & Soil Pollution 41 (1): 53-73. Bibcode:1988WASP...41...53S. S2CID 98404326. doi:10.1007/BF00160344.
- ↑ Kircheis, Dan; Dill, Richard (2006). mainesalmonrivers.org/pages/Liming%20Project%20Rpt.pdf «Efectos del bajo pH y el alto nivel de aluminio en los esguines de salmón del Atlántico en el este de Maine y análisis de viabilidad del proyecto de encalado» (reimpreso en Downeast Salmon Federation). National Marine Fisheries Service and Maine Atlantic Salmon Commission.
- ↑ Guhrén, M.; Bigler, C.; Renberg, I. (2006). «El encalado en una perspectiva a largo plazo: Un estudio paleolimnológico de 12 lagos en el programa de encalado sueco». Journal of Paleolimnology 37 (2): 247-258. Bibcode:2007JPall..37..247G. S2CID 129439066. doi:10.1007/s10933-006-9014-9.
Enlaces externos
 Wikcionario tiene definiciones y otra información sobre calcáreo.Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del carbonato cálcico.
Wikcionario tiene definiciones y otra información sobre calcáreo.Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del carbonato cálcico.- En MedlinePlus hay más información sobre Sobredosis de carbonato de calcio
- Guía de Minerales Industriales (AINDEX) «Guía de Minerales Industriales».


