Ácido fluoroacético
| Ácido fluoroacético | ||
|---|---|---|
| General | ||
| Fórmula estructural |
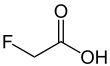 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 144-49-0[1] | |
| ChEBI | 30775 | |
| ChEMBL | CHEMBL509273 | |
| ChemSpider | 10205670 | |
| PubChem | 5237 | |
| UNII | AP1JV9U41M | |
| KEGG | C06108 | |
| Propiedades físicas | ||
| Masa molar | 78,012 g/mol | |
El ácido fluoroacético es un compuesto organofluorado con la fórmula química FCH
2CO
2H Es un sólido incoloro que se caracteriza por su toxicidad relativamente alta.[2] La base conjugada, fluoroacetato, se encuentra de forma natural en al menos 40 plantas en Australia, Brasil y África. Es uno de los cinco únicos productos naturales conocidos que contienen organofluorados.[3]
Toxicidad
El ácido fluoroacético es un metabolito nocivo de algunos fármacos que contienen flúor (dosis letal media, LD50 = 10 mg/kg en humanos). Las fuentes metabólicas más comunes de ácido fluoroacético son las fluoroaminas y los fluoroéteres. El ácido fluoroacético puede alterar el ciclo de Krebs. [4] El metabolito del ácido fluoroacético es el ácido fluorocítrico y es muy tóxico porque no es procesable por la aconitasa en el ciclo de Krebs (donde el fluorocitrato reemplaza al citrato como sustrato). La enzima se inhibe y el ciclo deja de funcionar. [5]
A diferencia del ácido fluoroacético, el ácido difluoroacético y el ácido trifluoroacético son mucho menos tóxicos. Su pKa es 2,66, en contraste con 1,24 y 0,23 para el ácido di-trifluoroacético respectivamente. [6]
Usos
El ácido fluoroacético se utiliza para fabricar pesticidas, especialmente rodenticidas (véase fluoroacetato de sodio). Se proyecta que el mercado en general aumentará a un ritmo considerable durante el período de pronóstico, de 2021 a 2027. [7]
Véase también
Referencias
- ↑ Número CAS
- ↑ Timperley, Christopher M. (2000). «Highly-toxic fluorine compounds». Fluorine Chemistry at the Millennium. pp. 499-538. ISBN 9780080434056. doi:10.1016/B978-008043405-6/50040-2.
- ↑ K.K. Jason Chan; David O'Hagan (2012). «The Rare Fluorinated Natural Products and Biotechnological Prospects for Fluorine Enzymology». Natural Product Biosynthesis by Microorganisms and Plants, Part B. Methods in Enzymology 516. pp. 219-235. ISBN 9780123942913. PMID 23034231. doi:10.1016/B978-0-12-394291-3.00003-4.
- ↑ Kyzer, Jillian L.; Martens, Marvin (15 March 2021). «Metabolism and Toxicity of Fluorine Compounds». Chemical Research in Toxicology 34 (3): 678-680. PMC 8023797. PMID 33513303. doi:10.1021/acs.chemrestox.0c00439.
- ↑ Horák, J.; Linhart, I.; Klusoň, P. (2004). Úvod do toxikologie a ekologie pro chemiky (en czech) (1st edición). Prague: VŠCHT v Praze. ISBN 80-7080-548-X.
- ↑ Wiley-VCH, ed. (11 de marzo de 2003). Ullmann's Encyclopedia of Industrial Chemistry (en inglés) (1 edición). Wiley. ISBN 978-3-527-30385-4. doi:10.1002/14356007.a11_349. Consultado el 10 de enero de 2025.
- ↑ Industry Research (October 25, 2021). «Global Fluoroacetic Acid Market Share, Size 2021: Consumption Analysis By Applications, Future Demand, Top Leading Players, Competitive Situation and Emerging Trends, and Forecast to 2027». MarketWatch. Archivado desde el original el 5 de enero de 2022. Consultado el 5 January 2022.
