Halogenación
La halogenación es el proceso químico mediante el cual se adicionan o sustituyen uno o varios átomos de elementos del grupo de los halógenos (grupo 17 de la tabla periódica) a una molécula orgánica. Una de las halogenaciones más simples es la halogenación de alcanos. En estas reacciones los átomos de hidrógeno de los alcanos siempre resultan sustituidos total o parcialmente por átomos del grupo de los halógenos. La reacción que tiene lugar es la siguiente:
Son posibles una gran variedad de productos químicos. La composición de la mezcla de productos vendrá dada por la concentración de los reactivos y otras condiciones del medio de reacción, por ejemplo, la temperatura.
Tipos de halogenación
En una halogenación se incorpora un átomo de halógeno a una molécula. Existen descripciones más concretas que especifican el tipo de halógeno: fluoración, cloración, bromación y yodación.
En una reacción de adición de Markovnikov, un halógeno como el bromo se hace reaccionar con un alqueno que hace que el enlace π del doble enlace se rompa para dar la formación de un haloalcano con enlace sencillo. Esto hace más reactivo al hidrocarburo, y el bromo, como resultado, es un buen grupo saliente en diversas reacciones químicas tales como las reacciones de sustitución nucleofílica alifática y las reacciones de eliminación.
Existen varios tipos principales de halogenación, incluyendo:
- Halogenación radicalaria, típica de alcanos
- Halogenación de cetonas
- Halogenación electrofílica
- Reacción de adición de halógeno
- Halogenación de alquenos
Asimismo, en la deshalogenación un átomo de halógeno se elimina de una molécula como consecuencia de una reacción.
Ejemplos
- La formación de cloruro de oro (III) por cloración de oro.
Otros métodos específicos de halogenación son la reacción de Hunsdiecker (a partir de ácido carboxílico) y la reacción de Sandmeyer (haluro de arilo).
- Reacción de sustitución radicalaria en alcanos: La halogenación es la reacción de sustitución de un átomo de H en un alcano para sustituirlo por un átomo de halógeno como Cl, Br, I, F. Se trata de una reacción en tres etapas: de iniciación, de propagación y de terminación.[1] Generalmente transcurre bajo luz ultravioleta.
- La iniciación consiste en la formación de radicales a través de la rotura del enlace covalente. En este ejemplo, la molécula de cloro se divide en dos radicales cloro, (Cl·), cada uno de ellos con un electrón desapareado.
- En el paso 1 de la propagación se extrae un átomo como el hidrógeno de la cadena de alcano para formar un radical alquilo. El átomo de H separado se unirá al radical cloro, Cl·, formado en la etapa de iniciación.
- El paso 2 de la propagación consiste en añadir un átomo de halógeno al radical alquilo, formando un enlace covalente, por compartición de sus electrones. En este paso se forman nuevos radicales cloro, Cl·
- La terminación es donde los radicales se unen a través de reacciones de adición para formar nuevos compuestos, unidos covalentemente entre sí.
- Esto acaba con los radicales libres presentes uniéndose para impedir que continúe el mecanismo cíclico. Hay diferentes posibilidades de terminación, por lo que el resultado de esta reacción es una mezcla compleja de sustancias.
En resumen, el halógeno arranca un átomo de H de la cadena carbonada del alcano y luego se une en ese lugar a la cadena a través de una reacción de adición.
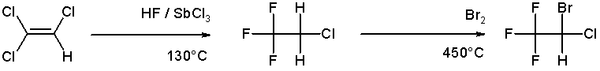
- Otro ejemplo de halogenación se puede encontrar en la síntesis orgánica del anestésico halotano a partir de tricloroetileno que implica una bromación a alta temperatura en la segunda etapa.:[2]
Véase también
- Haloalcano (halogenuro de alquilo)
- Halogenuro de arilo
- Halogenación radicalaria
- Halocetona
- Sustitución electrófila
Referencias
- ↑ Química Orgánica. EUNED, 1986. ISBN 996831496X. Pág. 40
- ↑ Synthesis of essential drugs, Ruben Vardanyan, Victor Hruby; Elsevier 2005 ISBN 0-444-52166-6





