Usuario:Maxpedico/Historia de la Tabla Periodica

La tabla periódica es una lista de los elementos químicos, estructurada por su número atómico, configuración electrónica y propiedades químicas recurrentes. En la forma básica, los elementos se presentan en orden de número atómico creciente, en la secuencia de lectura. Luego, las filas y columnas se crean comenzando nuevas filas e insertando celdas en blanco, de modo que las filas ( puntos ) y columnas ( grupos ) muestren elementos con propiedades recurrentes (llamadas periodicidad). Por ejemplo, todos los elementos del grupo (columna) 18 son gases nobles que apenas tienen reacción química.
La historia de la tabla periódica refleja más de dos siglos de crecimiento en la comprensión de las propiedades químicas y físicas de los elementos, con importantes contribuciones hechas por Antoine-Laurent de Lavoisier, Johann Wolfgang Döbereiner, John Newlands, Julius Lothar Meyer, Dmitri Mendeleev, Glenn T. Seaborg y otros. [1]
Historia Temprana
Varios elementos químicos, como carbono, azufre, hierro, cobre, plata, estaño, oro, mercurio y plomo, se conocen desde antes de la antigüedad, ya que se encuentran en su forma nativa y son relativamente simples de extraer con primitivos. instrumentos. [2] Hacia el 330 a. C., el filósofo griego Aristóteles propuso que todo está compuesto por una mezcla de una o más raíces, una idea sugerida originalmente por el filósofo siciliano Empédocles . Las cuatro raíces, que luego fueron rebautizadas como elementos por el filósofo de Atenas Platón, eran tierra, agua, aire y fuego . En otras tradiciones antiguas, como la filosofía india, existían ideas similares sobre estos cuatro elementos.
Se conocieron algunos elementos adicionales en la era de la alquimia: zinc, arsénico, antimonio y bismuto .
Primeras categorizaciones

La historia de la tabla periódica es también la historia del descubrimiento de los elementos químicos . La primera persona en la historia registrada en descubrir un nuevo elemento fue Hennig Brand, un comerciante alemán en bancarrota. Brand trató de descubrir la piedra filosofal, un objeto mítico que se suponía que convertía metales básicos económicos en oro. En 1669, o más tarde, sus experimentos con orina humana destilada dieron como resultado la producción de una sustancia blanca brillante, a la que llamó "portador de luz" ( kaltes Feuer ). [3] Mantuvo su descubrimiento en secreto hasta 1680, cuando el químico angloirlandés [4] Robert Boyle redescubrió el fósforo y publicó sus hallazgos. El descubrimiento del fósforo ayudó a plantear la cuestión de qué significaba que una sustancia fuera un elemento.
En 1661, Boyle definió un elemento como "aquellos Cuerpos primitivos y simples de los que se dice que están compuestos los mixtos y en los que finalmente se resuelven". [5]
En 1789, el químico francés Antoine Lavoisier escribió Traité Élémentaire de Chimie ( Tratado elemental de química ), que se considera el primer libro de texto moderno sobre química . Lavoisier definió un elemento como una sustancia cuyas unidades más pequeñas no se pueden descomponer en una sustancia más simple. [6] El libro de Lavoisier contenía una lista de "sustancias simples" que Lavoisier creía que no podían desglosarse más, que incluían oxígeno, nitrógeno, hidrógeno, fósforo, mercurio, zinc y azufre, que formaban la base de la lista moderna de elementos. La lista de Lavoisier también incluía " ligeros " y " calóricos ", que en ese momento se creía que eran sustancias materiales. Clasificó estas sustancias en metales y no metales. Si bien muchos de los principales químicos se negaron a creer en las nuevas revelaciones de Lavoisier, el Tratado elemental se escribió lo suficientemente bien como para convencer a la generación más joven. Sin embargo, las descripciones de Lavoisier de sus elementos carecen de integridad, ya que solo los clasificó como metales y no metales.

En 1808–10, el filósofo natural británico John Dalton publicó un método para llegar a el provisionales para los elementos conocidos en su época, a partir de medidas estequiométricas e inferencias razonables. La teoría atómica de Dalton fue adoptada por muchos químicos durante las décadas de 1810 y 1820.
En 1815, el médico y químico británico William Prout notó que los pesos atómicos parecían ser múltiplos de los del hidrógeno. [7] [8]
En 1817, el físico alemán Johann Wolfgang Döbereiner comenzó a formular uno de los primeros intentos de clasificar los elementos. [9] En 1829, descubrió que podía formar algunos de los elementos en grupos de tres, teniendo los miembros de cada grupo propiedades relacionadas. Llamó a estos grupos triadas. [10]
Definición de la ley de la tríada
"Los elementos químicamente análogos dispuestos en orden creciente de sus pesos atómicos formaron grupos bien marcados de tres llamados Tríadas en los que se encontró que el peso atómico del elemento medio era generalmente la media aritmética del peso atómico de los otros dos elementos de la tríada.
En 1860, se presentó una lista revisada de elementos y masas atómicas en una conferencia en Karlsruhe . Ayudó a estimular la creación de sistemas más extensos. El primer sistema de este tipo surgió en dos años. [11]
Formalizaciones integrales
Las propiedades de los elementos y, por tanto, las propiedades de los cuerpos ligeros y pesados formados por ellos, dependen periódicamente de su peso atómico.
El geólogo francés Alexandre-Émile Béguyer de Chancourtois notó que los elementos, cuando estaban ordenados por sus pesos atómicos, mostraban propiedades similares a intervalos regulares. En 1862, ideó un gráfico tridimensional, llamado "hélice telúrica", en honor al elemento telurio, que caía cerca del centro de su diagrama. [12] Con los elementos dispuestos en espiral sobre un cilindro por orden de peso atómico creciente, de Chancourtois vio que elementos con propiedades similares se alineaban verticalmente. El artículo original de Chancourtois en Comptes rendus de l'Académie des Sciences no incluía un gráfico y utilizaba términos geológicos en lugar de químicos. En 1863, amplió su trabajo al incluir un gráfico y agregar iones y compuestos . [13]
El siguiente intento se realizó en 1864. El químico británico John Newlands presentó una clasificación de los 62 elementos conocidos. Newlands notó tendencias recurrentes en las propiedades físicas de los elementos a intervalos recurrentes de múltiplos de ocho en orden de masa; basándose en esta observación, produjo una clasificación de estos elementos en ocho grupos. Cada grupo mostró una progresión similar; Newlands comparó estas progresiones con la progresión de notas dentro de una escala musical. [14] [15] [16] La tabla de Newlands no dejaba espacios para posibles elementos futuros y, en algunos casos, tenía dos elementos en la misma posición en la misma octava. La mesa de Newlands fue ridiculizada por algunos de sus contemporáneos. La Sociedad Química se negó a publicar su trabajo. El presidente de la Sociedad, William Odling, defendió la decisión de la Sociedad diciendo que esos temas "teóricos" podrían ser controvertidos; [17] hubo una oposición aún más dura desde dentro de la Sociedad, lo que sugiere que los elementos podrían haber sido listados alfabéticamente igualmente. [11] Más tarde ese año, Odling sugirió una mesa propia [18] pero no logró obtener reconocimiento después de su papel al oponerse a la mesa de Newlands. [17]
El químico alemán Lothar Meyer también notó las secuencias de propiedades químicas y físicas similares repetidas a intervalos periódicos. Según él, si los pesos atómicos se trazaran como ordenadas (es decir, verticalmente) y los volúmenes atómicos como abscisas (es decir, horizontalmente), la curva obtuvo una serie de máximos y mínimos, los elementos más electropositivos aparecerían en los picos de la curva en el orden de sus pesos atómicos. En 1864, se publicó un libro suyo; contenía una versión anterior de la tabla periódica que contenía 28 elementos y clasificaba los elementos en seis familias por su valencia; por primera vez, los elementos se habían agrupado según su valencia. Los trabajos para organizar los elementos por peso atómico se habían visto obstaculizados hasta entonces por mediciones inexactas de los pesos atómicos. [19] En 1868, revisó su tabla, pero esta revisión se publicó como borrador solo después de su muerte. [2] En un artículo fechado en diciembre de 1869 que apareció a principios de 1870, Meyer publicó una nueva tabla periódica de 55 elementos, en la que la serie de períodos termina con un elemento del grupo de los metales alcalinotérreos. El documento también incluía un gráfico de líneas de volúmenes atómicos relativos, que ilustraba las relaciones periódicas de las características físicas de los elementos y que ayudaba a Meyer a decidir dónde debían aparecer los elementos en su tabla periódica. En ese momento ya había visto la publicación de la primera tabla periódica de Mendeleev, pero su trabajo parece haber sido en gran parte independiente.[cita requerida]
En 1869, el químico ruso Dmitri Mendeleev ordenó 63 elementos aumentando el peso atómico en varias columnas, notando propiedades químicas recurrentes en ellas. A veces se dice que jugaba al "solitario químico" en largos viajes en tren, [20] usando cartas con los símbolos y los pesos atómicos de los elementos conocidos.[cita requerida] Otra posibilidad es que se inspiró en parte por la periodicidad del alfabeto sánscrito, que le fue señalado por su amigo y lingüista Otto von Böhtlingk . [21] Mendeleev usó las tendencias que vio para sugerir que los pesos atómicos de algunos elementos eran incorrectos y, en consecuencia, cambió su ubicación: por ejemplo, pensó que no había lugar para un berilio trivalente con el peso atómico de 14 en su trabajo, y cortó ambos el peso atómico y la valencia del berilio en un tercio, lo que sugiere que era un elemento divalente con un peso atómico de 9,4. Mendeleev distribuyó ampliamente hojas impresas de la mesa a varios químicos en Rusia y en el extranjero. [22] [23] [24] Mendeleev argumentó en 1869 que había siete tipos de óxidos superiores. [25] [lower-alpha 1] Mendeleev continuó mejorando su ordenación; en 1870, adquirió una forma tabular, ya cada columna se le dio su propio óxido más alto, [26] y en 1871, lo desarrolló aún más y formuló lo que llamó la "ley de la periodicidad". [27] Algunos cambios también ocurrieron con nuevas revisiones, con algunos elementos cambiando de posición.
- Various attempts to construct a comprehensive formalization
-
Tabla periódica de Meyer, publicada en "Die modernen Theorien der Chemie", 1864
-
Ley de octavas de Newlands, 1866
-
Primer intento de Mendeleev en un sistema de elementos, 1869
-
El sistema natural de los elementos de Mendeleev, 1870
-
Tabla periódica de Mendeleiev, 1871
Disputa y reconocimiento de prioridad
Las predicciones de Mendeleev y su incapacidad para incorporar los metales de las tierras raras
| Nombre | Peso atomico | Nombre Moderno
(año de descubrimiento) | |
|---|---|---|---|
| Mendeleev | Moderno | ||
| Éter | 0,17 | - | - |
| Coronium | 0.4 | - | - |
| Eka-boro | 44 | 44,6 | Escandio (1789) |
| Eka-cerio | 54 | - | - |
| Eka-aluminio | 68 | 69,2 | Galio (1785) |
| Eka-silicio | 72 | 72,0 | Germanio (1871) |
| Eka-manganeso | 100 | 99 | Tecnecio (1925) |
| Eka-molibdeno | 140 | - | - |
| Eka-niobio | 146 | - | - |
| Eka-cadmio | 155 | - | - |
| Eka-yodo | 170 | - | - |
| Tri-manganeso | 190 | 186 | Renio (1925) |
| Eka-cesio | 175 | - | - |
| Dvi-telurio | 212 | 210 | Polonio (1898) |
| Dvi-cesio | 220 | 223 | Francio (1937) |
| Eka-tantalio | 235 | 231 | Protactinio (1917) |
Incluso cuando Mendeleev corrigió las posiciones de algunos elementos, pensó que algunas relaciones que podía encontrar en su gran esquema de periodicidad no se podían encontrar porque algunos elementos aún estaban por descubrir, y que las propiedades de tales elementos no descubiertos podrían deducirse de sus relaciones esperadas. con otros elementos. En 1870, trató por primera vez de caracterizar los elementos aún no descubiertos, y dio predicciones detalladas para tres elementos, a los que denominó eka-boro, eka-aluminio y eka-silicio ; [29] también señaló más brevemente algunas otras expectativas. [30] Se ha propuesto que los prefijos eka, dvi y tri, sánscrito para uno, dos y tres, respectivamente, son un tributo a Pāṇini y otros gramáticos sánscritos antiguos por su invención de un alfabeto periódico. [21] En 1871, Mendeleev amplió aún más sus predicciones.
En comparación con el resto del trabajo, la lista de 1869 de Mendeleev extravía siete elementos conocidos en ese momento: indio, torio y cinco metales de tierras raras : itrio, cerio, lantano, erbio y didimio . Más tarde se descubrió que los dos últimos eran mezclas de dos elementos diferentes); ignorarlos le permitiría restaurar la lógica del aumento del peso atómico. Estos elementos (que se pensaba que eran divalentes en ese momento) desconcertaron a Mendeleev, ya que no mostraban un aumento regular en la valencia a pesar de sus pesos atómicos aparentemente consecuentes. [31] Mendeleev los agrupó, pensando en ellos como en un tipo particular de serie. [lower-alpha 3] A principios de 1870, decidió que los pesos de estos elementos debían ser incorrectos y que los metales de las tierras raras debían ser trivalentes (lo que, en consecuencia, aumentaba a la mitad sus pesos atómicos previstos). Midió la capacidad calorífica del indio, el uranio y el cerio para demostrar su mayor valencia supuesta (que pronto fue confirmada por el químico prusiano Robert Bunsen ). [32] Mendeleev trató el cambio evaluando cada elemento en un lugar individual en su sistema de elementos en lugar de continuar tratándolos como una serie.
Mendeleev notó que había una diferencia significativa en la masa atómica entre el cerio y el tantalio sin ningún elemento entre ellos; su consideración era que entre ellos, había una fila de elementos aún no descubiertos, que mostrarían propiedades similares a los elementos que se encontrarían por encima y por debajo de ellos: por ejemplo, un eka-molibdeno se comportaría como un homólogo más pesado de molibdeno y un homólogo más ligero de wolframio (el nombre con el que Mendeleev conocía al tungsteno ). [33] Esta fila comenzaría con un lantano trivalente, un cerio tetravalente y un didimio pentavalente. Sin embargo, no se había establecido la valencia más alta para el didimio, y Mendeleev intentó hacerlo él mismo. [34] Al no haber tenido éxito en eso, abandonó sus intentos de incorporar los metales de tierras raras a fines de 1871 y se embarcó en su gran idea del éter luminífero . Su idea fue llevada a cabo por el químico austriaco-húngaro Bohuslav Brauner, quien trató de encontrar un lugar en la tabla periódica para los metales de las tierras raras; [35] Mendeleev se refirió más tarde a él como "uno de los verdaderos consolidadores de la ley periódica". [lower-alpha 4]
Además de las predicciones de escandio, galio y germanio que se realizaron rápidamente, la tabla de 1871 de Mendeleev dejó muchos más espacios para elementos no descubiertos, aunque no proporcionó predicciones detalladas de sus propiedades. En total, predijo dieciocho elementos, aunque solo la mitad correspondía a elementos que se descubrieron más tarde. [36]
Prioridad de descubrimiento
Ninguna de las propuestas fue aceptada de inmediato, y muchos químicos contemporáneos la encontraron demasiado abstracta para tener algún valor significativo. De los químicos que propusieron sus categorizaciones, Mendeleev se destacó por esforzarse por respaldar su trabajo y promover su visión de la periodicidad.[cita requerida] En contraste, Meyer no promovió su trabajo de manera muy activa, y Newlands no hizo ni un solo intento por ganar reconocimiento en el extranjero.[cita requerida]
Tanto Mendeleev como Meyer crearon sus respectivas tablas para sus necesidades pedagógicas; la diferencia entre sus tablas se explica bien por el hecho de que los dos químicos buscaron utilizar un sistema formalizado para resolver diferentes problemas. [37] La intención de Mendeleev era ayudar a la composición de su libro de texto, Fundamentos de la química, mientras que Meyer estaba más bien preocupado por la presentación de teorías. [37] Las predicciones de Mendeleev surgieron fuera del ámbito pedagógico en el ámbito de la ciencia de las revistas, [38] mientras que Meyer no hizo predicciones en absoluto y declaró explícitamente que su tabla y su libro de texto en el que estaba contenido, Teorías modernas, no deberían usarse para predicciones. para que sus estudiantes no hagan demasiadas proyecciones construidas puramente teóricamente. [39]
Mendeleev y Meyer diferían en temperamento, al menos en lo que respecta a la promoción de sus respectivas obras. Algunos químicos contemporáneos señalaron la audacia de las predicciones de Mendeleev, por muy escépticos que pudieran haber sido. [40] Meyer se refirió a la "audacia" de Mendeleev en una edición de Modern Theories, mientras que Mendeleev se burló de la indecisión de Meyer para predecir en una edición de Foundations of Chemistry . [40]
Reconocimiento de la Tabla de Mendeleev
Finalmente, la tabla periódica fue apreciada por su poder descriptivo y por finalmente sistematizar la relación entre los elementos, [41] aunque tal apreciación no fue universal. [42] En 1881, Mendeleev y Meyer tuvieron una discusión a través de un intercambio de artículos en la revista británica Chemical News sobre la prioridad de la tabla periódica, que incluía un artículo de Mendeleev, uno de Meyer, uno de crítica a la noción de periodicidad y mucho mas. [43] En 1882, la Royal Society de Londres otorgó la medalla Davy tanto a Mendeleev como a Meyer por su trabajo para clasificar los elementos; aunque para entonces se habían descubierto dos de los elementos predichos de Mendeleev, las predicciones de Mendeleev no se mencionaron en absoluto en la justificación del premio.
El eka-aluminio de Mendeleev se descubrió en 1875 y se conoció como galio ; eka-boro y eka-silicium se descubrieron en 1879 y 1886, respectivamente, y se denominaron escandio y germanio . Mendeleev incluso pudo corregir algunas mediciones iniciales con sus predicciones, incluida la primera predicción del galio, que coincidía bastante con el eka-aluminio pero tenía una densidad diferente. Mendeleev aconsejó al descubridor, el químico francés Paul-Émile Lecoq de Boisbaudran, que volviera a medir la densidad; De Boisbaudran se mostró inicialmente escéptico (sobre todo porque pensó que Mendeleev estaba tratando de atribuirse el mérito de él), pero finalmente admitió la exactitud de la predicción. Mendeleev se puso en contacto con los tres descubridores; Los tres notaron la estrecha similitud de sus elementos descubiertos con las predicciones de Mendeleev, y el último de ellos, el químico alemán Clemens Winkler, admitió que esta sugerencia no fue hecha primero por Mendeleev o él mismo después de la correspondencia con él, sino por una persona diferente, el químico alemán. Hieronymous Theodor Richter . [lower-alpha 5] Algunos químicos contemporáneos no estaban convencidos por estos descubrimientos, notando las diferencias entre los nuevos elementos y las predicciones o afirmando que las similitudes que existían eran una coincidencia. [42] Sin embargo, el éxito de las predicciones de Mendeleev ayudó a correr la voz sobre su tabla periódica. [44] químicos posteriores utilizaron los éxitos de estas predicciones de Mendeleev para justificar su tabla. [11]
En 1890, la tabla periódica de Mendeleev había sido reconocida universalmente como una pieza de conocimiento químico básico. [45] Aparte de sus propias predicciones correctas, varios aspectos pueden haber contribuido a esto, como la correcta acomodación de muchos elementos cuyos pesos atómicos se pensaba que tenían valores incorrectos pero que luego fueron corregidos. [44] El debate sobre la posición de los metales de las tierras raras también ayudó a estimular la discusión sobre la mesa. [44] [lower-alpha 6] En 1889, Mendeleev señaló en la Conferencia de Faraday ante la Royal Institution de Londres que no había esperado vivir lo suficiente "para mencionar su descubrimiento a la Sociedad Química de Gran Bretaña como una confirmación de la exactitud y generalidad de la ley periódica ". [46]
Gases inertes y éter
Gases inertes
El químico británico Henry Cavendish, descubridor del hidrógeno en 1766, descubrió que el aire está compuesto de más gases que nitrógeno y oxígeno . [47] Registró estos hallazgos en 1784 y 1785; entre ellos, encontró un gas no identificado en ese momento menos reactivo que el nitrógeno. El helio se informó por primera vez en 1868; el informe se basó en la nueva técnica de espectroscopia ; algunas líneas espectrales de la luz emitida por el Sol no coincidían con las de ninguno de los elementos conocidos. A Mendeleev no le convenció este hallazgo, ya que la variación de la temperatura provocó cambios en la intensidad de las líneas espectrales y su ubicación en el espectro; [48] esta opinión fue sostenida por algunos otros científicos de la época. Otros creían que las líneas espectrales podrían pertenecer a un elemento que se encontraba en el Sol pero no en la Tierra; algunos creían que aún no se había encontrado en la Tierra.[cita requerida]
En 1894, el químico británico William Ramsay y el físico británico Lord Rayleigh aislaron el argón del aire y determinaron que era un elemento nuevo. El argón, sin embargo, no participó en ninguna reacción química y fue, muy inusualmente para un gas, monoatómico; [lower-alpha 7] no encajaba en la ley periódica y, por lo tanto, desafió la noción misma de la misma. No todos los científicos aceptaron este informe de inmediato; La respuesta original de Mendeleev fue que el argón era una forma triatómica de nitrógeno en lugar de un elemento propio. [49] Si bien había existido la noción de una posibilidad de un grupo entre el de los halógenos y el de los metales alcalinos (algunos científicos creían que faltaban varios valores de peso atómico entre los halógenos y los metales alcalinos, especialmente porque los lugares en esta mitad del grupo VIII permanecían vacantes), [50] argón no coincidía fácilmente con la posición entre el cloro y el potasio porque su peso atómico excedía los del cloro y el potasio. [51] Se propusieron otras explicaciones; por ejemplo, Ramsay supuso que el argón podría ser una mezcla de diferentes gases. [51] Por un tiempo, Ramsay creyó que el argón podría ser una mezcla de tres gases de pesos atómicos similares; esta tríada se asemejaría a la tríada de hierro, cobalto y níquel, y se ubicaría de manera similar en el grupo VIII. [52] Seguro de que los períodos más cortos contienen tríadas de gases en sus extremos, Ramsay sugirió en 1898 la existencia de un gas entre el helio y el argón con un peso atómico de 20; después de su descubrimiento más tarde ese año (se llamó neón ), Ramsay continuó interpretándolo como un miembro de una tríada horizontal al final de ese período. [53]
En 1896, Ramsay probó un informe del químico estadounidense William Francis Hillebrand, quien encontró una corriente de un gas no reactivo de una muestra de uraninita . Deseando demostrar que era nitrógeno, Ramsay analizó un mineral de uranio diferente, cleveita, y encontró un nuevo elemento, al que llamó kriptón. Este hallazgo fue corregido por el químico británico William Crookes, quien comparó su espectro con el del helio del Sol. [54] Después de este descubrimiento, Ramsay, utilizando la destilación fraccionada para separar los componentes del aire, descubrió varios gases de este tipo en 1898: metargón, criptón, neón y xenón ; El análisis espectroscópico detallado del primero de ellos demostró que era argón contaminado por una impureza a base de carbono.[cita requerida] Ramsay se mostró inicialmente escéptico sobre la existencia de gases más pesados que el argón, y el descubrimiento del kriptón y el xenón le sorprendió; sin embargo, Ramsay aceptó su propio descubrimiento, y los cinco gases inertes recién descubiertos (ahora gases nobles ) se colocaron en una sola columna en la tabla periódica. [55] Aunque la tabla de Mendeleev predijo varios elementos no descubiertos, no predijo la existencia de tales gases inertes, y Mendeleev originalmente rechazó esos hallazgos también. [56] [lower-alpha 8]
Cambios en la tabla periódica
Aunque la secuencia de pesos atómicos sugirió que los gases inertes deberían ubicarse entre los halógenos y los metales alcalinos, y hubo sugerencias para colocarlos en el grupo VIII desde 1895, [57] tal ubicación contradecía una de las consideraciones básicas de Mendeleev, la de los óxidos más altos. Los gases inertes no formaban óxidos ni otros compuestos, y como tal, su ubicación en un grupo donde los elementos debían formar tetraóxidos se consideraba meramente auxiliar y no natural; Mendeleev dudaba de la inclusión de esos elementos en el grupo VIII. [57] Desarrollos posteriores, particularmente por científicos británicos, se centraron en la correspondencia de gases inertes con halógenos a su izquierda y metales alcalinos a su derecha. En 1898, cuando solo se conocía definitivamente el helio, el argón y el criptón, Crookes sugirió que estos elementos se colocaran en una sola columna entre el grupo hidrógeno y el grupo flúor. [58] En 1900, en la Academia de Ciencias de Prusia, Ramsay y Mendeleev discutieron los nuevos gases inertes y su ubicación en la tabla periódica; Ramsay propuso que estos elementos se pusieran en un nuevo grupo entre halógenos y metales alcalinos, a lo que Mendeleev estuvo de acuerdo. [44] Ramsay publicó un artículo después de sus discusiones con Mendeleev; las tablas mostraban halógenos a la izquierda de gases inertes y metales alcalinos a la derecha. [59] Dos semanas antes de esa discusión, el botánico belga Léo Errera había propuesto a la Real Academia de Ciencias, Letras y Bellas Artes de Bélgica colocar esos elementos en un nuevo grupo 0. En 1902, Mendeleev escribió que esos elementos deberían incluirse en un nuevo grupo 0; dijo que esta idea era consistente con lo que le sugirió Ramsay y se refirió a Errera como la primera persona que sugirió la idea. [60] El propio Mendeleev agregó estos elementos a la tabla como grupo 0 en 1902, sin alterar el concepto básico de la tabla periódica. [60] [61]
En 1905, el químico suizo Alfred Werner resolvió la zona muerta de la mesa de Mendeleev. Determinó que los elementos de tierras raras ( lantánidos ), 13 de los cuales eran conocidos, se encontraban dentro de ese espacio. Aunque Mendeleev conocía la existencia de lantano, cerio y erbio, anteriormente no se tenían en cuenta en la tabla porque no se conocían su número total ni su orden exacto; Mendeleev todavía no podía caberlos en su mesa en 1901. [56] Esto fue en parte una consecuencia de su química similar y la determinación imprecisa de sus masas atómicas. Combinado con la falta de un grupo conocido de elementos similares, esto dificultó la ubicación de los lantánidos en la tabla periódica. [62] Este descubrimiento condujo a una reestructuración de la tabla y la primera aparición del formulario de 32 columnas . [63]
Éter
En 1904, la tabla de Mendeleev reorganizó varios elementos e incluyó los gases nobles junto con la mayoría de los otros elementos recién descubiertos. Todavía tenía la zona muerta, y se agregó una fila cero sobre el hidrógeno y el helio para incluir el coronio y el éter, que se creía ampliamente que eran elementos en ese momento. [63] Aunque el experimento de Michelson-Morley en 1887 arrojó dudas sobre la posibilidad de un éter luminífero como medio que llena el espacio, los físicos establecieron restricciones para sus propiedades. [64] Mendeleev creía que era un gas muy ligero, con un peso atómico varios órdenes de magnitud menor que el del hidrógeno. También postuló que rara vez interactuaría con otros elementos, similares a los gases nobles de su grupo cero, y en cambio permearía sustancias a una velocidad de 2250 kilómetros (1398,1 mi) por segundo. [lower-alpha 9]
Mendeleev no estaba satisfecho con la falta de comprensión de la naturaleza de esta periodicidad; esto solo sería posible con la comprensión de la composición del átomo. Sin embargo, Mendeleev creía firmemente que el futuro solo desarrollaría la noción en lugar de desafiarla y reafirmó su creencia por escrito en 1902. [65]
- Early developments of Mendeleev's table
-
Tabla principal de la tabla periódica publicada por el químico australiano David Orme Masson en 1895
-
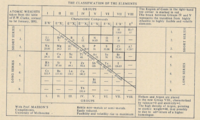
[en→es]Fragment of a periodic table published by Ramsay in 1896
-
[en→es]Fragment of a periodic table published by Ramsay in 1900
-
[en→es]Periodic table as published by Errera in 1900
-
[en→es]Werner's 32-column 1905 table. This table left spaces for many then-unknown elements, and several elements had their positions revised following advances in atomic theory.
Teoría atómica e isótopos
Radiactividad e isótopos

En 1907 se descubrió que el torio y el radiotorio, productos de la desintegración radiactiva, eran físicamente diferentes pero químicamente idénticos; esto llevó a Frederick Soddy a proponer en 1910 que eran el mismo elemento pero con diferentes pesos atómicos. [66] Soddy propuso más tarde llamar a estos elementos con identidad química completa "isótopos". [67]
El problema de colocar isótopos en la tabla periódica había surgido a partir de 1900 cuando se conocían cuatro elementos radiactivos: radio, actinio, torio y uranio . Estos elementos radiactivos (denominados "radioelementos") se colocaron en consecuencia en la parte inferior de la tabla periódica, ya que se sabía que tenían mayores pesos atómicos que los elementos estables, aunque no se conocía su orden exacto. Los investigadores creían que aún quedaban más elementos radiactivos por descubrir y, durante la década siguiente, se estudiaron ampliamente las cadenas de desintegración del torio y el uranio. Se encontraron muchas sustancias radiactivas nuevas, incluido el gas noble radón, y se investigaron sus propiedades químicas. En 1912, se habían encontrado casi 50 sustancias radiactivas diferentes en las cadenas de desintegración del torio y el uranio. El químico estadounidense Bertram Boltwood propuso varias cadenas de desintegración que unen estos radioelementos entre el uranio y el plomo. En ese momento, se pensó que eran nuevos elementos químicos, lo que aumentó sustancialmente el número de "elementos" conocidos y llevó a especulaciones de que sus descubrimientos socavarían el concepto de tabla periódica que se había establecido durante mucho tiempo para obedecer la regla del octeto . [36] Por ejemplo, no había suficiente espacio entre el plomo y el uranio para dar cabida a estos descubrimientos, incluso suponiendo que algunos descubrimientos fueran duplicados o identificaciones incorrectas. También se creía que la desintegración radiactiva violaba uno de los principios centrales de la tabla periódica, a saber, que los elementos químicos no podían sufrir transmutaciones y siempre tenían identidades únicas.
Soddy y Kazimierz Fajans, que habían estado siguiendo estos desarrollos, publicaron en 1913 que aunque estas sustancias emitían radiaciones diferentes, muchas de estas sustancias eran idénticas en sus características químicas, por lo que compartían el mismo lugar en la tabla periódica. [68] [69] Se les conoció como isótopos, del griego isos topos ("mismo lugar"). [70] El químico austriaco Friedrich Paneth citó una diferencia entre "elementos reales" (elementos) y "sustancias simples" (isótopos), y también determinó que la existencia de diferentes isótopos era en su mayoría irrelevante para determinar las propiedades químicas. [36]
Tras el descubrimiento del físico británico Charles Glover Barkla de los rayos X característicos emitidos por metales en 1906, el físico británico Henry Moseley consideró una posible correlación entre las emisiones de rayos X y las propiedades físicas de los elementos. Moseley, junto con Charles Galton Darwin, Niels Bohr y George de Hevesy, propusieron que la carga nuclear ( Z ) podría estar relacionada matemáticamente con las propiedades físicas. La importancia de estas propiedades atómicas se determinó en el experimento de Geiger-Marsden, en el que se descubrió el núcleo atómico y su carga. [71]
Modelo de Rutherford y número atómico
En 1913, el físico aficionado holandés Antonius van den Broek fue el primero en proponer que el número atómico (carga nuclear) determinaba la ubicación de los elementos en la tabla periódica. Determinó correctamente el número atómico de todos los elementos hasta el número atómico 50 ( estaño ), aunque cometió varios errores con los elementos más pesados. Sin embargo, Van den Broek no tenía ningún método para verificar experimentalmente los números atómicos de los elementos; por lo tanto, todavía se creía que eran una consecuencia del peso atómico, que seguía utilizándose para ordenar elementos.
Moseley estaba decidido a probar la hipótesis de Van den Broek. Después de un año de investigación de las líneas de Fraunhofer de varios elementos, encontró una relación entre la longitud de onda de rayos X de un elemento y su número atómico. [72] Con esto, Moseley obtuvo las primeras medidas precisas de números atómicos y determinó una secuencia absoluta a los elementos, lo que le permitió reestructurar la tabla periódica. La investigación de Moseley resolvió inmediatamente las discrepancias entre el peso atómico y las propiedades químicas, donde la secuenciación estrictamente por peso atómico daría como resultado grupos con propiedades químicas inconsistentes. Por ejemplo, sus mediciones de longitudes de onda de rayos X le permitieron colocar correctamente el argón ( Z = 18) antes que el potasio ( Z = 19), cobalto ( Z = 27) antes del níquel ( Z = 28), así como telurio ( Z = 52) antes del yodo ( Z = 53), en línea con las tendencias periódicas . La determinación de los números atómicos también aclaró el orden de los elementos de tierras raras químicamente similares; también se utilizó para confirmar que el supuesto descubrimiento de Georges Urbain de un nuevo elemento de tierras raras (celtium) no era válido, lo que le valió la aclamación de Moseley por esta técnica.
El físico sueco Karl Siegbahn continuó el trabajo de Moseley para elementos más pesados que el oro ( Z = 79), y descubrió que el elemento más pesado conocido en ese momento, el uranio, tenía el número atómico 92. Al determinar el número atómico identificado más grande, se determinaron de manera concluyente las brechas en la secuencia del número atómico cuando un número atómico no tenía un elemento correspondiente conocido; las brechas se produjeron en los números atómicos 43 ( tecnecio ), 61 ( prometio ), 72 ( hafnio ), 75 ( renio ), 85 ( astato ) y 87 ( francio ).
Capa de electrones y mecánica cuántica
En 1888, [73] el físico sueco Johannes Rydberg, trabajando con la fórmula de Balmer de 1885, notó que los números atómicos de los gases nobles eran iguales a las sumas de cuadrados de números simples duplicadas: 2 = 2 · 1 2, 10 = 2 (1 2 + 2 2 ), 18 = 2 (1 2 + 2 2 + 2 2 ), 36 = 2 (1 2 + 2 2 + 2 2 + 3 2 ), 54 = 2 (1 2 + 2 2 + 2 2 + 3 2 + 3 2 ), 86 = 2 (1 2 + 2 2 + 2 2 + 3 2 + 3 2 + 4 2 ). Este hallazgo fue aceptado como una explicación de las longitudes fijas de los períodos y condujo al reposicionamiento de los gases nobles desde el borde izquierdo de la tabla, en el grupo 0, hacia la derecha, en el grupo VIII. [60] La falta de voluntad de los gases nobles para participar en una reacción química se explicó en la estabilidad aludida de las configuraciones cerradas de electrones de los gases nobles; de esta noción surgió la regla del octeto originalmente referida como Regla de Abegg de 1904. [74] Entre los trabajos notables que establecieron la importancia de la periodicidad de ocho se encuentran la teoría del enlace de valencia, publicada en 1916 por el químico estadounidense Gilbert N. Lewis [75] y la teoría del octeto del enlace químico, publicada en 1919 por el químico estadounidense Irving Langmuir . [76] [77] El enfoque de los químicos durante el período de la antigua teoría cuántica (1913 a 1925) se incorporó a la comprensión de las capas de electrones y orbitales bajo la mecánica cuántica actual. Un verdadero pionero que nos dio la base para nuestro modelo actual de electrones es Irving Langmuir . En su artículo de 1919, postuló la existencia de "células", que ahora llamamos orbitales, cada una de las cuales solo podía contener dos electrones, y estos estaban dispuestos en "capas equidistantes" que ahora llamamos capas. Hizo una excepción para la primera capa que solo contenía dos electrones. Estos postulados se introdujeron sobre la base de la regla de Rydberg que Niels Bohr había utilizado no en química, sino en física, para aplicar a las órbitas de los electrones alrededor del núcleo. En el artículo de Langmuir, introdujo la regla como 2N 2 donde N era un número entero positivo. [78]
El químico Charles Rugeley Bury dio el siguiente gran paso hacia nuestra teoría moderna en 1921, al sugerir que ocho y dieciocho electrones en una capa forman configuraciones estables. El esquema de Bury se basó en el de los químicos anteriores y era un modelo químico. Bury propuso que las configuraciones electrónicas en los elementos de transición dependían de los electrones de valencia en su capa exterior. [79] En algunos artículos iniciales, el modelo se llamaba "Átomo de Bohr-Bury". Introdujo la palabra transición para describir los elementos que ahora se conocen como metales de transición o elementos de transición. [80]
En las décadas de 1910 y 1920, la investigación pionera en mecánica cuántica condujo a nuevos desarrollos en la teoría atómica y pequeños cambios en la tabla periódica. En el siglo XIX, Mendeleev ya había afirmado que había una periodicidad fija de ocho y esperaba una correlación matemática entre el número atómico y las propiedades químicas. [81] El modelo de Bohr se desarrolló a partir de 1913 y defendió la idea de configuraciones electrónicas que determinan las propiedades químicas. Bohr propuso que los elementos del mismo grupo se comportaban de manera similar porque tienen configuraciones electrónicas similares y que los gases nobles habían llenado las capas de valencia; [82] esto forma la base de la regla moderna del octeto. El estudio de Bohr sobre espectroscopia y química no era habitual entre los físicos atómicos teóricos. Incluso Rutherford le dijo a Bohr que estaba luchando por "formarse una idea de cómo llegar a sus conclusiones". [83] Esto se debe a que ninguna de las ecuaciones de la mecánica cuántica describe el número de electrones por capa y orbital. Bohr reconoció que fue influenciado por el trabajo de Walther Kossel, quien en 1916 fue el primero en establecer una conexión importante entre el átomo cuántico y la tabla periódica. Notó que la diferencia entre los números atómicos 2, 10, 18 de los primeros tres gases nobles, helio, neón, argón, era 8, y argumentó que los electrones en tales átomos orbitaban en "capas cerradas". El primero contenía solo 2 electrones, el segundo y el tercero, 8 cada uno. [84] [85] La investigación de Bohr llevó al físico austriaco Wolfgang Pauli a investigar la longitud de los períodos en la tabla periódica en 1924. Pauli demostró que este no era el caso. En cambio, el principio de exclusión de Pauli se desarrolló, no sobre una base matemática, sino sobre los desarrollos previos en alineación con la química. [86] Esta regla establece que ningún electrón puede coexistir en el mismo estado cuántico y mostró, junto con observaciones empíricas, la existencia de cuatro números cuánticos y la consecuencia en el orden de llenado de la capa. [82] Esto determina el orden en que se llenan las capas de electrones y explica la periodicidad de la tabla periódica.
Al químico británico Charles Bury se le atribuye el primer uso del término metal de transición en 1921 para referirse a elementos entre los elementos del grupo principal de los grupos II y III. Explicó las propiedades químicas de los elementos de transición como consecuencia del llenado de una subcapa interna en lugar de la capa de valencia. Esta proposición, basada en el trabajo del químico estadounidense Gilbert N. Lewis, sugirió la aparición de la subcapa d en el período 4 y la subcapa f en el período 6, alargando los períodos de 8 a 18 y luego de 18 a 32 elementos, explicando así la posición de los lantánidos en la tabla periódica. [87]
Protón y neutrón
El descubrimiento de protones y neutrones demostró que un átomo era divisible; esto hizo obsoleta la definición de Lavoisier de un elemento químico. Un elemento químico se define hoy como una especie de átomos con un número constante de protones [88] y ahora se sabe que ese número es precisamente el número atómico de un elemento. El descubrimiento también explicó el mecanismo de varios tipos de desintegración radiactiva, como la desintegración alfa .
Finalmente, se propuso que los protones y neutrones estaban compuestos por partículas aún más pequeñas llamadas quarks ; su descubrimiento explicó la transmutación de neutrones en protones en desintegración beta .
Expansiones posteriores y el final de la tabla periódica
Actínidos
Ya en 1913, la investigación de Bohr sobre la estructura electrónica llevó a físicos como Johannes Rydberg a extrapolar las propiedades de elementos no descubiertos más pesados que el uranio. Muchos estuvieron de acuerdo en que el siguiente gas noble después del radón probablemente tendría el número atómico 118, del cual se deducía que la serie de transición en el séptimo período debería parecerse a las del sexto . Aunque se pensó que estas series de transición incluirían una serie análoga a los elementos de tierras raras, caracterizados por el llenado de la capa 5f, se desconocía dónde comenzaba esta serie. Las predicciones iban desde el número atómico 90 (torio) hasta el 99, muchas de las cuales proponían un comienzo más allá de los elementos conocidos (en o más allá del número atómico 93). En cambio, se creía que los elementos del actinio al uranio formaban parte de una cuarta serie de metales de transición debido a sus altos estados de oxidación ; en consecuencia, se colocaron en los grupos 3 a 6. [89]
En 1940, el neptunio y el plutonio fueron los primeros elementos transuránicos que se descubrieron; se colocaron en secuencia debajo del renio y el osmio, respectivamente. Sin embargo, las investigaciones preliminares de su química sugirieron una mayor similitud con el uranio que con los metales de transición más ligeros, desafiando su ubicación en la tabla periódica. Durante su investigación del Proyecto Manhattan en 1943, el químico estadounidense Glenn T. Seaborg experimentó dificultades inesperadas para aislar los elementos americio y curio, ya que se creía que eran parte de una cuarta serie de metales de transición. Seaborg se preguntó si estos elementos pertenecían a una serie diferente, lo que explicaría por qué sus propiedades químicas, en particular la inestabilidad de los estados de oxidación superiores, eran diferentes de las predicciones. En 1945, en contra del consejo de sus colegas, propuso un cambio significativo en la tabla de Mendeleev: la serie de actínidos . [89] [90]
El concepto de actínidos de Seaborg de estructura electrónica de elementos pesados propuso que los actínidos forman una serie de transición interna análoga a la serie de tierras raras de elementos lantánidos : comprenderían la segunda fila del bloque f (la serie 5f), en la que se formaron los lantánidos la serie 4f. Esto facilitó la identificación química de americio y curio, [90] y experimentos posteriores corroboraron la hipótesis de Seaborg; un estudio espectroscópico en el Laboratorio Nacional de Los Alamos realizado por un grupo dirigido por el físico estadounidense Edwin McMillan indicó que los orbitales 5f, en lugar de los orbitales 6d, de hecho se estaban llenando. Sin embargo, estos estudios no pudieron determinar de manera inequívoca el primer elemento con electrones 5f y, por lo tanto, el primer elemento de la serie de actínidos; lo tanto, también se la conoció como la serie "tórida" o "uranida" hasta que más tarde se descubrió que la serie comenzaba con actinio. [89] [91]
A la luz de estas observaciones y una aparente explicación de la química de los elementos transuránicos, ya pesar del temor entre sus colegas de que fuera una idea radical que arruinaría su reputación, Seaborg la envió a Chemical & Engineering News y obtuvo una amplia aceptación; así, las nuevas tablas periódicas colocaron los actínidos debajo de los lantánidos. [90] Tras su aceptación, el concepto de actínidos resultó fundamental en el trabajo preliminar para los descubrimientos de elementos más pesados, como el berkelio en 1949. [92] También apoyó los resultados experimentales de una tendencia hacia los estados de oxidación +3 en los elementos más allá del americio, una tendencia observada en la serie análoga 4f. [89]
Efectos relativistas y expansiones más allá del período 7
Las elaboraciones posteriores de Seaborg del concepto de actínidos teorizaron una serie de elementos superpesados en una serie de transactínidos que comprende elementos de 104 a 121 y una serie de elementos de superactínidos de 122 a 153. Propuso una tabla periódica ampliada con un período adicional de 50 elementos (alcanzando así el elemento 168); este octavo período se derivó de una extrapolación del principio de Aufbau y elementos colocados 121 hasta 138 en un bloque g, en el que se llenaría una nueva subcapa g. [93] El modelo de Seaborg, sin embargo, no tuvo en cuenta los efectos relativistas resultantes del alto número atómico y la velocidad orbital de los electrones. Burkhard Fricke en 1971 [94] y Pekka Pyykkö en 2010 [95] utilizaron modelos informáticos para calcular las posiciones de los elementos hasta Z = 172, y encontró que las posiciones de varios elementos eran diferentes de las predichas por Seaborg. Aunque los modelos de Pyykkö y Fricke generalmente colocan elementos 172 como el siguiente gas noble, no existe un consenso claro sobre las configuraciones electrónicas de los elementos más allá de 120 y, por lo tanto, su ubicación en una tabla periódica extendida. Ahora se piensa que debido a los efectos relativistas, tal extensión contará con elementos que rompen la periodicidad en elementos conocidos, planteando así otro obstáculo para las futuras construcciones de la tabla periódica. [95]
El descubrimiento de tennessine en 2010 llenó el último vacío restante en el séptimo período. Por lo tanto, cualquier elemento recién descubierto se colocará en un octavo período.
A pesar de la finalización del séptimo período, se ha demostrado que la química experimental de algunos transactínidos es incompatible con la ley periódica. En la década de 1990, Ken Czerwinski de la Universidad de California, Berkeley observó similitudes entre el rutherfordio y el plutonio y entre el dubnio y el protactinio, en lugar de una clara continuación de la periodicidad en grupos. 4 y 5. Experimentos más recientes sobre copernicio y flerovio han arrojado resultados inconsistentes, algunos de los cuales sugieren que estos elementos se comportan más como el gas noble radón que como mercurio y plomo, sus respectivos congéneres . Como tal, la química de muchos elementos superpesados aún no se ha caracterizado bien, y no está claro si la ley periódica todavía se puede utilizar para extrapolar las propiedades de elementos no descubiertos. [1]
Efectos de caparazón, la isla de la estabilidad y la búsqueda del final de la tabla periódica
Ver también
- Alternative periodic tables
- History of chemistry
- Periodic systems of small molecules
- The Mystery of Matter: Search for the Elements (PBS film)
- Timeline of chemical element discoveries
|}
Notas
- ↑ a b Roberts, Siobhan (27 August 2019). «Is It Time to Upend the Periodic Table? - The iconic chart of elements has served chemistry well for 150 years. But it's not the only option out there, and scientists are pushing its limits.». Consultado el 27 August 2019.
- ↑ a b Scerri, E. R. (2006). The Periodic Table: Its Story ad Its Significance; New York City, New York; Oxford University Press.
- ↑ Weeks, Mary (1956). Discovery of the Elements (6th edición). Easton, Pennsylvania, USA: Journal of Chemical Education. p. 122.
- ↑ «Robert Boyle». Encyclopædia Britannica. Consultado el 24 February 2016.
- ↑ Boyle, Robert (1661). The Skeptical Chymist. London, England: J. Crooke. p. 16.
- ↑ Lavoisier with Robert Kerr, trans. (1790) Elements of Chemistry. Edinburgh, Scotland: William Creech. From p. xxiv: "I shall therefore only add upon this subject, that if, by the term elements, we mean to express those simple and indivisible atoms of which matter is composed, it is extremely probable we know nothing at all about them; but, if we apply the term elements, or principles of bodies, to express our idea of the last point which analysis is capable of reaching, we must admit, as elements, all substances into which we are capable, by any means, to reduce bodies by decomposition. Not that we are entitled to affirm, that these substances we consider as simple may not be compounded of two, or even of a greater number of principles; but, since these principles cannot be separated, or rather since we have not hitherto discovered means of separating them, they act with regard to us as simple substances, and we ought never to suppose them compounded until experiment and observation has proved them to be so."
- ↑ Prout, William (November 1815). «On the relation between the specific gravities of bodies in their gaseous state and the weights of their atoms». Annals of Philosophy 6: 321-330.
- ↑ Prout, William (February 1816). «Correction of a mistake in the essay on the relation between the specific gravities of bodies in their gaseous state and the weights of their atoms». Annals of Philosophy 7: 111-113.
- ↑ Wurzer, Ferdinand (1817). «Auszug eines Briefes vom Hofrath Wurzer, Prof. der Chemie zu Marburg» [Excerpt of a letter from Court Advisor Wurzer, Professor of Chemistry at Marburg]. Annalen der Physik (en alemán) 56 (7): 331-334. Bibcode:1817AnP....56..331.. doi:10.1002/andp.18170560709. Here, Döbereiner found that strontium's properties were intermediate to those of calcium and barium.
- ↑ Döbereiner, J. W. (1829). «Versuch zu einer Gruppirung der elementaren Stoffe nach ihrer Analogie» [An attempt to group elementary substances according to their analogies]. Annalen der Physik und Chemie. 2nd series (en alemán) 15 (2): 301-307. Bibcode:1829AnP....91..301D. doi:10.1002/andp.18290910217. For an English translation of this article, see: Johann Wolfgang Döbereiner: "An Attempt to Group Elementary Substances according to Their Analogies" (Lemoyne College (Syracuse, New York, USA))
- ↑ a b c «Development of the periodic table». www.rsc.org. Consultado el 12 de julio de 2019.
- ↑ Béguyer de Chancourtois (1862). «Tableau du classement naturel des corps simples, dit vis tellurique» [Table of the natural classification of elements, called the "telluric helix"]. Comptes rendus de l'Académie des Sciences (en francés) 55: 600-601.
- ↑ Chancourtois, Alexandre-Émile Béguyer de (1863). Vis tellurique. Classement des corps simples ou radicaux, obtenu au moyen d'un système de classification hélicoïdal et numérique (en francés). Paris, France: Mallet-Bachelier. 21 pages.
- ↑ See:
- ↑ in a letter published in Chemistry News in February 1863, according to the Notable Names Data Base
- ↑ «An Unsystematic Foreshadowing: J. A. R. Newlands». web.lemoyne.edu. Consultado el 13 de julio de 2019.
- ↑ a b Shaviv, Giora (2012). The Synthesis of the Elements. Berlin, Germany: Springer-Verlag. p. 38. ISBN 9783642283857. From p. 38: "The reason [for rejecting Newlands's paper, which was] given by Odling, then the president of the Chemical Society, was that they made a rule not to publish theoretical papers, and this on the quite astonishing grounds that such papers lead to a correspondence of controversial character."
- ↑ See:
- ↑ Meyer, Julius Lothar; Die modernen Theorien der Chemie (1864); table on page 137.
- ↑ Physical Science, Holt Rinehart & Winston (January 2004), page 302 ISBN 0-03-073168-2
- ↑ a b Ghosh, Abhik; Kiparsky, Paul (2019). «The Grammar of the Elements». American Scientist 107 (6): 350. ISSN 0003-0996. doi:10.1511/2019.107.6.350.
- ↑ Mendeleev, Dmitri (1869). «Versuche eines Systems der Elemente nach ihren Atomgewichten und chemischen Functionen» [System of Elements according to their Atomic Weights and Chemical Functions]. Journal für Praktische Chemie 106: 251.
- ↑ Менделеев, Д. (1869). «Соотношение свойств с атомным весом элементов» [Relationship of properties of the elements to their atomic weights]. Журнал Русского Химического Общества (Journal of the Russian Chemical Society) (en ruso) 1: 60-77.
- ↑ Mendeleev, Dmitri (1869). «Ueber die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente» [On the relations of properties of the elements to their atomic weights]. Zeitschrift für Chemie 12: 405-406.
- ↑ Petrov, 1981, p. 65.
- ↑ Mendeleev, 1870, p. 76.
- ↑ Mendeleev, 1871, p. 111.
- ↑ Scerri, 2019, p. 142.
- ↑ Mendeleev, 1870, pp. 90–98.
- ↑ Mendeleev, 1870, pp. 98–101.
- ↑ Thyssen y Binnemans, 2015, p. 159.
- ↑ Thyssen y Binnemans, 2015, pp. 174–175.
- ↑ Cheisson, T.; Schelter, E. J. (2019). «Rare earth elements: Mendeleev's bane, modern marvels». Science 363 (6426): 489-493. Bibcode:2019Sci...363..489C. PMID 30705185. doi:10.1126/science.aau7628.
- ↑ Thyssen y Binnemans, 2015, p. 177.
- ↑ Thyssen y Binnemans, 2015, pp. 179–181.
- ↑ a b c Scerri, E.R. (2008). «The past and future of the periodic table». American Scientist 96 (1): 52-58. doi:10.1511/2008.69.52.
- ↑ a b Gordin, 2012, pp. 75–76.
- ↑ Gordin, 2012, p. 76.
- ↑ Gordin, 2012, pp. 71–74.
- ↑ a b Gordin, 2012, p. 75.
- ↑ Scerri, Eric R. (1998). «The Evolution of the Periodic System». Scientific American 279 (3): 78-83. Bibcode:1998SciAm.279c..78S. ISSN 0036-8733. doi:10.1038/scientificamerican0998-78.
- ↑ a b Scerri, 2019, pp. 170–172.
- ↑ Scerri, 2019, pp. 147–149.
- ↑ a b c d Scerri, 2019, p. 156.
- ↑ Scerri, 2019, p. 157.
- ↑ Rouvray, R. «Dmitri Mendeleev». New Scientist (en inglés estadounidense). Consultado el 19 de abril de 2020.
- ↑ Wisniak, J. (2007). «The composition of air: Discovery of argon». Educación Química 18 (1): 69-84. doi:10.22201/fq.18708404e.2007.1.65979.
- ↑ Assovskaya, A. S. (1984). «Первый век гелия» [The first century of helium]. Гелий на Земле и во Вселенной [Helium on Earth and in the Universe] (en ruso). Leningrad: Nedra.
- ↑ Lente, Gábor (2019). «Where Mendeleev was wrong: predicted elements that have never been found». ChemTexts (en inglés) 5 (3): 17. ISSN 2199-3793. doi:10.1007/s40828-019-0092-5.
- ↑ Petrov, 1981, pp. 38-44.
- ↑ a b Petrov, 1981, pp. 58-59.
- ↑ Petrov, 1981, pp. 59-61.
- ↑ Petrov, 1981, pp. 54-55.
- ↑ Sears, W. M., Jr. (2015). Helium: The Disappearing Element (en inglés). Springer. pp. 50-52. ISBN 978-3-319-15123-6.
- ↑ Petrov, 1981, pp. 63-64.
- ↑ a b Stewart, P. J. (2007). «A century on from Dmitrii Mendeleev: Tables and spirals, noble gases, and Nobel prizes». Foundations of Chemistry 9 (3): 235-245. doi:10.1007/s10698-007-9038-x.
- ↑ a b Petrov, 1981, pp. 64-65.
- ↑ Crookes, W. (1898). «On the position of helium, argon, and krypton in the scheme of elements». Proceedings of the Royal Society of London (en inglés) 63 (389–400): 408-411. ISSN 0370-1662. doi:10.1098/rspl.1898.0052.
- ↑ Petrov, 1981, pp. 64-66.
- ↑ a b c Trifonov, D. N. «Сорок лет химии благородных газов» [Forty years of noble gas chemistry] (en ruso). Moscow State University. Consultado el 12 de abril de 2020.
- ↑ Mendeleev, D. (1903). Popytka khimicheskogo ponimaniia mirovogo efira (en ruso). St. Petersburg.
An English translation appeared as
Mendeléeff, D. (1904). G. Kamensky (translator), ed. An Attempt Towards A Chemical Conception Of The Ether. Longmans, Green & Co. - ↑ Cotton, S. (2006). «Introduction to the lanthanides». Lanthanide and Actinide Chemistry. John Wiley & Sons, Ltd. pp. 1-7. ISBN 978-0-470-01005-1.
- ↑ a b Stewart, P.J. (2019). «Mendeleev's predictions: success and failure». Foundations of Chemistry 21 (1): 3-9. doi:10.1007/s10698-018-9312-0.
- ↑ Michelson, Albert A.; Morley, Edward W. (1887). «On the Relative Motion of the Earth and the Luminiferous Ether». American Journal of Science 34 (203): 333-345. Bibcode:1887AmJS...34..333M. doi:10.2475/ajs.s3-34.203.333.
- ↑ Trifonov, D. N. «Д.И. Менделеев. Нетрадиционный взгляд (II)» [D.I. Mendeleev. An unconventional view (II)] (en ruso). Moscow State University. Consultado el 12 de abril de 2020.
- ↑ Howorth, Muriel (1958), The Life of Frederick Soddy (London: New World)
- ↑ Soddy, Frederick (1913), ‘Intra-Atomic Charge’, Nature, 92, 399–400
- ↑ Soddy, Frederick (1913). «Radioactivity». Annual Reports on the Progress of Chemistry 10: 262-288. doi:10.1039/ar9131000262.
- ↑ Soddy, Frederick (28 February 1913). «The radio-elements and the periodic law». The Chemical News 107 (2779): 97-99.
- ↑ Soddy first used the word "isotope" in: Soddy, Frederick (4 December 1913). «Intra-atomic charge». Nature 92 (2301): 399-400. Bibcode:1913Natur..92..399S. doi:10.1038/092399c0. See p. 400.
- ↑ Rutherford, Ernest; Nuttal, John Mitchell (1913). «Scattering of α-Particles by Gases». Philosophical Magazine. Series 6 26 (154): 702-712. doi:10.1080/14786441308635014.
- ↑ Moseley, H.G.J. (1914). «The high-frequency spectra of the elements». Philosophical Magazine. 6th series 27: 703-713. doi:10.1080/14786440408635141.
- ↑ J.R. Rydberg, Den Kungliga Svenska Vetenskapsakadem- iens Handlingar 23 (11) (1889).
- ↑ See Octet Rule
- ↑ Lewis, Gilbert N. (1916). «The atom and the molecule». Journal of the American Chemical Society 38 (4): 762-785. doi:10.1021/ja02261a002.
- ↑ Langmuir, Irving (1919). «The structure of atoms and the octet theory of valence». Proceedings of the National Academy of Sciences of the United States of America 5 (7): 252-259. Bibcode:1919PNAS....5..252L. PMC 1091587. PMID 16576386. doi:10.1073/pnas.5.7.252.
- ↑ Langmuir, Irving (1919). «The arrangement of electrons in atoms and molecules». Journal of the American Chemical Society 41 (6): 868-934. doi:10.1021/ja02227a002.
- ↑ I. Langmuir, "The Arrangement of Electrons in Atoms and Molecules", J. Am. Chem. Soc., 41 (1919), p.868-934.
- ↑ C.R. Bury, “Langmuir’s Theory on the Arrangement of Electrons in Atoms and Molecules, J. Am. Chem. Soc., 43 (1921), 1602-1609.
- ↑ Jensen, William B. (2003). «The Place of Zinc, Cadmium, and Mercury in the Periodic Table». Journal of Chemical Education 80 (8): 952-961. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. «The first use of the term “transition” in its modern electronic sense appears to be due to the British chemist C. R.Bury, who first used the term in his 1921 paper on the electronic structure of atoms and the periodic table».
- ↑ Hettema, H.; Kuipers, T.A.F. (1998). «The periodic table — its formalization, status, and relation to atomic theory». Erkenntnis 28 (3): 387-408. doi:10.1007/BF00184902.
- ↑ a b Scerri, E.R. (1998). «The Evolution of the Periodic System». Scientific American 279 (3): 78-83. Bibcode:1998SciAm.279c..78S. doi:10.1038/scientificamerican0998-78.
- ↑ Pais, Abraham (1991), Niels Bohr’s Times, in Physics, Philosophy, and Polity (Oxford: Clarendon Press), p. 205.
- ↑ Walther Kossel Bemerkung zum Seriencharakter der Röntgenstrahlen, Verh. D. Deutsch. Phys Ges (2) 18 339-359 (1916). Received 31 August 1916, published in issue No. 15-18 of 30 September 1916. As cited in Mehra, Volume 5, Part 2, 2001, p. 919.
- ↑ Walther Kossel, "Uber Molkulbildung als Frage der Atombau", Ann. Phys., 1916, 49:229-362.
- ↑ Pauli admitted in his paper, "On the Connection between the Closing of Electron Groups in Atoms and the Complex Structure of Spectra", published on 21 March 1925 in Zeitschrift für Physik: "We cannot give a more precise reason for this rule." Pais, Abraham (2000), The Genius of Science: A portrait gallery of twentieth-century physicists (New York: Oxford University Press), p. 223.
- ↑ Jensen, William B. (2003). «The Place of Zinc, Cadmium, and Mercury in the Periodic Table». Journal of Chemical Education 80 (8): 952-961. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952.
- ↑ Unión Internacional de Química Pura y Aplicada. «chemical element». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ a b c d Seaborg, G. (1994). «Origin of the Actinide Concept». Lanthanides/Actinides: Chemistry. Handbook on the Physics and Chemistry of Rare Earths 18 (1 edición). ISBN 9780444536648. LBL-31179.
- ↑ a b c Clark, D.L.; Hobart, D.E. (2000). «Reflections on the Legacy of a Legend: Glenn T. Seaborg, 1912–1999». Los Alamos Science 26: 56-61.
- ↑ . NATO Advanced Study Institute on "Actinides and the Environment". 1996.
- ↑ Trabesinger, A. (2017). «Peaceful berkelium». Nature Chemistry 9 (9): 924. Bibcode:2017NatCh...9..924T. PMID 28837169. doi:10.1038/nchem.2845.
- ↑ Hoffman, D.C; Ghiorso, A.; Seaborg, G.T. (2000). The Transuranium People: The Inside Story. Imperial College Press. pp. 435-436. ISBN 978-1-86094-087-3.
- ↑ Fricke, B.; Greiner, W.; Waber, J. T. (1971). «The continuation of the periodic table up to Z = 172. The chemistry of superheavy elements». Theoretica Chimica Acta 21 (3): 235-260. doi:10.1007/BF01172015.
- ↑ a b Pyykkö, Pekka (2011). «A suggested periodic table up to Z≤ 172, based on Dirac–Fock calculations on atoms and ions». Physical Chemistry Chemical Physics 13 (1): 161-8. Bibcode:2011PCCP...13..161P. PMID 20967377. doi:10.1039/c0cp01575j.
Referencias
Fuentes
Otras lecturas
enlaces externos
- Desarrollo de la tabla periódica (parte de una colección de páginas que explora la tabla periódica y los elementos) por la Royal Society of Chemistry
- La página web del Dr. Eric Scerri, que contiene entrevistas, conferencias y artículos sobre varios aspectos del sistema periódico, incluida la historia de la tabla periódica.
- La base de datos de Internet de tablas periódicas : una gran colección de tablas periódicas y formulaciones de sistemas periódicos.
- Historia de la tabla periódica de elementos de Mendeleev como visualización de datos en Stack Exchange
[[Categoría:Tabla periódica]] [[Categoría:Historia de la física]] [[Categoría:Historia de la química]]






![[en→es]Fragment of a periodic table published by Ramsay in 1896](/upwiki/wikipedia/commons/thumb/8/8f/Ramsay_1896_fragment.png/200px-Ramsay_1896_fragment.png)
![[en→es]Fragment of a periodic table published by Ramsay in 1900](/upwiki/wikipedia/commons/thumb/0/04/Ramsay_1900_fragment.png/200px-Ramsay_1900_fragment.png)
![[en→es]Periodic table as published by Errera in 1900](/upwiki/wikipedia/commons/thumb/d/dc/Errera_1900.png/193px-Errera_1900.png)
![[en→es]Mendeleev's 1904 table. It includes the noble gases in group 0, and it has two reserved gaps for coronium and ether.](/upwiki/wikipedia/commons/thumb/2/22/Mendeleev_1904_Periodic_Table.png/198px-Mendeleev_1904_Periodic_Table.png)
![[en→es]Werner's 32-column 1905 table. This table left spaces for many then-unknown elements, and several elements had their positions revised following advances in atomic theory.](/upwiki/wikipedia/commons/thumb/a/a0/Taula_peri%C3%B2dica_de_Werner_%281905%29.gif/200px-Taula_peri%C3%B2dica_de_Werner_%281905%29.gif)