Diferencia entre revisiones de «Virus»
m Revertidos los cambios de 189.177.148.90 (disc.) a la última edición de Diegusjaimes |
|||
| Línea 616: | Línea 616: | ||
{{Cita publicación |
{{Cita publicación |
||
| autor=Gao, F., Bailes, E., Robertson, D. L., Chen, Y., Rodenburg, C. M., Michael, S. F., Cummins, L. B., Arthur, L. O., Peeters, M., Shaw, G. M., Sharp, P. M. and Hahn, B. H. |
| autor=Gao, F., Bailes, E., Robertson, D. L., Chen, Y., Rodenburg, C. M., Michael, S. F., Cummins, L. B., Arthur, L. O., Peeters, M., Shaw, G. M., Sharp, P. M. and Hahn, B. H. |
||
| título=Origin |
| título=Origin of HIV-1 in the Chimpanzee Pan troglodytes troglodytes |
||
| revista=Nature |
|||
| año=1999 |
|||
| páginas=436–441 |
|||
| volumen=397 |
|||
| número=6718 |
|||
| pmid=9989410 {{doi|10.1038/17130}} |
|||
| doi=10.1038/17130 |
|||
}}</ref> El VIH es ahora una pandemia, con una cifra estimada de 38,6 millones de personas infectadas actualmente por la enfermedad en todo el mundo.<ref name=UNAIDS2006>{{cita libro |
}}</ref> El VIH es ahora una pandemia, con una cifra estimada de 38,6 millones de personas infectadas actualmente por la enfermedad en todo el mundo.<ref name=UNAIDS2006>{{cita libro |
||
| autor=[[UNAIDS]] |
| autor=[[UNAIDS]] |
||
| año= 2006 |
| año= 2006 |
||
| título= 2006 Report on the global AIDS epidemic |
| título= 2006 Report on the global AIDS epidemic |
||
| capítulo= Overview of the global AIDS |
| capítulo= Overview of the global AIDS epidemic |
||
| urlcapítulo = http://data.unaids.org/pub/GlobalReport/2006/2006_GR_CH02_en.pdf |
|||
| fechaacceso= 2006-06-08 |
|||
| formato= PDF |
|||
}}</ref> El [[Programa Conjunto de las Naciones Unidas sobre el VIH/SIDA]] (ONUSIDA) y la [[Organización Mundial de la Salud]] (OMS) estiman que el SIDA ha matado a más de 25 millones de personas desde que se reconoció por primera vez el 5 de junio de 1981, convirtiéndose en una de las [[epidemia]]s más destructivas de la historia.<ref> Mawar N, Saha S, Pandit A, Mahajan U. |
|||
The third phase of HIV pandemic: social consequences of HIV/AIDS stigma & |
|||
discrimination & future needs.Indian J Med Res. 2005 Dec;122(6):471-84. Review.</ref> |
|||
==== Ébola ==== |
==== Ébola ==== |
||
Revisión del 03:52 27 ago 2009
| Virus | ||
|---|---|---|
|
Archivo:Herpes simpex virus.jpg | ||
| Taxonomía | ||
| Grupos | ||
Un virus (de la palabra latina virus, toxina o veneno) es una entidad biológica que para reproducirse necesita de una célula huésped. Cada partícula de virus o virión es un agente potencialmente patógeno compuesto por una cápside (o cápsida) de proteínas que envuelve al ácido nucléico, que puede ser ADN o ARN. La forma de la cápside puede ser sencilla, típicamente de tipo helicoidal o icosaédrica (poliédrica o casi esférica), o compuesta, típicamente comprendiendo una cabeza y una cola. Esta estructura puede, a su vez, estar rodeada por la envoltura vírica, una capa lipídica con diferentes proteínas, dependiendo del virus.
El ciclo vital de un virus siempre necesita de la maquinaria metabólica de la célula invadida para poder replicar su material genético, produciendo luego muchas copias del virus original. En dicho proceso reside la capacidad destructora de los virus, ya que pueden perjudicar a la célula hasta destruirla. Pueden infectar células eucariotas (plantas, animales, hongos o protistas) o procariotas (en cuyo caso se les llama bacteriófagos, o simplemente fagos). Algunos virus necesitan de enzimas poco usuales por lo que las cargan dentro de su envoltorio como parte de su equipaje.
Los biólogos debaten si los virus son o no organismos vivos. Algunos consideran que no están vivos, puesto que no cumplen los criterios de definición de vida. Por ejemplo, a diferencia de los organismos vivos (macroscópicos o microscópicos), los virus no tienen células. Sin embargo, sí tienen genes y evolucionan por selección natural. Otros biólogos los han descrito como organismos en el borde de la vida, en el límite entre la materia viva y la materia inerte.
Las infecciones virales en humanos y animales por lo general dan como resultado una respuesta inmune del organismo invadido y, a menudo, enfermedades o incluso la muerte. Entre los padecimientos se incluyen el resfriado común, la gripe, la varicela, el sarampión, la hepatitis B, la fiebre amarilla, la rabia, el SIDA, etc. Muchas veces, el virus es completamente eliminado por el sistema inmunológico. Los antibióticos, destinados a combatir a las bacterias, no tienen ningún efecto sobre los virus, pero se han desarrollado medicamentos antivirales para el tratamiento de las infecciones por virus. Las vacunas pueden prevenir las infecciones virales produciendo inmunidad durante tiempo prolongado.

Descubrimiento de los virus

Las enfermedades virales, como la rabia, la fiebre amarilla y la viruela, han afectado a los seres humanos desde hace muchos siglos. Se conocen jeroglíficos que describen la poliomielitis en la medicina del Antiguo Egipto,[1] aunque en ese entonces no se conocía todavía la causa de la enfermedad. En el siglo X, Al-Razi escribe el Tratado sobre la viruela y el sarampión, que ofrece la primera descripción clara de estas enfermedades.[2]
La naturaleza contagiosa de las enfermedades infecciosas (virales y bacterianas) es descrita por Avicena en la década de 1020, en su obra Canon de medicina. En ella describe la tuberculosis y las enfermedades de transmisión sexual y su propagación a través del contacto físico, agua y suelo.[3] Sostiene que las secreciones corporales se contaminan por "organismos extraños" que producen la infección[4] e introduce la práctica de la cuarentena como medio para limitar la propagación de las enfermedades contagiosas.[5] Cuando la Peste Negra (o peste bubónica) llega a Al-Ándalus en el siglo XIV, Ibn Khatima descubre que las enfermedades infecciosas son causadas por microorganismos que se introducen en el cuerpo humano. Otro médico andaluz del siglo XIV, Ibn al-Khatib (1313-1374), escribe el tratado titulado Sobre la peste, en el que afirma que las enfermedades infecciosas se pueden transmitir a través del contacto corporal y "por prendas de vestir, buques y pendientes."[4] Las causas etiológicas de la tuberculosis, de la peste bubónica y de algunas infecciones de transmisión sexual más tarde se identificaron como bacterias.
Las primeras vacunas para prevenir las enfermedades virales se descubren en el siglo XVIII. En 1717, Mary Montagu, la esposa de un embajador inglés en el Imperio otomano, observa que las mujeres locales tienen la costumbre de inocular a sus hijos con fluidos tomados de casos leves de viruela.[6] A finales del siglo XVIII, Edward Jenner observa y estudia a Miss Sarah Nelmes, una lechera que había sufrido la «viruela de vaca» y que como consecuencia era inmune a la viruela, un virus similar que afecta a las personas. Jenner desarrolla la vacuna contra la viruela sobre la base de estas conclusiones. Después de largas campañas de vacunación, la Organización Mundial de la Salud (OMS) certifica la erradicación de la viruela en 1979.

La primera referencia sobre la existencia de los virus se debe al botánico ruso Dimitri Ivanovski en 1892. Un poco antes, Charles Chamberland desarrolla un filtro de porcelana con poros lo suficientemente pequeños para retener a las bacterias y separarlas de su medio de cultivo.[7] Dimitri Ivanovski usa este filtro para identificar al agente causante de la enfermedad denominada mosaico del tabaco y llega a la conclusión de que debe tratarse de una toxina o de un organismo más pequeño que las bacterias, pues atraviesa los filtros que retienen a éstas. Al pasar extractos de hojas de plantas de tabaco infectadas a través del filtro y luego utilizar el extracto filtrado para infectar a otras plantas, demuestra que el agente infeccioso no es una bacteria. Experimentos similares son realizados por varios otros investigadores, con resultados similares y muestran que los virus son algunos órdenes de magnitud más pequeños que las bacterias.
El término virus fue acuñado por el microbiólogo holandés Martinus Beijerinck quien, utilizando métodos basados en el trabajo de Ivanovski, en 1897 desecha la idea de las toxinas. Comprueba que el agente causante de la enfermedad del mosaico del tabaco es capaz de reproducirse, ya que mantiene su poder infeccioso sin diluirse al pasar de unas plantas a otras, y acuña la frase latina "contagium vivum fluidum" (que significa "germen soluble de vida"), la primera aproximación al concepto de virus.[8] Poco después, los microbiólogos alemanes Frederick Loeffler y Paul Frosch descubren que la fiebre aftosa del ganado es también producida por un virus filtrable que actúa como agente infeccioso. El primer virus humano identificado fue el virus de la fiebre amarilla.

A principios del siglo XX, Frederick Twort descubre que también las bacterias pueden ser infectadas por virus.[9] Félix d'Herelle, que trabajaba independientemente, muestra que un preparado viral origina áreas muertas en cultivos celulares realizados sobre agar. Contando los áreas muertas, pudo estimar el número original de virus en la suspensión. En la década de los 30, con el uso de filtros de tamaño de poro inferior, con las técnicas de cultivo celular in vitro que permiten la obtención de gran cantidad de estos agentes, con la ultracentrifugación y finalmente con el microscopio electrónico y la difracción de rayos X, se logra por fin visualizar a los virus. En 1935, Wendell Stanley cristaliza el virus del mosaico del tabaco y descubre que está compuesto, en su mayor parte, de proteínas.[10] Poco tiempo después, el virus fue separado en proteínas y ácidos nucleicos.[11][12] En 1939, Max Delbrück y El Ellis demostraron que, en contraste con los organismos celulares, los bacteriófagos se reproducen en "un paso", en lugar de exponencialmente.[13]
Un problema importante para los primeros virólogos fue la incapacidad de cultivar virus en medios de cultivo estériles, tal como se hace con los microorganismos celulares. Esta limitación requiere que los virólogos médicos infecten animales vivos, lo cual es peligroso. El primer avance se produce en 1931, cuando William Ernest Goodpasture demuestra el crecimiento de la gripe y de otros virus en huevos de gallina fertilizados.[14] Sin embargo, algunos virus no crecen en huevos y era necesaria una mayor flexibilidad técnica para el cultivo de los virus. La solución llega en 1949 cuando John Franklin Enders, Thomas H. Weller y Frederick Chapman Robbins desarrollan conjuntamente una técnica para reproducir el virus de la polio en cultivos de células vivas de animales.[15] Sus métodos se han extendido y se aplican al crecimiento de virus y de otros agentes infecciosos que no crecen en medios de cultivo estéril.
Características de los virus
Ninguno de los virus posee orgánulos y, sobre todo, ninguno tiene autonomía metabólica, por lo que no son considerados células. Su ciclo biológico tiene dos fases: una extracelular, que es metabólicamente inerte, y otra intracelular, que es reproductiva. Se pueden agrupar las características definitorias de los virus en torno a tres cuestiones: su tamaño, el hecho de que sean cristalizables y el hecho de que sean parásitos intracelulares o microcelulares obligados. Estas tres cuestiones colocan a los virus en la frontera entre lo vivo y lo inerte.

Tamaño
Los virus son estructuras extraordinariamente pequeñas. Su tamaño oscila entre los 24 nm del virus de la fiebre aftosa a los 300 nm de los poxvirus. Algunos filovirus tienen una longitud total de hasta 1400 nm; sin embargo, el diámetro de su cápside es de sólo alrededor de 80 nm. La mayor parte de los virus no puede verse con el microscopio óptico, pero algunos son tan grandes o mayores que las bacterias más pequeñas y pueden verse bajo magnificación óptica alta.
Más comúnmente, se utilizan microscopios electrónicos tanto de barrido como de transmisión para visualizar las partículas de virus. Para aumentar el contraste entre los virus y el fondo, se utilizan tintes de alto contraste a los electrones. Se trata de soluciones de sales de metales pesados, como el tungsteno, que dispersan los electrones de las regiones cubiertas por el tinte. Cuando las partículas del virus están recubiertas por el tinte (tinción positiva), los finos detalles quedan oscurecidos. La tinción negativa resuelve este problema entintando únicamente el fondo.[16]
Cristalizables
Los virus son cristalizables, como demostró W. Stanley en 1935. Esto depende del hecho de que las partículas víricas tienen formas geométricas precisas y son idénticas entre sí, lo cual las separa de la irregularidad característica de los organismos, las células o los orgánulos, y las acerca a las características de los minerales y de agregados de macromoléculas como los ribosomas. Al tener un volumen y forma idénticos, las partículas víricas tienden a ordenarse en una pauta tridimensional regular, periódica, es decir, tienden a cristalizar.
Parásitos intracelulares obligados

Los virus son parásitos intracelulares obligados. Desde los años treinta se sabe que los virus se componen principalmente de ácido nucleico y proteínas, estas últimas forman la cápside, que se conoce también como envoltura proteica. Esto quiere decir que necesitan un huésped (hospedante), ya que en vida libre no sobreviven. Se sabe que algunos virus pueden vivir alrededor de unos cuarenta días sin que tengan algún hospedante en el cual reproducirse.
También se han encontrado virus que presentan lípidos, aunque éstos son tomados de la célula que infectan. Hasta ahora todos los virus que se conocen presentan un solo tipo de ácido nucleico (ya sea ADN o ARN, pero no los dos), el cual puede ser de una o de dos cadenas y puede ser segmentado. Para que el ácido nucleico del virus pueda replicarse, necesita utilizar la maquinaria enzimática y estructural de una célula viva y, por otra parte, solamente dentro de una célula viva tienen los virus las funciones de autoconservación que, junto con la reproducción, caracterizan a los seres vivos. Esta condición es la causa de que muchísimos virus se consideren gérmenes patógenos que producen enfermedades en plantas y animales, e incluso en las bacterias.
Estructura de los virus
Una partícula de virus, conocida como virión, está compuesta de una molécula de ácido nucleico (ADN o ARN) y una envoltura proteínica. Ésta es la estructura básica de un virus, aunque algunos de ellos pueden añadir a esto la presencia de alguna enzima, bien junto al ácido nucleico, como la transcriptasa inversa de los retrovirus, bien en la envoltura, para facilitar la apertura de una brecha en la membrana de la célula hospedadora.
La envoltura proteínica recibe el nombre de cápside. Está formada por unas subunidades idénticas denominadas capsómeros. Los capsómeros son proteínas globulares que en ocasiones tienen una parte glicídica unida. Son codificadas por el genoma viral y su forma sirve de base para la distinción morfológica y antigénica.[17][18] Se autoensamblan entre sí, por lo general requiriendo la presencia del genoma del virus, dando a la cubierta una forma geométrica. Sin embargo, los virus complejos codifican proteínas que contribuyen a la construcción de la cápside.[19] Los capsómeros, a su vez, están compuestos de unidades denominadas protómeros. Las proteínas estructuralmente asociadas con el ácido nucleico se denominan nucleoproteínas, mientras que la asociación de las proteínas de la cápside viral con el ácido nucleico se denomina nucleocápside.
Atendiendo la forma de la cápsida, se pueden distinguir los siguientes tres tipos básicos de virus:
| Virus cilíndricos o helicoidales | |
 |
En los virus cilíndricos o helicoidales, los capsómeros, que son de un solo tipo, se ajustan en una estructura helicoidal en torno a un eje central donde se encuentra una hélice simple de ácido nucleico. Esta estructura se traduce en un virión con forma de varilla o filamentoso con una gran diversidad, desde los muy cortos y rígidos hasta los muy largos y flexibles.
El material genético, generalmente ARN monocatenario y con menos frecuencia ADN monocatenario, está rodeado por la hélice de proteínas a la que se une por la interacción entre la carga negativa del ácido nucleico y la positiva de la proteína. En general, la longitud de la cápside helicoidal está relacionada con la longitud del ácido nucleico contenido en ella, y el diámetro depende del tamaño y disposición de los capsómeros. Un ejemplo bien estudiado lo constituye el virus del mosaico del tabaco. |
| Virus icosaédricos | |
 |
En los virus icosaédricos, los capsómeros se ajustan formando un icosaedro regular (es decir, 20 caras triangulares y 12 vértices), y dejando un hueco central donde se sitúa el ácido nucleico fuertemente apelotonado. Algunos forman poliedros con más caras que el icosaedro, y algunos presentan fibras proteicas que sobresalen de la cápside. El icosaedro es la estructura cuasiesférica más eficiente y robusta que se puede construir a partir del ensamblado de varias piezas. Esta estructura se traduce en una apariencia esférica de los virus cuando se observan al microscopio.
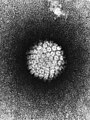
Los capsómeros pueden ser pentagonales o hexagonales, y se construyen con varios protómeros. Éstos se asocian a través de una unión no covalente para encerrar el ácido nucleico, aunque por lo general menos íntimamente que las cápsides helicoidales. El número de protómeros necesario para constituir la cápside se denota por el número T,[20] el cual indica que se precisan 60×T proteínas para formar la cápside. En el caso del Virus de la hepatitis B, T=4 y se requieren 240 proteínas para formar la cápside. Otros ejemplos de este tipo de virus lo constituyen los adenovirus, que incluyen virus que producen enfermedades respiratorias, faringitis, gastroenteritis, etc. |
| Virus complejos | |
 |
Los virus complejos, con pequeñas variantes, responden a la siguiente estructura general:
Como ejemplo de este tipo de virus podemos citar a la mayor parte de los virus bacteriófagos (que infectan bacterias). |
Envoltura lipoproteica

Muchos virus, exteriormente a la cápsida, presentan una envoltura de características similares a una membrana plasmática: doble capa fosfolipídica y proteínas, muchas de ellas glicoproteínas que proyectan salientes hacia el exterior llamados espículas. La cápsida de estos virus suele ser icosaédrica, aunque también los hay con cápsida helicoidal. Se interpreta que la envoltura lipoproteica es un resto de la membrana de la célula infectada donde se ha formado el virus, ya sea de la membrana citoplasmática que rodea la célula, o de las membranas internas como la membrana nuclear o el retículo endoplasmático. Esta membrana es integrada en el virus por las proteínas codificadas por el genoma viral, sin embargo los lípidos y carbohidratos en sí mismo no son codificados, sino que se obtienen de la célula huésped.

La envoltura viral puede dar al virión algunas ventajas, como por ejemplo, la protección contra ciertas enzimas y productos químicos. Puede incluir glicoproteínas que funcionan como moléculas receptoras, permitiendo que las células huéspedes la reconozcan y se unan a estos viriones, dando lugar a la posible adsorción del virion por parte de la célula. La mayoría de los virus con envoltura dependen de esta para su infectividad. Un ejemplo de este tipo de virus lo constituye el de la gripe.
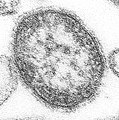
Algunos autores denominan virus complejos a virus con cubierta lipoproteica que presentan además varias moléculas de ácido nucleico en su interior y algunas enzimas, como es el caso del virus de la gripe. Otros como los poxvirus son virus grandes y complejos que tienen una inusual morfología. El genoma viral se asocia con las proteínas dentro de una estructura central de disco denominado nucleoide. El nucleoide está rodeado por una membrana y dos cuerpos laterales de función desconocida. El virus tiene una envoltura exterior con una gruesa capa de proteínas sobre su superficie. La partícula del virus es ligeramente pleomórfica, yendo desde ovoide a forma de ladrillo.[21]
Genoma
Los virus presentan una enorme variedad de estructuras genómicas y como grupo presentan más diversidad genómica estructural que el conjunto de los seres vivos.[22]
Ácido nucleico
El ácido nucleico es sólamente de un tipo, ADN o ARN. Hay unas pocas excepciones que tienen ambos, como los citomegalovirus que contienen un núcleo de ADN con varios segmentos ARNm.[19] Con bastante diferencia, la mayoría de los virus contienen ARN. Los virus que afectan a las plantas tienden a tener una cadena monocatenaria de ARN, mientras que los bacteriófagos suelen tener ADN bicatenario. Algunas especies de virus presentan nucleótidos anormales, como hidroximetilcitosina en lugar de citosina, como una parte normal de su genoma.[19]
Así podemos distinguir dos tipos de virus:
Tomando en consideración el tipo de cadena del ácido nucleico (doble o sencilla de sentido positivo o negativo) y la forma en que se replica el virus utilizando la célula huésped (retrotranscrito o no), los virus pueden subdividirse todavía más de acuerdo con la Clasificación de Baltimore.
Forma
Los genomas virales pueden ser circulares, como en los poliomavirus, o lineales, como en los adenovirus. El tipo de ácido nucleico es irrelevante para la forma del genoma. Entre los virus ARN, el genoma se suele dividir en varias partes separadas dentro del virión y se denominan segmentados. Los genomas ARN bicatenarios y algunos ARN monocatenarios son segmentados. Cada segmento a menudo codifica una proteína y por lo general se encuentran juntos en una cápside. No se requiere que cada segmento esté en el mismo virión para que el conjunto de virus sea infeccioso, como se demostró con el Virus del mosaico del Bromus.[19]
Cadena simple/doble
Un genoma viral, con independencia del tipo de ácido nucleico, puede ser monocatenario o bicatenario. Algunos virus, tales como los pertenecientes a Hepadnaviridae, contienen un genoma que es parcialmente bicatenario y monocatenario.[22] Los virus que infectan a los seres humanos incluyen ARN bicatenario (p.e. rotavirus), ARN monocatenario (p.e. virus de la gripe), ADN monocatenario (p.e. parvovirus B19) y ADN bicatenario (p.e. virus del herpes).
Sentido
Para los virus con ARN como ácido nucleico, las cadenas pueden ser de sentido positivo (+) o negativo (-), dependiendo de si es o no complementario al ARNm viral. EL ARN viral de sentido positivo es idéntico al ARNm viral y, por tanto, puede traducirse inmediatamente en la célula huésped. El ARN de sentido negativo es complementario del ARNm y, por tanto, se debe convertir en ARN de sentido positivo por una ARN polimerasa antes de la traducción. Para los virus con ADN la nomenclatura es similar, de forma que las cadenas que codifican el ARNm viral son complementarias a este (-) y las cadenas no codificadoras son una copia de este (+).
Tamaño del genoma
El tamaño del genoma en términos de la masa de nucleótidos varía entre especies. El genoma más pequeño tiene aproximadamente una masa de 106 umas y codifica sólo cuatro proteínas, mientras que el mayor tiene una masa sobre 108 umas y códifica para más de un centenar de proteínas.[19] Los virus ARN tienen por lo general genomas más pequeños que los virus de ADN debido a una mayor tasa de errores cuando se replican, lo que limita en la práctica su tamaño. Más allá de este límite, los errores de replicación hacen el virus inútil o poco competitivo. Para compensar esto, los virus ARN tienen a menudo genomas segmentados (dividido en segmentos), lo que reduce la probabilidad de error de cada molécula.[23] En contraste, los virus ADN suelen tener genomas más grandes debido a la alta fidelidad de las enzimas de replicación.[22]
Modificaciones genéticas
Los virus pueden experimentar cambios genéticos a través de tres mecanismos:
- El genoma puede sufrir deleciones, inserciones o cambios de nucleóticos en la secuencia de ARN o ADN. La mayoría de estas mutaciones puntuales son perjudiciales para al funcionamiento normal del virus, otras son silenciosas en el caso de que no cambien la proteína que codifica el gen, mientras que otras pueden conferir ventajas evolutivas, tales como la resistencia a los fármacos antivirales.[24] Se produce un cambio antigénico cuando hay un cambio importante en el genoma del virus.
- La recombinación genética es el proceso mediante el cual una cadena de ADN primero se divide y luego se une al extremo de otra molécula de ADN diferente. Esto puede ocurrir con los fragmentos o regiones de un mismo virus o cuando varios virus infectan simultáneamente a una única célula.[25] Estudios de evolución viral han mostrado que esto ha ocurrido frecuentemente en las especies estudiadas, tanto en virus ADN como ARN.[26][27]
- La redistribución de genes se produce en los virus con genoma segmentado. Diferentes cepas de un virus que infecten a la misma célula pueden mezclar y combinar sus segmentos dando lugar a virus completamente nuevos.[28] Esta es una razón por la que el virus de la gripe cambia constantemente,[29] dando lugar a una pandemia cada vez que se produce una redistribución.[30][31] La redistribución de genes también se puede producir entre las diferentes especies del virus de la gripe que afectan a cerdos, aves o seres humanos, por ejemplo.
Los virus ARN son mucho más propensos a mutar que los virus ADN, por las razones antes expuestas. Los virus a menudo existen como cuasiespecies o enjambres de virus de la misma especie pero con secuencias genómicas ligeramente diferentes. Tales cuasiespecies son el objetivo primario de la la selección natural.[32]
Ciclo reproductivo de los virus
Los virus tienen un objetivo básico: producir copias de sí mismos en gran cantidad sirviéndose de la maquinaria que tiene una célula viva para los procesos de transcripción, traducción y replicación. El ciclo reproductivo de los virus varía considerablemente entre las especies, pero siempre están presentes seis etapas básicas:

- Adsorción. Es la unión entre la cápside viral de proteínas y los receptores específicos en la superficie celular del huésped. La unión virus-célula es bastante específica y determina la gama de huéspedes de un virus. Este mecanismo ha evolucionado a favor de que los virus sólo infecten a células en los que sean capaces de reproducirse. Por ejemplo, el Virus de la inmunodeficiencia humana (VIH) presenta la proteína de superficie gp120 que puede interactuar con los receptores CD4 de los linfocitos T humanos.
- Penetración. La forma en la que el virus entra en la célula huésped varía dependiendo de la especie. La endocitosis es común en los virus con o sin envoltura; en este caso, la partícula del virus es rodeada por la membrana plasmática de la célula, se forma una invaginación y luego la vesícula se introduce en el citoplasma. Otro método que se presenta en los virus con envoltura se basa en la fusión de la membrana plasmática con la envoltura del virus. La penetración directa se observa sólo en los virus sin envoltura. Por último, algunos virus sin envoltura y los bacteriófagos son capaces de inyectar directamente el genoma en la célula huésped.
- Desnudamiento. Es el proceso por el cual el ácido nucleico del virus es liberado dentro de la célula. Puede ocurrir simultáneamente o poco después de la penetración. En este último caso, la cápside vírica es degradada por las enzimas del huésped (o algunas veces por las enzimas que trae consigo el virus).
- Multiplicación. Es la biosíntesis de los elementos necesarios para la formación de nuevos virus: ARNm, proteínas y ácidos nucleicos. Incluye la expresión genética (transcripción y traducción) y la replicación del genoma. La transcripción es la síntesis de ARN mensajero (ARNm) a partir del genoma del virus. La traducción es la síntesis, en los ribosomas del huésped, de las proteínas virales, tanto las que componen la cápsida como las proteínas enzimáticas. Durante la replicación se obtienen las copias del genoma viral. El proceso es muy variado y depende del tipo de virus (véase el apartado de Clasificación de Baltimore).
- Ensamblaje. En esta etapa se forma la cápside viral y se asocia con el genoma viral. Tras la formación de las partículas del virus, a menudo se realiza una modificación post-translacional de las proteínas virales. En los virus como el VIH, esta modificación (a veces llamada maduración), se produce después de que el virus haya sido liberado de la célula huésped.[33]
- Liberación. Los virus salen de la célula huésped por lisis o por gemación. Los virus sin envoltura se acumulan por algún tiempo en la célula hasta que ésta se rompe (lisis). Los virus con envoltura (por ejemplo, el VIH) suelen ser liberados por gemación, proceso durante el cual el virus adquiere su envoltura de fosfolípidos en la que se insertan las glicoproteínas virales.
Tipos de virus
En este apartado consideraremos tres grupos de virus según el tipo de células que infecten, y en cada grupo se citarán los ejemplos más destacados y sus otras características definitorias.
virus que afectan celulas animales:Hay también virus de células animales icosaédricos sin envoltura lipoproteica
- El virus de la polio humana tiene ARN monocatenario.
- La mayor parte de los reovirus (con ARN bicatenario) infectan células animales.
- Los virus que contienen ADN bicatenario suelen ser poco virulentos, como los adenovirus (causantes de enfermedades respiratorias) y los papilomavirus (de verrugas).
- Entre los virus con ARN monocatenario se pueden citar los de la rabia, el sarampión, la gripe y la rubéola.
- Los retrovirus contienen ARN monocatenario y la enzima transcriptasa inversa. Al infectar la célula, transcriben el ARN en una molécula de ADN bicatenario que se une al ADN celular. Pertenecen a este grupo el virus del SIDA y algunos virus oncogénicos.
- Entre los virus con ADN bicatenario se puede citar el grupo de los herpesvíridos como los del herpes, y de la hepatitis.
Virus que infectan bacterias:fueron descubiertos independientemente en 1915 y 1917 por Frederick Twort, bacteriólogo británico y Felix D'Herelle en Canadá. La mayoría son virus complejos y contienen ADN bicatenario; pertenecen al grupo de los Caudovirales. Hay también bacteriófagos que no responden al tipo común, como los Corticoviridae, icosaédricos, o los Leviviridae, con ARN monocatenario, o los bacteriófagos con envoltura lipoproteica.
Virus que infectan células vegetales:Son los primeros que se descubrieron (virus del mosaico del tabaco, Ivanovski, 1892). La mayor parte de ellos contienen ARN monocatenario y cápsida helicoidal, y carecen de envoltura lipoproteica. El virus del mosaico del tabaco es un ejemplo. Algunos reovirus (virus con ARN bicatenario, icosaédricos y sin envoltura lipoproteica) producen tumores en las heridas de las plantas. En este grupo hay también virus con ADN y cápsida icosaédrica, como el del estriado del maíz o el del mosaico de la coliflor.
Virus que infectan bacterias
Fueron descubiertos independientemente en 1915 y 1917 por Frederick Twort, bacteriólogo británico y Felix D'Herelle en Canadá. La mayoría son virus complejos y contienen ADN bicatenario; pertenecen al grupo de los Caudovirales. Hay también bacteriófagos que no responden al tipo común, como los Corticoviridae, icosaédricos, o los Leviviridae, con ARN monocatenario, o los bacteriófagos con envoltura lipoproteica.
Virus que infectan células vegetales
Son los primeros que se descubrieron (virus del mosaico del tabaco, Ivanovski, 1892). La mayor parte de ellos contienen ARN monocatenario y cápsida helicoidal, y carecen de envoltura lipoproteica. El virus del mosaico del tabaco es un ejemplo. Algunos reovirus (virus con ARN bicatenario, icosaédricos y sin envoltura lipoproteica) producen tumores en las heridas de las plantas. En este grupo hay también virus con ADN y cápsida icosaédrica, como el del estriado del maíz o el del mosaico de la coliflor.
Clasificación de los virus
Los virus se han venido clasificando atendiendo al tipo de ácido nucleico que contienen, a las características de la envoltura del virión, cuando existe, a la posición taxonómica de sus huéspedes, a la patología que producen, etc. Combinando caracteres como los enumerados, y por ese orden de importancia, se han reconocido varias decenas de grupos de virus internamente bien definidos.
Taxonómicamente, debido a la ausencia de registro fósil, a su falta de autonomía para el desarrollo y a su probable carácter polifilético, es muy difícil aplicarles de forma consistente los criterios de clasificación y nomenclatura que sirven tan bien para la clasificación de los organismos celulares, o verdaderos organismos.[34][35] Los virus no encajan fácilmente en cualquiera de los ámbitos de la clasificación biológica, y la clasificación comienza en el rango de familia u orden. No todas las familias son actualmente clasificadas en órdenes, ni todos los géneros son clasificados en familias. Sin embargo, se ha sugerido el nombre de dominio Acytota (acelular), lo que pondría a los virus a la par con los dominios de seres vivos: Bacteria, Archaea y Eukarya.
El esfuerzo por alcanzar una necesaria clasificación natural, ha producido distintos resultados, de los que consideramos aquí dos, la clasificación de Baltimore y la del International Committee for Taxonomy of Viruses (ICTV).
Clasificación de Baltimore

La clasificación de Baltimore[36][38][39] distribuye los virus en siete grupos fundamentales en función de la base química del genoma y en el mecanismo de producción de ARNm. Todos los virus deben generar cadenas positivas de ARN a partir de sus genomas para producir proteínas y replicarse a sí mismos, pero se utilizan distintos mecanismos en cada uno de los siete grupos:
- Grupo I: Virus ADN bicatenario (o Virus dsDNA).
- Los virus de ADN de cadena doble entran en la célula (independientemente del mecanismo de infección) y las ARN polimerasas no distinguen el genoma celular del genoma vírico, forman ARNm, que se traduce en los ribosomas y da lugar a las proteínas de la cápsida, y a veces a enzimas replicativos. Son los virus más simples y como ejemplo podemos citar a los fagos de la serie T par, que fueron los primeros que se descubrieron.
Síntesis de proteínas: dsDNA → mRNA → proteínas Replicación del genoma: dsDNA → dsDNA
- Grupo II: Virus ADN monocatenario (o Virus ssDNA).
- Su material genético es ADN de una cadena de carácter positivo. Ya que es de polaridad positiva, necesita una cadena negativa para poder transcribir; así, al entrar a la célula la ADN polimerasa (enzima de reparación o alargamiento) hace un ADN bicatenario que sirve para sintetizar (a partir de la hebra negativa) un ARNm que lleva la información necesaria para fabricar capsómeros y enzimas replicativos.
Síntesis de proteínas: ssDNA → dsDNA → mRNA → proteínas Replicación del genoma: ssDNA → dsDNA → ssDNA
- Grupo III: Virus ARN bicatenario (o Virus dsRNA).
- Los virus de ARN bicatenario llevan como parte del virión una transcriptasa viral que es una ARN polimerasa dependiente del ARN que utiliza para, a partir de la hebra negativa del ARN bicatenario, fabricar el ARNm. Además de ser una enzima es una proteína estructural, ya que forma parte de la cápsida, por ello sólo se replica si a la célula entra la cápsida junto al genoma vírico.
Síntesis de proteínas: dsRNA → mRNA → proteínas Replicación del genoma: dsRNA → (+)ssRNA → dsRNA
- Grupo IV: Virus ARN monocatenario positivo (o Virus (+)ssRNA).
- Son virus de ARN monocatenario cuyo genoma tiene naturaleza de ARNm. Son virus simples.
Síntesis de proteínas: (+)ssRNA (=mRNA) → proteínas Replicación del genoma: (+)ssRNA → (-)ssRNA → (+)ssRNA
- Grupo V: Virus ARN monocatenario negativo (o Virus (-)ssRNA).
- Son virus de ARN monocatenario con polaridad de antimensajero. Poseen una ARN polimerasa dependiente de ARN de una cadena. Así, dentro de la célula infectada forman el ARN complementario a su genoma y que actúa de ARNm.
Síntesis de proteínas: (-)ssRNA → mRNA → proteínas Replicación del genoma: (-)ssRNA → (+)ssRNA → (-)ssRNA
- Grupo VI: Virus ARN monocatenario retrotranscrito (o Virus ssRNA-RT).
- Son virus de ARN cuyo genoma podría actuar como mensajero pero “in vivo” no lo hace. Poseen una transcriptasa inversa que de un genoma ARN transcribe una molécula de ADN, primero de una cadena y luego de dos. Posteriormente y usando los enzimas celulares se elabora un mensajero. Estos virus son capaces de alcanzar el núcleo de las células e insertarse en los cromosomas de las células que infectan: son los retrovirus.
Síntesis de proteínas: (+)ssRNA → RNA/DNA → dsDNA → mRNA → proteínas Replicación del genoma: (+)ssRNA → RNA/DNA → dsDNA → (+)ssRNA
- Grupo VII: Virus ADN bicatenario retrotranscrito (o Virus dsDNA-RT).
- Es el grupo más recientemente descubierto y descrito. Tiene un genoma de ADN bicatenario que se expresa formando un mensajero, que se traduce como el grupo I. No obstante, en el momento de la encapsidación, es el mensajero el que se encapsida. Éste, por retrotranscripción a partir de una transcriptasa inversa, en el interior del virión, forma de nuevo una molécula de ADN, primero mono y después bicatenaria, que se convierte en el genoma del virus. Son ejemplos claros de estas rarezas, las familias Hepadnaviridae y Caulimoviridae.
Síntesis de proteínas: dsDNA → mRNA → proteínas Replicación del genoma: dsDNA → (+)ssRNA → RNA/DNA → dsDNA

Clasificación del ICTV
El ICTV (International Committee on Taxonomy of Viruses) intenta conseguir una clasificación universal que pueda funcionar como el necesario estándar de clasificación de los virus, regulando la descripción formal de las nuevas cepas y ordenando su ubicación dentro del esquema clasificatorio.[40] Intenta que las reglas de nomenclatura y clasificación se asemejen lo más posible al estándar tradicional de la clasificación de los organismos utilizando algunas de sus categorías, sufijos que indican el rango taxonómico y aplicando cursiva a los nombres de los taxones:
Los nombres de los taxones de categoría superior se escriben en cursiva, como en el Código Internacional de Nomenclatura Botánica (pero no en el Zoológico). Los nombres de especie siguen una regla sistemática, nombrándose en la lengua vernácula con el nombre de la enfermedad y la palabra que significa virus. Por ejemplo, virus de la inmunodeficiencia humana (VIH). El reconocimiento de órdenes se ha producido tardíamente y se usan con parsimonia, habiéndose designado hasta ahora sólo cinco, de manera que la mayoría de las 80 familias todavía no han sido adscritas a ninguno. La lista del ICTV contiene unos 5.000 tipos de virus, agrupados en unas 2.000 especies.[41][42][43]
Virus y vida
Los virus han sido descritos como "organismos en el borde de la vida".[34] En general, se considera que no están vivos, aunque no hay un acuerdo unánime. Los virus se asemejan a otros organismos en que poseen genes y pueden evolucionar por selección natural.[44][45] Se pueden reproducir mediante la creación de múltiples copias de sí mismos a través de autoensamblaje. Sin embargo, los virus no tienen una estructura celular, considerada generalmente como la unidad básica de la vida. Además, aunque se reproducen, no tienen metabolismo y requieren de una célula huésped para replicarse y sintetizar nuevos virus. Sin embargo, algunas especies bacterianas, como Rickettsia y Chlamydia, se consideran organismos vivos a pesar de que no son capaces de reproducirse fuera de una célula huésped.
Un posible criterio es considerar seres vivos a aquellos que usan la división celular para reproducirse, en comparación con los virus que se ensamblan espontáneamente. Esto establece la analogía entre el autoesamblado viral dentro de las células huésped y el crecimiento autónomo de los cristales. Sin embargo, el autoensambldo de los virus tiene implicaciones para el estudio del origen de la vida, ya que da credibilidad a la hipótesis de que la vida podría haber comenzado mediante el autoensamblado de las moléculas orgánicas.[46]
Si se considera que los virus están vivos, la cuestión se podría ampliar para discutir si las partículas infecciosas más pequeñas, como los viroides y priones, están vivas.
Origen de los virus
Los virus no fosilizan y además, por desgracia, la mayoría de los virus que han sido conservados y almacenados en los laboratorios cuentan con menos de 90 años de antigüedad.[47][48] Por tanto, para determinar el origen y evolución de los virus deben emplearse técnicas de biología molecular.[49] Estas técnicas se basan en el estudio de las secuencias de ARN y ADN, así como de las relaciones entre los virus y sus huéspedes a través del mecanismo de la coevolución. Hasta la fecha estos análisis no podido determinar cuál de las posibles hipótesis de origen es la correcta. Además, parece poco probable que todos los virus conocidos actualmente tengan un ancestro común, sino que más bien, probablemente distintas familias de virus hayan surgido independientemente a lo largo del tiempo por uno o más mecanismos.[50]
En primer lugar, la posición de los virus como frontera entre lo vivo y lo inerte plantea a los científicos dos posibles alternativas:
- Los virus serían los primeros seres, en la historia de la evolución de lo inerte a lo vivo, que lograron reunir con eficacia las funciones de replicación, transcripción y traducción. Serían, pues, los organismos menos evolucionados.[51]
- El hecho de que los virus solamente puedan realizar esas tres funciones vitales en el interior de células vivas, lleva a pensar que los virus no pudieron existir antes de que aparecieran las primeras células, por muy simples que éstas fueran.
La segunda de estas alternativas es actualmente la más aceptada. El descubrimiento de otras formas acelulares más sencillas (viroides, virus satélite, plásmidos, transposones, priones, etc) nos ayuda a comprender mejor la naturaleza y significado biológico de los virus, pero nos mantiene en la duda de su origen. Existen actualmente tres hipótesis principales que intentan explicar el origen de los virus:[47][48]
Hipótesis de coevolución
Los virus podrían haber surgido al mismo tiempo que aparecieron las primeras células sobre la tierra y derivarían de las primitivas moléculas de proteínas y ácidos nucleicos. La cápsida de los virus sería un logro evolutivo por el que el material genético se vería protegido en su desplazamiento de una célula otra, y garantizaría el éxito de la infección.
Hipótesis del origen celular
Algunos virus pueden haber evolucionado a partir de fragmentos de ADN o ARN que "escaparon" de los genes de un organismo mayor.[50][48] Los virus ADN podrían proceder de plásmidos (cadenas de ADN desnudo que pueden moverse entre células) o transposones (cadenas de ADN que se mueven entre diferentes posiciones dentro de los genes de la célula.[47] Plásmidos y transposones son ejemplos de los llamados elementos genéticos móviles.
Los viroides son moléculas de ARN que no están clasificados como virus ya que carecen de una capa de proteínas. Sin embargo, tienen características que son comunes a varios virus y a menudo son denominados agentes subvirales.[50] Los viroides son importantes patógenos de plantas[47] y al utilizar la maquinaria del huésped para su replicación no codifican proteínas.[52] El virus de la hepatitis D de los seres humanos tiene un genoma ARN similar a los viroides, pero tiene una cápsida de proteínas procedente de del virus de la hepatitis B. Esto es, es un virus defectuoso que no puede replicarse sin la ayuda del virus de la hepatitis B.[47]
Al igual que en la hipótesis anterior, la cápsida de los virus sería un logro evolutivo por el que el material genético se vería protegido en su desplazamiento de una célula otra. Sin embargo, también pudo darse el proceso inverso: una pérdida de la cápsida reduciría a las unidades autónomas de replicación-transcripción-traducción a la condición de plásmido o viroide.
Hipótesis regresiva
Los virus pueden haber sido alguna vez pequeñas células que parasitaban a células más grandes. Con el tiempo, los componentes no requeridos para su estilo de vida parasitaria se perdieron en un proceso de simplificación conocido como evolución regresiva. Las bacterias Rickettsia y Chlamydia son células vivas que, al igual que los virus, sólo se pueden reproducir dentro de una célula huésped. El estilo de vida parasitaria de estos organismos les ha ocasionado una pérdida de genes que en el pasado les habrían permitido sobrevivir fuera de la célula huésped. Estos ejemplos prestan credibilidad a la hipótesis de la simplificación.[50][48] Los virus con genomas más grandes, como los poxvirus pueden haber seguir este camino.
Los virus y las enfermedades
Ejemplos comunes de enfermedades humanas causadas por virus incluyen el resfriado común, gripe, varicela, sarampión, paperas y rubéola. Entre las enfermedades graves causadas por virus están el ébola, SIDA, gripe aviar y SARS. Otras enfermedades son poliomielitis, hepatitis B, hepatitis C, fiebre amarilla, dengue, viruela (erradicada), etc. Algunas enfermedades se encuentran bajo investigación para determinar si tienen un virus como agente causal, por ejemplo, el Herpesvirus humano tipo 6 (HHV6) podría estar relacionado con enfermedades neurológicas tales como la esclerosis múltiple y el síndrome de fatiga crónica. También se investiga si el Virus de Borna, causante de enfermedades neurológicas en caballos, pudiera ser responsable de enfermedades psiquiátricas en los seres humanos.[53]
La capacidad relativa de los virus para causar enfermedades se describe en términos de virulencia. Los virus producen la enfermedad en el huésped a través de diferentes mecanismos que dependen en gran medida de la especie de virus. Los mecanismos a nivel celular incluyen principalmente la lisis y la posterior muerte de la célula. En los organismos pluricelulares, si suficientes células mueren, todo el organismo empezará a verse afectado. Los virus pueden también existir dentro de un organismo relativamente sin efectos. A esto se le llama estado latente[54] y es una característica de los herpesvirus incluyendo el Virus del herpes simple, causante del herpes labial, el Virus de Epstein-Barr, que causa la fiebre glandular, y el virus varicela-zóster, que causa la varicela. El virus de la varicela, una vez superada la enfermedad, regresa en etapas posteriores de la vida como herpes zóster.
Algunos virus pueden causar infecciones crónicas, en las cuales el virus sigue replicándose en el cuerpo, a pesar de los mecanismos de defensa del huésped.[55] Esto es común en las infecciones de hepatitis B y hepatitis C. Las personas infectadas crónicamente con el virus de la hepatitis B sirven como reservorios del virus (son los portadores). Cuando hay una alta proporción de portadores en una población, se dice que la enfermedad es endémica.[56]
Epidemiología
La epidemiología viral es la rama de la ciencia médica se ocupa del estudio de la transmisión y el control de las infecciones virales en los seres humanos. La transmisión de los virus puede ser vertical, es decir de madre a hijo, u horizontal, de una persona a otra. Ejemplos de transmisión vertical incluyen la hepatitis B y el VIH; cuando el bebé nace ya está infectado por el virus.[57] Otro ejemplo menos frecuente es la varicela-zóster, que aunque causa infecciones relativamente leves en los seres humanos, puede ser fatal para el feto y los recién nacidos.[58]
La transmisión horizontal es el mecanismo de propagación más común de los virus en las poblaciones. La transmisión puede realizarse a través del intercambio de sangre o por actividad sexual (por ejemplo, VIH, hepatitis B y hepatitis C), por vía bucal mediante el intercambio de saliva (por ejemplo, el Virus de Epstein-Barr), por alimentos o agua contaminados (por ejemplo, Norovirus), por respiración de los virus a través de aerosoles (por ejemplo, el virus de la gripe) o por insectos vectores como mosquitos (por ejemplo, el dengue). La tasa o velocidad de transmisión de las infecciones virales depende de factores que incluyen la densidad de población, el número de individuos susceptibles (es decir, aquellos que no son inmunes), la calidad de la atención médica y las condiciones climáticas.[59]
Epidemias y pandemias



Las poblaciones nativas americanas fueron devastadas por las enfermedades contagiosas, especialmente la viruela, traída a América por los colonizadores europeos. No está claro cuántos americanos nativos fueron muertos por las enfermedades después de la llegada de Cristobal Colón a las Américas, pero ha sido estimado en cerca del 70% de la población indígena. El daño causado por esta enfermedad ayudó significativamente a los europeos para conquistar y desplazar a la población nativa. [60][61][62][63][64][65][66]
Gripe española
La pandemia de gripe de 1918, comúnmente conocida como gripe española, fue una pandemia de gripe de categoría 5 causada por un inusualmente severo y mortal Virus de la gripe A. Las víctimas a menudo eran adultos jóvenes sanos, en contraste con la mayoría de los brotes de gripe, que afectan principalmente a niños, ancianos, o pacientes debilitados.
La «gripe española» duró desde 1918 a 1919. Las estimaciones clásicas consideran unos 40-50 millones de muertos,[67] mientras que las más recientes sugieren que pueden haber muerto hasta 100 millones de personas, o el 5% de la población mundial de 1918.[68]
SIDA
La mayoría de los investigadores cree que el VIH se originó en el África subsahariana durante el siglo XX.[69] El VIH es ahora una pandemia, con una cifra estimada de 38,6 millones de personas infectadas actualmente por la enfermedad en todo el mundo.[70] El Programa Conjunto de las Naciones Unidas sobre el VIH/SIDA (ONUSIDA) y la Organización Mundial de la Salud (OMS) estiman que el SIDA ha matado a más de 25 millones de personas desde que se reconoció por primera vez el 5 de junio de 1981, convirtiéndose en una de las epidemias más destructivas de la historia.[71]
Ébola
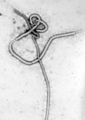
Varios virus patógenos altamente letales son miembros de la familia Filoviridae. Estos son virus filamentosos que causan fiebre hemorrágica viral e incluyen el Virus Ébola y el Virus de Marburgo. El virus de Marburgo atrajo la atención de la prensa en abril de 2005 por un brote en Angola. El brote comenzó en octubre de 2004 y continuó en 2005 y fue la peor epidemia de cualquier tipo de fiebre hemorrágica viral.[72]
Virus y cáncer

Los virus son una causa de cáncer en los seres humanos y otras especies. Los principales virus asociados con cánceres humanos son los virus del papiloma humano, hepatitis B, hepatitis C, Virus de Epstein-Barr y el Virus linfotrópico T humano.
Los virus de la hepatitis, entre ellos, hepatitis B y hepatitis C, puede inducir una infección viral crónica que provoca cáncer de hígado.[73][74] La infección por virus linfotrópico T humano puede conducir a la paraparesia espástica tropical y la leucemia de células T en adultos.[75] Los virus del papiloma humanos son una causa del cáncer de cuello uterino, piel, ano y pene.[76] En la familia Herpesviridae, el Virus herpes humano 8 (VHH-8) causa el sarcoma de Kaposi y el linfoma de cavidad corporal, y el virus de Epstein-Barr causa linfoma de Burkitt, linfoma de Hodgkin, trastorno linfoproliferativo y carcinoma nasofaríngeo.[77]
Diagnóstico en el laboratorio
Las infecciónes virales son confirmadas en el laboratorio por varios métodos que incluyen:
- Crecimiento del virus en un cultivo celular a partir de una muestra tomada del paciente.
- Detección de anticuerpos IgM específicos del virus en la sangre (véase más adelante).
- Detección de antígenos del virus por ELISA en los tejidos y fluidos.
- Detección del ADN y ARN viral por PCR.
- Observación de partículas virales por microscopía electrónica.
Prevención y tratamiento
Puesto que los virus utilizan la maquinaria de una célula huésped para reproducirse y residir dentro de ellas, son difíciles de eliminar sin matar a la célula huésped. Los enfoques médicos más eficaces para combatir las enfermedades virales son las vacunas que proporcionan resistencia a la infección, y los medicamentos antivirales que tratan los síntomas de las infecciones virales.
Respuesta inmune del huésped
La primera línea de defensa del organismo contra los virus es el sistema inmunitario innato. Esté incluye las células y otros mecanismos que defienden al organismo de la infección de una forma no específica. Esto significa que las células del sistema innato reconocen y responden a los agentes patógenos de una manera genérica, pero, a diferencia del sistema inmune adaptativo, no confieren protección de larga duración o inmunidad.[78]
El ARN interferente es una importante defensa innata contra los virus.[79] Muchos virus tienen una estrategia de replicación que implica ARN bicatenario (dsRNA). Cuando tales virus infectan a una célula y liberan su molécula o moléculas de ARN, inmediatamente una proteína compleja denominada dicer se une al ARN y lo corta en pedazos más pequeños. Una vía bioquímica denominada complejo RISC se activa y degrada el ARNm viral. Los rotavirus evitan este mecanismo no desnudándose completamente dentro de la célula. El dsRNA genómico continúa protegido en el interior del núcleo del virión y se liberan los nuevos ARNm producidos a través de los poros de la cápside.[80][81]
Cuando el sistema inmunitario adaptativo de un vertebrado encuentra un virus, produce anticuerpos específicos que se unen al virus y lo hacen no infeccioso, lo que se denomina inmunidad humoral. Dos tipos de anticuerpos son importantes. El primero se denomina IgM y es altamente eficaz para neutralizar los virus, pero sólo es producido por las células del sistema inmune durante unas pocas semanas. El segundo, denominado IgG, se produce indefinidamente. La presencia de IgM en la sangre del huésped se utiliza para determinar una infección aguda, mientras que el IgG indica una infección en el pasado.[82] Los dos tipos de anticuerpos se analizan cuando se llevan a cabo las pruebas de inmunidad.[83]
Una segunda línea de defensa de los vertebrados frente a los virus se denomina inmunidad celular y consiste en las células inmunitarias conocidas como linfocitos T. Las células del organismo constantemente muestran cortos fragmentos de sus proteínas en la superficie celular. Si un linfocito T reconoce en una célula un fragmento sospechoso de ser viral, destruye dicha célula y a continuación se produce una proliferación de los linfocitos T específicos para ese virus. Los macrófagos son las células especialistas en la presentación antigénica.[84][85] La producción de interferón es un importante mecanismo que interviene también en la defensa.[86]
No todas las infecciones por virus producen de esta manera una respuesta inmune protectora. El VIH evade al sistema inmunológico por el cambio constante de la secuencia de aminoácidos de las proteínas en la superficie del virión. Estos persistentes virus eluden el control mediante el secuestro y bloqueo de la presentación antigénica, resistencia a las citoquinas, evasión a las actividades de los lifocitos T, inactivación de la apoptosis, y el cambio antigénico.[87] Otros virus, denominados "virus neurotróficos", se propagagan en el sistema neural, donde el sistema inmunológico puede ser incapaz de llegar a ellos.
Vacunas
La vacunación es una forma barata y eficaz para la prevención de las infecciones causadas por los virus. Las vacunas se han utilizado para prevenir las enfermedades virales desde mucho antes al descubrimiento de los virus. Su uso ha dado lugar a una dramática disminución de la morbilidad (enfermedad) y mortalidad (muerte) asociada a infecciones virales como poliomielitis, sarampión, paperas y rubéola.[88] La viruela ha sido erradicada.[89] En la actualidad se dispone de vacunas para prevenir más de trece infecciones virales en los seres humanos,[90] y algunas más se utilizan para prevenir infecciones virales en animales.[91]
Las vacunas pueden consistir en virus vivos atenuados o en virus muertos, o en sólo las proteínas virales (antígenos).[92] Las vacunas vivas contienen formas debilitadas del virus que causa la enfermedad. Las vacunas vivas pueden ser peligrosas cuando se administran a las personas inmunodeficientes, puesto que en estas personas incluso el virus debilitado puede causar la enfermedad original.[93] Sin embargo, la vacuna contra el virus de la fiebre amarilla, obtenida de una cepa atenuada denominada 17D, es posiblemente una de las vacunas más seguras y eficaces fabricadas.
La biotecnología y las técnicas de ingeniería genética se utilizan para producir vacunas de subunidades. Estas vacunas usan sólo la cápside de proteínas del virus. La vacuna de la hepatitis B es un ejemplo de este tipo de vacuna.[94]Las vacunas de subunidades son seguras para pacientes inmunodeficientes, ya que no pueden causar la enfermedad.[95]
Medicamentos antivirales


Durante los últimos veinte años, el desarrollo de fármacos antivirales ha aumentado rápidamente, impulsado por la epidemia del SIDA. Los medicamentos antivirales son a menudo «análogos de nucleósidos» (falsos nucleósidos, los bloques de construcción de los ácidos nucleicos) que los virus incorporan a sus genomas durante la replicación. El ciclo de vida del virus entonces se detiene debido a que las nuevas cadenas de ADN síntetizadas son defectuosas. Esto se debe a que los análogos carecen de los grupos hidroxilos que junto a los átomos de fósforo forman los enlaces de la fuerte "columna vertebral" de la molécula de ADN. A esto se le denomina interrupción de la cadena de ADN.[96] Ejemplos de análogos de nucleósidos son el aciclovir para tratar el virus del herpes y lamivudina para las infecciones de VIH y hepatitis B. Aciclovir es uno de los fármacos antivirales más antiguos y frecuentemente prescritos.[97]


La hepatitis C es causada por un virus ARN. En el 80% de las personas infectadas, la enfermedad es crónica y sin tratamiento continúan siendo infecciosas para el resto de sus vidas. Sin embargo, ahora existe un tratamiento efectivo con el fármaco ribavirina, un análogo de nucleósido, en combinación con interferón.[98] Actualmente se está desarrollando una estrategia similar con lamivudina para el tratamiento de los portadores crónicos de hepatitis B.[99]
Otros fármacos antivirales en uso tienen como objetivo diferentes etapas del ciclo replicativo viral. El VIH depende de una enzima proteolítica denominada proteasa VIH-1 para ser plenamente infeccioso. Existe una clase de medicamentos denominados inhibidores de la proteasa que han sido diseñados para inactivar esta enzima.
Aplicaciones
Ciencias de la vida y medicina
Los virus son importantes para el estudio de la biología celular y molecular ya que constituyen sistemas simples que pueden utilizarse para investigar o manipular las funciones de las células. Por ejemplo, los virus han sido útiles en el estudio de los mecanismos básicos de la genética molecular, tales como la replicación de ADN, la transcripción, el procesamiento de ARN, la traducción genética, el transporte de proteínas y la inmunología.

Los genetistas suelen utilizar virus como vectores para introducir genes en las células que están estudiando. Esto es útil para estudiar el efecto de un nuevo gen o forzar a la célula para que produzca sustancias extrañas. De manera similar, la viroterapia utiliza virus como vectores para el tratamiento de diversas enfermedades, puesto que los virus pueden dirigirse específicamente a ciertas células. Esto es prometedor para el tratamiento del cáncer y en la terapia génica. Además, los científicos de Europa Oriental han estado utilizando la terapia fágica como alternativa a los antibióticos durante algún tiempo, enfoque cuyo interés es cada vez mayor debido al alto nivel de resistencia a los antibióticos que presentan actualmente algunas bacterias patógenas.[100]
Por otro lado, los virus Granulovirus (GV) y Nucleopolyhedrovirus (VPN) pueden ser utilizados como insecticidas biológicos (p. ej. Granulovirus de Cydia pomonella).
Los virus en la ciencia de materiales y la nanotecnología
Desde un punto de vista práctico, los virus pueden ser considerados como nanopartículas orgánicas.[101] En este sentido, su superficie lleva instrumentos específicos diseñados para cruzar las barreras de las células huésped. Puesto que el tamaño y forma de los virus y el número y naturaleza de los grupos funcionales en su superficie están exactamente definidos, pueden ser utilizados en la ciencia de los materiales como herramientas base para realizar modificaciones en superficies ligadas covalentemente. Una característica adicional de los virus es que pueden adaptarse mediante evolución dirigida. En la actualidad se está haciendo uso de estás características para aumentar el rango de aplicaciones de los virus, más allá de la biología y la medicina.
Por ejemplo, los virus se están utilizando en nanotecnología para la organización de materiales, debido a su tamaño, forma y estructura química bien definidas.[102] Un ejemplo reciente es el uso de las partículas del Virus del mosaico del caupí (CPMV) para la fabricación de micromatrices de amplificación de señales en sensores, llevado a cabo en el Laboratorio de Investigación Naval en Washington, DC. En esta aplicación, las partículas virales separaron los tintes fluorescentes utilizados para la señalización, con el fin de prevenir la formación de dímeros no fluorescentes que actúan como absorbentes.[103] El CPMV también se ha utilizado para fabricar placas en nanoescala para la electrónica molecular.[104] Una aplicación similar es el uso de virus modificados genéticamente para la creación de cables metálicos en nanoescala, realizado en el Instituto de Tecnología de Massachusetts (MIT).[105] El equipo del MIT fue capaz de utilizar el virus para crear una batería con una densidad de energía de hasta tres veces superior a las actuales. Usos potenciales de esta tecnología incluyen la fabricación de cristales líquidos, células solares, pilas de combustible y otros tipos de componentes electrónicos.
Guerra biológica
Puesto que los virus tienen la capacidad de causar epidemias devastadoras podrían ser utilizados como armas biológicas. El temor está justificado por el éxito en la recreación del virus de la gripe de 1918 en el laboratorio.[106] El virus de la viruela devastó en el pasado numerosas sociedades humanas. La enfermedad fue erradicada, pero el virus se conserva en varios laboratorios y podría ser utilizado como arma biológica. La vacuna contra la viruela dejó de administrarse después de la erradicación de la enfermedad, por lo que la población mundial actualmente no presenta casi ninguna resistencia al virus. En caso de que el virus fuera liberado, produciría una elevada mortalidad antes de que la epidemia pudiera ser controlada.[107][108]
Ejemplos de virus
La siguiente tabla recoge algunos virus que causan enfermedades en los seres humanos.
Galería
-
Los adenovirus (Mastadenovirus) causan enfermedad respiratoria, sarpullido, gastroenteritis, cistitis, conjuntivitis, etc.
-
Los Coronavirus son virus con un halo o "corona" que afectan principalmente a niños, ancianos y pacientes inmunocomprometidos.
-
Morbillivirus (sección). Este virus causa sarampión.
-
Virus sincicial respiratorio (Pneumovirus), que causa infección del tracto respiratorio.
-
Orthomyxoviridae, los virus de la gripe.
-
Poliovirus, causante de la polio.
Referencias
- ↑ Paul GF. (1971). A History of Poliomyelitis. Yale University Press: New Haven and London.
- ↑ Abdul Nasser Kaadan (2007), Al-Razi on Smallpox and Measles, FSTC
- ↑ George Sarton, Introduction to the History of Science (cf. Dr. A. Zahoor and Dr. Z. Haq (1997), Quotations From Famous Historians of Science, Cyberistan.
- ↑ a b Ibrahim B. Syed, Ph.D. (2002). "Islamic Medicine: 1000 years ahead of its times", Journal of the Islamic Medical Association 2, p. 2-9.
- ↑ David W. Tschanz, MSPH, PhD (August 2003). "Arab Roots of European Medicine", Heart Views 4 (2).
- ↑ Behbehani AM (1983). «The smallpox story: life and death of an old disease». Microbiol Rev 47 (4): 455-509. PMID 6319980.
- ↑ Horzinek MC (1997). «The birth of virology». Antonie van Leeuwenhoek 71: 15-20. doi:10.1023/A:1000197505492.
- ↑ Chung, King-Thom and Ferris, Deam Hunter (1996). PDF Martinus Willem Beijerinck (1851-1931), pioneer of general microbiology. AMS News 62, 539-543.
- ↑ Frederick William Twort.
- ↑ Stanley WM, Loring HS (1936). THE ISOLATION OF CRYSTALLINE TOBACCO MOSAIC VIRUS PROTEIN FROM DISEASED TOMATO PLANTS 83 (2143). p. 85. PMID 17756690. doi:10.1126/science.83.2143.85.
- ↑ Stanley WM, Lauffer MA (1939). DISINTEGRATION OF TOBACCO MOSAIC VIRUS IN UREA SOLUTIONS 89 (2311). pp. 345-347. PMID 17788438. doi:10.1126/science.89.2311.345.
- ↑ Tsugita A, Gish DT, Young J, Fraenkel-Conrat H, Knight CA, Stanley WM (1960). «THE COMPLETE AMINO ACID SEQUENCE OF THE PROTEIN OF TOBACCO MOSAIC VIRUS». Proc. Natl. Acad. Sci. U.S.A. 46 (11): 1463-9. PMID 16590772. doi:10.1073/pnas.46.11.1463.
- ↑ Pennazio S (2006). «The origin of phage virology». Riv. Biol. 99 (1): 103-29. PMID 16791793.
- ↑ Goodpasture EW, Woodruff AM, Buddingh GJ (1931). THE CULTIVATION OF VACCINE AND OTHER VIRUSES IN THE CHORIOALLANTOIC MEMBRANE OF CHICK EMBRYOS 74 (1919). pp. 371-372. PMID 17810781. doi:10.1126/science.74.1919.371.
- ↑ Rosen FS (2004). «Isolation of poliovirus--John Enders and the Nobel Prize». N. Engl. J. Med. 351 (15): 1481-3. PMID 15470207. doi:10.1056/NEJMp048202.
- ↑ Kiselev NA, Sherman MB, Tsuprun VL (1990). «Negative staining of proteins». Electron Microsc. Rev. 3 (1): 43-72. PMID 1715774.
- ↑ CASPAR DL, KLUG A (1962). «Physical principles in the construction of regular viruses». Cold Spring Harb. Symp. Quant. Biol. 27: 1-24. PMID 14019094.
- ↑ CRICK FH, WATSON JD (1956). «Structure of small viruses». Nature 177 (4506): 473-5. PMID 13309339. doi:10.1038/177473a0.
- ↑ a b c d e Prescott, L (1993). Microbiology. Wm. C. Brown Publishers. 0-697-01372-3.
- ↑ «Virus triangulation numbers via Internet Archive». Consultado el 5 de abril de 2006.
- ↑ Long GW, Nobel J, Murphy FA, Herrmann KL, and Lourie B (1970) Experience with electron microscopy in the differential diagnosis of smallpox. Applied Microbiology 20(3):497-504.
- ↑ a b c Flinth; et al. (2004). Principles of Virology (2nd edn edición). ASM Press, New York. 1-55581-259-7.
- ↑ Pressing J, Reanney DC. Divided genomes and intrinsic noise.J Mol Evol. 1984;20(2):135-46.
- ↑ Pan XP, Li LJ, Du WB, Li MW, Cao HC, Sheng JF. Differences of YMDD mutational patterns, precore/core promoter mutations, serum HBV DNA levels in lamivudine-resistant hepatitis B genotypes B and C. J Viral Hepat. 2007 Nov;14(11):767-74.
- ↑ Worobey M, Holmes EC (1999). «Evolutionary aspects of recombination in RNA viruses». J. Gen. Virol. 80 ( Pt 10): 2535-43. PMID 10573145.
- ↑ Lukashev AN (2005). «Role of recombination in evolution of enteroviruses». Rev. Med. Virol. 15 (3): 157-67. PMID 15578739. doi:10.1002/rmv.457.
- ↑ Umene K (1999). «Mechanism and application of genetic recombination in herpesviruses». Rev. Med. Virol. 9 (3): 171-82. PMID 10479778.
- ↑ Goudsmit, Jaap. Viral Sex. Oxford Univ Press, 1998.ISBN-13: 9780195124965 ISBN-10: 0195124960
- ↑ Zhou NN, Senne DA, Landgraf JS, Swenson SL, Erickson G, Rossow K, Liu L, Yoon K, Krauss S, Webster RG. Genetic reassortment of avian, swine, and human influenza A viruses in American pigs.J Virol. 1999 Oct;73(10):8851-6.
- ↑ Hampson AW, Mackenzie JS. The influenza viruses.Med J Aust. 2006 Nov 20;185(10 Suppl):S39-43.
- ↑ Nakajima K. The mechanism of antigenic shift and drift of human influenza virus Nippon Rinsho. 2003 Nov;61(11):1897-903.
- ↑ Metzner KJ. Detection and significance of minority quasispecies of drug-resistant HIV-1. HIV Ther. 2006 Dec;11(4):74-81.
- ↑ Barman S, Ali A, Hui EK, Adhikary L, Nayak DP (2001). «Transport of viral proteins to the apical membranes and interaction of matrix protein with glycoproteins in the assembly of influenza viruses». Virus Res. 77 (1): 61-9. PMID 11451488. doi:10.1016/S0168-1702(01)00266-0.
- ↑ a b Rybicki EP (1990) The classification of organisms at the edge of life, or problems with virus systematics. S Aft J Sci 86:182-186
- ↑ LWOFF A (1957). «The concept of virus». J. Gen. Microbiol. 17 (2): 239-53. PMID 13481308.
- ↑ a b Baltimore D (1971). «Expression of animal virus genomes». Bacteriol Rev 35 (3): 235-41. PMID 4329869.
- ↑ N.J. Dimmock, A.J. Easton y K. Leppard, Introduction to Modern Virology, Ed. Wiley, 2006, ISBN: 978-1-4051-3645-7.
- ↑ Baltimore D (1974). «The strategy of RNA viruses». Harvey Lect. 70 Series: 57-74. PMID 4377923.
- ↑ Temin HM, Baltimore D (1972). «RNA-directed DNA synthesis and RNA tumor viruses». Adv. Virus Res. 17: 129-86. PMID 4348509.
- ↑ van Regenmortel MH, Mahy BW (2004). «Emerging issues in virus taxonomy». Emerging Infect. Dis. 10 (1): 8-13. PMID 15078590.
- ↑ Virus Taxonomy 8th Reports of the International Committee on Taxonomy of Viruses C.M. Fauquet, M.A. Mayo, J. Maniloff, U. Desselberger, and L.A. Ball (eds) Academic Press, 1162 pp. (2005) Elsevier Publication Date: 27 May 2005
- ↑ "ICTVdb Index of Viruses: Virus Taxonomy, 8th Reports of the International Committee on Taxonomy of Viruses: Listing in Taxonomic Order." (Website). U.S. National Center for Biotechnology Information, National Library for Medicine, National Institutes of Health. Consultado el 28-09-2007.
- ↑ Virus Taxonomy 2008, International Committee on Taxonomy of Viruses (website). Consultado el 14-11-2008.
- ↑ Holmes EC.PLoS Biol. 2007 Oct 2;5(10):e278. Viral Evolution in the Genomic Age
- ↑ Shackelton LA, Holmes EC.Phylogenetic evidence for the rapid evolution of human B19 erythrovirus.J Virol. 2006 Apr;80(7):3666-9.
- ↑ Vlassov, Alexander V. (Jul 2005). "The RNA World on Ice: A New Scenario for the Emergence of RNA Information". Journal of Molecular Evolution 61: 264-273.
- ↑ a b c d e Shors, Teri (2008). Understanding Viruses. Jones and Bartlett Publishers. ISBN 0-7637-2932-9.
- ↑ a b c d Collier, Leslie; Balows, Albert; Sussman, Max (1998) Topley and Wilson's Microbiology and Microbial Infections ninth edition, Volume 1, Virology, volume editors: Mahy, Brian and Collier, Leslie. Arnold. ISBN 0-340-66316-2.
- ↑ Liu Y, Nickle DC, Shriner D, et al. (2004). "Molecular clock-like evolution of human immunodeficiency virus type 1". Virology. 10;329(1):101–8, PMID 15476878
- ↑ a b c d Dimmock, N.J; Easton, Andrew J; Leppard, Keith (2007) Introduction to Modern Virology sixth edition, Blackwell Publishing, ISBN 1-4051-3645-6.
- ↑ Koonin EV. The Biological Big Bang model for the major transitions in evolution.Biol Direct. 2007 Aug 20;2:21.
- ↑ Tsagris EM, de Alba AE, Gozmanova M, Kalantidis K (September de 2008). «Viroids». Cell. Microbiol. 10: 2168. PMID 18764915. doi:10.1111/j.1462-5822.2008.01231.x. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ Chen C, Chiu Y, Wei F, Koong F, Liu H, Shaw C, Hwu H, Hsiao K (1999). «High seroprevalence of Borna virus infection in schizophrenic patients, family members and mental health workers in Taiwan». Mol Psychiatry 4 (1): 33-8. PMID 10089006. doi:10.1038/sj.mp.4000484.
- ↑ Margolis TP, Elfman FL, Leib D, Pakpour N, Apakupakul K, Imai Y, Voytek C. Spontaneous reactivation of herpes simplex virus type 1 in latently infected murine sensory Ganglia.J Virol. 2007 Oct;81(20):11069-74. Epub 2007 Aug 8.
- ↑ Bertoletti A, Gehring A (2007). «Immune response and tolerance during chronic hepatitis B virus infection». Hepatol. Res. 37 Suppl 3: S331-8. PMID 17931183. doi:10.1111/j.1872-034X.2007.00221.x.
- ↑ Nguyen VT, McLaws ML, Dore GJ (2007). Highly endemic hepatitis B infection in rural Vietnam. p. 2093. PMID 17645465. doi:10.1111/j.1440-1746.2007.05010.x.
- ↑ Fowler MG, Lampe MA, Jamieson DJ, Kourtis AP, Rogers MF (2007). «Reducing the risk of mother-to-child human immunodeficiency virus transmission: past successes, current progress and challenges, and future directions». Am. J. Obstet. Gynecol. 197 (3 Suppl): S3-9. PMID 17825648. doi:10.1016/j.ajog.2007.06.048.
- ↑ Sauerbrei A, Wutzler P (2000). «The congenital varicella syndrome». Journal of perinatology : official journal of the California Perinatal Association 20 (8 Pt 1): 548-54. PMID 11190597.
- ↑ Platonov AE (2006). «(The influence of weather conditions on the epidemiology of vector-borne diseases by the example of West Nile fever in Russia)». Vestn. Akad. Med. Nauk SSSR (en russian) (2): 25-9. PMID 16544901.
- ↑ Ranlet P. The British, the Indians, and smallpox: what actually happened at Fort Pitt in 1763? Pa Hist. 2000;67(3):427-41.
- ↑ Van Rijn K. "Lo! The poor Indian!" colonial responses to the 1862-63 smallpox epidemic inBritish Columbia and Vancouver Island.Can Bull Med Hist. 2006;23(2):541-60.
- ↑ Patterson KB, Runge T. Smallpox and the Native American.Am J Med Sci. 2002 Apr;323(4):216-22.
- ↑ Sessa R, Palagiano C, Scifoni MG, di Pietro M, Del Piano M. The major epidemic infections: a gift from the Old World to the New? Panminerva Med. 1999 Mar;41(1):78-84.
- ↑ Bianchine PJ, Russo TA. The role of epidemic infectious diseases in the discovery of America. Allergy Proc. 1992 Sep-Oct;13(5):225-32.
- ↑ Hauptman LM. Smallpox and American Indian; Depopulation in Colonial New York. N Y State J Med. 1979 Nov;79(12):1945-9.
- ↑ Fortuine R. Smallpox decimates the Tlingit (1787). Alaska Med. 1988 May-Jun;30(3):109.
- ↑ Patterson, KD; Pyle GF (Spring de 1991). «The geography and mortality of the 1918 influenza pandemic.». Bull Hist Med. 65 (1): 4-21. PMID 2021692.
- ↑ Johnson, Niall P. A. S. and Mueller, Juergen, "Updating the Accounts: Global Mortality of the 1918–1920 'Spanish' Influenza Pandemic," Bulletin of the History of Medicine 76 (2002), pp. 105–115.
- ↑
Gao, F., Bailes, E., Robertson, D. L., Chen, Y., Rodenburg, C. M., Michael, S. F., Cummins, L. B., Arthur, L. O., Peeters, M., Shaw, G. M., Sharp, P. M. and Hahn, B. H. (1999). «Origin of HIV-1 in the Chimpanzee Pan troglodytes troglodytes». Nature 397 (6718): 436-441. PMID doi [//dx.doi.org/10.1038/17130 10.1038/17130 9989410 [[Identificador de objeto digital|doi]] [//dx.doi.org/10.1038/17130 10.1038/17130]]
|pmid=incorrecto (ayuda). doi:10.1038/17130. - ↑ UNAIDS (2006). «Overview of the global AIDS epidemic» (PDF). 2006 Report on the global AIDS epidemic. Consultado el 8 de junio de 2006.
- ↑ Mawar N, Saha S, Pandit A, Mahajan U. The third phase of HIV pandemic: social consequences of HIV/AIDS stigma & discrimination & future needs.Indian J Med Res. 2005 Dec;122(6):471-84. Review.
- ↑ Towner JS, Khristova ML, Sealy TK, Vincent MJ, Erickson BR, Bawiec DA, HartmanAL, Comer JA, Zaki SR, Stroher U, Gomes da Silva F, del Castillo F, Rollin PE,Ksiazek TG, Nichol ST. Marburgvirus genomics and association with a large hemorrhagic fever outbreak in Angola.J Virol. 2006 Jul;80(13):6497-516.
- ↑ Koike K (2007). «Hepatitis C virus contributes to hepatocarcinogenesis by modulating metabolic and intracellular signalling pathways». J. Gastroenterol. Hepatol. 22 Suppl 1: S108-11. PMID 17567457. doi:10.1111/j.1440-1746.2006.04669.x.
- ↑ Hu J, Ludgate L (2007). «HIV-HBV and HIV-HCV coinfection and liver cancer development». Cancer Treat. Res. 133: 241-52. PMID 17672044.
- ↑ Bellon M, Nicot C (2007). «Telomerase: a crucial player in HTLV-I-induced human T-cell leukemia». Cancer genomics & proteomics 4 (1): 21-5. PMID 17726237.
- ↑ Schiffman M, Castle PE, Jeronimo J, Rodriguez AC, Wacholder S (2007). «Human papillomavirus and cervical cancer». Lancet 370 (9590): 890-907. PMID 17826171. doi:10.1016/S0140-6736(07)61416-0.
- ↑ Klein E, Kis LL, Klein G (2007). «Epstein-Barr virus infection in humans: from harmless to life endangering virus-lymphocyte interactions». Oncogene 26 (9): 1297-305. PMID 17322915. doi:10.1038/sj.onc.1210240.
- ↑ Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters (2002). Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. ISBN 0-8153-3218-1.
- ↑ Ding SW, Voinnet O. Antiviral immunity directed by small RNAs. Cell. 2007 Aug 10;130(3):413-26.
- ↑ Patton JT, Vasquez-Del Carpio R, Spencer E (2004). «Replication and transcription of the rotavirus genome». Curr. Pharm. Des. 10 (30): 3769-77. PMID 15579070. doi:10.2174/1381612043382620.
- ↑ Jayaram H, Estes MK, Prasad BV (2004). «Emerging themes in rotavirus cell entry, genome organization, transcription and replication». Virus Res. 101 (1): 67-81. PMID 15010218. doi:10.1016/j.virusres.2003.12.007.
- ↑ Greer S, Alexander GJ. Viral serology and detection. Baillieres Clin Gastroenterol. 1995 Dec;9(4):689-721
- ↑ Laurence JC. Hepatitis A and B immunizations of individuals infected with humanimmunodeficiency virus.Am J Med. 2005 Oct;118 Suppl 10A:75S-83S.
- ↑ Cascalho M, Platt JL. Novel functions of B cells.Crit Rev Immunol. 2007;27(2):141-51.
- ↑ Khatri M, Sharma JM. Modulation of macrophages by infectious bursal disease virus.Cytogenet Genome Res. 2007;117(1-4):388-93
- ↑ Le Page C, Genin P, Baines MG, Hiscott J. Interferon activation and innate immunity.Rev Immunogenet. 2000;2(3):374-86.
- ↑ Hilleman MR. Strategies and mechanisms for host and pathogen survival in acute and persistent viral infections. Proc Natl Acad Sci U S A. 2004 Oct 5;101 Suppl 2:14560-6. Epub 2004 Aug 5.
- ↑ Asaria P, MacMahon E (2006). «Measles in the United Kingdom: can we eradicate it by 2010?». BMJ 333 (7574): 890-5. PMID 17068034. doi:10.1136/bmj.38989.445845.7C.
- ↑ Lane JM (2006). «Mass vaccination and surveillance/containment in the eradication of smallpox». Curr. Top. Microbiol. Immunol. 304: 17-29. PMID 16989262.
- ↑ Arvin AM, Greenberg HB (2006). «New viral vaccines». Virology 344 (1): 240-9. PMID 16364754. doi:10.1016/j.virol.2005.09.057.
- ↑ Pastoret PP, Schudel AA, Lombard M (2007). «Conclusions--future trends in veterinary vaccinology». Rev. - Off. Int. Epizoot. 26 (2): 489-94, 495-501, 503-9. PMID 17892169.
- ↑ Palese P (2006). «Making better influenza virus vaccines?». Emerging Infect. Dis. 12 (1): 61-5. PMID 16494719.
- ↑ Thomssen R (1975). «Live attenuated versus killed virus vaccines». Monographs in allergy 9: 155-76. PMID 1090805.
- ↑ McLean AA (1986). «Development of vaccines against hepatitis A and hepatitis B». Rev. Infect. Dis. 8 (4): 591-8. PMID 3018891.
- ↑ Casswall TH, Fischler B (2005). «Vaccination of the immunocompromised child». Expert review of vaccines 4 (5): 725-38. PMID 16221073. doi:10.1586/14760584.4.5.725.
- ↑ Magden J, Kääriäinen L, Ahola T (2005). «Inhibitors of virus replication: recent developments and prospects». Appl. Microbiol. Biotechnol. 66 (6): 612-21. PMID 15592828. doi:10.1007/s00253-004-1783-3.
- ↑ Mindel A, Sutherland S (1983). «Genital herpes - the disease and its treatment including intravenous acyclovir». J. Antimicrob. Chemother. 12 Suppl B: 51-9. PMID 6355051.
- ↑ Witthoft T, Moller B, Wiedmann KH, Mauss S, Link R, Lohmeyer J, Lafrenz M,Gelbmann CM, Huppe D, Niederau C, Alshuth U. Safety, tolerability and efficacy of peginterferon alpha-2a and ribavirin in chronic hepatitis C in clinical practice: The German Open Safety Trial. J Viral Hepat. 2007 Nov;14(11):788-96.
- ↑ Rudin D, Shah SM, Kiss A, Wetz RV, Sottile VM. Interferon and lamivudine vs. interferon for hepatitis B e antigen-positive hepatitis B treatment: meta-analysis of randomized controlled trials.Liver Int. 2007 Nov;27(9):1185-93.
- ↑ Matsuzaki S, Rashel M, Uchiyama J, et al (2005). «Bacteriophage therapy: a revitalized therapy against bacterial infectious diseases». J. Infect. Chemother. 11 (5): 211-9. PMID 16258815. doi:10.1007/s10156-005-0408-9.
- ↑ Proceedings of SPIE -- Volume 6413Smart Materials IV, Nicolas H. Voelcker, Editor, 64130F (Dec. 22, 2006). Hybrid organic-inorganic nanoparticles: controlled incorporation of gold nanoparticles into virus-like particles and application in surface-enhanced Raman spectroscopy Marcus Niebert, James Riches, Mark Howes, Charles Ferguson, Robert G. Parton, Anton P. J. Middelberg, Llew Rintoul, and Peter M. Fredericks.Queensland Univ. of Technology (Australia) (published online Dec. 22, 2006)
- ↑ Fischlechner M, Donath E (2007). «Viruses as Building Blocks for Materials and Devices». Angewandte Chemie International Edition 46: 3184. doi:10.1002/anie.200603445.
- ↑ Fluorescent signal amplification of carbocyanine dyes using engineered viral nanoparticles. Carissa M. Soto, Amy Szuchmacher Blum, Nikolai Lebedev, Gary J. Vora, Carolyn E. Meador, Angela P. Won, Anju Chatterji, John E. Johnson, and Banahalli R. Ratna, Journal of the American Chemical Society, 128, 5184 (2006).
- ↑ An Engineered Virus as a Scaffold for Three-Dimensional Self-Assembly on the Nanoscale. Amy Szuchmacher Blum, Carissa M. Soto, Charmaine D. Wilson, Tina L. Brower, Steven K. Pollack, Terence L. Schull, Anju Chatterji, Tianwei Lin, John E. Johnson, Christian Amsinck, Paul Franzon, Ranganathan Shashidhar and Banahalli Ratna, Small, 7, 702 (2005).
- ↑ «Researchers build tiny batteries with viruses». MIT News Office. Consultado el 5 de abril de 2007.
- ↑ «Researchers Reconstruct 1918 Pandemic Influenza Virus; Effort Designed to Advance Preparedness». Centers for Disease Control. Consultado el 5 de abril de 2007.
- ↑ Aragón TJ, Ulrich S, Fernyak S, Rutherford GW (2003). «Risks of serious complications and death from smallpox vaccination: a systematic review of the United States experience, 1963-1968». BMC public health 3: 26. PMID 12911836. doi:10.1186/1471-2458-3-26.
- ↑ Weiss MM, Weiss PD, Mathisen G, Guze P (2004). «Rethinking smallpox». Clin. Infect. Dis. 39 (11): 1668-73. PMID 15578369. doi:10.1086/425745.
Véase también
- Anexo:Virus, Anexo:Tipos de virus y Anexo:Virus importantes en la clínica
- Bacteria, plásmido, prión, provirus, viroide, nanobio.
- Ciclo reproductivo de los virus
- Virus y cáncer
- Virus satélite
- Gripe aviar
- Gripe porcina
Enlaces externos
 Wikispecies tiene un artículo sobre Virus.
Wikispecies tiene un artículo sobre Virus. Wikcionario tiene definiciones y otra información sobre virus.
Wikcionario tiene definiciones y otra información sobre virus. Wikimedia Commons alberga una categoría multimedia sobre Virus.
Wikimedia Commons alberga una categoría multimedia sobre Virus.