Ácido hidroxietiletilendiaminotriacético
| Ácido hidroxietiletilendiaminotriacético | ||
|---|---|---|
| Nombre IUPAC | ||
| Ácido N-(2-hidroxietil)etilendiaminotriacético o HEDTA | ||
| General | ||
| Fórmula estructural |
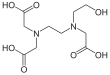 | |
| Fórmula molecular | C10H18N2O7 | |
| Identificadores | ||
| Número CAS | 150-39-0[1] | |
| ChEMBL | CHEMBL1620428 | |
| ChemSpider | 8443 | |
| PubChem | 8773 | |
| UNII | R79J91U341 | |
| Propiedades físicas | ||
| Masa molar | 278,24484 g/mol g/mol | |
| Compuestos relacionados | ||
| Compuestos relacionados | EDTA | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido hidroxietiletilendiaminotriacético[2] o HEDTA, es una sustancia utilizada como agente quelante que puede crear complejos con un metal que tenga una estructura de coordinación octaédrica. Coordina a metales pesados de forma reversible por tres posiciones acetato, dos amino y una hidroxietil, lo que lo convierte en un ligando quelato hexadentado.
Importancia
[editar]Como derivado del EDTA tiene la valiosa propiedad química de combinarse con iones metálicos polivalentes en solución para formar complejos coordinados cíclicos de anillo (no iónicos), solubles en agua y virtualmente no disociables, de gran importancia biomédica. A estos complejos se les conoce como quelatos.
Además se utiliza en composiciones farmacéuticas antibióticas para mejorar la absorción gastrointestinal, ya que es capaz de formar complejos con iones metálicos como cobre o hierro, y así inhibir las reacciones de descomposición que utilizan metales pesados como cofactores catalíticos.[3]
También es usado en agricultura para formar quelatos sintéticos de hierro (FeHEDTA), ya que administrado en esta forma es capaz de corregir la deficiencia de hierro de los suelos, siendo usado más que nada en suelos ácidos, en los cuales el quelato es más estable.[4]
Modo de acción y propiedades
[editar]

Al igual que el EDTA, la estructura de esta molécula se pliega sobre el catión metálico formando un complejo octaédrico cuya estabilidad depende del pH. Sin embargo, a diferencia del EDTA, en el HEDTA uno de los grupos —COOH (ácido carboxílico) ha sido reemplazado por (o reducido a) un grupo —CH2OH (alcohol primario), a pesar de lo cual aporta carga negativa, ya que al formar el quelato se transforma en alcóxido (—CH2O-).
El átomo de nitrógeno al cual está unido el grupo 2-hidroxietil será un centro quiral, ya que por ser sp3 posee una geometría trigonal piramidal, con todos sus vértices distintos entre sí. En uno de los vértices estará el hidroxietil, en otro el carboxietil, en el otro la etilendiamina y en el vértice superior el átomo de nitrógeno, que queda en un plano superior debido al par electrónico no enlazante. A pesar de esto, el HEDTA se emplea como mezcla racémica, ya que la quiralidad no modifica sus propiedades físicas.
Notas
[editar]- ↑ Número CAS
- ↑ Se utiliza aquí el nombre completo del fármaco porque el acrónimo HEDTA se utiliza por convencionalismo. Esto se hace para estar en conformidad con los textos de farmacología y farmacopeas, en donde en las cabeceras de los artículos y capítulos se utiliza el nombre completo, mientras que en el cuerpo del texto se usa el acrónimo.
- ↑ Ver Patente ES 2 256 035 T3
- ↑ Ver Nutrición Férrica
Enlaces
[editar]- Titulación de complejos (en inglés)[1]
