Mecanismo de reacción

En química un mecanismo de reacción es un postulado teórico que intenta explicar de manera lógica cual es la secuencia de reacción(es) elemental(es) e intermediarios que suceden en una reacción química.[1]
La información que proveee el mecanismo de reacción permite explicar las características cualitativas (desarrollo de color, aparición de precipitados, etc.) y cuantitativas (una de las más importantes la velocidad de reacción) observadas en su desarrollo. El mecanismo debe soportarse en los datos experimentales reportados para la reacción estudiada como los intermediarios, complejo(s) activado(s) y/o especies aislados en el trabajo experimental; la energía involucrada en cada paso propuesto (que determina la velocidad de reacción), cambios de fase, los efectos inducidos por el catalizador (si es que se adiciona alguno), los productos obtenidos, el rendimiento de la reacción, la estereoquímica de los productos, entre otros.[2]
Las reacciones elementales pueden estudiarse a partir del cambio de la energía potencial en las moléculas involucradas mientras se aproximan entre sí, el primer estudio de este tipo fue realizado por Henry Eyring y fue la base para el desarrollo de la dinámica química. Basados en cálculos de física cuántica Eyring realizó una superficie donde se representa el cambio de coordenadas internas (distancia de aproximación entre los átomos de las moléculas) vs energía potencial. Todas las posibles configuraciones que puedan llegar a ocurrir en el sistema se encuentran allí, la disociación de las moléculas en átomos el "rompimiento" y la "formación" de nuevos enlaces y la formación de cualquier tipo de Intermediario o especie química. Existen dos zonas especialmente importantes que permiten caracterizar la velocidad de las reacción(es) elemental(es) una es conocida como valle de potencial y es donde se encuentran las especies estables y otra como punto de silla donde encontramos el estado de transición. Una reacción química es entonces un proceso donde las moléculas pasan desde un valle de potencial a otro, por intermedio de un estado de transición y continuará hasta que se formen los productos observados y/o la entropía del sistema sea la máxima que pueda obtenerse en las condiciones que se realiza. Los mecanismos de reacción son postulados teóricos sobre la superficie de energía potencial y la ruta que sigue una reacción química, y pueden "demostrarse" basados en las características cuantitativas y cualitativas observadas experimentalmente, generalmente la más importante de todas es la velocidad de reacción.

Conceptos básicos
[editar]Desde un punto de vista termodinámico, una ecuación química, los reactivos que son el estado inicial y los productos el estado final, hay una variación de energía libre. La energía libre debe ser negativa ya que será una reacción espontánea, es decir, que la reacción podrá llevarse a cabo sin ningún impedimento termodinámico.
Para hacer más fácil la explicación será mejor hacerla con un ejemplo:
Para hacer el enlace A-B, los reactivos se tienen que cortar las distancias, pero esto aumenta la fuerza de repulsión de los electrones. Para evitar esta repulsión, los reactivos tendrán que acercarse con suficiente energía cinética. Por encima de esta energía, las moléculas A y B forman enlaces y a la vez, las moléculas B y C están rompiendo el suyo. En este momento hay un complejo formado por A, B y C, llamado complejo activado. Al final todos los enlaces del B y C serán rotos y los enlaces A y B serán formados, es decir, los productos.
También hay que hacer mención de la energía de activación , que es la diferencia entre la energía de los reactivos y la del complejo activado. Se puede considerar como una barrera energética por la que deben pasar los reactivos para pasar a ser productos.
Intermedios de reacción
[editar]Los intermedios de reacción son especies químicas, a menudo inestables y de vida corta (aunque a veces pueden aislarse), que no son reactantes ni productos de la reacción química global, sino productos y/o reactantes temporales en los pasos de reacción del mecanismo. Los intermediarios de la reacción suelen ser radicales libres o iones.
La cinética (velocidades relativas de los pasos de reacción y la ecuación de velocidad para la reacción global) se explica en términos de la energía necesaria para la conversión de los reactantes a los estados de transición propuestos (estados moleculares que corresponden a los máximos en las coordenadas de reacción y a puntos de equilibrio en la superficie de energía potencial para la reacción).
Tipos
[editar]Reacciones elementales o concertadas
[editar]La Ley de velocidad permite caracterizar un mecanismo de reacción en Una reacción elemental transcurre en solo una etapa. Esta reacción se produce con una formación de un solo complejo activado y solo tiene que superar una barrera energética. Se representa en una sola ecuación química.
Existen 3 tipos de reacciones elementales, los cuales son:
- Combinación: A+B → AB
- Descomposición: AB → A+B
- Desplazamiento: AB+C → AC+B
Reacciones complejas
[editar]Una reacción compleja transcurre en 2 o más etapas, con formación de intermediarios. También podemos decir que es un conjunto de reacciones elementales, donde hay más de una formación de complejos activados diferentes y supera diferentes barreras energéticas. Se expresa en varias ecuaciones químicas o en una global. En la ecuación química global, se representa el estado inicial y el estado final del global de las reacciones, pero no presenta como ha transcurrido la reacción.
Los intermediarios son moléculas que aparecen en el mecanismo de la reacción, pero no en la ecuación inicial.
Molecularidad
[editar]La molecularidad es un concepto bastante útil para poder determinar cómo es el estado de transición y cuanta energía se necesita para llegar a él. Dado que las velocidades de reacción en una primera aproximación dependen únicamente del paso lento, se define como el número de moléculas involucradas en el estado de transición de la reacción elemental más lenta:
- Unimoleculares: Solo participa una molécula.
- Bimoleculares: Participan 2 moléculas.
- Trimoleculares: Participan 3 moléculas
La molecularidad puede obtenerse experimentalmente como el orden de reacción en la ley de velocidad. En ocasiones existen órdenes de reacción fraccionarios, porque el reactivo adicionado no reacciona directamente sino lo hace un intermediario que está en equilibrio con este o si existe más de un reacción elemental "lenta" (en estos casos los órdenes de reacción no pueden interpretarse como la molecularidad). Teniendo en cuenta que las moléculas de una sustancia se encuentran en una distribución de Boltzmann es muy improbable estadísticamente que choquen cuatro moléculas al mismo tiempo por eso no existen reacciones tetramoleculares.
Ejemplo de mecanismo
[editar]Como ejemplo consideramos la reacción global entre el óxido nítrico y el oxígeno:
Se sabe que los productos no se forman directamente como resultado de la colisión de dos moléculas NO con una molécula de O2 porque se ha encontrado la especie N2O2 durante el curso de la reacción. Un mecanismo posible es suponer que la reacción se lleva a cabo en dos etapas o reacciones elementales como las siguientes:
primera etapa
segunda etapa
En la primera etapa dos moléculas de NO chocan para formar una molécula de N2O2; es una reacción bimolecular. Después, sigue una reacción, entre el N2O2 y el O2 para formar dos moléculas de NO2; es una reacción bimolecular. La ecuación química global, que representa el cambio total, se puede interpretar como la suma de estas dos etapas.
Las especies como el N2O2 es el intermediario de la reacción.
Reacciones orgánicas por su mecanismo
[editar]En química orgánica cada reacción tiene un mecanismo de reacción por pasos que explica cómo sucede, aunque no siempre es clara una descripción detallada a partir solamente de una lista de reactantes. Las reacciones orgánicas pueden ser organizadas en algunos tipos básicos. Algunas reacciones encajan en más de una categoría. Por ejemplo, algunas reacciones de sustitución siguen una trayectoria de adición-eliminación. Esta apreciación general no pretende incluir cada reacción orgánica individual. Por el contrario, solamente pretende cubrir las reacciones básicas.
| Tipo de reacción | Subtipo | Comentario |
|---|---|---|
| Reacciones de adición | adición electrofílica | incluye reacciones tales como la halogenación, hidrohalogenación e hidratación. |
| adición nucleofílica | ||
| adición radicalaria | ||
| Reacción de eliminación | incluye procesos tales como la deshidratación, y se observa que siguen mecanismos de reacción E1, E2, o E1cB | |
| Reacciones de sustitución | sustitución nucleofílica alifática | con mecanismos de reacción SN1, SN2 y SNi |
| sustitución nucleofílica aromática | ||
| sustitución nucleofílica acílica | ||
| sustitución electrofílica | ||
| sustitución electrofílica aromática | ||
| sustitución radicalaria | ||
| reacciones orgánicas redox | son reacciones redox específicas de los compuestos orgánicos y son muy comunes. | |
| Reacciones de transposición | Transposiciones 1,2 | |
| Reacciones pericíclicas | ||
| metátesis |
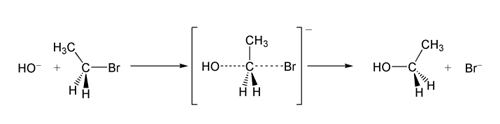
En general, el curso paso a paso de los mecanismos de reacción puede ser representado usando fórmulas estructurales y estructuras moleculares, en las que se usan flechas curvadas para seguir el movimiento de los electrones como materiales de transición iniciales, hasta los intermediarios y productos.
Otros métodos experimentales para determinar el mecanismo
[editar]Se han diseñado muchos experimentos que sugieren la posible secuencia de pasos en un mecanismo de reacción, entre ellos:
- medición del efecto de la temperatura (ecuación de Arrhenius) para determinar la energía de activación[3]
- observación espectroscópica de productos intermedios de reacción
- determinación de la estereoquímica de los productos, por ejemplo en las reacciones de sustitución nucleofílica[4]
- medición del efecto del sustitución isotópica en la velocidad de reacción[5]
- para reacciones en disolución, medición del efecto de la presión sobre la velocidad de reacción para determinar el cambio de volumen en la formación del complejo activado[6][7]
- Para reacciones de iones en solución, medición del efecto de la fuerza iónica en la velocidad de reacción[8][9].
- observación directa del complejo activado mediante espectroscopía de sonda de bomba[10]
- quimioluminiscencia infrarroja para detectar la excitación vibracional en los productos[11][12].
- espectrometría de masas por ionización de electrospray.[13]
- Experimentos cruzados.[14]. En un experimento cruzado, dos reactantes similares pero distinguibles experimentan simultáneamente una reacción como parte de la misma mezcla de reacción. Los productos formados corresponderán directamente a uno de los dos reactantes (productos no cruzados) o incluirán componentes de ambos reactantes (productos cruzados). El objetivo de un experimento de cruce es determinar si un proceso de reacción implica o no una etapa en la que los componentes de cada reactante tienen la oportunidad de intercambiarse entre sí.
Véase también
[editar]- Reacción orgánica
- Mecanismo de reacción electroquímico
- Abstracción nucleofílica
- Asistencia anquimérica
- Reacción de Finkelstein
Referencias
[editar]- ↑ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 3rd edition, New York: Wiley, ISBN 9780471854722
- ↑ Espenson, James H. Chemical Kinetics and Reaction Mechanisms (2nd ed., McGraw-Hill, 2002) chap.6, Deduction of Reaction Mechanisms ISBN 0-07-288362-6
- ↑ Espenson p.156-160
- ↑ Morrison R.T. y Boyd R.N. Organic Chemistry (4ª ed., Allyn and Bacon 1983) p.216-9 y p.228-231, ISBN 0-205-05838-8
- ↑ Atkins P y de Paula J, Physical Chemistry (8ª ed., W.H. Freeman 2006) p.816-8 ISBN 0-7167-8759-8
- ↑ Moore J.W. y Pearson R.G. Cinética y Mecanismo (3ª ed., John Wiley 1981) p.276-8 ISBN 0-471-03558-0
- ↑ Laidler K.J. y Meiser J.H., Physical Chemistry (Benjamin/Cummings 1982) p.389-392 ISBN 0-8053-5682-7
- ↑ Atkins y de Paula p.884-5
- ↑ Laidler y Meiser p.388-9
- ↑ Atkins y de Paula p.892-3
- ↑ Atkins y de Paula p.886
- ↑ Laidler y Meiser p.396-7
- ↑ Investigación de reacciones químicas en solución utilizando API-MS Leonardo Silva Santos, Larissa Knaack, Jurgen O. Metzger Int. J. Mass Spectrom.; 2005; 246 pp 84 - 104; (Revisión) doi 10.1016/j.ijms.2005.08.016
- ↑ Espenson p.112




