Тиазол: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
дописал |
|||
| (не показаны 4 промежуточные версии 4 участников) | |||
| Строка 7: | Строка 7: | ||
| традиционные названия = |
| традиционные названия = |
||
| хим. формула = C<sub>3</sub>H<sub>3</sub>SN |
| хим. формула = C<sub>3</sub>H<sub>3</sub>SN |
||
| эмпирическая формула = |
|||
| молярная масса = 85,13 |
| молярная масса = 85,13 |
||
| темп. плавления = |
| темп. плавления = |
||
| Строка 35: | Строка 34: | ||
| EINECS = |
| EINECS = |
||
| SMILES = |
| SMILES = |
||
| Номер UN = |
|||
| RTECS = |
| RTECS = |
||
| ЕС = |
| ЕС = |
||
| Строка 55: | Строка 53: | ||
== Физические и химические свойства == |
== Физические и химические свойства == |
||
Тиазол представляет собой бесцветную жидкость с запахом [[пиридин]]а. Тиазол растворим в воде и в органических растворителях. |
Тиазол представляет собой бесцветную жидкость с запахом [[пиридин]]а. Тиазол растворим в воде и в органических растворителях. |
||
| Строка 68: | Строка 65: | ||
Тиазол вступает также в реакции [[Нуклеофильное замещение|нуклеофильного замещения]]. Легче всего замещение идёт в положение 2 по механизму [[Реакция Чичибабина|реакции Чичибабина]], например, замещение атома водорода на аминогруппу и реакции металлирования. |
Тиазол вступает также в реакции [[Нуклеофильное замещение|нуклеофильного замещения]]. Легче всего замещение идёт в положение 2 по механизму [[Реакция Чичибабина|реакции Чичибабина]], например, замещение атома водорода на аминогруппу и реакции металлирования. |
||
Окисление тиазола протекает по атому азота с образованием N-оксидов. Тиазол устойчив к восстановителям в т. ч. к водороду в момент выделения и в присутствии катализаторов. В то же время он реагирует с сильными восстановителями: [[никель Ренея]] разрушает молекулу тиазола с десульфуризацией и образованием алифатических соединений, а [[борогидрид натрия]] NaBH{{sub|4}} превращает его в тетрагидротиазол. |
Окисление тиазола протекает по атому азота с образованием [[Оксиды аминов|N-оксидов]]. Тиазол устойчив к восстановителям в т. ч. к водороду в момент выделения и в присутствии катализаторов. В то же время он реагирует с сильными восстановителями: [[никель Ренея]] разрушает молекулу тиазола с десульфуризацией и образованием алифатических соединений, а [[борогидрид натрия]] NaBH{{sub|4}} превращает его в тетрагидротиазол. |
||
== Получение и применение == |
== Получение и применение == |
||
Синтез тиазола и его производных осуществляется из аминотиолов и из тиоамидов по общей схеме: |
Синтез тиазола и его производных осуществляется из аминотиолов и из тиоамидов по общей схеме: |
||
| Строка 80: | Строка 76: | ||
Некоторые окрашенные производные тиазола являются красителями. |
Некоторые окрашенные производные тиазола являются красителями. |
||
== |
== Примечания == |
||
{{примечания}} |
|||
== Литература == |
|||
| ⚫ | |||
* {{книга |автор = |
* {{книга |автор = Зефиров Н.С. и др.|часть = т.4 Пол-Три|заглавие = Химическая энциклопедия|оригинал = |ссылка = |ответственный = |издание = |место = М.|издательство = Большая Российская Энциклопедия|год = 1995|том = |страницы = |страниц = 639|серия = |isbn = 5-85270-092-4|тираж = 20000}} |
||
| ⚫ | |||
[[Категория: |
[[Категория:Тиазолы]] |
||
Текущая версия от 19:41, 18 апреля 2021
| Тиазол | |
|---|---|
 | |
| Общие | |
| Хим. формула | C3H3SN |
| Физические свойства | |
| Молярная масса | 85,13 г/моль |
| Плотность | 1,198 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | −33 °C[1] |
| • кипения | 117-118 °C |
| Оптические свойства | |
| Показатель преломления | 1,5969 |
| Классификация | |
| Рег. номер CAS | 288-47-1 |
| PubChem | 9256 |
| Рег. номер EINECS | 206-021-3 |
| SMILES | |
| InChI | |
| ChEBI | 43732 |
| ChemSpider | 8899 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
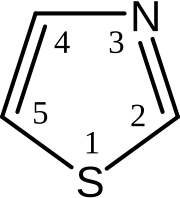
Тиазол — гетероциклическое соединение, аналог тиофена, содержащий вместо CH-группы в положении 3 атом азота.
Физические и химические свойства
[править | править код]Тиазол представляет собой бесцветную жидкость с запахом пиридина. Тиазол растворим в воде и в органических растворителях.
Как и молекулы других азолов, молекула тиазола обладает гетероароматической 6π-электронной системой. По своим химическим свойствам тиазол приближается к пиридину и тиофену. Тиазол вступает в реакции электрофильного замещения, но его реакционноспособность снижается вследствие N-протонирования или комплексообразования с кислотами Льюиса. Однако в отсутствие кислот Льюиса реакции электрофильного замещения, в частности, нитрование в среде уксусного ангидрида и бромирование в бензоле, идут в положение 5 по механизму образования σ-комплекса. При этом реакционноспособность уменьшается в ряду 5- > 2- > 4-положение.
Также возможно протекание реакций по илидному механизму, например, реакция изотопного обмена:
Тиазол вступает также в реакции нуклеофильного замещения. Легче всего замещение идёт в положение 2 по механизму реакции Чичибабина, например, замещение атома водорода на аминогруппу и реакции металлирования.
Окисление тиазола протекает по атому азота с образованием N-оксидов. Тиазол устойчив к восстановителям в т. ч. к водороду в момент выделения и в присутствии катализаторов. В то же время он реагирует с сильными восстановителями: никель Ренея разрушает молекулу тиазола с десульфуризацией и образованием алифатических соединений, а борогидрид натрия NaBH4 превращает его в тетрагидротиазол.
Получение и применение
[править | править код]Синтез тиазола и его производных осуществляется из аминотиолов и из тиоамидов по общей схеме:
Некоторые производные тиазола являются лекарственными препаратами: 2-сульфаниламидотиазол (норсульфазол) и 2-(N-о-карбоксибензоилсульфанил)амидотиазол (фталазол). Тиазолидиновый цикл является структурными фрагментом молекулы пенициллина и его полусинтетических аналогов. Цикл тиазола входит в состав тиамина.
Некоторые окрашенные производные тиазола являются красителями.
Примечания
[править | править код]- ↑ Bradley J., Williams A., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // (unknown type) — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
Литература
[править | править код]- Зефиров Н.С. и др. т.4 Пол-Три // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1995. — 639 с. — 20 000 экз. — ISBN 5-85270-092-4.
- О. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.

