Бактериородопсин: различия между версиями
| [непроверенная версия] | [отпатрулированная версия] |
Спасено источников — 2, отмечено мёртвыми — 0. Сообщить об ошибке. См. FAQ.) #IABot (v2.0.8.8 |
|||
| (не показана 21 промежуточная версия 13 участников) | |||
| Строка 2: | Строка 2: | ||
| Symbol = Bac_rhodopsin |
| Symbol = Bac_rhodopsin |
||
| Name = |
| Name = |
||
| image = |
| image =1m0l_opm.png |
||
| width = |
| width = |
||
| caption = Тример бактериородопсина |
| caption = Тример бактериородопсина |
||
| Строка 16: | Строка 16: | ||
}} |
}} |
||
''' |
'''Бактериородопси́ны''' — семейство [[мембранные белки|мембранных]] светочувствительных [[белки|белков]] [[археи|археот]] (например, [[галобактерии|галобактерий]]). Бактериородопсины осуществляют перенос [[протон]]а через [[плазматическая мембрана|плазматическую мембрану]], по строению сходны с [[родопсин]]ами [[млекопитающие|млекопитающих]]. |
||
Этот белок выполняет ту же функцию, что и [[хлорофилл]] в других организмах - обеспечивает преобразование энергии солнечного света в энергию химических связей. Он действует как зависимая от света [[протонная помпа]]. Поглощение кванта света приводит к быстрым структурным изменениям в молекуле, благодаря которым происходит перенос катиона водорода с цитоплазмы на внешнюю сторону клеточной мембраны. |
|||
== Состав белка == |
== Состав белка == |
||
Трансмембранная часть бактериородопсина сложена из 7 регулярных <math>\alpha</math>-спиралей, идущих от одного до другого края мембраны, а одинокая <math>\beta</math>-шпилька и все нерегулярные участки цепи (соединяющие спирали-петли) выходят из мембраны<ref> А. В. Финкельштейн, О. Б. Птицын, «Физика белка», 2002 </ref>. Сидящие на <math>\alpha</math>-спиралях [[гидрофобность|гидрофобные]] группы обращены «наружу» к липидам (тоже [[гидрофобность|гидрофобным]]) мембраны. Полярные же группы (их немного) обращены внутрь очень узкого канала, по которому идет протон. |
Трансмембранная часть бактериородопсина сложена из 7 регулярных <math>\alpha</math>-спиралей, идущих от одного до другого края мембраны, а одинокая <math>\beta</math>-шпилька и все нерегулярные участки цепи (соединяющие спирали-петли) выходят из мембраны<ref> А. В. Финкельштейн, О. Б. Птицын, «Физика белка», 2002 </ref>. Сидящие на <math>\alpha</math>-спиралях [[гидрофобность|гидрофобные]] группы обращены «наружу» к липидам (тоже [[гидрофобность|гидрофобным]]) мембраны. Полярные же группы (их немного) обращены внутрь очень узкого канала, по которому идет протон. |
||
== Процесс переноса протона через мембрану == |
== Процесс переноса протона через мембрану == |
||
[[Протонная проводимость]] осуществляется при содействии |
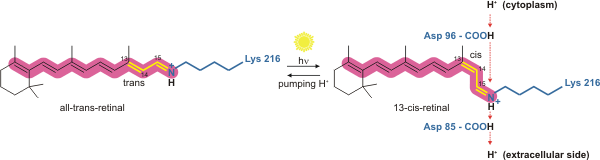
[[Протонная проводимость]] осуществляется при содействии прикреплённой внутри пучка спиралей молекулы кофактора — [[Ретиналь|ретиналя]]. Он перекрывает центральный канал бактериородопсина. Поглотив [[фотон]], ретиналь переходит из полностью-транс- в 13-цис-форму. При этом он изгибается и переносит [[протон]] с одного конца семиспирального пучка на другой. А потом ретиналь разгибается и возвращается назад, но уже без протона. |
||
[[Файл:Bacteriorhodopsin retinal.png|Alt text]] |
|||
== Применение бактериородопсина в нано-биотехнологиях == |
== Применение бактериородопсина в нано-биотехнологиях == |
||
| ⚫ | В 1971 году Остерхельт (ФРГ) и Стохениус (США) сумели выделить бактериородопсин из клеточной мембраны галобактерии Halobacterium halobium<ref> Oesterhelt D., Stoeckenius W. (1971) Rhodopsin — Like Protein from the Purple Membrane of Halobacterium Halobium, Nature, V. 233, № 89, pp. 149-60. </ref><ref> Vought B.W., Birge R.R. (eds.) (1999) Molecular electronics and hybrid computers./in: Wiley Encyclopedia of Electrical and Electronics Engineering, Wiley-Interscience: New York,.pp. 477—490.</ref>. Природные фотопреобразующие наноматериалы используются в фармакологии, биомедицине, био- и нанотехнологиях. В 1994-м группа российских ученых впервые в мире получила пластинки с бактериородопсином. Пластинки с бактериородопсином можно применять в биомолекулярной электронике. Главный результат достижения — ориентирование пурпурных мембран, которые содержат бактериородопсин в гидрофобных и гидрофильных средах<ref> Мосин О. В., Складнев Д. А., Егорова Т. А., Швец В. И. Получение бактериородопсина H. halobium, меченного дейтерием по остаткам ароматическим аминокислот фенилаланина, тирозина и триптофана // Биотехнология, 1996. — № 10. — С. 24-40.</ref>. В пластинках на желатиновой основе содержится около 50 % бактериородопсина. На основе бактериородопсина создается фоторецептор с микроэлектродом из SnO<sub>2</sub> и на светоизлучающие диоды подается сигнал.<ref> Мосин O.В., Складнев Д. А., Швец В. И. Включение дейтерированных ароматических аминокислот в молекулу бактериородопсина Halobacterium halobium // Прикладная биохимия и микробиология, 1999. — Т. 35. — № 1. — с. 34-42. </ref> Главное применение этого нанотехнологического материала — в искусственных энерго- и фотопреобразующих мембранах и нанопленках. |
||
== Галерея == |
|||
| ⚫ | В 1971 году Остерхельт (ФРГ) и Стохениус (США) сумели выделить бактериородопсин из клеточной мембраны галобактерии Halobacterium halobium<ref> Oesterhelt D., Stoeckenius W. (1971) Rhodopsin — Like Protein from the Purple Membrane of Halobacterium Halobium, Nature, V. 233, № 89, pp. 149-60. </ref><ref> Vought B.W., Birge R.R. (eds.) (1999) Molecular electronics and hybrid computers./in: Wiley Encyclopedia of Electrical and Electronics Engineering, Wiley-Interscience: New York,.pp. 477—490.</ref>. Природные фотопреобразующие наноматериалы используются в фармакологии, биомедицине, био- и нанотехнологиях. В 1994 группа российских ученых |
||
{|align="left" |
|||
|-valign="top" |
|||
|[[Файл:Bacteriorhodopsin conformation change.gif|thumb|400px|Конформационный переход.]] |
|||
|[[Файл:Bacteriorhodopsin subunit 1X0S.png|thumb|400px|Мономер бактериородопсина<ref name=PDB1X0S>{{cite web |url=http://www.rcsb.org/pdb/explore/explore.do?structureId=1X0S |title=Crystal structure of the 13-cis isomer of bacteriorhodopsin. |last1=Nishikawa |first1=T. |last2=Murakami |first2=M. |date=2005-03-28 |publisher=RCSB Protein Data Bank (PDB) |id=PDB ID: 1X0S |doi=10.2210/pdb1x0s/pdb |accessdate=2012-10-07 |archive-date=2013-10-15 |archive-url=https://web.archive.org/web/20131015193322/http://www.rcsb.org/pdb/explore/explore.do?structureId=1X0S |deadlink=no }}</ref><ref name=Nishikawa05>{{статья |заглавие=Crystal structure of the 13-cis isomer of bacteriorhodopsin in the dark-adapted state. |издание=J.Mol.Biol. |том=352 |страницы=319—328 |издательство=Elsevier |id=PDB ID: 1X0S |pmid=16084526 |doi=10.1016/j.jmb.2005.07.021 |ссылка=http://www.sciencedirect.com/science/article/pii/S0022283605008090 |accessdate=2012-10-07 |язык=en |тип=journal |автор=Nishikawa, T.; Murakami, M. |год=2005}}</ref><ref name="RasTop">Image created with [http://www.geneinfinity.org/rastop/ RasTop] {{Wayback|url=http://www.geneinfinity.org/rastop/ |date=20150417231543 }} (Molecular Visualization Software)</ref>.]] |
|||
|[[Файл:Bacteriorhodopsin trimer 1X0S.png|thumb|800px|Тример бактериородопсина (вид сверху).]] |
|||
|} |
|||
{{-}} |
|||
== Примечания == |
== Примечания == |
||
| Строка 32: | Строка 43: | ||
== См. также == |
== См. также == |
||
* [[Протеородопсин]] |
|||
* [[Родопсин]] |
* [[Родопсин]] |
||
* [[Ретинол]] |
* [[Ретинол]] |
||
* [[Сенсорный родопсин II]] |
* [[Сенсорный родопсин II]] |
||
* [[Бактериородопсин-содержащие |
* [[Бактериородопсин-содержащие плёнки]] |
||
{{внешние ссылки}} |
|||
[[Категория:Белки]] |
[[Категория:Белки]] |
||
[[Категория:Фотосинтез]] |
|||
Текущая версия от 22:02, 4 июня 2022
| Бактериородопсин | |
|---|---|
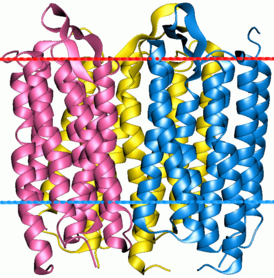 Тример бактериородопсина | |
| Идентификаторы | |
| Символ | Bac_rhodopsin |
| Pfam | PF01036 |
| InterPro | IPR001425 |
| PROSITE | PDOC00291 |
| SCOP | 2brd |
| SUPERFAMILY | 2brd |
| TCDB | 3.E.1 |
| OPM superfamily | 6 |
| OPM protein | 1vgo |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Бактериородопси́ны — семейство мембранных светочувствительных белков археот (например, галобактерий). Бактериородопсины осуществляют перенос протона через плазматическую мембрану, по строению сходны с родопсинами млекопитающих.
Этот белок выполняет ту же функцию, что и хлорофилл в других организмах - обеспечивает преобразование энергии солнечного света в энергию химических связей. Он действует как зависимая от света протонная помпа. Поглощение кванта света приводит к быстрым структурным изменениям в молекуле, благодаря которым происходит перенос катиона водорода с цитоплазмы на внешнюю сторону клеточной мембраны.
Состав белка
[править | править код]Трансмембранная часть бактериородопсина сложена из 7 регулярных -спиралей, идущих от одного до другого края мембраны, а одинокая -шпилька и все нерегулярные участки цепи (соединяющие спирали-петли) выходят из мембраны[1]. Сидящие на -спиралях гидрофобные группы обращены «наружу» к липидам (тоже гидрофобным) мембраны. Полярные же группы (их немного) обращены внутрь очень узкого канала, по которому идет протон.
Процесс переноса протона через мембрану
[править | править код]Протонная проводимость осуществляется при содействии прикреплённой внутри пучка спиралей молекулы кофактора — ретиналя. Он перекрывает центральный канал бактериородопсина. Поглотив фотон, ретиналь переходит из полностью-транс- в 13-цис-форму. При этом он изгибается и переносит протон с одного конца семиспирального пучка на другой. А потом ретиналь разгибается и возвращается назад, но уже без протона.
Применение бактериородопсина в нано-биотехнологиях
[править | править код]В 1971 году Остерхельт (ФРГ) и Стохениус (США) сумели выделить бактериородопсин из клеточной мембраны галобактерии Halobacterium halobium[2][3]. Природные фотопреобразующие наноматериалы используются в фармакологии, биомедицине, био- и нанотехнологиях. В 1994-м группа российских ученых впервые в мире получила пластинки с бактериородопсином. Пластинки с бактериородопсином можно применять в биомолекулярной электронике. Главный результат достижения — ориентирование пурпурных мембран, которые содержат бактериородопсин в гидрофобных и гидрофильных средах[4]. В пластинках на желатиновой основе содержится около 50 % бактериородопсина. На основе бактериородопсина создается фоторецептор с микроэлектродом из SnO2 и на светоизлучающие диоды подается сигнал.[5] Главное применение этого нанотехнологического материала — в искусственных энерго- и фотопреобразующих мембранах и нанопленках.
Галерея
[править | править код] |
 |
 |
Примечания
[править | править код]- ↑ А. В. Финкельштейн, О. Б. Птицын, «Физика белка», 2002
- ↑ Oesterhelt D., Stoeckenius W. (1971) Rhodopsin — Like Protein from the Purple Membrane of Halobacterium Halobium, Nature, V. 233, № 89, pp. 149-60.
- ↑ Vought B.W., Birge R.R. (eds.) (1999) Molecular electronics and hybrid computers./in: Wiley Encyclopedia of Electrical and Electronics Engineering, Wiley-Interscience: New York,.pp. 477—490.
- ↑ Мосин О. В., Складнев Д. А., Егорова Т. А., Швец В. И. Получение бактериородопсина H. halobium, меченного дейтерием по остаткам ароматическим аминокислот фенилаланина, тирозина и триптофана // Биотехнология, 1996. — № 10. — С. 24-40.
- ↑ Мосин O.В., Складнев Д. А., Швец В. И. Включение дейтерированных ароматических аминокислот в молекулу бактериородопсина Halobacterium halobium // Прикладная биохимия и микробиология, 1999. — Т. 35. — № 1. — с. 34-42.
- ↑ Nishikawa, T.; Murakami, M. Crystal structure of the 13-cis isomer of bacteriorhodopsin. RCSB Protein Data Bank (PDB) (28 марта 2005). doi:10.2210/pdb1x0s/pdb. Дата обращения: 7 октября 2012. Архивировано 15 октября 2013 года.
- ↑ Nishikawa, T.; Murakami, M. Crystal structure of the 13-cis isomer of bacteriorhodopsin in the dark-adapted state. (англ.) // J.Mol.Biol. : journal. — Elsevier, 2005. — Vol. 352. — P. 319—328. — doi:10.1016/j.jmb.2005.07.021. — PMID 16084526.
- ↑ Image created with RasTop Архивная копия от 17 апреля 2015 на Wayback Machine (Molecular Visualization Software)