Креатинфосфорная кислота: различия между версиями
| [непроверенная версия] | [отпатрулированная версия] |
Bokshits (обсуждение | вклад) Нет описания правки |
Спасено источников — 2, отмечено мёртвыми — 0. Сообщить об ошибке. См. FAQ.) #IABot (v2.0.9.3 |
||
| (не показано 16 промежуточных версий 15 участников) | |||
| Строка 1: | Строка 1: | ||
{{Вещество |
{{Вещество |
||
| картинка = Phosphocreatine. |
| картинка = Phosphocreatine.svg |
||
| картинка3D = |
| картинка3D = |
||
| картинка малая = |
| картинка малая = |
||
| наименование = |
| наименование = |
||
| Строка 16: | Строка 16: | ||
| состояние = |
| состояние = |
||
| динамическая вязкость = |
| динамическая вязкость = |
||
| кинематическая вязкость = |
| кинематическая вязкость = |
||
| темп. плавления = |
| темп. плавления = |
||
| Строка 33: | Строка 33: | ||
| интервал трансформации = |
| интервал трансформации = |
||
| температура размягчения = |
| температура размягчения = |
||
| давление пара = |
| давление пара = |
||
| конст. диссоц. кислоты = |
| конст. диссоц. кислоты = |
||
| Строка 46: | Строка 46: | ||
| вещество4 = |
| вещество4 = |
||
| вращение = |
| вращение = |
||
| изоэлектрическая точка = |
| изоэлектрическая точка = |
||
| диапазон прозрачности = |
| диапазон прозрачности = |
||
| показатель преломления = |
| показатель преломления = |
||
| угол Брюстера = |
| угол Брюстера = |
||
| гибридизация = |
| гибридизация = |
||
| координационная геометрия = |
| координационная геометрия = |
||
| кристаллическая структура = |
| кристаллическая структура = |
||
| дипольный момент = |
| дипольный момент = |
||
| CAS = 67-07-2 |
| CAS = 67-07-2 |
||
| Строка 61: | Строка 61: | ||
| SMILES = OC(CN(C)C(N)=NP(O)(O)=O)=O |
| SMILES = OC(CN(C)C(N)=NP(O)(O)=O)=O |
||
| ЕС = |
| ЕС = |
||
| RTECS = |
| RTECS = |
||
| ЛД50 = |
| ЛД50 = |
||
| Строка 68: | Строка 68: | ||
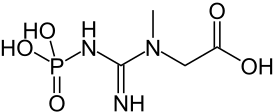
'''Креатинфосфорная кислота''' ('''креатинфосфат''', фосфокреатин) — 2-[метил-(N'-фосфонокарбоимидоил)амино]уксусная кислота. Бесцветные кристаллы, растворимые в воде, легко гидролизуется с расщеплением фосфамидной связи N-P в кислой среде, устойчива в щелочной. |
'''Креатинфосфорная кислота''' ('''креатинфосфат''', фосфокреатин) — 2-[метил-(N'-фосфонокарбоимидоил)амино]уксусная кислота. Бесцветные кристаллы, растворимые в воде, легко гидролизуется с расщеплением фосфамидной связи N-P в кислой среде, устойчива в щелочной. |
||
Кислота была открыта<ref>{{книга |
|||
|author=Saks, Valdur |
|||
|год=2007 |
|||
|заглавие=Molecular system bioenergetics: energy for life |
|||
|ссылка=https://archive.org/details/molecularsystemb0000unse |
|||
|место=Weinheim |
|||
|издательство=[[Wiley-VCH]] |
|||
|страницы=[https://archive.org/details/molecularsystemb0000unse/page/2 2] |
|||
|isbn=978-3-527-31787-5 |
|||
|язык=und |
|||
}}</ref><ref name=ochoa>{{книга |
|||
|год=1989 |
|||
|заглавие=David Nachmansohn |
|||
|серия=Biographical Memoirs |
|||
|издательство={{Нп3|National Academies Press}} |
|||
|том=58 |
|||
|страницы=357—404 |
|||
|isbn=978-0-309-03938-3 |
|||
|язык=und |
|||
|автор=Ochoa, Severo |
|||
|ответственный=Sherman, E. J.; National Academy of Sciences |
|||
}}</ref> Филиппом и Грейс Эгглтонами из [[Кембриджский университет|Кембриджского университета]]<ref>{{статья |
|||
|заглавие=The inorganic phosphate and a labile form of organic phosphate in the gastrocnemius of the frog |
|||
|издание={{Нп3|Biochemical Journal}} |
|||
|том=21 |
|||
|номер=1 |
|||
|страницы=190—195 |
|||
|ссылка=http://www.biochemj.org/bj/021/bj0210190.htm |
|||
|pmid=16743804 |
|||
|pmc=1251888 |
|||
|язык=en |
|||
|тип=journal |
|||
|автор=Eggleton, Philip; Eggleton, Grace Palmer |
|||
|год=1927 |
|||
|archivedate=2020-05-30 |
|||
|archiveurl=https://web.archive.org/web/20200530010056/https://portlandpress.com/biochemj |
|||
}}</ref> и независимо [[Фиске, Сайрус|Сайрусом Фиске]] и [[Суббарао, Йеллапрагада|Йеллапрагадой Суббарао]] из Гарвардской медицинской школы<ref>{{статья |
|||
|заглавие=The nature of the 'inorganic phosphate' in voluntary muscle |
|||
|издание=Science |
|||
|том=65 |
|||
|номер=1686 |
|||
|страницы=401—403 |
|||
|ссылка=http://www.sciencemag.org/content/vol65/issue1686/index.dtl#articles |
|||
|doi=10.1126/science.65.1686.401 |
|||
|pmid=17807679 |
|||
|язык=en |
|||
|тип=journal |
|||
|автор=Fiske, Cyrus H.; Subbarao, Yellapragada |
|||
|год=1927 |
|||
|archivedate=2009-10-17 |
|||
|archiveurl=https://web.archive.org/web/20091017112346/http://www.sciencemag.org/content/vol65/issue1686/index.dtl#articles |
|||
}}</ref> в 1927 году. |
|||
Лабораторный синтез — [[фосфорилирование]] креатина POCl<sub>3</sub> в щелочной среде. |
Лабораторный синтез — [[фосфорилирование]] креатина POCl<sub>3</sub> в щелочной среде. |
||
Креатинфосфат — продукт обратимого метаболического N-фосфорилирования [[креатин]]а, являющийся, подобно [[Аденозинтрифосфорная кислота|АТФ]], высокоэнергетическим соединением. Однако, в отличие от АТФ, гидролизуемой по пирофосфатной связи O-P, |
Креатинфосфат — продукт обратимого метаболического N-фосфорилирования [[креатин]]а, являющийся, подобно [[Аденозинтрифосфорная кислота|АТФ]], высокоэнергетическим соединением. Однако, в отличие от АТФ, гидролизуемой по пирофосфатной связи O-P, креатинфосфат гидролизуется по фосфамидной связи N-P, что обуславливает значительно больший энергетический эффект реакции. Так, при гидролизе изменение свободной энергии для креатина G<sub>0</sub>~ −43 кДж/моль, в то время как при гидролизе АТФ до [[Аденозиндифосфат|АДФ]] G<sub>0</sub>~ −30.5 кДж/моль. |
||
Креатинфосфат содержится преимущественно в возбудимых тканях (мышечная и нервная ткани) и его биологической функцией является поддержание постоянной концентрации АТФ за счёт обратимой реакции перефосфорилирования: |
Креатинфосфат содержится преимущественно в возбудимых тканях (мышечная и нервная ткани) и его биологической функцией является поддержание постоянной концентрации АТФ за счёт обратимой реакции перефосфорилирования: |
||
: '''креатинфосфат + АДФ ⇔ креатин + АТФ''' |
: '''креатинфосфат + АДФ ⇔ креатин + АТФ''' |
||
Эта реакция катализируется цитоплазматическими и митохондриальными ферментами-креатинкиназами; при расходе (и, соответственно, падении концентрации) АТФ, например, при сокращении клеток мышечной ткани, равновесие реакции сдвигается |
Эта реакция катализируется цитоплазматическими и митохондриальными ферментами-креатинкиназами; при расходе (и, соответственно, падении концентрации) АТФ, например, при сокращении клеток мышечной ткани, равновесие реакции сдвигается вправо, что ведёт к восстановлению нормальной концентрации АТФ. |
||
Концентрация креатинфосфата в покоящейся мышечной ткани в 3-8 раз превышает концентрацию АТФ, что позволяет компенсировать расход АТФ во время кратких периодов мышечной активности, в период покоя при отсутствии мышечной активности в ткани идёт гликолиз и окислительное фосфорилирование АДФ в АТФ, в результате чего равновесие реакции смещается влево и концентрация креатинфосфата восстанавливается. |
Концентрация креатинфосфата в покоящейся мышечной ткани в 3-8 раз превышает концентрацию АТФ, что позволяет компенсировать расход АТФ во время кратких периодов мышечной активности, в период покоя при отсутствии мышечной активности в ткани идёт гликолиз и окислительное фосфорилирование АДФ в АТФ, в результате чего равновесие реакции смещается влево и концентрация креатинфосфата восстанавливается. |
||
| Строка 82: | Строка 135: | ||
Креатинфосфат является одним из [[Фосфагены|фосфагенов]] — N-фосфорилированных производных [[гуанидин]]а, являющихся энергетическим депо, обеспечивающим быстрый синтез АТФ. Так, у многих [[Беспозвоночные|беспозвоночных]] (например, [[Насекомые|насекомых]]) роль фосфагена играет [[аргининфосфорная кислота]], у некоторых кольчатых червей — N-фосфоломбрицин. |
Креатинфосфат является одним из [[Фосфагены|фосфагенов]] — N-фосфорилированных производных [[гуанидин]]а, являющихся энергетическим депо, обеспечивающим быстрый синтез АТФ. Так, у многих [[Беспозвоночные|беспозвоночных]] (например, [[Насекомые|насекомых]]) роль фосфагена играет [[аргининфосфорная кислота]], у некоторых кольчатых червей — N-фосфоломбрицин. |
||
== Примечания == |
|||
{{примечания}} |
|||
== См. также == |
== См. также == |
||
| Строка 90: | Строка 146: | ||
== Литература == |
== Литература == |
||
* {{Из БСЭ|заглавие=Креатинфосфорная кислота (формула)}} |
|||
* [http://slovari.yandex.ru/art.xml?art=bse/00038/71300.htm&encpage=bse&mrkp=http%3A//hghltd.yandex.com/yandbtm%3Furl%3Dhttp%253A//encycl.yandex.ru/texts/bse/00038/71300.htm%26text%3D%25EA%25F0%25E5%25E0%25F2%25E8%25ED%25F4%25EE%25F1%25F4%25E0%25F2%26reqtext%3D%25EA%25F0%25E5%25E0%25F2%25E8%25ED%25F4%25EE%25F1%25F4%25E0%25F2%253A%253A1819103916%26%26isu%3D2 Креатинфосфорная кислота (формула). Большая советская энциклопедия] |
|||
{{biochem-stub}} |
{{biochem-stub}} |
||
[[Категория:Органические кислоты]] |
[[Категория:Органические кислоты]] |
||
[[Категория:Моноамидофосфаты]] |
|||
[[Категория:Гуанидины]] |
[[Категория:Гуанидины]] |
||
[[Категория:Соединения азота по алфавиту]] |
|||
Текущая версия от 10:58, 27 февраля 2023
| Креатинфосфорная кислота | |
|---|---|
 | |
| Общие | |
| Хим. формула | C4H10N3O5P |
| Физические свойства | |
| Молярная масса | 211,113 г/моль |
| Классификация | |
| Рег. номер CAS | 67-07-2 |
| PubChem | 9548602, 587 и 5359254 |
| Рег. номер EINECS | 200-643-9 |
| SMILES | |
| InChI | |
| ChEBI | 17287 |
| ChemSpider | 567 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Креатинфосфорная кислота (креатинфосфат, фосфокреатин) — 2-[метил-(N'-фосфонокарбоимидоил)амино]уксусная кислота. Бесцветные кристаллы, растворимые в воде, легко гидролизуется с расщеплением фосфамидной связи N-P в кислой среде, устойчива в щелочной.
Кислота была открыта[1][2] Филиппом и Грейс Эгглтонами из Кембриджского университета[3] и независимо Сайрусом Фиске и Йеллапрагадой Суббарао из Гарвардской медицинской школы[4] в 1927 году.
Лабораторный синтез — фосфорилирование креатина POCl3 в щелочной среде.
Креатинфосфат — продукт обратимого метаболического N-фосфорилирования креатина, являющийся, подобно АТФ, высокоэнергетическим соединением. Однако, в отличие от АТФ, гидролизуемой по пирофосфатной связи O-P, креатинфосфат гидролизуется по фосфамидной связи N-P, что обуславливает значительно больший энергетический эффект реакции. Так, при гидролизе изменение свободной энергии для креатина G0~ −43 кДж/моль, в то время как при гидролизе АТФ до АДФ G0~ −30.5 кДж/моль.
Креатинфосфат содержится преимущественно в возбудимых тканях (мышечная и нервная ткани) и его биологической функцией является поддержание постоянной концентрации АТФ за счёт обратимой реакции перефосфорилирования:
- креатинфосфат + АДФ ⇔ креатин + АТФ
Эта реакция катализируется цитоплазматическими и митохондриальными ферментами-креатинкиназами; при расходе (и, соответственно, падении концентрации) АТФ, например, при сокращении клеток мышечной ткани, равновесие реакции сдвигается вправо, что ведёт к восстановлению нормальной концентрации АТФ.
Концентрация креатинфосфата в покоящейся мышечной ткани в 3-8 раз превышает концентрацию АТФ, что позволяет компенсировать расход АТФ во время кратких периодов мышечной активности, в период покоя при отсутствии мышечной активности в ткани идёт гликолиз и окислительное фосфорилирование АДФ в АТФ, в результате чего равновесие реакции смещается влево и концентрация креатинфосфата восстанавливается.
В тканях креатинфосфат подвергается самопроизвольному неферментативному гидролизу с циклизацией в креатинин, выводящийся с мочой, уровень выделения креатинина зависит от состояния организма, меняясь при патологических состояниях, и является диагностическим признаком.
Креатинфосфат является одним из фосфагенов — N-фосфорилированных производных гуанидина, являющихся энергетическим депо, обеспечивающим быстрый синтез АТФ. Так, у многих беспозвоночных (например, насекомых) роль фосфагена играет аргининфосфорная кислота, у некоторых кольчатых червей — N-фосфоломбрицин.
Примечания
[править | править код]- ↑ Molecular system bioenergetics: energy for life (неопр.). — Weinheim: Wiley-VCH, 2007. — С. 2. — ISBN 978-3-527-31787-5.
- ↑ Ochoa, Severo. David Nachmansohn (неопр.) / Sherman, E. J.; National Academy of Sciences. — National Academies Press[англ.], 1989. — Т. 58. — С. 357—404. — (Biographical Memoirs). — ISBN 978-0-309-03938-3.
- ↑ Eggleton, Philip; Eggleton, Grace Palmer. The inorganic phosphate and a labile form of organic phosphate in the gastrocnemius of the frog (англ.) // Biochemical Journal[англ.] : journal. — 1927. — Vol. 21, no. 1. — P. 190—195. — PMID 16743804. — PMC 1251888. Архивировано 30 мая 2020 года.
- ↑ Fiske, Cyrus H.; Subbarao, Yellapragada. The nature of the 'inorganic phosphate' in voluntary muscle (англ.) // Science : journal. — 1927. — Vol. 65, no. 1686. — P. 401—403. — doi:10.1126/science.65.1686.401. — PMID 17807679. Архивировано 17 октября 2009 года.
См. также
[править | править код]Литература
[править | править код]- Креатинфосфорная кислота (формула) — статья из Большой советской энциклопедии.
Это заготовка статьи по биохимии. Помогите Википедии, дополнив её. |