Алкафтадин: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
KrBot (обсуждение | вклад) м - изолированная статья |
м Форматирование дат согласно Википедия:Техническое соглашение о датах и времени и Википедия:Обсуждение правил/Википедия:Техническое соглашение о датах и времени |
||
| (не показано 10 промежуточных версий 4 участников) | |||
| Строка 12: | Строка 12: | ||
}} |
}} |
||
'''Алкафтадин''' — [[лекарственный препарат]] для лечения [[Аллергический конъюнктивит|аллергического конъюнктивит]]а. Одобрен для применения: США (2010)<ref>{{cite web|url=https://www.fda.gov/drugs/nda-and-bla-approvals/new-molecular-entity-nme-drug-and-new-biologic-approvals|title=New Molecular Entity (NME) Drug and New Biologic Approvals|publisher=[[FDA]]|lang=en}}</ref> |
'''Алкафтадин''' — [[лекарственный препарат]] для лечения [[Аллергический конъюнктивит|аллергического конъюнктивит]]а<ref name="dailymed"/>. Одобрен для применения: США (2010)<ref>{{cite web|url=https://www.fda.gov/drugs/nda-and-bla-approvals/new-molecular-entity-nme-drug-and-new-biologic-approvals|title=New Molecular Entity (NME) Drug and New Biologic Approvals|publisher=[[FDA]]|lang=en|access-date=2020-04-26|archive-date=2021-09-29|archive-url=https://web.archive.org/web/20210929205356/https://www.fda.gov/drugs/nda-and-bla-approvals/new-molecular-entity-nme-drug-and-new-biologic-approvals|deadlink=no}}</ref><ref>{{citeweb |
||
|url = https://www.accessdata.fda.gov/drugsatfda_docs/nda/2010/022134s000TOC.cfm |
|||
|title = "Drug Approval Package: Lastacaft (alcaftadine) Ophthalmic Solution NDA #022134" |
|||
|author = |
|||
|date = 1999 |
|||
|publisher = U.S. Food and Drug Administration (FDA) |
|||
|accessdate = 2021-12-29 |
|||
|archive-date = 2020-06-10 |
|||
|archive-url = https://web.archive.org/web/20200610221126/https://www.accessdata.fda.gov/drugsatfda_docs/nda/2010/022134s000TOC.cfm |
|||
|deadlink = no |
|||
}}</ref>. |
|||
== Механизм действия == |
== Механизм действия == |
||
| Строка 25: | Строка 35: | ||
== Способ применения == |
== Способ применения == |
||
[[Глазные капли]]. 1 капля - 1 раз в день. |
[[Глазные капли]]. 1 капля - 1 раз в день. |
||
== Побочные эффекты == |
|||
В исследованиях, сравнивающих эффективность олопатадина к алькафтадину, не было показано увеличению неблагоприятных последствий в результате увеличения дозы от 0,05% до 0,1% и до 0,25%. Наиболее распространенным видимым побочным эффектом является раздражение в месте применения<ref name="Greiner">{{cite journal | vauthors = Greiner JV, Edwards-Swanson K, Ingerman A | title = Evaluation of alcaftadine 0.25% ophthalmic solution in acute allergic conjunctivitis at 15 minutes and 16 hours after instillation versus placebo and olopatadine 0.1% | journal = Clinical Ophthalmology | volume = 5 | pages = 87–93 | date = January 2011 | pmid = 21339800| pmc = 3037035 | doi = 10.2147/OPTH.S15379 }}</ref>. |
|||
== Продажи == |
|||
Продажи для алкафтадина компанией Allergan начались в июле 2010 года. С периода июля 2010 года до марта 2012 года совокупные продажи достигли 139 тысячи рецептов. Из этих 139 000 рецептов было 104 тысячи уникальных пациентов. В марте 2012 года алкафтадин превысил продажи элестата, и эта тенденция может продолжиться, поскольку выписывающие рецепты врачи считают алкафтадин наиболее действенным препаратом<ref>{{cite web | title = Lastacaft (alcaftadine ophthalmic solution 0.25%) | url = https://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/PediatricAdvisoryCommittee/UCM317430.pdf | archive-url = https://web.archive.org/web/20170215193100/https://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/PediatricAdvisoryCommittee/UCM317430.pdf | archive-date = 2017-02-15 | work = Drug Use Review | publisher = U.S. Food and Drug Administration | date = 2012-06-21 }}</ref>. |
|||
== Примечания == |
== Примечания == |
||
Текущая версия от 23:58, 12 ноября 2023
| Алкафтадин | |
|---|---|
 | |
| Химическое соединение | |
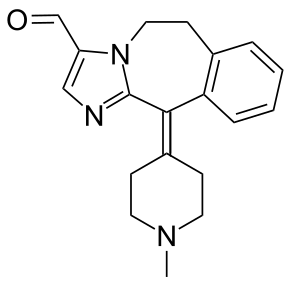
| ИЮПАК | 2-(1-Methylpiperidin-4-ylidene)-4,7-diazatricyclo[8.4.0.0(3,7)]tetradeca- 1(14),3,5,10,12-pentaene-6-carbaldehyde |
| Брутто-формула | C19H21N3O |
| CAS | 147084-10-4 |
| PubChem | 19371515 |
| DrugBank | DB06766 |
| Состав | |
| Классификация | |
| АТХ | S01GX11 |
| Другие названия | |
| Lastacaft | |
Алкафтадин — лекарственный препарат для лечения аллергического конъюнктивита[1]. Одобрен для применения: США (2010)[2][3].
Механизм действия
[править | править код]Показания
[править | править код]Аллергический конъюнктивит[1].
Противопоказания
[править | править код]Способ применения
[править | править код]Глазные капли. 1 капля - 1 раз в день.
Побочные эффекты
[править | править код]В исследованиях, сравнивающих эффективность олопатадина к алькафтадину, не было показано увеличению неблагоприятных последствий в результате увеличения дозы от 0,05% до 0,1% и до 0,25%. Наиболее распространенным видимым побочным эффектом является раздражение в месте применения[4].
Продажи
[править | править код]Продажи для алкафтадина компанией Allergan начались в июле 2010 года. С периода июля 2010 года до марта 2012 года совокупные продажи достигли 139 тысячи рецептов. Из этих 139 000 рецептов было 104 тысячи уникальных пациентов. В марте 2012 года алкафтадин превысил продажи элестата, и эта тенденция может продолжиться, поскольку выписывающие рецепты врачи считают алкафтадин наиболее действенным препаратом[5].
Примечания
[править | править код]- ↑ 1 2 LASTACAFT- alcaftadine solution/ drops (англ.). DailyMed. U. S. National Library of Medicine.
- ↑ New Molecular Entity (NME) Drug and New Biologic Approvals (англ.). FDA. Дата обращения: 26 апреля 2020. Архивировано 29 сентября 2021 года.
- ↑ "Drug Approval Package: Lastacaft (alcaftadine) Ophthalmic Solution NDA #022134". U.S. Food and Drug Administration (FDA) (1999). Дата обращения: 29 декабря 2021. Архивировано 10 июня 2020 года.
- ↑ Greiner JV, Edwards-Swanson K, Ingerman A (January 2011). "Evaluation of alcaftadine 0.25% ophthalmic solution in acute allergic conjunctivitis at 15 minutes and 16 hours after instillation versus placebo and olopatadine 0.1%". Clinical Ophthalmology. 5: 87—93. doi:10.2147/OPTH.S15379. PMC 3037035. PMID 21339800.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Lastacaft (alcaftadine ophthalmic solution 0.25%). Drug Use Review. U.S. Food and Drug Administration (21 июня 2012). Архивировано 15 февраля 2017 года.
Это заготовка статьи по фармакологии. Помогите Википедии, дополнив её. |