Муравьиная кислота: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
Нет описания правки |
|||
| (не показано 28 промежуточных версий 19 участников) | |||
| Строка 1: | Строка 1: | ||
{{Вещество |
{{Вещество |
||
| картинка = Formic acid.svg |
|||
| картинка3D = |
|||
| картинка малая = Formic-acid-3D-vdW.png |
|||
| изображение = Formic acid 85 percent.jpg |
|||
| картинка2 = Formic-acid-3D-ball-stick.png |
|||
| наименование = Метановая кислота |
|||
| традиционные названия = Муравьиная кислота |
|||
| сокращения = <!-- принятые сокращения названия --> |
|||
| традиционные названия = Муравьиная кислота |
|||
| рац. формула = HCOOH |
|||
| сокращения = <!-- принятые сокращения названия --> |
|||
| молярная масса = 46,025380 <!-- число, в г/моль --> |
|||
| рац. формула = HCOOH |
|||
| плотность = 1,2196 <!-- число, в г/см³ --> |
|||
| примеси = <!-- типичное кол-во, указать единицы --> |
|||
| состояние = Жидкость |
|||
| плотность = 1,2196 <!-- число, в г/см³ --> |
|||
| динамическая вязкость = 0,16 <!-- число, в Па·с (при 20 °C) --> |
|||
| примеси = <!-- типичное кол-во, указать единицы --> |
|||
| кинематическая вязкость = <!-- число, в см²/с (при 20 °C) --> |
|||
| состояние = Жидкость |
|||
| темп. плавления = 8,25 <!-- число, в °C --> |
|||
| темп. кипения = 100,7 <!-- число, в °C --> |
|||
| темп. разложения = <!-- число, в °C --> |
|||
| темп. вспышки = 60 <!-- число, в °C --> |
|||
| темп. воспламенения = <!-- число, в °C --> |
|||
| темп. самовоспламенения = 520 <!-- число, в °C --> |
|||
| тройная точка = 281,40 K (8,25 °C), 2,2 кПа |
|||
| темп. вспышки = 60 <!-- число, в °C --> |
|||
| критическая точка = 588 K (315 °C), 5,81 МПа |
|||
| темп. воспламенения = <!-- число, в °C --> |
|||
| теплоёмкость = 98,74 <!-- число, в Дж/(моль·К) (молярная теп.-ём.) --> |
|||
| теплоёмкость2 = <!-- число, в Дж/(кг·К) (удельная теп.-ём.) --> |
|||
| тройная точка = 281,40 K (8,25 °C), 2,2 кПа |
|||
| теплопроводность = <!-- число, в Вт/(м·K) --> |
|||
| критическая точка = 588 K (315 °C), 5,81 МПа |
|||
| энтальпия образования = −409,19 <!-- число, в кДж/моль --> |
|||
| энтальпия плавления = 12,72 |
|||
| теплоёмкость2 = <!-- число, в Дж/(кг·К) (удельная теп.-ём.) --> |
|||
| энтальпия кипения = 22,24 |
|||
| теплопроводность = <!-- число, в Вт/(м·K) --> |
|||
| удельная теплота парообразования = <!-- число, в Дж/кг --> |
|||
| удельная теплота плавления = <!-- число, в Дж/кг --> |
|||
| тепловое расширение = <!-- число (безразм.) --> |
|||
| интервал трансформации = <!-- число, в ° --> |
|||
| температура размягчения = <!-- число, в ° --> |
|||
| давление пара = {{nobr|120 [[миллиметр ртутного столба|мм рт. ст.]] (16 к[[Паскаль (единица измерения)|Па]])}} при 50 °C |
|||
| температура размягчения = <!-- число, в ° --> |
|||
| конст. диссоц. кислоты = 3,7515 |
|||
| давление пара = {{nobr|120 [[миллиметр ртутного столба|мм. рт. ст.]] (16 к[[Паскаль (единица измерения)|Па]])}} при 50 °C |
|||
| растворимость = <!-- число, в г/100 мл --> |
|||
| растворимость1 = <!-- число, в г/100 мл --> |
|||
| конст. диссоц. кислоты = 3,75 |
|||
| вещество1 = <!-- веществе 1 --> |
|||
| растворимость = <!-- число, в г/100 мл --> |
|||
| растворимость2 = <!-- число, в г/100 мл --> |
|||
| вещество2 = <!-- веществе 2 --> |
|||
| растворимость3 = <!-- число, в г/100 мл --> |
|||
| вещество3 = <!-- веществе 3 --> |
|||
| растворимость4 = <!-- число, в г/100 мл --> |
|||
| вещество4 = <!-- веществе 4 --> |
|||
| вращение = <!-- число, в ° --> |
|||
| изоэлектрическая точка = <!-- число (безразм.) --> |
|||
| вещество4 = <!-- веществе 4 --> |
|||
| диапазон прозрачности = <!-- число-число, в нм --> |
|||
| показатель преломления = 1,3714 |
|||
| изоэлектрическая точка = <!-- число (безразм.) --> |
|||
| угол Брюстера = <!-- число, в ° --> |
|||
| гибридизация = <!-- ? --> |
|||
| диапазон прозрачности = <!-- число-число, в нм --> |
|||
| координационная геометрия = <!-- ? --> |
|||
| показатель преломления = 1,3714 |
|||
| кристаллическая структура = <!-- описание решётки --> |
|||
| угол Брюстера = <!-- число, в ° --> |
|||
| дипольный момент = 1,41 <small>(газ)</small><!-- число, в Дебай --> |
|||
| CAS = 64-18-6 |
|||
| гибридизация = <!-- ? --> |
|||
| EINECS = <!-- № по EINECS совпадает с № EC--> |
|||
| координационная геометрия = <!-- ? --> |
|||
| SMILES = O=CO |
|||
| кристаллическая структура = <!-- описание решётки --> |
|||
| RTECS = LQ4900000 |
|||
| дипольный момент = 1,41 <small>(газ)</small><!-- число, в Дебай --> |
|||
| ЛД50 = <!-- число, в мг/кг --> |
|||
| NFPA 704 = {{NFPA 704 |
|||
| CAS = 64-18-6 |
|||
| EINECS = <!-- № по EINECS совпадает с № EC--> |
|||
| SMILES = O=CO |
|||
| RTECS = LQ4900000 |
|||
| ЛД50 = <!-- число, в мг/кг --> |
|||
| NFPA 704 = {{NFPA 704 |
|||
| опасность для здоровья = 3 |
| опасность для здоровья = 3 |
||
| огнеопасность = 2 |
| огнеопасность = 2 |
||
| реакционноспособность = 1 |
|||
| реакционоспособность = 1 |
|||
| прочее = ACID |
| прочее = ACID |
||
}} |
}} |
||
| токсичность = |
|||
| ECB = {{ECB|C}} |
|||
}} |
|||
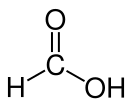
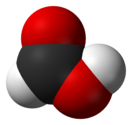
'''Муравьи́ная кислота́''' (мета́новая кислота́, [[химическая формула]] — '''CH<sub>2</sub>O<sub>2</sub>''' или '''HCOOH''') — [[Слабые электролиты|cлабая]] [[Химическое соединение|химическая]] [[органические кислоты|органическая кислота]], возглавляющая класс предельных одноосновных [[Карбоновые кислоты|карбоновых кислот]]. |
|||
При [[Стандартные условия|стандартных условиях]] '''муравьиная кислота''' — это бесцветная жидкость с резким запахом. |
|||
| ECB = {{ECB|C}} |
|||
}} |
|||
Соли и анионы муравьиной кислоты называются '''[[Формиаты|формиа́тами]]'''. |
|||
'''Муравьиная кислота''' ([[Систематическая номенклатура карбоновых кислот и их производных|систематическое наименование]]: метановая кислота) HCOOH — [[органическое соединение]], первый представитель в ряду насыщенных одноосновных кислот. Зарегистрирована в качестве [[Пищевые добавки|пищевой добавки]] под обозначением '''E236'''. Своё название муравьиная кислота получила потому, что впервые она была выделена в 1670 году английским натуралистом [[Рэй, Джон (натуралист)|Джоном Рэйем]] из [[Formica rufa|рыжих лесных муравьёв]]. В природе также обнаружена у [[Пчёлы|пчёл]], в [[Крапива|крапиве]], [[Хвоя|хвое]]<ref name="Wray1670" /><ref name="ХЭ" /> и некоторых фруктах. Соли и анионы муравьиной кислоты называются формиатами. |
|||
== История и нахождение в природе == |
|||
Муравьиная кислота обязана своим названием [[Рыжий лесной муравей|рыжим лесным муравьям (Formica rufa)]], из которых впервые была выделена в [[1670 год]]у английским натуралистом [[Рей, Джон (натуралист)|Джоном Реем]]<ref name="Wray1670">{{статья|автор=Wray, J.|заглавие=Extract of a Letter, Written by Mr. John Wray to the Publisher January 13. 1670. Concerning Some Un-Common Observations and Experiments Made with an Acid Juyce to be Found in Ants|год=1670|язык=en|издание=[[Philosophical Transactions of the Royal Society|Philosophical Transactions of the Royal Society of London]]|тип=journal|том=5|номер=57—68|страницы=2063|doi=10.1098/rstl.1670.0052}}</ref><ref name="Johnson1803">{{книга|ссылка=http://books.google.de/books?id=i1eS9LAe3PsC&pg=PA51|автор=Johnson W. B.|заглавие=History of the process and present state of animal chemistry|год=1803|язык=en|место=London|том=2}}</ref><ref>{{книга|автор=Charles Earle Raven|заглавие=John Ray, naturalist : his life and works|год=1986|язык=en|издательство=[[Издательство Кембриджского университета|Cambridge University Press]]|isbn=0521310830}}</ref><ref name="ХЭ">{{книга|автор=Вергунова Н.Г.|заглавие=Химическая энциклопедия: В 5 т|ответственный=Редкол.: [[Кнунянц, Иван Людвигович|И. Л. Кнунянц]] и др.|год=1992|часть=Муравьиная кислота|место=М.|издательство=Советская энциклопедия|том=3|страницы=148—149|страниц=639|isbn=5-85270-039-8}}</ref>. В природе она обнаружена в едких выделениях и других муравьёв, а также [[Медуза|медуз]], [[Пчёлы|пчёл]] и т. п., в [[Хвоя|хвое]], [[крапива|крапиве]], [[фрукт]]ах. |
|||
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении [[Бутан (вещество)|бутана]] и лёгкой [[бензин]]овой фракции в производстве [[Уксусная кислота|уксусной кислоты]]. Муравьиную кислоту получают также гидролизом [[формамид]]а (~35 % от общего мирового производства); процесс состоит из нескольких стадий: [[карбонилирование]] [[метанол]]а, взаимодействие [[метилформиат]]а с безводным [[Аммиак|NH<sub>3</sub>]] и последующий [[гидролиз]] образовавшегося формамида в присутствии 75%-й [[Серная кислота|H<sub>2</sub>SO<sub>4</sub>]]. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного [[Амины|амина]]), [[Гидратация|гидратацию]] [[Монооксид углерода|СО]] в присутствии щёлочи (кислоту выделяют из соли действием [[Серная кислота|H<sub>2</sub>SO<sub>4</sub>)]], дегидрогенизацию метанола в паровой фазе в присутствии [[катализатор]]ов, содержащих [[Медь|Cu]], а также [[Цирконий|Zr]], [[Цинк|Zn]], [[Хром|Cr]], [[Марганец|Mn]], [[Магний|Mg]] и др. (метод не имеет промышленного значения). |
|||
== Физические и химические свойства == |
== Физические и химические свойства == |
||
При стандартных условиях муравьиная кислота представляет собой резко пахнущую бесцветную жидкость. Растворима в [[ацетон]]е, [[бензол]]е, [[глицерин]]е, [[толуол]]е. Смешивается с [[вода|водой]], [[диэтиловый эфир|диэтиловым эфиром]], [[этанол]]ом. |
При стандартных условиях муравьиная кислота представляет собой резко пахнущую бесцветную жидкость. Растворима в [[ацетон]]е, [[бензол]]е, [[глицерин]]е, [[толуол]]е. Смешивается с [[вода|водой]], [[диэтиловый эфир|диэтиловым эфиром]], [[этанол]]ом. |
||
[[Константа диссоциации]]: {{val|1.772|e=−4}}. |
[[Константа диссоциации]]: K<sub>a</sub> = {{val|1.772|e=−4}}. |
||
Муравьиная кислота |
Муравьиная кислота кроме кислотных свойств проявляет также некоторые свойства [[альдегиды|альдегидов]], в частности, восстановительные. При этом она окисляется до углекислого газа. Например: |
||
:: <math>\mathsf{2KMnO_4 + 5HCOOH + 3H_2SO_4 \rightarrow K_2SO_4 + 2MnSO_4 + 5CO_2 + 8H_2O}</math> |
:: <math>\mathsf{2KMnO_4 + 5HCOOH + 3H_2SO_4 \rightarrow K_2SO_4 + 2MnSO_4 + 5CO_2 + 8H_2O}</math> |
||
При нагревании с сильными водоотнимающими средствами (H<sub>2</sub>SO<sub>4 (конц.)</sub> или P<sub>4</sub>O<sub>10</sub>) разлагается на [[Вода|воду]] и [[моноксид углерода]]<ref>[http://school-collection.edu.ru/catalog/res/665a25f3-5872-5a4a-073f-e824d8b2c563 Разложение муравьиной кислоты] — видеоопыт в Единой коллекции цифровых образовательных ресурсов</ref>: |
При нагревании с сильными водоотнимающими средствами (H<sub>2</sub>SO<sub>4 (конц.)</sub> или P<sub>4</sub>O<sub>10</sub>) разлагается на [[Вода|воду]] и [[моноксид углерода]]<ref>[http://school-collection.edu.ru/catalog/res/665a25f3-5872-5a4a-073f-e824d8b2c563 Разложение муравьиной кислоты] {{Wayback|url=http://school-collection.edu.ru/catalog/res/665a25f3-5872-5a4a-073f-e824d8b2c563 |date=20141225154330 }} — видеоопыт в Единой коллекции цифровых образовательных ресурсов</ref> — лабораторный способ получения CO (угарный газ): |
||
:: < |
:: <chem>HCOOH ->[H_2SO_4 or P_4O_{10}, t] H_2O + CO</chem> |
||
Проявляет свойства альдегидов, реагируя с аммиачным раствором оксида серебра ([[Реактив Толленса|реактивом Толленса]]) — реакция серебряного зеркала: |
|||
:: <math>\mathsf{HCOOH + 2[Ag(NH_3)_2]OH \rightarrow 2Ag + (NH_4)_2CO_3 + 2NH_3 + H_2O}</math> |
:: <math>\mathsf{HCOOH + 2[Ag(NH_3)_2]OH \rightarrow 2Ag + (NH_4)_2CO_3 + 2NH_3 + H_2O}</math> |
||
Проявляет все свойства одноосновных карбоновых кислот: |
'''Проявляет все свойства одноосновных карбоновых кислот:''' |
||
Образует формиаты с металлами: |
Образует формиаты с металлами: |
||
| Строка 102: | Строка 104: | ||
== Получение == |
== Получение == |
||
# Побочный продукт в производстве [[уксусная кислота|уксусной кислоты]] жидкофазным [[окисление]]м [[Бутан (вещество)|бутана]]. |
# Побочный продукт в производстве [[уксусная кислота|уксусной кислоты]] жидкофазным [[окисление]]м [[Бутан (вещество)|бутана]]. |
||
# Окисление [[метанол]]а: |
# Окисление [[метанол]]а: |
||
#: <math>\mathsf{CH_3OH \rightarrow HCHO \rightarrow HCOOH }</math>. |
|||
# Реакцией [[монооксид углерода|монооксида углерода]] с [[гидроксид натрия|гидроксидом натрия]]:< |
# Реакцией [[монооксид углерода|монооксида углерода]] с [[гидроксид натрия|гидроксидом натрия]]: |
||
#: <math>\mathsf{NaOH + CO \rightarrow HCOONa \rightarrow HCOOH}</math> |
|||
#: Это основной промышленный метод, который осуществляют в две стадии: на первой стадии монооксид углерода под давлением 0,6—0,8 МПа пропускают через нагретый до 120—130 °C гидроксид натрия; на второй стадии проводят обработку формиата натрия [[серная кислота|серной кислотой]] и вакуумную перегонку продукта. |
|||
# Разложением глицериновых эфиров [[Щавелевая кислота|щавелевой кислоты]]. Для этого нагревают безводный глицерин со щавелевой кислотой, при этом отгоняется вода и образуются щавелевые эфиры. При дальнейшем нагревании эфиры разлагаются, выделяя [[Диоксид углерода|углекислый газ]], при этом образуются муравьиные эфиры, которые после разложения водой дают муравьиную кислоту и [[глицерин]]. |
# Разложением глицериновых эфиров [[Щавелевая кислота|щавелевой кислоты]]. Для этого нагревают безводный глицерин со щавелевой кислотой, при этом отгоняется вода и образуются щавелевые эфиры. При дальнейшем нагревании эфиры разлагаются, выделяя [[Диоксид углерода|углекислый газ]], при этом образуются муравьиные эфиры, которые после разложения водой дают муравьиную кислоту и [[глицерин]]. |
||
== Безопасность == |
== Безопасность == |
||
[[Файл:GHS-pictogram-acid.svg|справа|100пкс]] |
[[Файл:GHS-pictogram-acid.svg|справа|100пкс]] |
||
Муравьиная кислота |
Муравьиная кислота — это естественный продукт клеточного метаболизма. Она образуется при расщеплении некоторых аминокислот, а также из метанола и формальдегида. |
||
При попадании в организм человека муравьиная кислота быстро [[Обмен веществ|метаболизируется]] и выводится организмом. |
При попадании в организм человека муравьиная кислота быстро [[Обмен веществ|метаболизируется]] и выводится организмом. Вследствие хорошей растворимости муравьиная кислота легко всасывается, в том числе через кожу и слизистые оболочки. |
||
Она является нормальной составной частью крови и тканей человека, а также играет важную роль в обмене веществ при переносе С1-фрагментов. Меньшая часть введённой в организм муравьиной кислоты выводится с мочой в |
Она является нормальной составной частью крови и тканей человека, а также играет важную роль в обмене веществ при переносе С1-фрагментов. Меньшая часть введённой в организм муравьиной кислоты выводится с мочой в неизменённом виде, а большая подвергается метаболизму. Период полураспада муравьиной кислоты в плазме крови человека после орального введения формиата натрия составляет около 45 минут. |
||
Ежедневный приём человеком 0,5 г муравьиной кислоты (что соответствует 8 мг на 1 кг массы тела) в течение 4 недель не оказывает заметного действия. |
|||
Ежедневный приём человеком 0,5 г муравьиной кислоты (что соответствует 8 мг на 1 кг массы тела) в течение 4 недель не оказывает заметного действия. |
|||
Опасность муравьиной кислоты зависит от концентрации. Согласно [[Директива 67/548/EEC|классификации Европейского союза]], концентрация до 10 % обладает раздражающим эффектом, больше 10 % — разъедающим. |
Опасность муравьиной кислоты зависит от концентрации. Согласно [[Директива 67/548/EEC|классификации Европейского союза]], концентрация до 10 % обладает раздражающим эффектом, больше 10 % — разъедающим. |
||
При контакте с кожей 100%-я жидкая муравьиная кислота может вызывать сильные химические [[ |
При контакте с кожей 100%-я жидкая муравьиная кислота может вызывать сильные химические [[ожог]]и. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором [[Гидрокарбонат натрия|соды]] необходимо произвести немедленно. Контакт с концентрированными парами муравьиной кислоты может привести к повреждению [[глаз]] и дыхательных путей. Случайное попадание внутрь даже разбавленных растворов вызывает явления тяжёлого [[Некроз|некротического]] [[гастроэнтерит]]а. |
||
Муравьиная кислота оказывает мутагенное действие на насекомых, например рода Drosophila, и некоторые микроорганизмы, но не на клетки млекопитающих. Муравьиная кислота и формиаты |
Муравьиная кислота оказывает [[Мутагенез|мутагенное]] действие на насекомых, например рода Drosophila, и на некоторые микроорганизмы, но не на клетки млекопитающих. Муравьиная кислота и формиаты не[[Тератогенное действие|тератогенны]] и не[[канцероген]]ны. |
||
Добавление 0 |
Добавление 0,5—1 % муравьиной кислоты к питьевой воде замедляет рост крыс и наносит вред их внутренним органам. |
||
== Охрана труда == |
== Охрана труда == |
||
По |
По российским гигиеническим нормативам, [[Предельно допустимая концентрация|ПДК]] в воздухе рабочей зоны равна 1 мг/м<sup>3</sup> (максимальная разовая)<ref name="ГН-2-2-5-3532-18">{{Книга|автор=''(Роспотребнадзор)''|заглавие=ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны»|ответственный=утверждены [[Попова, Анна Юрьевна|А.Ю. Поповой]]|место=Москва|год=2018|страницы=90|страниц=170|язык=ru|ссылка=https://www.rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=9967|часть=№ 1272. Метановая кислота (муравьиная кислота)|серия=Санитарные правила|archive-date=2020-06-12|archive-url=https://web.archive.org/web/20200612125827/https://www.rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=9967}}</ref>. Может попадать в организм при вдыхании<ref name="OМКХБ-0403">[[МКХБ]] {{cite web |author= [[Международная организация труда]] |title= МКХБ № 0485. Муравьиная кислота. Метановая кислота |url= http://www.ilo.org/dyn/icsc/showcard.display?p_lang=ru&p_card_id=0485&p_version=2 |website= www.ilo.org/dyn/icsc/ |date= 2018 |accessdate= 2019-11-12 |language= ru |location= |archive-date= 2021-01-19 |archive-url= https://web.archive.org/web/20210119064443/http://www.ilo.org/dyn/icsc/showcard.display?p_lang=ru&p_card_id=0485&p_version=2 |deadlink= no }}</ref>. Порог восприятия запаха может достигать 453 мг/м<sup>3</sup><ref name="Kleinschmidt-1983">{{Статья|автор=Kleinschmidt E.-G|заглавие=Untersuchungen zum Zusammenhang Zwischen Riechschwelle des Menschen für Einige Substanzen und Deren Chemischer Struktur|ссылка=|язык=de|издание=Wissenschaftliche Zeitschrift der Wilhelm-Pieck-Universitat Rostock. Naturwissenschaften Reihe|год=1983|issn=0323-4630|том=32|выпуск=7|страницы=54-58|место=Rostock|издательство=The University of Rostock}}</ref>. |
||
== Применение == |
|||
== Нахождение в природе == |
|||
В основном муравьиную кислоту используют как консервирующий и антибактериальный агент при заготовке корма. Муравьиная кислота замедляет процессы гниения и распада, поэтому [[сено]] и [[силос]], обработанные ею, дольше сохраняются. Муравьиная кислота также используется в протравном крашении шерсти, для борьбы с паразитами в [[Пчеловодство|пчеловодстве]], как [[растворитель]] в некоторых химических реакциях. |
|||
В природе муравьиная кислота обнаружена в [[Хвоя|хвое]], [[крапива|крапиве]], [[фрукт]]ах, едких выделениях медуз, пчёл и муравьёв. Муравьиная кислота впервые была выделена в [[1670 год]]у английским натуралистом [[Рэй, Джон (натуралист)|Джоном Рэйем]] из [[Formica rufa|рыжих лесных муравьёв]], чем и объясняется её название<ref name="Wray1670">{{статья |doi=10.1098/rstl.1670.0052 |заглавие=Extract of a Letter, Written by Mr. John Wray to the Publisher January 13. 1670. Concerning Some Un-Common Observations and Experiments Made with an Acid Juyce to be Found in Ants |издание=[[Philosophical Transactions of the Royal Society|Philosophical Transactions of the Royal Society of London]] |том=5 |номер=57—68 |страницы=2063 |язык=en |тип=journal |автор=Wray, J. |год=1670}}</ref><ref name="Johnson1803">{{книга |ссылка=http://books.google.de/books?id=i1eS9LAe3PsC&pg=PA51 |заглавие=History of the process and present state of animal chemistry |год=1803 |язык=en |автор=W. B.; Johnson}}</ref><ref>{{книга |издательство=[[Издательство Кембриджского университета|Cambridge University Press]] |год=1986 |isbn=0521310830 |заглавие=John Ray, naturalist : his life and works |язык=en |автор=Charles Earle Raven}}</ref><ref name="ХЭ">{{книга|автор=Вергунова Н.Г.|часть=Муравьиная кислота|заглавие=Химическая энциклопедия: В 5 т |ответственный=Редкол.: [[Кнунянц, Иван Людвигович|И. Л. Кнунянц]] и др.|место=М.|издательство=Советская энциклопедия |год=1992|том=3 |страницы=148—149|страниц=639 |isbn=5-85270-039-8}}</ref>. |
|||
Зарегистрирована в качестве [[Пищевые добавки|пищевой добавки]] под обозначением '''[[Список пищевых добавок E200 — E299|E236]]'''. |
|||
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении [[Бутан (вещество)|бутана]] и лёгкой [[бензин]]овой фракции в производстве [[Уксусная кислота|уксусной кислоты]]. Муравьиную кислоту получают также гидролизом [[формамид]]а (~35 % от общего мирового производства); процесс состоит из нескольких стадий: карбонилирование [[метанол]]а, взаимодействие [[метилформиат]]а с безводным [[Аммиак|NH<sub>3</sub>]] и последующий [[гидролиз]] образовавшегося формамида 75%-ной [[Серная кислота|H<sub>2</sub>SO<sub>4</sub>]]. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного [[Амины|амина]]), [[Гидратация|гидратацию]] [[Монооксид углерода|СО]] в присутствии щёлочи (кислоту выделяют из соли действием [[Серная кислота| H<sub>2</sub>SO<sub>4</sub>)]], дегидрогенизацию метанола в паровой фазе в присутствии [[катализатор]]ов, содержащих [[Медь|Cu]], а также [[Цирконий|Zr]], [[Цинк|Zn]], [[Хром|Cr]], [[Марганец|Mn]], [[Магний|Mg]] и др. (метод не имеет промышленного значения). |
|||
Применяется для получения [[Формиаты|формиатов]], используемых для улучшения свойств [[бетон]]а{{нет АИ|18|09|2021}}. |
|||
== Применение == |
|||
В основном, муравьиную кислоту используют как консервирующий и антибактериальный агент при заготовке корма. Муравьиная кислота замедляет процессы гниения и распада, поэтому сено и силос, обработанные ей, дольше сохраняются. Муравьиная кислота также используется в протравном крашении шерсти, для борьбы с паразитами в пчеловодстве, как [[растворитель]] в некоторых химических реакциях. |
|||
Применяется для получения формиатов, использующихся для улучшения свойств бетона{{нет АИ|18|09|2021}}. |
|||
В лабораториях используют разложение жидкой муравьиной кислоты под действием горячей концентрированной [[Серная кислота|серной кислоты]] |
В лабораториях используют разложение жидкой муравьиной кислоты под действием горячей концентрированной [[Серная кислота|серной кислоты]] либо пропускают муравьиную кислоту над оксидом [[фосфор]]а [[Оксид фосфора(V)|P<sub>2</sub>O<sub>5</sub>]] для получения [[Монооксид углерода|монооксида углерода]]. |
||
В медицине используется для приготовления растворов [[пермуравьиная кислота|пермуравьиной кислоты]] («первомур», или рецептура «С-4» (смесь перекиси водорода и муравьиной кислоты)). Первомур используют в [[Хирургия|хирургии]] в качестве предоперационного антисептического средства, в фармацевтической промышленности для дезинфекции оборудования<ref>{{книга|автор=Красильников А. П.|заглавие=Справочник по антисептике |место=Мн. |год=1995}}</ref>. |
В медицине используется для приготовления растворов [[пермуравьиная кислота|пермуравьиной кислоты]] («первомур», или рецептура «С-4» (смесь перекиси водорода и муравьиной кислоты)). Первомур используют в [[Хирургия|хирургии]] в качестве предоперационного антисептического средства, в фармацевтической промышленности для дезинфекции оборудования<ref>{{книга|автор=Красильников А. П.|заглавие=Справочник по антисептике |место=Мн. |год=1995}}</ref>. |
||
| Строка 153: | Строка 154: | ||
{{примечания}} |
{{примечания}} |
||
== Дополнительные источники == |
|||
* {{БМЭ3|статья=Муравьиная кислота|автор=Будковская Н. Г.|том=16|страницы=22|ref=Будковская}} |
|||
{{Внешние ссылки}} |
{{Внешние ссылки}} |
||
{{Одноосновные предельные карбоновые кислоты}} |
{{Одноосновные предельные карбоновые кислоты}} |
||
Текущая версия от 06:47, 19 февраля 2024
| Муравьиная кислота | |||
|---|---|---|---|
 | |||
 | |||
| Общие | |||
| Систематическое наименование |
Метановая кислота | ||
| Традиционные названия | Муравьиная кислота | ||
| Хим. формула | CH2O2 | ||
| Рац. формула | HCOOH | ||
| Физические свойства | |||
| Состояние | Жидкость | ||
| Молярная масса | 46,025380 г/моль | ||
| Плотность | 1,2196 г/см³ | ||
| Динамическая вязкость | 0,16 Па·с | ||
| Энергия ионизации | 11,05 ± 0,01 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 8,25 °C | ||
| • кипения | 100,7 °C | ||
| • вспышки | 60 °C | ||
| • самовоспламенения | 520 °C | ||
| Пределы взрываемости | 18 ± 1 об.%[1] | ||
| Тройная точка | 281,40 K (8,25 °C), 2,2 кПа | ||
| Критическая точка | 588 K (315 °C), 5,81 МПа | ||
| Мол. теплоёмк. | 98,74 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −409,19 кДж/моль | ||
| • плавления | 12,72 кДж/моль | ||
| • кипения | 22,24 кДж/моль | ||
| Давление пара | 120 мм рт. ст. (16 кПа) при 50 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 3,7515 | ||
| Оптические свойства | |||
| Показатель преломления | 1,3714 | ||
| Структура | |||
| Дипольный момент | 1,41 (газ) Д | ||
| Классификация | |||
| Рег. номер CAS | 64-18-6 | ||
| PubChem | 284 и 18971002 | ||
| Рег. номер EINECS | 200-579-1 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E236 | ||
| RTECS | LQ4900000 | ||
| ChEBI | 30751 | ||
| ChemSpider | 278 | ||
| Безопасность | |||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Муравьи́ная кислота́ (мета́новая кислота́, химическая формула — CH2O2 или HCOOH) — cлабая химическая органическая кислота, возглавляющая класс предельных одноосновных карбоновых кислот.
При стандартных условиях муравьиная кислота — это бесцветная жидкость с резким запахом.
Соли и анионы муравьиной кислоты называются формиа́тами.
История и нахождение в природе
[править | править код]Муравьиная кислота обязана своим названием рыжим лесным муравьям (Formica rufa), из которых впервые была выделена в 1670 году английским натуралистом Джоном Реем[2][3][4][5]. В природе она обнаружена в едких выделениях и других муравьёв, а также медуз, пчёл и т. п., в хвое, крапиве, фруктах.
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении бутана и лёгкой бензиновой фракции в производстве уксусной кислоты. Муравьиную кислоту получают также гидролизом формамида (~35 % от общего мирового производства); процесс состоит из нескольких стадий: карбонилирование метанола, взаимодействие метилформиата с безводным NH3 и последующий гидролиз образовавшегося формамида в присутствии 75%-й H2SO4. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного амина), гидратацию СО в присутствии щёлочи (кислоту выделяют из соли действием H2SO4), дегидрогенизацию метанола в паровой фазе в присутствии катализаторов, содержащих Cu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет промышленного значения).
Физические и химические свойства
[править | править код]При стандартных условиях муравьиная кислота представляет собой резко пахнущую бесцветную жидкость. Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом.
Константа диссоциации: Ka = 1,772⋅10−4.
Муравьиная кислота кроме кислотных свойств проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается на воду и моноксид углерода[6] — лабораторный способ получения CO (угарный газ):
Проявляет свойства альдегидов, реагируя с аммиачным раствором оксида серебра (реактивом Толленса) — реакция серебряного зеркала:
Проявляет все свойства одноосновных карбоновых кислот:
Образует формиаты с металлами:
Со спиртами образует сложные эфиры:
Получение
[править | править код]- Побочный продукт в производстве уксусной кислоты жидкофазным окислением бутана.
- Окисление метанола:
- .
- Реакцией монооксида углерода с гидроксидом натрия:
- Это основной промышленный метод, который осуществляют в две стадии: на первой стадии монооксид углерода под давлением 0,6—0,8 МПа пропускают через нагретый до 120—130 °C гидроксид натрия; на второй стадии проводят обработку формиата натрия серной кислотой и вакуумную перегонку продукта.
- Разложением глицериновых эфиров щавелевой кислоты. Для этого нагревают безводный глицерин со щавелевой кислотой, при этом отгоняется вода и образуются щавелевые эфиры. При дальнейшем нагревании эфиры разлагаются, выделяя углекислый газ, при этом образуются муравьиные эфиры, которые после разложения водой дают муравьиную кислоту и глицерин.
Безопасность
[править | править код]
Муравьиная кислота — это естественный продукт клеточного метаболизма. Она образуется при расщеплении некоторых аминокислот, а также из метанола и формальдегида.
При попадании в организм человека муравьиная кислота быстро метаболизируется и выводится организмом. Вследствие хорошей растворимости муравьиная кислота легко всасывается, в том числе через кожу и слизистые оболочки.
Она является нормальной составной частью крови и тканей человека, а также играет важную роль в обмене веществ при переносе С1-фрагментов. Меньшая часть введённой в организм муравьиной кислоты выводится с мочой в неизменённом виде, а большая подвергается метаболизму. Период полураспада муравьиной кислоты в плазме крови человека после орального введения формиата натрия составляет около 45 минут.
Ежедневный приём человеком 0,5 г муравьиной кислоты (что соответствует 8 мг на 1 кг массы тела) в течение 4 недель не оказывает заметного действия.
Опасность муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10 % обладает раздражающим эффектом, больше 10 % — разъедающим.
При контакте с кожей 100%-я жидкая муравьиная кислота может вызывать сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Контакт с концентрированными парами муравьиной кислоты может привести к повреждению глаз и дыхательных путей. Случайное попадание внутрь даже разбавленных растворов вызывает явления тяжёлого некротического гастроэнтерита.
Муравьиная кислота оказывает мутагенное действие на насекомых, например рода Drosophila, и на некоторые микроорганизмы, но не на клетки млекопитающих. Муравьиная кислота и формиаты нетератогенны и неканцерогенны.
Добавление 0,5—1 % муравьиной кислоты к питьевой воде замедляет рост крыс и наносит вред их внутренним органам.
Охрана труда
[править | править код]По российским гигиеническим нормативам, ПДК в воздухе рабочей зоны равна 1 мг/м3 (максимальная разовая)[7]. Может попадать в организм при вдыхании[8]. Порог восприятия запаха может достигать 453 мг/м3[9].
Применение
[править | править код]В основном муравьиную кислоту используют как консервирующий и антибактериальный агент при заготовке корма. Муравьиная кислота замедляет процессы гниения и распада, поэтому сено и силос, обработанные ею, дольше сохраняются. Муравьиная кислота также используется в протравном крашении шерсти, для борьбы с паразитами в пчеловодстве, как растворитель в некоторых химических реакциях.
Зарегистрирована в качестве пищевой добавки под обозначением E236.
Применяется для получения формиатов, используемых для улучшения свойств бетона[источник не указан 1202 дня].
В лабораториях используют разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты либо пропускают муравьиную кислоту над оксидом фосфора P2O5 для получения монооксида углерода.
В медицине используется для приготовления растворов пермуравьиной кислоты («первомур», или рецептура «С-4» (смесь перекиси водорода и муравьиной кислоты)). Первомур используют в хирургии в качестве предоперационного антисептического средства, в фармацевтической промышленности для дезинфекции оборудования[10].
Производные муравьиной кислоты
[править | править код]Соли и эфиры муравьиной кислоты называют формиатами.
См. также
[править | править код]Примечания
[править | править код]- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0296.html
- ↑ Wray, J. Extract of a Letter, Written by Mr. John Wray to the Publisher January 13. 1670. Concerning Some Un-Common Observations and Experiments Made with an Acid Juyce to be Found in Ants (англ.) // Philosophical Transactions of the Royal Society of London : journal. — 1670. — Vol. 5, no. 57—68. — P. 2063. — doi:10.1098/rstl.1670.0052.
- ↑ Johnson W. B. History of the process and present state of animal chemistry (англ.). — London, 1803. — Vol. 2.
- ↑ Charles Earle Raven. John Ray, naturalist : his life and works (англ.). — Cambridge University Press, 1986. — ISBN 0521310830.
- ↑ Вергунова Н.Г. Муравьиная кислота // Химическая энциклопедия: В 5 т / Редкол.: И. Л. Кнунянц и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — С. 148—149. — 639 с. — ISBN 5-85270-039-8.
- ↑ Разложение муравьиной кислоты Архивная копия от 25 декабря 2014 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ (Роспотребнадзор). № 1272. Метановая кислота (муравьиная кислота) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 90. — 170 с. — (Санитарные правила). Архивировано 12 июня 2020 года.
- ↑ МКХБ Международная организация труда. МКХБ № 0485. Муравьиная кислота. Метановая кислота. www.ilo.org/dyn/icsc/ (2018). Дата обращения: 12 ноября 2019. Архивировано 19 января 2021 года.
- ↑ Kleinschmidt E.-G. Untersuchungen zum Zusammenhang Zwischen Riechschwelle des Menschen für Einige Substanzen und Deren Chemischer Struktur (нем.) // Wissenschaftliche Zeitschrift der Wilhelm-Pieck-Universitat Rostock. Naturwissenschaften Reihe. — Rostock: The University of Rostock, 1983. — Bd. 32, H. 7. — S. 54-58. — ISSN 0323-4630.
- ↑ Красильников А. П. Справочник по антисептике. — Минск, 1995.
Дополнительные источники
[править | править код]- Будковская Н. Г. Муравьиная кислота // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1981. — Т. 16 : Музеи — Нил. — С. 22. — 512 с. : ил.



![{\displaystyle {\ce {HCOOH ->[H_2SO_4 or P_4O_{10}, t] H_2O + CO}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/4cfd980fa1f5d23d14ae6a4638f68888584c2339)
![{\displaystyle {\mathsf {HCOOH+2[Ag(NH_{3})_{2}]OH\rightarrow 2Ag+(NH_{4})_{2}CO_{3}+2NH_{3}+H_{2}O}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/f436bad6d41c174cd58dafe76276dc4fcd190430)




