Аполипопротеин E: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
Maria.gur (обсуждение | вклад) Добавлены источники |
Исправлена стилистическая ошибка. |
||
| (не показано 15 промежуточных версий 8 участников) | |||
| Строка 16: | Строка 16: | ||
|UniProt=P02649 |
|UniProt=P02649 |
||
}} |
}} |
||
'''Аполипопротеин E''' (АпоЕ, {{lang-en|apolipoprotein E, APOE}}) — белок, участвующий в метаболизме [[Липиды|липидов]] в организме. Он |
'''Аполипопротеин E''' (АпоЕ, {{lang-en|apolipoprotein E, APOE}}) — белок, участвующий в метаболизме [[Липиды|липидов]] в организме. Он вовлечён в развитие [[Болезнь Альцгеймера|болезни Альцгеймера]] и [[Сердечно-сосудистые заболевания|сердечно-сосудистых заболеваний]].<ref>{{Книга|год=2010|isbn=978-3-642-27772-6, 3-642-27772-1, 978-3-540-68706-1, 3-540-68706-8, 978-3-540-68709-2, 3-540-68709-2|страниц=1 online resource|место=Berlin|издательство=Springer|заглавие=Encyclopedia of psychopharmacology|ссылка=https://www.worldcat.org/oclc/668095784|archivedate=2019-09-24|archiveurl=https://web.archive.org/web/20190924180720/https://www.worldcat.org/oclc/668095784}}</ref> Основной функцией ApoE является транспортировка липидов между различными клетками и тканями организма. |
||
ApoE принадлежит к семейству [[Аполипопротеины| |
ApoE принадлежит к семейству [[Аполипопротеины|аполипопротеинов]] - белков, специфически связывающихся с соответствующими липидами. Он является [[Лиганд (биохимия)|лигандом]] для нескольких типов рецепторов, в том числе для рецептора [[Липопротеины|липопротеинов]] низкой плотности ([[Рецептор липопротеинов низкой плотности|ЛПНП-рецептор]]), который необходим для нормального [[Катаболизм|катаболизма]] липопротеинов богатых [[Триглицерид|триглицеридами]].<ref>{{Cite web|url=https://www.ncbi.nlm.nih.gov/gene?Db=gene&Cmd=ShowDetailView&TermToSearch=348|title=APOE apolipoprotein E [Homo sapiens (human)] - Gene - NCBI|publisher=www.ncbi.nlm.nih.gov|accessdate=2019-11-27}}</ref> |
||
Существуют три основные [[Изоформа белка|изоформы]] белка — ɛ2, ɛ3 и ɛ4, встречающиеся в популяциях с частотами 6.4, 78.3 и 14.5%, соответственно.<ref>{{Статья|автор=Dan T.A. Eisenberg, Christopher W. Kuzawa, M. Geoffrey Hayes|год=2010-09|doi=10.1002/ajpa.21298|выпуск=1|язык=en|страницы=100–111|издание=American Journal of Physical Anthropology|заглавие=Worldwide allele frequencies of the human apolipoprotein E gene: Climate, local adaptations, and evolutionary history|ссылка=http://doi.wiley.com/10.1002/ajpa.21298|том=143}}</ref> Изоформа ɛ4 является важнейшим генетическим фактором риска [[Болезнь Альцгеймера|болезни Альцгеймера]], в то время как ɛ2 изоформа защищает от данного заболевания.<ref>{{Статья|автор=A. M. Saunders, W. J. Strittmatter, D. Schmechel, P. H. St. George-Hyslop, M. A. Pericak-Vance|год=1993-08-01|doi=10.1212/wnl.43.8.1467|issn=0028-3878, 1526-632X|выпуск=8|страницы=1467–1467|издание=Neurology|заглавие=Association of apolipoprotein E allele 4 with late-onset familial and sporadic Alzheimer's disease|ссылка=http://dx.doi.org/10.1212/wnl.43.8.1467|том=43}}</ref> |
|||
| ⚫ | |||
[[Ген]] апоЕ человека локализуется в [[19-я хромосома человека|хромосоме 19]] и находится в кластере с другими аполипопротеинами [[апоС1]] и [[апоС2]]. Ген состоит из 4 [[экзон]]ов, 3 [[интрон]]ов, 3597 пар [[нуклеотид]]ов. Ген характеризуется высоким уровнем [[Полиморфизм (биология)|полиморфизмов]]. |
|||
== Структура == |
== Структура == |
||
[[Гликопротеины|Гликопротеин]] ApoE состоит из 299 аминокислотных остатков с молекулярной массой ~34кДа. Он включает два домена, |
[[Гликопротеины|Гликопротеин]] ApoE состоит из 299 аминокислотных остатков с молекулярной массой ~34кДа. Он включает два домена, соединённых шарнирной областью.<ref>{{Статья|автор=Lawrence P. Aggerbeck, John R. Wetterau, Karl H. Weisgraber, Robert W. Mahley, David A. Agard|год=1988-07|doi=10.1016/0022-2836(88)90531-1|issn=0022-2836|выпуск=1|страницы=179–181|издание=Journal of Molecular Biology|заглавие=Crystallization and preliminary X-ray diffraction studies on the amino-terminal (receptor-binding) domain of human apolipoprotein E3 from serum very low density lipoproteins|ссылка=http://dx.doi.org/10.1016/0022-2836(88)90531-1|том=202}}</ref> N-концевой домен (1-167 а.о.) представляет собой 4 альфа спирали с областью, насыщенной положительно заряженными а.о. – Arg и Lys (135-150), которая и формирует область связывания [[Рецептор липопротеинов низкой плотности|ЛПНП-рецептора]] (заряженные боковые цепи обращены наружу). C-концевой домен (206-299 а.о.) включает 3 альфа-спирали, образующие большую гидрофобную поверхность, которая взаимодействует с таковой в N-концевом домене через [[Водородная связь|водородные связи]] и солевые мостики. В C-концевой домен также входит участок связывания липидов (244–272 а.о).<ref>{{Статья|автор=Chi-Cheng Luo, Wen-Hsiung Li, Marsha N. Moore, Lawrence Chan|год=1986-02|doi=10.1016/0022-2836(86)90436-5|issn=0022-2836|выпуск=3|страницы=325–340|издание=Journal of Molecular Biology|заглавие=Structure and evolution of the apolipoprotein multigene family|ссылка=http://dx.doi.org/10.1016/0022-2836(86)90436-5|том=187}}</ref> |
||
Три существующих изоформы: ɛ2, ɛ3 и ɛ4 – отличаются всего по двум позициям: 112 и 158. У ApoE2 в обеих позициях находится Cys; АpoE3 также содержит Cys в 112 позиции, а на 158 – Arg. У ApoE4 Arg располагается и в 112, и 158 позициях.<ref>{{Статья|автор=K. H. Weisgraber, S. C. Rall, T. L. Innerarity, R. W. Mahley|год=1983|isbn=978-3-642-81819-6, 978-3-642-81817-2|страницы=537–542|заглавие=Receptor Interactions of Human Apolipoprotein E|ссылка=http://dx.doi.org/10.1007/978-3-642-81817-2_97|место=Berlin, Heidelberg|издательство=Springer Berlin Heidelberg|издание=Atherosclerosis VI}}</ref> |
Три существующих изоформы: ɛ2, ɛ3 и ɛ4 – отличаются всего по двум позициям: 112 и 158. У ApoE2 в обеих позициях находится Cys; АpoE3 также содержит Cys в 112 позиции, а на 158 – Arg. У ApoE4 Arg располагается и в 112, и 158 позициях.<ref>{{Статья|автор=K. H. Weisgraber, S. C. Rall, T. L. Innerarity, R. W. Mahley|год=1983|isbn=978-3-642-81819-6, 978-3-642-81817-2|страницы=537–542|заглавие=Receptor Interactions of Human Apolipoprotein E|ссылка=http://dx.doi.org/10.1007/978-3-642-81817-2_97|место=Berlin, Heidelberg|издательство=Springer Berlin Heidelberg|издание=Atherosclerosis VI}}</ref> |
||
| Строка 32: | Строка 35: | ||
== Функции == |
== Функции == |
||
В периферических тканях ApoE в основном продуцируется [[Гепатоциты|гепатоцитами]] и [[Макрофаги|макрофагами]] |
В периферических тканях ApoE в основном продуцируется [[Гепатоциты|гепатоцитами]] и [[Макрофаги|макрофагами]]. ApoE транспортирует [[липиды]], жирорастворимые липиды и [[Холестерин|холестерол]] через лимфатическую систему в кровь, обеспечивая метаболизм холестерина. В крови ApoE определяет поглощение остатков [[Хиломикрон|хиломикронов]] и остатков [[Липопротеины очень низкой плотности|ЛПОНП]] печенью. |
||
В [[Центральная нервная система|центральной нервной системе (ЦНС)]] ApoE является внеклеточным белком и главным образом синтезируется [[Астроцит|астроцитами]]. Два пула ApoE (в периферических тканях и ЦНС) совершенно независимы друг от друга, так как ApoE не способен преодолеть [[Гемато-энцефалический барьер|барьер между кровью и церебро-спинальной жидкостью.]] В ЦНС он участвует в транспорте холестерина и других липидов к [[Нейрон|нейронам]], участвуя в их перераспределении и обеспечивая поглощение клетками. <ref>{{Статья|автор=R. Mahley|год=1988-04-29|doi=10.1126/science.3283935|issn=0036-8075, 1095-9203|выпуск=4852|страницы=622–630|издание=Science|заглавие=Apolipoprotein E: cholesterol transport protein with expanding role in cell biology|ссылка=http://dx.doi.org/10.1126/science.3283935|том=240}}</ref> Нейроны, в свою очередь, преимущественно [[Экспрессия генов|экспрессируют]] рецепторы к ApoE. <ref>{{Статья|автор=Zhaohui Zhang, Junlin Mu, Jing Li, Wenqiang Li, Jinggui Song|год=2013-01|doi=10.1089/gtmb.2012.0253|issn=1945-0265, 1945-0257|выпуск=1|страницы=47–51|издание=Genetic Testing and Molecular Biomarkers|заглавие=Aberrant Apolipoprotein E Expression and Cognitive Dysfunction in Patients with Poststroke Depression|ссылка=http://dx.doi.org/10.1089/gtmb.2012.0253|том=17}}</ref> ApoE осуществляет доставку холестерина к месту [[Миелинизация нейронов|миелинизации]], что обусловливает его необходимость для поддержания миелиновой и нейрональной мембран как в центральной, так и в [[Периферическая нервная система|периферической нервной системе]]. <ref>{{Статья|автор=Valérie Leduc, Stéphanie Jasmin-Bélanger, Judes Poirier|год=2010-10|doi=10.1016/j.molmed.2010.07.008|issn=1471-4914|выпуск=10|страницы=469–477|издание=Trends in Molecular Medicine|заглавие=APOE and cholesterol homeostasis in Alzheimer's disease|ссылка=http://dx.doi.org/10.1016/j.molmed.2010.07.008|том=16}}</ref> |
|||
| ⚫ | |||
[[Ген]] апоЕ человека локализуется в [[19-я хромосома человека|хромосоме 19]] и находится в кластере с другими аполипопротеинами [[апоС1]] и [[апоС2]]. Ген состоит из 4 [[экзон]]ов, 3 [[интрон]]ов, 3597 пар [[нуклеотид]]ов. Ген характеризуется [[Полиморфизм (биология)|полиморфизмом]]. Существуют 3 основных [[аллель|аллеля]] апоЕ: нормальная AПОE-ε3, AПОE-ε2, не способная связываться с ЛПНП-рецептором и AПОE-ε4. Аллели отличаются друг от друга лишь [[точечная мутация|точечной мутацией]]. AПОE-ε2 связан с гиперлипопротеинемией III типа и повышенным риском [[атеросклероз]]а. AПОE-ε4 связан с повышенным уровнем холестерина в крови и задержкой в [[регенерация|регенерации]] нейронов, является главным генетическим риском болезни Альцгеймера. |
|||
В мозге ApoE способствует очистке от [[Бета-амилоиды|амилоида β]] (Aβ) и передаче сигналов нейронами. ApoE, как и [[Кластерин|ApoJ]], взаимодействует с липидным дебрисом в мозге и необходим для удаления мембран, дегенерирующих после повреждений. APOE накапливает липиды, выходящие из клетки при помощи транспортерного белка ABCA1. Удаление гена ABCA1 снижает уровень ApoE и увеличивает отложение Aβ в мозге. <ref>{{Статья|автор=Suzanne E. Wahrle, Hong Jiang, Maia Parsadanian, Richard E. Hartman, Kelly R. Bales|год=2005-12-30|doi=10.1074/jbc.M508780200|issn=0021-9258, 1083-351X|выпуск=52|язык=en|страницы=43236–43242|издание=Journal of Biological Chemistry|заглавие=Deletion of Abca1 Increases Aβ Deposition in the PDAPP Transgenic Mouse Model of Alzheimer Disease|ссылка=http://www.jbc.org/lookup/doi/10.1074/jbc.M508780200|том=280}}</ref> |
|||
== Роль в болезни Альцгеймера == |
== Роль в болезни Альцгеймера == |
||
Изоформы ApoE отличаются по способности стимулировать отток холестерина из клеток. ApoE2 обладает наибольшей эффективностью, а ApoE4 - наименьшей. Этот процесс - первый этап в создании ApoE-липидных комплексов. Изоформа ApoE4 формирует мелкие комплексы, а, ApoE2, напротив, ассоциирован с более крупными комплексами. Причём самые большие комплексы ApoE наблюдаются у людей с [[Генотип|генотипом]] ɛ2/3; самые мелкие - у генотипа ɛ4/4. Таким образом, ApoE4 способствует меньшему оттоку холестерина, чем алипопротеины ApoE3 и ApoE2.<ref name=":0">{{Статья|автор=G. William Rebeck|год=2017-03-02|doi=10.1194/jlr.r075408|issn=0022-2275, 1539-7262|выпуск=8|страницы=1493–1499|издание=Journal of Lipid Research|заглавие=The role of APOE on lipid homeostasis and inflammation in normal brains|ссылка=http://dx.doi.org/10.1194/jlr.r075408|том=58}}</ref> |
|||
Аллель AПОE-ε4 значительно повышает риск развития болезни Альцгеймера. От 40 до 65 % больных имеют по крайней мере одну копию апоЕ4, тогда как только 25 % всей популяции имеют этот аллель. Неизвестно, как апоЕ4 повышает риск развития болезни Альцгеймера. |
|||
Доставка липидов в клетки происходит при [[эндоцитоз]] ApoE через [[Рецептор липопротеинов низкой плотности|ЛПНП-рецепторы]]; Это способствует росту [[Нейрит|нейритов]], прорастанию [[Нейрон|нейронов]] и образованию [[Синапс|синапсов]]. Эти процессы включают клиренс в нейронах и [[Глия|глии]]. Потребность в очищении мозга от липидов возрастает с возрастом, поскольку увеличивается количество повреждений мембран и потери нейронов. Эффекты сниженной липидной активности ApoE4 могут привести к ухудшению защиты и восстановления нейронов. Повреждение нейронов постепенно увеличивает уровень ApoE в мозге, приводя к повышению уровня холестерина.<ref name=":0" /> Вследствие высоких концентраций холестерина в крови, в тканях мозга начинает быстро накапливаться [[Бета-амилоиды|бета-амилоид]]. Он составляет основу старческих бляшек и [[Нейрофибриллярные клубки|нейрофибриллярных клубков]] альцгеймеровского типа - главных патоморфологических элементов болезни Альцгеймера, [[Сенильная деменция|сенильной деменции]] и ряда других лобно-височных дегенераций.<ref>{{Статья|автор=Козырев К.м, Марзаганова З.а, Дзиццоева П.а|год=2013|выпуск=1|издание=Вестник новых медицинских технологий. Электронное издание|заглавие=Сравнительная клинико-морфологическая характеристика болезни Пика и болезни Альцгеймера|ссылка=https://cyberleninka.ru/article/n/sravnitelnaya-kliniko-morfologicheskaya-harakteristika-bolezni-pika-i-bolezni-altsgeymera|archivedate=2019-11-28|archiveurl=https://web.archive.org/web/20191128110302/https://cyberleninka.ru/article/n/sravnitelnaya-kliniko-morfologicheskaya-harakteristika-bolezni-pika-i-bolezni-altsgeymera}}</ref> |
|||
Эти наблюдения позволяют предположить, что ApoE4, скорее всего, увеличивает риск AD, инициируя и ускоряя накопление, агрегацию и отложение Aβ в мозге. |
|||
ApoE2 ассоциируется с более медленным снижением когнитивных функций по сравнению с ApoE3 и ApoE4, что свидетельствует о нейропротекторном эффекте ApoE2 при болезни Альцгеймера. |
|||
== Связь с продолжительностью жизни == |
|||
ApoE является единственным геном человека, который отвечает трём критериям генов, влияющих на смертность на уровне популяции.<ref>{{Статья|год=2001-01-19|doi=10.17226/9995|заглавие=Cells and Surveys|ссылка=http://dx.doi.org/10.17226/9995}}</ref> |
|||
Во-первых, замены, дифференцирующие аллели, ассоциированы со значительным различиями риска двух распространённых причин смертности в популяциях европейского происхождения: [[Ишемическая болезнь сердца|ишемической болезни]] и [[Болезнь Альцгеймера|болезни Альцгеймера]].<ref>{{Статья|автор=E. Corder, A. Saunders, W. Strittmatter, D. Schmechel, P. Gaskell|год=1993-08-13|doi=10.1126/science.8346443|issn=0036-8075, 1095-9203|выпуск=5123|страницы=921–923|издание=Science|заглавие=Gene dose of apolipoprotein E type 4 allele and the risk of Alzheimer's disease in late onset families|ссылка=http://dx.doi.org/10.1126/science.8346443|том=261|archivedate=2006-08-25|archiveurl=https://web.archive.org/web/20060825222505/http://dx.doi.org/10.1126%2Fscience.8346443}}</ref> Во-вторых, все три аллеля относительно распространены. В большинстве популяций, примерно, 50% населения имеют две копии аллеля ɛ3 (генотип ɛ3/3), и 20% в среднем имеют хотя бы одну копию аллеля ɛ4(ɛ2/4, ɛ3/4 или ɛ4/4). Аллель ɛ2, по-видимому, отсутствует в некоторых популяциях, живущих в арктических регионах, но в большинстве популяций представлен на 5% (ɛ2/2, ɛ2/3 или ɛ2/4). <ref>{{Статья|автор=J. E. Eichner|год=2002-03-15|doi=10.1093/aje/155.6.487|issn=0002-9262|выпуск=6|страницы=487–495|издание=American Journal of Epidemiology|заглавие=Apolipoprotein E Polymorphism and Cardiovascular Disease: A HuGE Review|ссылка=http://dx.doi.org/10.1093/aje/155.6.487|том=155}}</ref> В-третьих, частота аллеля ɛ4 существенно варьирует в разных популяциях. |
|||
По статистике, у людей, доживающих до 80-100 лет, а так же долгожителей, частота встречаемости аллеля ɛ4 ниже, чем у средних и младших возрастных. При этом они также имеют большую вероятность аллеля ɛ2. В популяциях европейского происхождения сообщается о повышенном риске смертности людей с генотипом ɛ3/4 по сравнению с генотипом ɛ3/3, а генотип ɛ2/3, напротив, связан со слегка сниженным риском.<ref>{{Статья|автор=I. Skoog, C. Hesse, O. Aevarsson, S. Landahl, J. Wahlstrom|год=1998-01-01|doi=10.1136/jnnp.64.1.37|issn=0022-3050|выпуск=1|страницы=37–43|издание=Journal of Neurology, Neurosurgery & Psychiatry|заглавие=A population study of apoE genotype at the age of 85: relation to dementia, cerebrovascular disease, and mortality|ссылка=http://dx.doi.org/10.1136/jnnp.64.1.37|том=64}}</ref> |
|||
В данном контексте ApoE2 рассматривается как предполагаемый «защитный фактор», тогда как ApoE4 является «хрупким» аллелем<ref>{{Статья|автор=Lars Ulrik Gerdes, Bernard Jeune, Karen Andersen Ranberg, Hanne Nybo, James W. Vaupel|год=2000-10|doi=10.1002/1098-2272(200010)19:3<202::aid-gepi2>3.3.co;2-h|issn=0741-0395, 1098-2272|выпуск=3|страницы=202–210|издание=Genetic Epidemiology|заглавие=Estimation of apolipoprotein E genotype‐specific relative mortality risks from the distribution of genotypes in centenarians and middle‐aged men: Apolipoprotein E gene is a “frailty gene,” not a “longevity gene”|ссылка=http://dx.doi.org/10.1002/1098-2272(200010)19:3<202::aid-gepi2>3.3.co;2-h|том=19}}</ref>, связанным с более высоким уровнем холестерина и повышенным риском метаболических и нейродегенеративных заболеваний.<ref>{{Статья|автор=B.V.P. de-Almada, L.D. de-Almeida, D. Camporez, M.V.D. de-Moraes, R.L. Morelato|год=2012-01|doi=10.1590/s0100-879x2011007500151|issn=0100-879X|выпуск=1|страницы=8–12|издание=Brazilian Journal of Medical and Biological Research|заглавие=Protective effect of the APOE-e3 allele in Alzheimer’s disease|ссылка=http://dx.doi.org/10.1590/s0100-879x2011007500151|том=45}}</ref> |
|||
Это даёт обоснование тому, что долгоживущие индивидуумы демонстрируют более низкие частоты аллеля ɛ4 по сравнению с более молодыми. Тем не менее, вариант ɛ4 обнаруживается с более высокой частотой, чем можно было ожидать (6-37%) в различных популяциях, распространённых по всему миру. |
|||
Возможным объяснением аномально высокой частоты этого вредного аллеля является теория [[Антагонистическая плейотропия|«Антагонистической плейотропии»]].<ref>{{Статья|автор=Alfredo Santovito, Gabriella Galli, Stefano Ruberto|год=2019-07-04|doi=10.1080/03014460.2019.1659413|issn=0301-4460, 1464-5033|выпуск=5|язык=en|страницы=425–429|издание=Annals of Human Biology|заглавие=Evaluation of the possible association of body mass index and four metabolic gene polymorphisms with longevity in an Italian cohort: a role for APOE , eNOS and FTO gene polymorphisms|ссылка=https://www.tandfonline.com/doi/full/10.1080/03014460.2019.1659413|том=46}}</ref> По-видимому, аллель ɛ4 обладает преимуществом в [[Репродуктивная система|репродуктивности]] и выживаемости в молодом возрасте за счёт его связи с усиленной фертильностью у женщин и улучшенными когнитивными способностями у обоих полов. В старшем возрасте ,однако, они связаны с повышенным риском заболеваний, связанных со старением.<ref>{{Статья|автор=Elizabeth R. Tuminello, S. Duke Han|год=2011|doi=10.4061/2011/726197|issn=2090-0252|страницы=1–12|издание=International Journal of Alzheimer's Disease|заглавие=The Apolipoprotein E Antagonistic Pleiotropy Hypothesis: Review and Recommendations|ссылка=http://dx.doi.org/10.4061/2011/726197|том=2011}}</ref> |
|||
В ходе крупного генетического исследования было обнаружено, что у носителей аллели AПОE-ε4 на риск заболевания влияют некоторые вариации гена [[GAB2]].<!-- |
|||
Однако систематического исследования роли ApoE в объяснении различий смертности в разных странах не проводилось. |
|||
--><ref name="pmid17553421">{{статья |заглавие=GAB2 Alleles Modify Alzheimer's Risk in APOE varepsilon4 Carriers |том=54 |номер=5 |страницы=713—720 |pmid=17553421 |doi=10.1016/j.neuron.2007.05.022 |язык=und |автор=Reiman E.M., Webster J.A., Myers A.J., Hardy J., Dunckley T., Zismann V.L., Joshipura K.D., Pearson J.V., Hu-Lince D., Huentelman M.J., Craig D.W., Coon K.D., Liang W.S., Herbert R.H., Beach T., Rohrer K.C., Zhao A.S., Leung D., Bryden L., Marlowe L., Kaleem M., Mastroeni D., Grover A., Heward C.B., Ravid R., Rogers J., Hutton M.L., Melquist S., Petersen R.C., Alexander G.E., Caselli R.J., Kukull W., Papassotiropoulos A., Stephan D.A. |год=2007}} [http://www.neuron.org/content/article/fulltext?uid=PIIS0896627307003790&highlight=GAB2 Free full text]{{Недоступная ссылка|date=Сентябрь 2017 |bot=InternetArchiveBot }} [http://download.neuron.org/pdfs/0896-6273/PIIS0896627307003790.pdf Free PDF]{{Недоступная ссылка|date=Сентябрь 2017 |bot=InternetArchiveBot }} [http://www.tgen.org/research/index.cfm?pageid=1065 Genetic data in the public domain] {{webarchive|url=https://web.archive.org/web/20070928120732/http://www.tgen.org/research/index.cfm?pageid=1065 |date=2007-09-28 }}</ref> |
|||
== См. также == |
== См. также == |
||
| Строка 48: | Строка 69: | ||
* [[Болезнь Альцгеймера]] |
* [[Болезнь Альцгеймера]] |
||
* [[Гиперлипопротеинемия]] |
* [[Гиперлипопротеинемия]] |
||
*[[Кластерин]] |
|||
== Ссылки == |
== Ссылки == |
||
| Строка 59: | Строка 81: | ||
{{перевести|en|Apolipoprotein E}} |
{{перевести|en|Apolipoprotein E}} |
||
{{Липопротеины}} |
{{Липопротеины}} |
||
{{Долголетие}} |
|||
[[Категория:Аполипопротеины]] |
[[Категория:Аполипопротеины]] |
||
Текущая версия от 15:10, 5 сентября 2024
| Аполипопротеин E | |
|---|---|
 Структура белка | |
| Обозначения | |
| Символы | АпоE; AD2 |
| Entrez Gene | 348 |
| HGNC | 613 |
| OMIM | 107741 |
| RefSeq | NM_000041 |
| UniProt | P02649 |
| Другие данные | |
| Локус | 19-я хр. , 19q13.31 |
Аполипопротеин E (АпоЕ, англ. apolipoprotein E, APOE) — белок, участвующий в метаболизме липидов в организме. Он вовлечён в развитие болезни Альцгеймера и сердечно-сосудистых заболеваний.[1] Основной функцией ApoE является транспортировка липидов между различными клетками и тканями организма.
ApoE принадлежит к семейству аполипопротеинов - белков, специфически связывающихся с соответствующими липидами. Он является лигандом для нескольких типов рецепторов, в том числе для рецептора липопротеинов низкой плотности (ЛПНП-рецептор), который необходим для нормального катаболизма липопротеинов богатых триглицеридами.[2]
Существуют три основные изоформы белка — ɛ2, ɛ3 и ɛ4, встречающиеся в популяциях с частотами 6.4, 78.3 и 14.5%, соответственно.[3] Изоформа ɛ4 является важнейшим генетическим фактором риска болезни Альцгеймера, в то время как ɛ2 изоформа защищает от данного заболевания.[4]
Ген
[править | править код]Ген апоЕ человека локализуется в хромосоме 19 и находится в кластере с другими аполипопротеинами апоС1 и апоС2. Ген состоит из 4 экзонов, 3 интронов, 3597 пар нуклеотидов. Ген характеризуется высоким уровнем полиморфизмов.
Структура
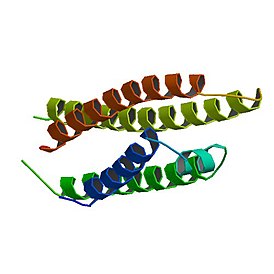
[править | править код]Гликопротеин ApoE состоит из 299 аминокислотных остатков с молекулярной массой ~34кДа. Он включает два домена, соединённых шарнирной областью.[5] N-концевой домен (1-167 а.о.) представляет собой 4 альфа спирали с областью, насыщенной положительно заряженными а.о. – Arg и Lys (135-150), которая и формирует область связывания ЛПНП-рецептора (заряженные боковые цепи обращены наружу). C-концевой домен (206-299 а.о.) включает 3 альфа-спирали, образующие большую гидрофобную поверхность, которая взаимодействует с таковой в N-концевом домене через водородные связи и солевые мостики. В C-концевой домен также входит участок связывания липидов (244–272 а.о).[6]
Три существующих изоформы: ɛ2, ɛ3 и ɛ4 – отличаются всего по двум позициям: 112 и 158. У ApoE2 в обеих позициях находится Cys; АpoE3 также содержит Cys в 112 позиции, а на 158 – Arg. У ApoE4 Arg располагается и в 112, и 158 позициях.[7]
Такие изменения в аминокислотной последовательности изоформ ведут к различию в устойчивости белков и их взаимодействий: при замене Cys112 на Arg112 в ApoE4, белок теряет ионную связь между Glu109 и Arg61. Освободившийся Arg61 взаимодействует с Glu255, формируя дополнительную связь между доменами, что снижает способность ApoE4 связывать липиды. В изоформах ApoE3 и ApoE4 между остатками Arg158 и Asp154 сформирован солевой мостик, который утрачен в ApoE2, с Cys в позиции 158. У ApoE2 солевой мостик образуется между Asp154 и Arg150, отодвигая Arg150 от связывающей ЛПНП-рецептор области. Это сказывается на его связывающей способности.[8]
Таким образом, в зависимости от аминокислотных взаимодействий меняется стабильность белка. ApoE4 является наименее стабильной изоформой, затем следует ApoE3, а АpoE2 является наиболее стабильным.[9]
Функции
[править | править код]В периферических тканях ApoE в основном продуцируется гепатоцитами и макрофагами. ApoE транспортирует липиды, жирорастворимые липиды и холестерол через лимфатическую систему в кровь, обеспечивая метаболизм холестерина. В крови ApoE определяет поглощение остатков хиломикронов и остатков ЛПОНП печенью.
В центральной нервной системе (ЦНС) ApoE является внеклеточным белком и главным образом синтезируется астроцитами. Два пула ApoE (в периферических тканях и ЦНС) совершенно независимы друг от друга, так как ApoE не способен преодолеть барьер между кровью и церебро-спинальной жидкостью. В ЦНС он участвует в транспорте холестерина и других липидов к нейронам, участвуя в их перераспределении и обеспечивая поглощение клетками. [10] Нейроны, в свою очередь, преимущественно экспрессируют рецепторы к ApoE. [11] ApoE осуществляет доставку холестерина к месту миелинизации, что обусловливает его необходимость для поддержания миелиновой и нейрональной мембран как в центральной, так и в периферической нервной системе. [12]
В мозге ApoE способствует очистке от амилоида β (Aβ) и передаче сигналов нейронами. ApoE, как и ApoJ, взаимодействует с липидным дебрисом в мозге и необходим для удаления мембран, дегенерирующих после повреждений. APOE накапливает липиды, выходящие из клетки при помощи транспортерного белка ABCA1. Удаление гена ABCA1 снижает уровень ApoE и увеличивает отложение Aβ в мозге. [13]
Роль в болезни Альцгеймера
[править | править код]Изоформы ApoE отличаются по способности стимулировать отток холестерина из клеток. ApoE2 обладает наибольшей эффективностью, а ApoE4 - наименьшей. Этот процесс - первый этап в создании ApoE-липидных комплексов. Изоформа ApoE4 формирует мелкие комплексы, а, ApoE2, напротив, ассоциирован с более крупными комплексами. Причём самые большие комплексы ApoE наблюдаются у людей с генотипом ɛ2/3; самые мелкие - у генотипа ɛ4/4. Таким образом, ApoE4 способствует меньшему оттоку холестерина, чем алипопротеины ApoE3 и ApoE2.[14]
Доставка липидов в клетки происходит при эндоцитоз ApoE через ЛПНП-рецепторы; Это способствует росту нейритов, прорастанию нейронов и образованию синапсов. Эти процессы включают клиренс в нейронах и глии. Потребность в очищении мозга от липидов возрастает с возрастом, поскольку увеличивается количество повреждений мембран и потери нейронов. Эффекты сниженной липидной активности ApoE4 могут привести к ухудшению защиты и восстановления нейронов. Повреждение нейронов постепенно увеличивает уровень ApoE в мозге, приводя к повышению уровня холестерина.[14] Вследствие высоких концентраций холестерина в крови, в тканях мозга начинает быстро накапливаться бета-амилоид. Он составляет основу старческих бляшек и нейрофибриллярных клубков альцгеймеровского типа - главных патоморфологических элементов болезни Альцгеймера, сенильной деменции и ряда других лобно-височных дегенераций.[15]
Эти наблюдения позволяют предположить, что ApoE4, скорее всего, увеличивает риск AD, инициируя и ускоряя накопление, агрегацию и отложение Aβ в мозге.
ApoE2 ассоциируется с более медленным снижением когнитивных функций по сравнению с ApoE3 и ApoE4, что свидетельствует о нейропротекторном эффекте ApoE2 при болезни Альцгеймера.
Связь с продолжительностью жизни
[править | править код]ApoE является единственным геном человека, который отвечает трём критериям генов, влияющих на смертность на уровне популяции.[16]
Во-первых, замены, дифференцирующие аллели, ассоциированы со значительным различиями риска двух распространённых причин смертности в популяциях европейского происхождения: ишемической болезни и болезни Альцгеймера.[17] Во-вторых, все три аллеля относительно распространены. В большинстве популяций, примерно, 50% населения имеют две копии аллеля ɛ3 (генотип ɛ3/3), и 20% в среднем имеют хотя бы одну копию аллеля ɛ4(ɛ2/4, ɛ3/4 или ɛ4/4). Аллель ɛ2, по-видимому, отсутствует в некоторых популяциях, живущих в арктических регионах, но в большинстве популяций представлен на 5% (ɛ2/2, ɛ2/3 или ɛ2/4). [18] В-третьих, частота аллеля ɛ4 существенно варьирует в разных популяциях.
По статистике, у людей, доживающих до 80-100 лет, а так же долгожителей, частота встречаемости аллеля ɛ4 ниже, чем у средних и младших возрастных. При этом они также имеют большую вероятность аллеля ɛ2. В популяциях европейского происхождения сообщается о повышенном риске смертности людей с генотипом ɛ3/4 по сравнению с генотипом ɛ3/3, а генотип ɛ2/3, напротив, связан со слегка сниженным риском.[19]
В данном контексте ApoE2 рассматривается как предполагаемый «защитный фактор», тогда как ApoE4 является «хрупким» аллелем[20], связанным с более высоким уровнем холестерина и повышенным риском метаболических и нейродегенеративных заболеваний.[21]
Это даёт обоснование тому, что долгоживущие индивидуумы демонстрируют более низкие частоты аллеля ɛ4 по сравнению с более молодыми. Тем не менее, вариант ɛ4 обнаруживается с более высокой частотой, чем можно было ожидать (6-37%) в различных популяциях, распространённых по всему миру.
Возможным объяснением аномально высокой частоты этого вредного аллеля является теория «Антагонистической плейотропии».[22] По-видимому, аллель ɛ4 обладает преимуществом в репродуктивности и выживаемости в молодом возрасте за счёт его связи с усиленной фертильностью у женщин и улучшенными когнитивными способностями у обоих полов. В старшем возрасте ,однако, они связаны с повышенным риском заболеваний, связанных со старением.[23]
Однако систематического исследования роли ApoE в объяснении различий смертности в разных странах не проводилось.
См. также
[править | править код]Ссылки
[править | править код]- ПЕПТИДНЫЙ АНАЛОГ АПОЛИПОПРОТЕИНА Е УСИЛИВАЕТ КЛИРЕНС ЛИПОПРОТЕИНОВ И СНИЖАЕТ УРОВЕНЬ СЫВОРОТОЧНОГО ХОЛЕСТЕРИНА
- http://www.medterms.com/script/main/art.asp?articlekey=13299
- https://web.archive.org/web/20070425181921/http://wwwchem.csustan.edu/chem4400/sjbr/Dawn971.htm
Примечания
[править | править код]- ↑ Encyclopedia of psychopharmacology. — Berlin: Springer, 2010. — 1 online resource с. — ISBN 978-3-642-27772-6, 3-642-27772-1, 978-3-540-68706-1, 3-540-68706-8, 978-3-540-68709-2, 3-540-68709-2. Архивировано 24 сентября 2019 года.
- ↑ APOE apolipoprotein E [Homo sapiens (human)] - Gene - NCBI. www.ncbi.nlm.nih.gov. Дата обращения: 27 ноября 2019.
- ↑ Dan T.A. Eisenberg, Christopher W. Kuzawa, M. Geoffrey Hayes. Worldwide allele frequencies of the human apolipoprotein E gene: Climate, local adaptations, and evolutionary history (англ.) // American Journal of Physical Anthropology. — 2010-09. — Vol. 143, iss. 1. — P. 100–111. — doi:10.1002/ajpa.21298.
- ↑ A. M. Saunders, W. J. Strittmatter, D. Schmechel, P. H. St. George-Hyslop, M. A. Pericak-Vance. Association of apolipoprotein E allele 4 with late-onset familial and sporadic Alzheimer's disease // Neurology. — 1993-08-01. — Т. 43, вып. 8. — С. 1467–1467. — ISSN 1526-632X 0028-3878, 1526-632X. — doi:10.1212/wnl.43.8.1467.
- ↑ Lawrence P. Aggerbeck, John R. Wetterau, Karl H. Weisgraber, Robert W. Mahley, David A. Agard. Crystallization and preliminary X-ray diffraction studies on the amino-terminal (receptor-binding) domain of human apolipoprotein E3 from serum very low density lipoproteins // Journal of Molecular Biology. — 1988-07. — Т. 202, вып. 1. — С. 179–181. — ISSN 0022-2836. — doi:10.1016/0022-2836(88)90531-1.
- ↑ Chi-Cheng Luo, Wen-Hsiung Li, Marsha N. Moore, Lawrence Chan. Structure and evolution of the apolipoprotein multigene family // Journal of Molecular Biology. — 1986-02. — Т. 187, вып. 3. — С. 325–340. — ISSN 0022-2836. — doi:10.1016/0022-2836(86)90436-5.
- ↑ K. H. Weisgraber, S. C. Rall, T. L. Innerarity, R. W. Mahley. Receptor Interactions of Human Apolipoprotein E // Atherosclerosis VI. — Berlin, Heidelberg: Springer Berlin Heidelberg, 1983. — С. 537–542. — ISBN 978-3-642-81819-6, 978-3-642-81817-2.
- ↑ Danny M. Hatters, Madhu S. Budamagunta, John C. Voss, Karl H. Weisgraber. Modulation of Apolipoprotein E Structure by Domain Interaction: DIFFERENCES IN LIPID-BOUND AND LIPID-FREE FORMS (англ.) // Journal of Biological Chemistry. — 2005-10-07. — Vol. 280, iss. 40. — P. 34288–34295. — ISSN 1083-351X 0021-9258, 1083-351X. — doi:10.1074/jbc.M506044200.
- ↑ Julie A. Morrow, Mark L. Segall, Sissel Lund-Katz, Michael C. Phillips, Mark Knapp. Differences in Stability among the Human Apolipoprotein E Isoforms Determined by the Amino-Terminal Domain † (англ.) // Biochemistry. — 2000-09. — Vol. 39, iss. 38. — P. 11657–11666. — ISSN 1520-4995 0006-2960, 1520-4995. — doi:10.1021/bi000099m.
- ↑ R. Mahley. Apolipoprotein E: cholesterol transport protein with expanding role in cell biology // Science. — 1988-04-29. — Т. 240, вып. 4852. — С. 622–630. — ISSN 1095-9203 0036-8075, 1095-9203. — doi:10.1126/science.3283935.
- ↑ Zhaohui Zhang, Junlin Mu, Jing Li, Wenqiang Li, Jinggui Song. Aberrant Apolipoprotein E Expression and Cognitive Dysfunction in Patients with Poststroke Depression // Genetic Testing and Molecular Biomarkers. — 2013-01. — Т. 17, вып. 1. — С. 47–51. — ISSN 1945-0257 1945-0265, 1945-0257. — doi:10.1089/gtmb.2012.0253.
- ↑ Valérie Leduc, Stéphanie Jasmin-Bélanger, Judes Poirier. APOE and cholesterol homeostasis in Alzheimer's disease // Trends in Molecular Medicine. — 2010-10. — Т. 16, вып. 10. — С. 469–477. — ISSN 1471-4914. — doi:10.1016/j.molmed.2010.07.008.
- ↑ Suzanne E. Wahrle, Hong Jiang, Maia Parsadanian, Richard E. Hartman, Kelly R. Bales. Deletion of Abca1 Increases Aβ Deposition in the PDAPP Transgenic Mouse Model of Alzheimer Disease (англ.) // Journal of Biological Chemistry. — 2005-12-30. — Vol. 280, iss. 52. — P. 43236–43242. — ISSN 1083-351X 0021-9258, 1083-351X. — doi:10.1074/jbc.M508780200.
- ↑ 1 2 G. William Rebeck. The role of APOE on lipid homeostasis and inflammation in normal brains // Journal of Lipid Research. — 2017-03-02. — Т. 58, вып. 8. — С. 1493–1499. — ISSN 1539-7262 0022-2275, 1539-7262. — doi:10.1194/jlr.r075408.
- ↑ Козырев К.м, Марзаганова З.а, Дзиццоева П.а. Сравнительная клинико-морфологическая характеристика болезни Пика и болезни Альцгеймера // Вестник новых медицинских технологий. Электронное издание. — 2013. — Вып. 1. Архивировано 28 ноября 2019 года.
- ↑ Cells and Surveys. — 2001-01-19. — doi:10.17226/9995.
- ↑ E. Corder, A. Saunders, W. Strittmatter, D. Schmechel, P. Gaskell. Gene dose of apolipoprotein E type 4 allele and the risk of Alzheimer's disease in late onset families // Science. — 1993-08-13. — Т. 261, вып. 5123. — С. 921–923. — ISSN 1095-9203 0036-8075, 1095-9203. — doi:10.1126/science.8346443. Архивировано 25 августа 2006 года.
- ↑ J. E. Eichner. Apolipoprotein E Polymorphism and Cardiovascular Disease: A HuGE Review // American Journal of Epidemiology. — 2002-03-15. — Т. 155, вып. 6. — С. 487–495. — ISSN 0002-9262. — doi:10.1093/aje/155.6.487.
- ↑ I. Skoog, C. Hesse, O. Aevarsson, S. Landahl, J. Wahlstrom. A population study of apoE genotype at the age of 85: relation to dementia, cerebrovascular disease, and mortality // Journal of Neurology, Neurosurgery & Psychiatry. — 1998-01-01. — Т. 64, вып. 1. — С. 37–43. — ISSN 0022-3050. — doi:10.1136/jnnp.64.1.37.
- ↑ Lars Ulrik Gerdes, Bernard Jeune, Karen Andersen Ranberg, Hanne Nybo, James W. Vaupel. <202::aid-gepi2>3.3.co;2-h Estimation of apolipoprotein E genotype‐specific relative mortality risks from the distribution of genotypes in centenarians and middle‐aged men: Apolipoprotein E gene is a “frailty gene,” not a “longevity gene” // Genetic Epidemiology. — 2000-10. — Т. 19, вып. 3. — С. 202–210. — ISSN 1098-2272 0741-0395, 1098-2272. — doi:10.1002/1098-2272(200010)19:3<202::aid-gepi2>3.3.co;2-h.
- ↑ B.V.P. de-Almada, L.D. de-Almeida, D. Camporez, M.V.D. de-Moraes, R.L. Morelato. Protective effect of the APOE-e3 allele in Alzheimer’s disease // Brazilian Journal of Medical and Biological Research. — 2012-01. — Т. 45, вып. 1. — С. 8–12. — ISSN 0100-879X. — doi:10.1590/s0100-879x2011007500151.
- ↑ Alfredo Santovito, Gabriella Galli, Stefano Ruberto. Evaluation of the possible association of body mass index and four metabolic gene polymorphisms with longevity in an Italian cohort: a role for APOE , eNOS and FTO gene polymorphisms (англ.) // Annals of Human Biology. — 2019-07-04. — Vol. 46, iss. 5. — P. 425–429. — ISSN 1464-5033 0301-4460, 1464-5033. — doi:10.1080/03014460.2019.1659413.
- ↑ Elizabeth R. Tuminello, S. Duke Han. The Apolipoprotein E Antagonistic Pleiotropy Hypothesis: Review and Recommendations // International Journal of Alzheimer's Disease. — 2011. — Т. 2011. — С. 1–12. — ISSN 2090-0252. — doi:10.4061/2011/726197.
В другом языковом разделе есть более полная статья Apolipoprotein E (англ.). |