Фосфит натрия: различия между версиями
Перейти к навигации
Перейти к поиску
| [непроверенная версия] | [непроверенная версия] |
Содержимое удалено Содержимое добавлено
Фосфит натрия - Na3PO3, был записан Дигидрофосфит натрия |
Lvova (обсуждение | вклад) м оформление |
||
| (не показано 6 промежуточных версий 5 участников) | |||
| Строка 72: | Строка 72: | ||
| ЛД50 = <!-- число, в мг/кг --> |
| ЛД50 = <!-- число, в мг/кг --> |
||
| токсичность = |
| токсичность = Основные опасности: источник ядовитого газа [[фосфин]]а |
||
| NFPA 704 = {{NFPA 704 |
|||
| опасность для здоровья = 3 |
|||
| огнеопасность = 0 |
|||
| реакционноспособность = 3 |
|||
| прочее = <s>W</s>}} |
|||
}} |
}} |
||
'''Фосфит натрия''' |
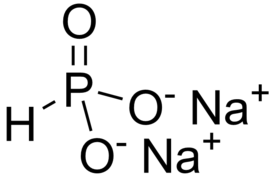
'''Фосфит натрия''' — неорганическое соединение, соль [[Щелочные металлы|щелочного металла]] [[Натрий|натрия]] и [[Фосфористая кислота|фосфористой кислоты]] с формулой Na{{sub|2}}(PHO{{sub|3}}), бесцветные кристаллы, очень хорошо растворимые в воде, образует [[кристаллогидрат]]. |
||
== Получение == |
== Получение == |
||
* Растворение белого [[фосфор]]а в горячем концентрированном растворе [[Гидроксид натрия|едкого натра]]: |
* Растворение белого [[фосфор]]а в горячем концентрированном растворе [[Гидроксид натрия|едкого натра]]: |
||
::<math>\mathsf{P_4 + 8NaOH + 4H_2O \ \xrightarrow{100^oC}\ 4Na_2(PHO_3) + 6H_2\uparrow }</math> |
:: <math>\mathsf{P_4 + 8NaOH + 4H_2O \ \xrightarrow{100^oC}\ 4Na_2(PHO_3) + 6H_2\uparrow }</math> |
||
* Растворение [[Оксид фосфора(III)|оксида фосфора(III)]] в концентрированной щелочи: |
* Растворение [[Оксид фосфора(III)|оксида фосфора(III)]] в концентрированной щелочи: |
||
::<math>\mathsf{P_4O_6 + 6NaOH \ \xrightarrow{}\ 2Na_2(PHO_3) + Na_2(PH_2O_5) + H_2O }</math> |
:: <math>\mathsf{P_4O_6 + 6NaOH \ \xrightarrow{}\ 2Na_2(PHO_3) + Na_2(PH_2O_5) + H_2O }</math> |
||
* Нейтрализация щелочью [[Фосфористая кислота|фосфористой кислоты]]: |
* Нейтрализация щелочью [[Фосфористая кислота|фосфористой кислоты]]: |
||
::<math>\mathsf{H_2(PHO_3) + 2NaOH \ \xrightarrow{}\ Na_2(PHO_3) + 2H_2O }</math> |
:: <math>\mathsf{H_2(PHO_3) + 2NaOH \ \xrightarrow{}\ Na_2(PHO_3) + 2H_2O }</math> |
||
* Реакция [[Хлорид фосфора(III)|хлорида фосфора(III)]] с щелочью: |
* Реакция [[Хлорид фосфора(III)|хлорида фосфора(III)]] с щелочью: |
||
::<math>\mathsf{PCl_3 + 5NaOH \ \xrightarrow{}\ Na_2(PHO_3) + 3NaCl + 2H_2O }</math> |
:: <math>\mathsf{PCl_3 + 5NaOH \ \xrightarrow{}\ Na_2(PHO_3) + 3NaCl + 2H_2O }</math> |
||
== Физические свойства == |
== Физические свойства == |
||
Фосфит натрия образует бесцветные кристаллы. |
Фосфит натрия образует бесцветные кристаллы. |
||
| Строка 102: | Строка 105: | ||
== Химические свойства == |
== Химические свойства == |
||
* При нагревании кристаллогидрат разлагается на [[фосфин]], [[пирофосфат натрия]] и [[фосфат натрия]]: |
* При нагревании кристаллогидрат разлагается на [[фосфин]], [[пирофосфат натрия]] и [[фосфат натрия]]: |
||
::<math>\mathsf{8Na_2(PHO_3)\cdot 5H_2O \ \xrightarrow{120-250^oC}\ Na_4P_2O_7 + 4Na_3PO_4 + 2PH_3\uparrow + 41H_2O }</math> |
:: <math>\mathsf{8Na_2(PHO_3)\cdot 5H_2O \ \xrightarrow{120-250^oC}\ Na_4P_2O_7 + 4Na_3PO_4 + 2PH_3\uparrow + 41H_2O }</math> |
||
* С избытком [[Фосфористая кислота|фосфористой кислоты]] образует кислую соль: |
* С избытком [[Фосфористая кислота|фосфористой кислоты]] образует кислую соль: |
||
::<math>\mathsf{Na_2(PHO_3) + H_2(PHO_3) \ \xrightarrow{0^oC}\ 2NaH(PHO_3) }</math> |
:: <math>\mathsf{Na_2(PHO_3) + H_2(PHO_3) \ \xrightarrow{0^oC}\ 2NaH(PHO_3) }</math> |
||
* Является восстановителем: |
* Является восстановителем: |
||
::<math>\mathsf{Na_2(PHO_3) + 3NaOH + Br_2 \ \xrightarrow{}\ Na_3PO_4 + 2NaBr + 2H_2O }</math> |
:: <math>\mathsf{Na_2(PHO_3) + 3NaOH + Br_2 \ \xrightarrow{}\ Na_3PO_4 + 2NaBr + 2H_2O }</math> |
||
* Вступает в обменные реакции: |
* Вступает в обменные реакции: |
||
::<math>\mathsf{Na_2(PHO_3) + 2AgNO_3 \ \xrightarrow{}\ Ag_2( |
:: <math>\mathsf{Na_2(PHO_3) + 2AgNO_3 \ \xrightarrow{}\ Ag_2(PHO_3)\downarrow + 2NaNO_3 }</math> |
||
== Литература == |
== Литература == |
||
Текущая версия от 13:47, 13 сентября 2024
| Фосфит натрия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Фосфит натрия |
| Традиционные названия | фосфористокислый натрий, фосфонат натрия |
| Хим. формула | Na2(PHO3) |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 125,96 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | гидрат 53 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 4190; 45625 г/100 мл |
| Классификация | |
| Рег. номер CAS | 13708-85-5 |
| PubChem | 6336603 |
| Рег. номер EINECS | 237-249-1 |
| SMILES | |
| InChI | |
| ChemSpider | 21106436 |
| Безопасность | |
| Токсичность | Основные опасности: источник ядовитого газа фосфина |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фосфит натрия — неорганическое соединение, соль щелочного металла натрия и фосфористой кислоты с формулой Na2(PHO3), бесцветные кристаллы, очень хорошо растворимые в воде, образует кристаллогидрат.
Получение
[править | править код]- Растворение белого фосфора в горячем концентрированном растворе едкого натра:
- Растворение оксида фосфора(III) в концентрированной щелочи:
- Нейтрализация щелочью фосфористой кислоты:
- Реакция хлорида фосфора(III) с щелочью:
Физические свойства
[править | править код]Фосфит натрия образует бесцветные кристаллы.
Хорошо растворяется в воде с гидролизом по аниону.
Из водных растворов выделяется кристаллогидрат состава Na2(PHO3)•5H2O, который плавится при 53°С в собственной кристаллизационной воде.
Не растворяется в этаноле.
Химические свойства
[править | править код]- При нагревании кристаллогидрат разлагается на фосфин, пирофосфат натрия и фосфат натрия:
- С избытком фосфористой кислоты образует кислую соль:
- Является восстановителем:
- Вступает в обменные реакции:
Литература
[править | править код]- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |








