Гемоцитобласт: различия между версиями
| [непроверенная версия] | [отпатрулированная версия] |
Jmarchn (обсуждение | вклад) м →Дополнительные изображения: Image in Russian |
|||
| (не показано 11 промежуточных версий 6 участников) | |||
| Строка 1: | Строка 1: | ||
{{Клетка | name = Гемоцитобласт | image = [[Файл:Hemocytoblast.png|150px]] | tissue = [[Соединительная ткань|соединительная]] | diffhistory = [[Зигота]] → [[Бластомер]] → [[Эмбриобласт]] → [[Эпибласт]] → [[Клетка первичной мезодермы]] → [[Прегемангиобласт]] → [[Гемангиобласт]] → Гемоцитобласт | diffto = [[Общий миелоидный прародитель]] • [[Общий лимфоидный прародитель]] <!-- | difffactors = | prolif = | ident = --> }} |
{{Клетка | name = Гемоцитобласт | image = [[Файл:Hemocytoblast.png|150px]] | tissue = [[Соединительная ткань|соединительная]] | diffhistory = [[Зигота]] → [[Бластомер]] → [[Эмбриобласт]] → [[Эпибласт]] → [[Клетка первичной мезодермы]] → [[Прегемангиобласт]] → [[Гемангиобласт]] → Гемоцитобласт | diffto = [[Общий миелоидный прародитель]] • [[Общий лимфоидный прародитель]] <!-- | difffactors = | prolif = | ident = --> }} |
||
{{Анатомическая карточка |
|||
{{Infobox Anatomy | |
|||
| название = Гемопоэтическая стволовая клетка (гемоцитобласт) |
|||
| изображение = Hematopoiesis simple.svg |
|||
Latin = Cellula haematopoietica praecursoria | |
|||
| подпись = Диаграмма нормального человеческого гемопоэза |
|||
GraySubject = | |
|||
| латынь = Cellula haematopoietica praecursoria |
|||
GrayPage = | |
|||
| система = |
|||
Image = Hematopoiesis simple.svg | |
|||
| лимфа = |
|||
Caption = Диаграмма нормального человеческого гемопоэза | |
|||
| кровоснабжение = |
|||
Image2 = | |
|||
| венозный отток = |
|||
Caption2 = | |
|||
| иннервация = |
|||
Precursor = | |
|||
| прекурсор = |
|||
Artery = | |
|||
Vein = | |
|||
Nerve = | |
|||
Lymph = | |
|||
MeshName = | |
|||
MeshNumber = | |
|||
Code = {{TerminologiaHistologica|2|00|01.0.00006}} | |
|||
}} |
}} |
||
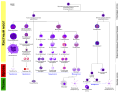
'''[[Гемопоэз|Гемопоэтические]] [[стволовые клетки]]''' ('''ГСК''', также называемые '''гемоцитобластами''') — это самые ранние предшественники клеток крови, которые дают начало всем остальным клеткам крови и происходят от [[гемангиобласт]]ов и [[прегемангиобласт]]ов, а те, в свою очередь — от клеток первичной эмбриональной [[мезодерма|мезодермы]]. Гемопоэтические стволовые клетки находятся в красном [[костный мозг|костном мозгу]], который, в свою очередь, находится внутри полостей большинства [[кость|костей]]. |
'''[[Гемопоэз|Гемопоэтические]] [[стволовые клетки]]''' ('''ГСК''', также называемые '''гемоцитобластами''') — это самые ранние предшественники клеток крови, которые дают начало всем остальным клеткам крови и происходят от [[гемангиобласт]]ов и [[прегемангиобласт]]ов, а те, в свою очередь — от клеток первичной эмбриональной [[мезодерма|мезодермы]]. Гемопоэтические стволовые клетки находятся в красном [[костный мозг|костном мозгу]], который, в свою очередь, находится внутри полостей большинства [[кость|костей]]. |
||
| Строка 27: | Строка 20: | ||
Как уже было сказано выше, гемопоэтические стволовые клетки являются гетерогенной популяцией, состоящей, на самом деле, из нескольких субпопуляций клеток с разными эпигенетическими программами дальнейшего развития. Так, выделяют три класса гемопоэтических стволовых клеток, различающихся по соотношению лимфоидных и миелоидных клеток (L/M ratio) в популяции их потомков. Миелоидно-уклоняющиеся ГСК (My-bi, от Myeloid-biased) имеют низкое соотношение L/M (0 < L/M < 3), лимфоидно-уклоняющиеся ГСК (Ly-bi, от Lymphoid-biased) имеют высокое соотношение L/M (L/M > 10), а так называемые «сбалансированные» ГСК (Bala, от Balanced) имеют промежуточное соотношение L/M (3 ≤ L/M ≤ 10). Только миелоидно-уклоняющиеся и «сбалансированные» ГСК являются долгоживущими и способны к длительному самовозобновлению популяции. Лимфоидно-уклоняющиеся ГСК — сравнительно короткоживущие. В дополнение к этим данным, эксперименты с последовательной трансплантацией тех или иных типов ГСК показали, что каждый подтип ГСК в условиях другого организма сохраняет свои «предпочтения» в отношении путей дифференцировки и предпочтительным образом воссоздаёт типичное для него распределение типов клеток крови (лимфоидных или миелоидных), характерное для данного подтипа, что заставляет предполагать наличие у этих клеток унаследованной эпигенетической программы дальнейшей дифференцировки для каждого подтипа, на которую оказывает сравнительно малое влияние свойства микроокружения (в частности, внутренняя среда нового организма). |
Как уже было сказано выше, гемопоэтические стволовые клетки являются гетерогенной популяцией, состоящей, на самом деле, из нескольких субпопуляций клеток с разными эпигенетическими программами дальнейшего развития. Так, выделяют три класса гемопоэтических стволовых клеток, различающихся по соотношению лимфоидных и миелоидных клеток (L/M ratio) в популяции их потомков. Миелоидно-уклоняющиеся ГСК (My-bi, от Myeloid-biased) имеют низкое соотношение L/M (0 < L/M < 3), лимфоидно-уклоняющиеся ГСК (Ly-bi, от Lymphoid-biased) имеют высокое соотношение L/M (L/M > 10), а так называемые «сбалансированные» ГСК (Bala, от Balanced) имеют промежуточное соотношение L/M (3 ≤ L/M ≤ 10). Только миелоидно-уклоняющиеся и «сбалансированные» ГСК являются долгоживущими и способны к длительному самовозобновлению популяции. Лимфоидно-уклоняющиеся ГСК — сравнительно короткоживущие. В дополнение к этим данным, эксперименты с последовательной трансплантацией тех или иных типов ГСК показали, что каждый подтип ГСК в условиях другого организма сохраняет свои «предпочтения» в отношении путей дифференцировки и предпочтительным образом воссоздаёт типичное для него распределение типов клеток крови (лимфоидных или миелоидных), характерное для данного подтипа, что заставляет предполагать наличие у этих клеток унаследованной эпигенетической программы дальнейшей дифференцировки для каждого подтипа, на которую оказывает сравнительно малое влияние свойства микроокружения (в частности, внутренняя среда нового организма). |
||
Изучение гемопоэтических стволовых клеток в течение последних 50 лет привело к значительно более глубокому пониманию их свойств, функций и природы. Прогресс в этом понимании сделал возможным широкое применение [[трансплантация гемопоэтических стволовых клеток|трансплантации гемопоэтических стволовых клеток]] при лечении [[злокачественная опухоль|злокачественных опухолей]] (особенно опухолей системы крови — [[лейкоз]]ов и [[лимфома|лимфом]]), ряда генетических, иммунологических (например, тяжёлый комбинированный иммунодефицит) и гематологических (например, [[миелодиспластический синдром]]) заболеваний.<ref>«5. Hematopoietic Stem Cells.» Stem Cell Information. National Institutes of Health, U.S. Department of Health and Human Services, 17 Jun 2011. Web. 9 Nov 2013. <http://stemcells.nih.gov/info/scireport/pages/chapter5.aspx ></ref> |
Изучение гемопоэтических стволовых клеток в течение последних 50 лет привело к значительно более глубокому пониманию их свойств, функций и природы. Прогресс в этом понимании сделал возможным широкое применение [[трансплантация гемопоэтических стволовых клеток|трансплантации гемопоэтических стволовых клеток]] при лечении [[злокачественная опухоль|злокачественных опухолей]] (особенно опухолей системы крови — [[лейкоз]]ов и [[лимфома|лимфом]]), ряда генетических, иммунологических (например, тяжёлый комбинированный иммунодефицит) и гематологических (например, [[миелодиспластический синдром]]) заболеваний.<ref>«5. Hematopoietic Stem Cells.» Stem Cell Information. National Institutes of Health, U.S. Department of Health and Human Services, 17 Jun 2011. Web. 9 Nov 2013. <http://stemcells.nih.gov/info/scireport/pages/chapter5.aspx {{Wayback|url=http://stemcells.nih.gov/info/scireport/pages/chapter5.aspx |date=20150929155557 }} ></ref> |
||
== Источники ГСК == |
== Источники ГСК == |
||
[[Файл:Gray72-en.svg|thumb|Схематическое изображение костного мозга и его клеток]] |
[[Файл:Gray72-en.svg|thumb|Схематическое изображение костного мозга и его клеток]] |
||
ГСК обнаруживаются в [[костный мозг|костном мозге]] взрослых. Большие их количества находятся в [[кость|костях]] [[Таз (анатомия)|таза]], [[бедро|бедра]] и [[грудина|грудины]]. Также в больших количествах ГСК обнаруживаются в [[плацента]]рной и [[пуповина|пуповинной]] крови [[плод]]а или [[новорождённый|новорождённого]]. В небольших количествах ГСК обнаруживаются также в периферической крови здоровых людей.<ref> |
ГСК обнаруживаются в [[костный мозг|костном мозге]] взрослых. Большие их количества находятся в [[кость|костях]] [[Таз (анатомия)|таза]], [[бедро|бедра]] и [[грудина|грудины]]. Также в больших количествах ГСК обнаруживаются в [[плацента]]рной и [[пуповина|пуповинной]] крови [[плод]]а или [[новорождённый|новорождённого]]. В небольших количествах ГСК обнаруживаются также в периферической крови здоровых людей.<ref>{{Cite web |url=http://cordadvantage.com/cord-blood-101/hematopoietic-stem-cell |title=Types Of Stem Cells {{!}} Americord Registry<!-- Заголовок добавлен ботом --> |accessdate=2014-09-22 |archiveurl=https://archive.today/20140623222517/http://cordadvantage.com/cord-blood-101/hematopoietic-stem-cell |archivedate=2014-06-23 |deadlink=yes }}</ref> Количество ГСК в периферической крови резко возрастает после введения колониестимулирующих факторов или в фазе восстановления после [[цитостатик|цитостатической]] [[химиотерапия|химиотерапии]]. |
||
Гемопоэтические стволовые клетки и другие клетки-предшественники могут быть взяты из костей таза в области подвздошной кости или из кости грудины, с использованием толстой иглы и шприца. Клетки могут быть изъяты в виде жидкого аспирата, получаемого при отсасывании шприцем (пункционная или аспирационная биопсия костного мозга) или в виде кусочка костномозговой кроветворной ткани, вместе с кусочком стромы костного мозга, костномозговыми сосудами и кусочком кости (так называемая трепанобиопсия костного мозга), при помощи троакара. Трепанобиоптат костного мозга, в отличие от аспирата, позволяет исследовать не только морфологическое строение, иммунофенотип, молекулярную генетику и цитогенетику самих клеток, но и их взаимоотношения друг с другом и с клетками микроокружения (стромы костного мозга, в частности), клетками сосудов и кости, архитектуру костномозговой кроветворной ткани. Это в ряде случаев очень важно для установления диагноза в [[гематология|гематологии]]. |
Гемопоэтические стволовые клетки и другие клетки-предшественники могут быть взяты из костей таза в области подвздошной кости или из кости грудины, с использованием толстой иглы и шприца. Клетки могут быть изъяты в виде жидкого аспирата, получаемого при отсасывании шприцем (пункционная или аспирационная биопсия костного мозга) или в виде кусочка костномозговой кроветворной ткани, вместе с кусочком стромы костного мозга, костномозговыми сосудами и кусочком кости (так называемая трепанобиопсия костного мозга), при помощи троакара. Трепанобиоптат костного мозга, в отличие от аспирата, позволяет исследовать не только морфологическое строение, иммунофенотип, молекулярную генетику и цитогенетику самих клеток, но и их взаимоотношения друг с другом и с клетками микроокружения (стромы костного мозга, в частности), клетками сосудов и кости, архитектуру костномозговой кроветворной ткани. Это в ряде случаев очень важно для установления диагноза в [[гематология|гематологии]]. |
||
| Строка 40: | Строка 32: | ||
В [[эмбриология|эмбриологии]] [[млекопитающие|млекопитающих]], первые явно гемопоэтические стволовые клетки обнаруживаются в области аорта-гонады-мезонефрос. Затем они массивно колонизируют фетальную [[печень]] и [[селезёнка|селезёнку]], которые у плода являются основными кроветворными органами. И только затем, сравнительно незадолго до родов, они колонизируют костный мозг и обживаются в нём, и функция органа кроветворения переходит от печени и селезёнки к костному мозгу. Тем не менее, в особых обстоятельствах и у взрослого человека может наблюдаться фетальный (экстрамедуллярный, внекостномозговой) тип кроветворения в [[селезёнка|селезёнке]] и в [[печень|печени]]. Например, это может случиться при [[лейкоз]]ах, при массивном разрушении костного мозга лейкозными клетками и вытеснении ими из него здоровых гемопоэтических стволовых клеток.<ref>Dzierzak & Speck, Of lineage and legacy: the development of mammalian hematopoietic stem cells, Nature Immunology, 2008</ref> |
В [[эмбриология|эмбриологии]] [[млекопитающие|млекопитающих]], первые явно гемопоэтические стволовые клетки обнаруживаются в области аорта-гонады-мезонефрос. Затем они массивно колонизируют фетальную [[печень]] и [[селезёнка|селезёнку]], которые у плода являются основными кроветворными органами. И только затем, сравнительно незадолго до родов, они колонизируют костный мозг и обживаются в нём, и функция органа кроветворения переходит от печени и селезёнки к костному мозгу. Тем не менее, в особых обстоятельствах и у взрослого человека может наблюдаться фетальный (экстрамедуллярный, внекостномозговой) тип кроветворения в [[селезёнка|селезёнке]] и в [[печень|печени]]. Например, это может случиться при [[лейкоз]]ах, при массивном разрушении костного мозга лейкозными клетками и вытеснении ими из него здоровых гемопоэтических стволовых клеток.<ref>Dzierzak & Speck, Of lineage and legacy: the development of mammalian hematopoietic stem cells, Nature Immunology, 2008</ref> |
||
<!--- |
|||
== Functional characteristics == |
|||
=== Multipotency and self-renewal === |
|||
Like all stem cells, HSCs can replenish all blood cell types (Multipotency) and self-renew. |
|||
It is known that a small number of HSCs can expand to generate a very large number of daughter HSCs. This phenomenon is used in [[bone marrow transplantation]], when a small number of HSCs reconstitute the hematopoietic system. This process indicates that, subsequent to bone marrow transplantation, symmetrical cell divisions into two daughter HSCs must occur. |
|||
Stem cell self-renewal is thought to occur in the [[stem cell niche]] in the bone marrow, and it is reasonable to assume that key signals present in this niche will be important in self-renewal. There is much interest in the environmental and molecular requirements for HSC self-renewal, as understanding the ability of HSC to replenish themselves will eventually allow the generation of expanded populations of HSC ''in vitro'' that can be used therapeutically. |
|||
=== Stem cell heterogeneity === |
|||
It was originally believed that all HSCs were alike in their self-renewal and differentiation abilities. This view was first challenged by the 2002 discovery by the Muller-Sieburg group in San Diego, who illustrated that different stem cells can show distinct repopulation patterns that are epigenetically predetermined intrinsic properties of clonal [[Thy-1]]<sup>lo</sup> Sca-1<sup>+</sup> lin<sup>-</sup> [[c-kit]]<sup>+</sup> HSC.<ref name="ReferenceA">Muller-Sieburg CE, Cho RH, Thoman M, Adkins B, Sieburg HB, Deterministc regulation of haematopoietic stem cell self-renewal and differentiation. Blood. 2002; 100; 1302-9</ref><ref name="MullerSieburg">Muller-Sieburg CE, Cho RH, Karlson L, Huang JF, Sieburg HB. Myeloid-biased hematopoietic stem cells have extensive self-renewal capacity but generate diminished progeny with impaired IL-7 responsiveness. Blood. 2004; 103:4111-8</ref><ref name="ReferenceB">Sieburg HB, Cho RH, Dykstra B, Eaves, CJ, Muller-Sieburg, CE. The haematopoietic stem cell compartment consists of a limited number of discrete stem cell subsets. Blood. 2006; 107:2311-6. Epub 2005 Nov 15</ref> The results of these clonal studies led to the notion of lineage bias. Using the ratio <math>\rho = L/M</math> of lymphoid (L) to myeloid (M) cells in blood as a quantitative marker, the stem cell compartment can be split into three categories of HSC. Balanced (Bala) HSC repopulate peripheral white blood cells in the same ratio of myeloid to lymphoid cells as seen in unmanipulated mice (on average about 15 % myeloid and 85 % lymphoid cells, or 3≤ρ≤10). Myeloid-biased (My-bi) HSC give rise to too few lymphocytes resulting in ratios 0<ρ<3, while lymphoid-biased (Ly-bi) HSC generate too few myeloid cells, which results in lymphoid-to-myeloid ratios of 10<ρ<oo. All three types are norm three types of HSC, and they do not represent stages of differentiation. Rather, these are three classes of HSC, each with an epigenetically fixed differentiation program. These studies also showed that lineage bias is not stochastically regulated or dependent on differences in environmental influence. My-bi HSC self-renew longer than balanced or Ly-bi HSC. The myeloid bias results from reduced responsiveness to the lymphopoetin [[interleukin 7]] (IL-7).<ref name="MullerSieburg" /> |
|||
Subsequent to this, other groups confirmed and highlighted the original findings.<ref name="Schroeder, T 2010">Schroeder, T. Haematopoietic Stem Cell Heterogeneity: Subtypes, Not Unpredictable Behavior. Cell Stem Cell 2010. DOI 10.1016/j.stem.2010.02.006</ref> For example, the Eaves group confirmed in 2007 that repopulation kinetics, long-term self-renewal capacity, and My-bi and Ly-bi are stably inherited intrinsic HSC properties.<ref name="ReferenceC">Dykstra, B et al. Long-Term Propagation of Distinct Hematopoietic Differentiation Programs In Vivo. Cell Stem Cell, Volume 1, Issue 2, 218—229, '''16 August 2007'''</ref> In 2010, the Goodell group provided additional insights about the molecular basis of lineage bias in [[side population]] (SP) SCA-1<sup>+</sup> lin<sup>-</sup> c-kit<sup>+</sup> HSC.<ref name="Challen, G. 2010">Challen, G., Boles, NC, Chambers, SM, Goodell, MA. Distinct Haematopoietic Stem Cell Subtypes Are Differentially Regulated by TGF-beta1. Cell Stem Cel 2010. DOI 10.1016/j.stem.2010.02.002</ref> As previously shown for IL-7 signaling, it was found that a member of the [[transforming growth factor]] family (TGF-beta) induces and inhibits the proliferation of My-bi and Ly-bi HSC, respectively. |
|||
=== Functional === |
|||
A ''cobblestone area-forming cell (CAFC)'' [[assay]] is a cell culture-based empirical assay. When plated onto a confluent culture of stromal [[feeder layer]], a fraction of HSCs creep between the gaps (even though the stromal cells are touching each other) and eventually settle between the stromal cells and the substratum (here the dish surface) or trapped in the cellular processes between the stromal cells. [[Emperipolesis]] is the ''in vivo'' phenomenon in which one cell is completely engulfed into another (e.g. [[thymocyte]]s into [[thymic nurse cell]]s); on the other hand, when ''in vitro'', lymphoid lineage cells creep beneath [[nurse-like cells]], the process is called [[pseudoemperipolesis]]. This similar phenomenon is more commonly known in the HSC field by the cell culture terminology ''cobble stone area-forming cells (CAFC)'', which means areas or clusters of cells look dull [[cobblestone]]-like under phase contrast microscopy, compared to the other HSCs, which are refractile. This happens because the cells that are floating loosely on top of the stromal cells are spherical and thus refractile. However, the cells that creep beneath the stromal cells are flattened and, thus, not refractile. The mechanism of pseudoemperipolesis is only recently coming to light. It may be mediated by interaction through [[CXCR4]] (CD184) the receptor for CXC Chemokines (e.g., [[SDF-1 (biology)|SDF1]]) and [[α4β1]] [[integrin]]s.<ref>Burger JA, Spoo A, Dwenger A, Burger M, Behringer D. CXCR4 chemokine receptors (CD184) and alpha4beta1 integrins mediate spontaneous migration of human CD34+ progenitors and acute myeloid leukaemia cells beneath marrow stromal cells (pseudoemperipolesis). |
|||
Br J Haematol. 2003 Aug;122(4):579-89. PMID 12899713</ref> |
|||
=== Mobility === |
|||
HSCs have a higher potential than other immature blood cells to pass the [[bone marrow barrier]], and, thus, may travel in the blood from the bone marrow in one bone to another bone. If they settle in the [[thymus]], they may develop into [[T cells]]. In the case of fetuses and other [[extramedullary hematopoiesis]], HSCs may also settle in the [[liver]] or [[spleen]] and develop. |
|||
This ability is the reason why HSCs may be harvested directly from the blood. |
|||
== Physical characteristics == |
|||
With regard to morphology, hematopoietic stem cells resemble lymphocytes. They are non-adherent, and rounded, with a rounded nucleus and low cytoplasm-to-nucleus ratio. Since PHSC cannot be isolated as a pure population, it is not possible to identify them in a microscope. The above description is based on the morphological characteristics of a heterogeneous population, of which PHSC are a component. |
|||
== Markers == |
|||
In reference to phenotype, hematopoeitic stem cells are identified by their small size, lack of lineage (lin) markers, low staining (side population) with vital dyes such as rhodamine 123 (rhodamine<sup>DULL</sup>, also called rho<sup>lo</sup>) or Hoechst 33342, and presence of various antigenic markers on their surface. |
|||
=== Cluster of differentiation and other markers === |
|||
Many of these markers belong to the [[cluster of differentiation]] series, like: [[CD34]], [[CD38]], [[CD90]], [[CD133]], [[CD105]], [[CD45]], and also [[c-kit]], — the receptor for [[stem cell factor]]. The hematopoietic stem cells are negative for the markers that are used for detection of lineage commitment, and are, thus, called Lin-; and, during their purification by [[flow cytometry|FACS]], a bunch of up to 14 different mature blood-lineage marker, e.g., [[CD13]] & [[CD33]] for myeloid, [[CD71]] for erythroid, [[CD19]] for B cells, [[CD61]] for megakaryocytic, etc. for humans; and, [[B220]] (murine [[CD45]]) for [[B cells]], [[Integrin alpha M|Mac-1]] ([[Integrin alpha M|CD11b]]/[[CD18]]) for [[monocytes]], [[Gr-1]] for [[Granulocyte]]s, [[Ter119]] for erythroid cells, [[Il7Ra]], [[CD3 (immunology)|CD3]], [[CD4]], [[CD5 (protein)|CD5]], [[CD8]] for [[T cells]], etc. (for mice) antibodies are used as a mixture to deplete the lin+ cells or late multipotent progenitors (MPP)s. |
|||
There are many differences between the human and mice hematopoietic cell markers for the commonly accepted type of hematopoietic stem cells.[http://stemcells.nih.gov/info/scireport/chapter5.asp]. |
|||
* '''Mouse HSC :''' [[CD34]]<sup>lo/-</sup>, [[SCA-1]]<sup>+</sup>, [[CD90|Thy1.1]]<sup>+/lo</sup>, [[CD38]]<sup>+</sup>, [[C-kit]]<sup>+</sup>, lin<sup>-</sup> |
|||
* '''Human HSC :''' [[CD34]]<sup>+</sup>, [[CD59]]<sup>+</sup>, [[CD90|Thy1/CD90]]<sup>+</sup>, [[CD38]]<sup>lo/-</sup>, [[CD117|C-kit/CD117]]<sup>+</sup>, lin<sup>-</sup> |
|||
However, not all stem cells are covered by these combinations that, nonetheless, have become popular. In fact, even in humans, there are hematopoietic stem cells that are [[CD34]]<sup>-</sup>/[[CD38]]<sup>-</sup>.<ref>Bhatia, M., D. Bonnet, B. Murdoch, O.I. Gan and J.E. Dick, A newly discovered class of human haematopoietic cells with [[Severe combined immunodeficiency|SCID]]-repopulating activity, 4(9), 1038, 1998.</ref><ref>Guo, Yalin, Lubbert, Michael, Engelhardt, Monika |
|||
CD34- Hematopoietic Stem Cells: Current Concepts and Controversies |
|||
Stem Cells 2003; 21: 15-20; First published online; doi=10.1634/stemcells.21-1-15</ref> Also some later studies suggested that earliest stem cells may lack c-kit on the cell surface.<ref>H. Doi et al. (1997) Proc. Natl. Acad. Sci. USA 94, 2513—2517</ref> For human HSCs use of [[CD133]] was one step ahead as both [[CD34]]<sup>+</sup> and [[CD34]]<sup>-</sup> HSCs were [[CD133]]<sup>+</sup>. |
|||
Traditional purification method used to yield a reasonable purity level of mouse hematopoietic stem cells, in general, requires a large(~10-12) battery of markers, most of which were surrogate markers with little functional significance, and thus partial overlap with the stem cell populations and sometimes other closely related cells that are not stem cells. Also, some of these markers (e.g., [[CD90|Thy1]]) are not conserved across mouse species, and use of markers like [[CD34]]<sup>-</sup> for HSC purification requires mice to be at least 8 weeks old. |
|||
=== SLAM code === |
|||
Alternative methods that could give rise to similar or better harvest of stem cells is a hot area of research and are presently emerging. One such method uses a signature of ''[[signaling lymphocyte activation molecule|SLAM]]'' family of cell surface molecules. SLAM ([[Signaling lymphocyte activation molecule]]) family is a group of >10 molecules whose genes are located mostly tandemly in a single locus on chromosome 1 (mouse), all belonging to a subset of immunoglobulin gene superfamily, and originally thought to be involved in T-cell stimulation. This family includes [[CD48]], [[CD150]], [[CD244]], etc., CD150 being the founding member, and, thus, also called slamF1, i.e., SLAM family member 1. |
|||
The signature '''SLAM code''' for the hemopoietic hierarchy are: |
|||
* '''[[Hematopoietic stem cells]] (HSC) :''' [[CD150]]<sup>+</sup>[[CD48]]<sup>-</sup>[[CD244]]<sup>-</sup> |
|||
* '''[[Multipotent progenitor cell]]s (MPPs) :''' [[CD150]]<sup>-</sup>[[CD48]]<sup>-</sup>[[CD244]]<sup>+</sup> |
|||
* '''[[Lineage-restricted progenitor cell]]s (LRPs) :''' [[CD150]]<sup>-</sup>[[CD48]]<sup>+</sup>[[CD244]]<sup>+</sup> |
|||
* '''[[Common myeloid progenitor]] (CMP) :''' lin<sup>-</sup>[[SCA-1]]<sup>-</sup>[[c-kit]]<sup>+</sup>[[CD34]]<sup>+</sup>[[CD16/32]]<sup>mid</sup> |
|||
* '''[[Granulocyte-macrophage progenitor]] (GMP) :''' lin<sup>-</sup>[[SCA-1]]<sup>-</sup>[[c-kit]]<sup>+</sup>[[CD34]]<sup>+</sup>[[CD16/32]]<sup>hi</sup> |
|||
* '''[[Megakaryocyte-erythroid progenitor]] (MEP) :''' lin<sup>-</sup>[[SCA-1]]<sup>-</sup>[[c-kit]]<sup>+</sup>[[CD34]]<sup>-</sup>[[CD16/32]]<sup>low</sup> |
|||
For HSCs, [[CD150]]<sup>+</sup>[[CD48]]<sup>-</sup> was sufficient instead of [[CD150]]<sup>+</sup>[[CD48]]<sup>-</sup>[[CD244]]<sup>-</sup> because CD48 is a ligand for CD244, and both would be positive only in the activated lineage-restricted progenitors. It seems that this code was more efficient than the more tedious earlier set of the large number of markers, and are also conserved across the mouse strains; however, recent work has shown that this method excludes a large number of HSCs and includes an equally large number of non-stem cells.<ref>David C Weksberg, Stuart M Chambers, Nathan C Boles, and Margaret A Goodell |
|||
CD150 negative Side Population cells represent a functionally distinct population of long-term haematopoietic stem cells. Blood 2007 : blood-2007-09-115006v1</ref> |
|||
.<ref>Gary Van Zant |
|||
Stem cell markers: less is more! |
|||
Blood 107: 855-856.</ref> [[CD150]]<sup>+</sup>[[CD48]]<sup>-</sup> gave stem cell purity comparable to [[CD90|Thy1]]<sup>lo</sup>[[SCA-1]]<sup>+</sup>lin<sup>-</sup>[[c-kit]]<sup>+</sup> in mice.<ref>Kiel et al., Cell, Vol. 121, 1109–1121, July 1, 2005, Copyright ©2005 by Elsevier Inc. DOI 10.1016/j.cell.2005.05.026</ref> |
|||
=== LT-HSC/ST-HSC/Early MPP/Late MPP === |
|||
[[Irving Weissman]]'s group at [[Stanford University]] was the first to isolate mouse hematopoietic stem cells in 1988 and was also the first to work out the markers to distinguish the mouse long-term (LT-HSC) and short-term (ST-HSC) hematopoietic stem cells (self-renew-capable), and the Multipotent progenitors (MPP, low or no self-renew capability — the later the developmental stage of MPP, the lesser the self-renewal ability and the more of some of the markers like CD4 and [[CD135]]): |
|||
* '''LT-HSC :''' [[CD34]]<sup>-</sup>, [[CD38]]<sup>-</sup>, [[SCA-1]]<sup>+</sup>, [[CD90|Thy1.1]]<sup>+/lo</sup>, [[C-kit]]<sup>+</sup>, [[lineage markers|lin]]<sup>-</sup>, [[CD135]]<sup>-</sup>, [[CD150|Slamf1/CD150]]<sup>+</sup> |
|||
* '''ST-HSC :''' [[CD34]]<sup>+</sup>, [[CD38]]<sup>+</sup>, [[SCA-1]]<sup>+</sup>, [[CD90|Thy1.1]]<sup>+/lo</sup>, [[C-kit]]<sup>+</sup>, [[lineage markers|lin]]<sup>-</sup>, [[CD135]]<sup>-</sup>, [[CD150|Slamf1/CD150]]<sup>+</sup>, [[CD11b|Mac-1 (CD11b)]]<sup>lo</sup> |
|||
* '''Early MPP :''' [[CD34]]<sup>+</sup>, [[SCA-1]]<sup>+</sup>, [[CD90|Thy1.1]]<sup>-</sup>, [[C-kit]]<sup>+</sup>, [[lineage markers|lin]]<sup>-</sup>, [[CD135]]<sup>+</sup>, [[CD150|Slamf1/CD150]]<sup>-</sup>, [[CD11b|Mac-1 (CD11b)]]<sup>lo</sup>, [[CD4]]<sup>lo</sup> |
|||
* '''Late MPP :''' [[CD34]]<sup>+</sup>, [[SCA-1]]<sup>+</sup>, [[CD90|Thy1.1]]<sup>-</sup>, [[C-kit]]<sup>+</sup>, [[lineage markers|lin]]<sup>-</sup>, [[CD135]]<sup>high</sup>, [[CD150|Slamf1/CD150]]<sup>-</sup>, [[CD11b|Mac-1 (CD11b)]]<sup>lo</sup>, [[CD4]]<sup>lo</sup> |
|||
== Nomenclature of hematopoietic colonies and lineages == |
|||
Between 1948 and 1950, the Committee for Clarification of the Nomenclature of Cells and Diseases of the Blood and Blood-forming Organs issued reports on the nomenclature of blood cells.<ref>{{cite journal | author = | title = First report of the Committee for Clarification of the Nomenclature of Cells and Diseases of the Blood and Blood-forming Organs | journal = Amer J Clin Pathol | volume = 18 | issue = | pages = 443–450 | year = 1948 | id = }}</ref><ref>{{cite journal | author = | title = Third, fourth and fifth reports of the committee for clarification of the nomenclature of cells and diseases of the blood and blood-forming organs | journal = Am J Clin Pathol | volume = 20 | issue = 6 | pages = 562–79 | year = 1950 | pmid = 15432355}}</ref> An overview of the terminology is shown below, from earliest to final stage of development: |
|||
* [root]blast |
|||
* pro[root]cyte |
|||
* [root]cyte |
|||
* meta[root]cyte |
|||
* mature cell name |
|||
The root for erythrocyte colony-forming units (CFU-E) is «rubri», for granulocyte-monocyte colony-forming units (CFU-GM) is «granulo» or «myelo» and «mono», for lympocyte colony-forming units (CFU-L) is «lympho» and for megakaryocyte colony-forming units (CFU-Meg) is «megakaryo». According to this terminology, the stages of red blood cell formation would be: rubriblast, prorubricyte, rubricyte, metarubricyte, and erythrocyte. However, the following nomenclature seems to be, at present, the most prevalent: |
|||
{| class="wikitable" |
|||
| '''Committee''' || '''«lympho»''' || '''«rubri»''' || '''«granulo» or «myelo»''' || '''«mono»''' || '''«megakaryo»''' |
|||
|- |
|||
| ''Lineage'' || [[Lymphoid]] || [[Myeloid]] || Myeloid || Myeloid || Myeloid |
|||
|- |
|||
| ''CFU'' || [[CFU-L]] || [[CFU-GEMM]]→[[CFU-E]] || CFU-GEMM→[[CFU-GM]]→[[CFU-G]] || CFU-GEMM→[[CFU-GM]]→[[CFU-M]] || CFU-GEMM→[[CFU-Meg]] |
|||
|- |
|||
| ''Process'' || [[lymphocytopoiesis]] || [[erythropoiesis]] || [[granulocytopoiesis]] || [[monocytopoiesis]] || [[thrombocytopoiesis]] |
|||
|- |
|||
| ''[root]blast'' || [[Lymphoblast]] || [[Proerythroblast]] || [[Myeloblast]] || [[Monoblast]] || [[Megakaryoblast]] |
|||
|- |
|||
| ''pro[root]cyte'' || [[Prolymphocyte]] || [[Polychromatophilic erythrocyte]] || [[Promyelocyte]] || [[Promonocyte]] || [[Promegakaryocyte]] |
|||
|- |
|||
| ''[root]cyte'' || - || [[Normoblast]] || [[Eosinophilic myelocyte|Eosino]]/[[neutrophilic myelocyte|neutro]]/[[basophilic myelocyte]] || || [[Megakaryocyte]] |
|||
|- |
|||
| ''meta[root]cyte'' || Large [[lymphocyte]] || [[Reticulocyte]] || Eosinophilic/neutrophilic/basophilic [[metamyelocyte]], Eosinophilic/neutrophilic/basophilic [[band cell]] || [[Early monocyte]] || - |
|||
|- |
|||
| ''mature cell name'' || Small [[lymphocyte]] || [[Erythrocyte]] || [[granulocytes]] ([[Eosinophil|Eosino]]/[[neutrophil|neutro]]/[[basophil]]) || [[Monocyte]] || [[thrombocytes]] ([[Platelets]]) |
|||
|} |
|||
Osteoclasts also arise from hemopoietic cells of the monocyte/neutrophil lineage, specifically CFU-GM. |
|||
== Colony-forming units == |
|||
There are various kinds of colony-forming units: |
|||
* Colony-forming unit [[lymphocyte]] (CFU-L) |
|||
* Colony-forming unit [[erythrocyte]] (CFU-E) |
|||
* Colony-forming unit granulo-[[monocyte]] (CFU-GM) |
|||
* Colony-forming unit [[megakaryocyte]] (CFU-Me) |
|||
* Colony-forming unit [[Basophil]] (CFU-B) |
|||
* Colony-forming unit [[Eosinophil]] (CFU-Eo) |
|||
The above CFUs are based on the lineage. Another CFU, the ''colony-forming unit-spleen'' ('''CFU-S''') was the basis of an ''in vivo'' clonal colony formation, which depends on the ability of infused bone marrow cells to give rise to clones of maturing hematopoietic cells in the spleens of irradiated mice after 8 to 12 days. It was used extensively in early studies, but is now considered to measure more mature progenitor or '''Transit Amplifying Cells''' rather than stem cells. |
|||
== HSC repopulation kinetics == |
|||
Hematopoietic stem cells (HSC) cannot be easily observed directly, and, therefore, their behaviors need to be inferred indirectly. Clonal studies are likely the closest technique for single cell in vivo studies of HSC. Here, sophisticated experimental and statistical methods are used to ascertain that, with a high probability, a single HSC is contained in a transplant administered to a lethally irradiated host. The clonal expansion of this stem cell can then be observed over time by monitoring the percent donor-type cells in blood as the host is reconstituted. The resulting time series is defined as the repopulation kinetic of the HSC. |
|||
The reconstitution kinetics are very heterogeneous. However, using [[symbolic dynamics]], one can show that they fall into a limited number of classes.<ref>Sieburg, HB, Muller-Sieburg, CE. Classification of short kinetics by shape. In Silico Biol. 2004;4(2):209-17</ref> To prove this, several hundred experimental repopulation kinetics from clonal Thy-1<sup>lo</sup> SCA-1<sup>+</sup> lin<sup>-</sup> c-kit<sup>+</sup> HSC were translated into symbolic sequences by assigning the symbols «+», «-», «~» whenever two successive measurements of the percent donor-type cells have a positive, negative, or unchanged slope, respectively. By using the [[Hamming distance]], the repopulation patterns were subjected to cluster analysis yielding 16 distinct groups of kinetics. To finish the empirical proof, the Laplace add-one approach was used to determine that the probability of finding kinetics not contained in these 16 groups is very small. By corollary, this result shows that the hematopoietic stem cell compartment is also heterogeneous by dynamical criteria. |
|||
---> |
|||
== Дополнительные изображения == |
== Дополнительные изображения == |
||
| Строка 164: | Строка 39: | ||
== Примечания == |
== Примечания == |
||
{{примечания|2}} |
{{примечания|2}} |
||
== Ссылки == |
== Ссылки == |
||
* [http://www.eurostemcell.org/factsheet/blood-stem-cells-pioneers-stem-cell-research Fact sheet about blood stem cells on EuroStemCell] {{Wayback|url=http://www.eurostemcell.org/factsheet/blood-stem-cells-pioneers-stem-cell-research |date=20141216130714 }} |
|||
* [http://www.eurostemcell.org/factsheet/blood-stem-cells-pioneers-stem-cell-research Fact sheet about blood stem cells on EuroStemCell] |
|||
* {{MeshName|Hematopoietic+stem+cells}} |
* {{MeshName|Hematopoietic+stem+cells}} |
||
* Meng Y. & Nerlov C. (2024). [https://www.cell.com/trends/cell-biology/fulltext/S0962-8924(24)00162-4 Epigenetic regulation of hematopoietic stem cell fate]. Trends in Cell Biology, |
|||
{{внешние ссылки}} |
|||
[[Категория:Клетки крови]] |
[[Категория:Клетки крови]] |
||
[[Категория:Гемопоэз]] |
[[Категория:Гемопоэз]] |
||
Текущая версия от 17:54, 13 сентября 2024
| Гемоцитобласт | |
|---|---|
 | |
| Ткань | соединительная |
| История дифференцировки клетки | Зигота → Бластомер → Эмбриобласт → Эпибласт → Клетка первичной мезодермы → Прегемангиобласт → Гемангиобласт → Гемоцитобласт |
| Возможности для дальнейшей дифференцировки | Общий миелоидный прародитель • Общий лимфоидный прародитель |
| Гемопоэтическая стволовая клетка (гемоцитобласт) | |
|---|---|
| лат. Cellula haematopoietica praecursoria | |
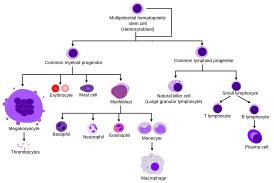 Диаграмма нормального человеческого гемопоэза | |
| Каталоги | |
Гемопоэтические стволовые клетки (ГСК, также называемые гемоцитобластами) — это самые ранние предшественники клеток крови, которые дают начало всем остальным клеткам крови и происходят от гемангиобластов и прегемангиобластов, а те, в свою очередь — от клеток первичной эмбриональной мезодермы. Гемопоэтические стволовые клетки находятся в красном костном мозгу, который, в свою очередь, находится внутри полостей большинства костей.
Плюрипотентные гемопоэтические стволовые клетки (гемоцитобласты) дают начало как миелоидным клеткам (моноцитам и макрофагам, трём разновидностям гранулоцитов — нейтрофилам, базофилам и эозинофилам, а также эритроцитам, мегакариоцитам/тромбоцитам, миелоидным дендритным клеткам), так и лимфоидным клеткам (Т-лимфоцитам, B-лимфоцитам, NK-лимфоцитам, лимфоидным дендритным клеткам). Именно в силу такого разнообразия (плюрализма) возможностей для дифференцировки их называют «плюрипотентными» или «универсальными». Ранее считалось, что плюрипотентные гемопоэтические стволовые клетки (гемоцитобласты) — это наиболее ранние из гемопоэтических стволовых клеток, встречающихся в постнатальном (то есть, уже родившемся) и тем более во взрослом организме. Однако в последнее время доказано наличие в постнатальном и даже во взрослом организме небольшого количества ещё более ранних, «пре-гемопоэтических», и ещё более плюрипотентных (то есть имеющих ещё больше различных возможностей для дифференцировки по тому или иному пути) стволовых клеток, могущих стать как гемопоэтическими стволовыми клетками (гемоцитобластами), так и стволовыми клетками эндотелия сосудов (ангиобластами) — так называемых клеток гемогенного эндотелия, гемангиобластов и даже прегемангиобластов. Более того, обнаружилось, что, по-видимому, в некоторых специфических обстоятельствах плюрипотентные гемопоэтические клетки способны к «обратной дифференцировке» — частичной «раздифференцировке» обратно в гемангиобласты и прегемангиобласты (а те, естественно, способны к созреванию в гемоцитобласты). То есть дифференцировка в этой клеточной системе не всегда идёт в одном направлении, от менее дифференцированных клеток к более дифференцированным, и определённое количество гемангиобластов и прегемангиобластов всегда поддерживается во взрослом организме «про запас», при необходимости даже путём «обратной дифференцировки» (которая возможна только на этом этапе, но не на более поздних).
В связи со всеми этими новыми данными определение термина «гемопоэтическая стволовая клетка» сильно изменилось за последние два десятилетия. В настоящее время общепризнано, что гемопоэтические (равно как и пре-гемопоэтические — гемангиобластные) стволовые клетки не представляют собой какую-то единую, однородную гомогенную популяцию одинаковых по своим свойствам клеток, а составляют сложную гетерогенную смесь различных субпопуляций гемопоэтических стволовых клеток разной степени зрелости (находящихся на разных стадиях дифференцировки), и обладающих несколько различными поверхностными антигенами (кластерами дифференцировки), разным временем жизни, разной краткосрочной и долгосрочной регенеративной активностью, разными профилями экспрессии генов и разными эпигенетическими программами дальнейшей дифференцировки, заложенными в них. А гемопоэтическая (кроветворная) ткань костного мозга содержит как собственно ранние гемопоэтические и пре-гемопоэтические стволовые клетки разных субпопуляций и разной степени зрелости, обладающие разными краткосрочными и долгосрочными регенеративными возможностями, так и более поздние, уже полностью или частично коммиттированные (рекрутированные) в ту или иную линию кроветворных клеток, мультипотентные, олигопотентные, бипотентные и унипотентные клетки-предшественники. Собственно, ранние гемопоэтические стволовые клетки (гемоцитобласты) составляют всего лишь 1 из каждых 10 000 клеток в кроветворной (миелоидной) ткани красного костного мозга. Ещё более ранних, пре-гемопоэтических стволовых клеток (гемангиобластов и прегемангиобластов) в кроветворной ткани костного мозга ещё меньше, приблизительно 1: 50 000. Однако чем более ранней является гемопоэтическая стволовая клетка, тем выше её пролиферативная активность и её способность к регенерации, поэтому сравнительно небольшое их количество (в экспериментах на мышах — всего одна гемопоэтическая стволовая клетка) способно реконституировать всю или почти всю кроветворную ткань после её уничтожения сублетальными дозами ионизирующей радиации или цитостатической химиотерапии. На этом основан принцип высокодозной химиотерапии и трансплантации гемопоэтических стволовых клеток.
Как уже было сказано выше, гемопоэтические стволовые клетки являются гетерогенной популяцией, состоящей, на самом деле, из нескольких субпопуляций клеток с разными эпигенетическими программами дальнейшего развития. Так, выделяют три класса гемопоэтических стволовых клеток, различающихся по соотношению лимфоидных и миелоидных клеток (L/M ratio) в популяции их потомков. Миелоидно-уклоняющиеся ГСК (My-bi, от Myeloid-biased) имеют низкое соотношение L/M (0 < L/M < 3), лимфоидно-уклоняющиеся ГСК (Ly-bi, от Lymphoid-biased) имеют высокое соотношение L/M (L/M > 10), а так называемые «сбалансированные» ГСК (Bala, от Balanced) имеют промежуточное соотношение L/M (3 ≤ L/M ≤ 10). Только миелоидно-уклоняющиеся и «сбалансированные» ГСК являются долгоживущими и способны к длительному самовозобновлению популяции. Лимфоидно-уклоняющиеся ГСК — сравнительно короткоживущие. В дополнение к этим данным, эксперименты с последовательной трансплантацией тех или иных типов ГСК показали, что каждый подтип ГСК в условиях другого организма сохраняет свои «предпочтения» в отношении путей дифференцировки и предпочтительным образом воссоздаёт типичное для него распределение типов клеток крови (лимфоидных или миелоидных), характерное для данного подтипа, что заставляет предполагать наличие у этих клеток унаследованной эпигенетической программы дальнейшей дифференцировки для каждого подтипа, на которую оказывает сравнительно малое влияние свойства микроокружения (в частности, внутренняя среда нового организма).
Изучение гемопоэтических стволовых клеток в течение последних 50 лет привело к значительно более глубокому пониманию их свойств, функций и природы. Прогресс в этом понимании сделал возможным широкое применение трансплантации гемопоэтических стволовых клеток при лечении злокачественных опухолей (особенно опухолей системы крови — лейкозов и лимфом), ряда генетических, иммунологических (например, тяжёлый комбинированный иммунодефицит) и гематологических (например, миелодиспластический синдром) заболеваний.[1]
Источники ГСК
[править | править код]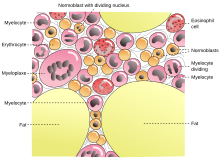
ГСК обнаруживаются в костном мозге взрослых. Большие их количества находятся в костях таза, бедра и грудины. Также в больших количествах ГСК обнаруживаются в плацентарной и пуповинной крови плода или новорождённого. В небольших количествах ГСК обнаруживаются также в периферической крови здоровых людей.[2] Количество ГСК в периферической крови резко возрастает после введения колониестимулирующих факторов или в фазе восстановления после цитостатической химиотерапии.
Гемопоэтические стволовые клетки и другие клетки-предшественники могут быть взяты из костей таза в области подвздошной кости или из кости грудины, с использованием толстой иглы и шприца. Клетки могут быть изъяты в виде жидкого аспирата, получаемого при отсасывании шприцем (пункционная или аспирационная биопсия костного мозга) или в виде кусочка костномозговой кроветворной ткани, вместе с кусочком стромы костного мозга, костномозговыми сосудами и кусочком кости (так называемая трепанобиопсия костного мозга), при помощи троакара. Трепанобиоптат костного мозга, в отличие от аспирата, позволяет исследовать не только морфологическое строение, иммунофенотип, молекулярную генетику и цитогенетику самих клеток, но и их взаимоотношения друг с другом и с клетками микроокружения (стромы костного мозга, в частности), клетками сосудов и кости, архитектуру костномозговой кроветворной ткани. Это в ряде случаев очень важно для установления диагноза в гематологии.
С целью мобилизации донорских гемопоэтических стволовых клеток из костного мозга в периферическую кровь и их и последующего успешного сбора из периферической крови, донору гемопоэтических стволовых клеток вводят цитокины, такие, как G-CSF и/или GM-CSF, которые, помимо того, что вызывают интенсивное размножение гемопоэтических стволовых клеток в костном мозгу и увеличение их количества, также вызывают их массовый выход из костного мозга в кровь и увеличение количества циркулирующих ГСК.
В эмбриологии млекопитающих, первые явно гемопоэтические стволовые клетки обнаруживаются в области аорта-гонады-мезонефрос. Затем они массивно колонизируют фетальную печень и селезёнку, которые у плода являются основными кроветворными органами. И только затем, сравнительно незадолго до родов, они колонизируют костный мозг и обживаются в нём, и функция органа кроветворения переходит от печени и селезёнки к костному мозгу. Тем не менее, в особых обстоятельствах и у взрослого человека может наблюдаться фетальный (экстрамедуллярный, внекостномозговой) тип кроветворения в селезёнке и в печени. Например, это может случиться при лейкозах, при массивном разрушении костного мозга лейкозными клетками и вытеснении ими из него здоровых гемопоэтических стволовых клеток.[3]
Дополнительные изображения
[править | править код]-
Диаграмма дифференцировки гемопоэтических клеток
Примечания
[править | править код]- ↑ «5. Hematopoietic Stem Cells.» Stem Cell Information. National Institutes of Health, U.S. Department of Health and Human Services, 17 Jun 2011. Web. 9 Nov 2013. <http://stemcells.nih.gov/info/scireport/pages/chapter5.aspx Архивная копия от 29 сентября 2015 на Wayback Machine >
- ↑ Types Of Stem Cells | Americord Registry. Дата обращения: 22 сентября 2014. Архивировано из оригинала 23 июня 2014 года.
- ↑ Dzierzak & Speck, Of lineage and legacy: the development of mammalian hematopoietic stem cells, Nature Immunology, 2008
Ссылки
[править | править код]- Fact sheet about blood stem cells on EuroStemCell Архивная копия от 16 декабря 2014 на Wayback Machine
- MeSH Hematopoietic+stem+cells
- Meng Y. & Nerlov C. (2024). Epigenetic regulation of hematopoietic stem cell fate. Trends in Cell Biology,