Кофермент A: различия между версиями
| [непроверенная версия] | [отпатрулированная версия] |
→Биосинтез: Исправлена опечатка Метки: с мобильного устройства из мобильной версии |
РобоСтася (обсуждение | вклад) м checkwiki fixes (1, 2, 9, 17, 22, 26, 38, 48, 50, 52, 54, 64, 65, 66, 76, 81, 86, 88, 89, 101) |
||
| (не показана 21 промежуточная версия 17 участников) | |||
| Строка 5: | Строка 5: | ||
| картинка малая = |
| картинка малая = |
||
| наименование = <nowiki>[(2R,3S,4R,5R)-5-(6-аминопурин-9-ил)-4-гидрокси-3-фосфонооксиоксолан-2-ил]метил-дифосфат-[(3R)-3-гидрокси-2,2-диметил-4-оксо-4-[[3-оксо-3-(2-сульфанилэтиламино)пропил]амино]бутокси]</nowiki> |
| наименование = <nowiki>[(2R,3S,4R,5R)-5-(6-аминопурин-9-ил)-4-гидрокси-3-фосфонооксиоксолан-2-ил]метил-дифосфат-[(3R)-3-гидрокси-2,2-диметил-4-оксо-4-[[3-оксо-3-(2-сульфанилэтиламино)пропил]амино]бутокси]</nowiki> |
||
| традиционные названия = |
| традиционные названия = кофермент{{nbsp}}A |
||
| сокращения = |
| сокращения = |
||
| хим. формула = C<sub>21</sub>H<sub>36</sub>N<sub>7</sub>O<sub>16</sub>P<sub>3</sub>S |
| хим. формула = C<sub>21</sub>H<sub>36</sub>N<sub>7</sub>O<sub>16</sub>P<sub>3</sub>S |
||
| Строка 16: | Строка 16: | ||
| состояние = |
| состояние = |
||
| динамическая вязкость = |
| динамическая вязкость = |
||
| кинематическая вязкость = |
| кинематическая вязкость = |
||
| темп. плавления = |
| темп. плавления = |
||
| Строка 33: | Строка 33: | ||
| интервал трансформации = |
| интервал трансформации = |
||
| температура размягчения = |
| температура размягчения = |
||
| давление пара = |
| давление пара = |
||
| конст. диссоц. кислоты = |
| конст. диссоц. кислоты = |
||
| Строка 46: | Строка 46: | ||
| вещество4 = |
| вещество4 = |
||
| вращение = |
| вращение = |
||
| изоэлектрическая точка = |
| изоэлектрическая точка = |
||
| диапазон прозрачности = |
| диапазон прозрачности = |
||
| показатель преломления = |
| показатель преломления = |
||
| угол Брюстера = |
| угол Брюстера = |
||
| гибридизация = |
| гибридизация = |
||
| координационная геометрия = |
| координационная геометрия = |
||
| кристаллическая структура = |
| кристаллическая структура = |
||
| дипольный момент = |
| дипольный момент = |
||
| CAS = 85-61-0 |
| CAS = 85-61-0 |
||
| Строка 61: | Строка 61: | ||
| SMILES = O=C(NCCS)CCNC(=O)C(O)C(C)(C)COP(=O)(O)OP(=O)(O)OC[C@H]3O[C@@H](n2cnc1c(ncnc12)N)[C@H](O)[C@@H]3OP(=O)(O)O |
| SMILES = O=C(NCCS)CCNC(=O)C(O)C(C)(C)COP(=O)(O)OP(=O)(O)OC[C@H]3O[C@@H](n2cnc1c(ncnc12)N)[C@H](O)[C@@H]3OP(=O)(O)O |
||
| ЕС = |
| ЕС = |
||
| RTECS = |
| RTECS = |
||
| ЛД50 = |
| ЛД50 = |
||
| Строка 67: | Строка 67: | ||
}} |
}} |
||
'''Кофермент |
'''Кофермент{{nbsp}}A''' ('''коэнзим{{nbsp}}A''', '''КоA''', '''СоА''', '''HSKoA''') — [[кофермент]] [[Ацилирование|ацетилирования]]; один из важнейших коферментов, принимающий участие в реакциях переноса [[ацил|ацильных групп]] при синтезе и [[Бета-окисление|окислении жирных кислот]] и окислении [[Пировиноградная кислота|пирувата]] в [[Цикл трикарбоновых кислот|цикле лимонной кислоты]].<ref name="Овчинников">''Овчинников Ю. А.'' Биоорганическая химия / Ю. А. Овчинников. — М.: Просвещение, 1987. — 815 с., ил.</ref> |
||
== Строение == |
== Строение == |
||
[[Молекула]] |
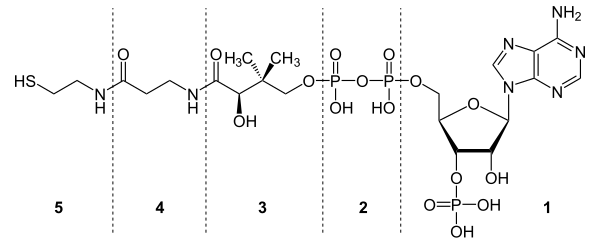
[[Молекула]] кофермента{{nbsp}}A состоит из [[остаток (биохимия)|остатка]] [[Аденозинмонофосфат|адениловой кислоты]] (1), связанной пирофосфатной группой (2) с остатком [[Пантоевая кислота|пантоевой кислоты]] (3), которая в свою очередь связана [[Амиды|амидной связью]] с [[Аминокислоты|аминокислотой]] β-[[аланин]]ом (4) (эти две группы представляют собой остаток [[пантотеновая кислота|пантотеновой кислоты]]), соединённой амидной связью с остатком [[β-меркаптоэтаноламин]]а (5). |
||
:[[Файл: |
: [[Файл:Coenzym A beschriftet.svg|600px]] |
||
== Биосинтез == |
== Биосинтез == |
||
Кофермент |
Кофермент{{nbsp}}A синтезируется в пять этапов из пантотеновой кислоты ([[Пантотеновая кислота|витамина{{nbsp}}B<sub>5</sub>]]) и [[цистеин]]а: |
||
# Пантотеновая кислота фосфорилируется в 4'-фосфопантотенат с помощью фермента пантотенаткиназы |
# Пантотеновая кислота [[Фосфорилирование|фосфорилируется]] в 4'-фосфопантотенат с помощью фермента пантотенаткиназы |
||
# Цистеин присоединяется к 4'-фосфопантотенату с помощью фермента фосфопантотеноилцистеинсинтетазы с образованием 4'-фосфо-N-пантотеноилцистеина |
# Цистеин присоединяется к 4'-фосфопантотенату с помощью фермента фосфопантотеноилцистеинсинтетазы с образованием 4'-фосфо-N-пантотеноилцистеина |
||
# 4'-фосфо-N-пантотеноилцистеин декарбоксилируется с образованием 4'-фосфопантотеина с помощью фермента фосфопантотеноилцистеиндекарбоксилазы |
# 4'-фосфо-N-пантотеноилцистеин [[Декарбоксилирование|декарбоксилируется]] с образованием 4'-фосфопантотеина с помощью фермента фосфопантотеноилцистеиндекарбоксилазы |
||
# 4'-фосфопантотеин с адениловой кислотой формирует дефосфо- |
# 4'-фосфопантотеин с адениловой кислотой формирует дефосфо-КоA под действием фермента фосфопантотеинаденилтрансферазы |
||
# Наконец, дефосфо- |
# Наконец, дефосфо-КоA фосфорилируется [[Аденозинтрифосфат|АТФ]] в кофермент{{nbsp}}A с помощью фермента дефосфокоэнзимкиназы. |
||
== Биохимическая роль == |
== Биохимическая роль == |
||
С КоА связан ряд биохимических реакций, лежащих в основе [[окисление|окисления]] и [[синтез]]а [[жирные кислоты|жирных кислот]], биосинтеза жиров, окислительных превращений продуктов распада углеводов. Во всех случаях |
С КоА связан ряд биохимических реакций, лежащих в основе [[окисление|окисления]] и [[синтез]]а [[жирные кислоты|жирных кислот]], биосинтеза жиров, окислительных превращений продуктов распада [[Углеводы|углеводов]]. Во всех случаях КоA действует в качестве промежуточного звена, связывающего и переносящего кислотные остатки на другие вещества. При этом кислотные остатки в составе соединения с КоA подвергаются тем или иным превращениям, либо передаются без изменений на определённые [[метаболиты]]. |
||
== История открытия == |
== История открытия == |
||
Впервые кофермент был выделен из печени голубя в |
Впервые кофермент был выделен из печени голубя в 1947 году [[Липман, Фриц Альберт|Ф.{{nbsp}}Липманом]]<ref name = "Nature">{{статья |заглавие=Structure of Coenzyme A |издание=[[Nature]] |том=171 |номер=4341 |страницы=76 |doi=10.1038/171076a0 |язык=en |автор=[[Бэддили, Джеймс|Baddiley]], J.; Thain, E. M.; Novelli, G. D.; Lipmann, F. |год=1953 |тип=journal}}</ref>. Структура кофермента{{nbsp}}A была определена в начале 1950-х годов [[Линен, Феодор|Ф.{{nbsp}}Линеном]] в Институте Листера в Лондоне. Полный синтез КоA осуществил в 1961 году [[Корана, Хар Гобинд|X.{{nbsp}}Корана]]. |
||
== Список ацил- |
== Список ацил-КоA == |
||
Из природных соединений выделены и идентифицированы различные ацильные производные кофермента |
Из природных соединений выделены и идентифицированы различные ацильные производные кофермента{{nbsp}}A: |
||
Ацил- |
Ацил-КоA из [[Карбоновые кислоты|карбоновых кислот]]: |
||
* [[Ацетил-CoA|Ацетил-КоА]] |
|||
* Пропионил-КоА |
|||
* Ацетоацетил-КоА |
|||
* Кумарол-КоА |
|||
* Бутирил-КоА |
|||
Ацил-КоА из дикарбоновых кислот: |
Ацил-КоА из [[Двухосновные карбоновые кислоты|дикарбоновых кислот]]: |
||
* [[Малонил-КоА]] |
|||
* [[Сукцинил-КоА]] |
|||
* Гидроксиметилглютарил-КоА |
|||
* Пименил-КоА |
|||
Ацил-КоА из карбоциклических кислот: |
Ацил-КоА из карбоциклических кислот: |
||
* Бензоил-КоА |
|||
* Фенилацетил-КоА |
|||
Существуют также разнообразные ацил-КоА [[Жирные кислоты| |
Существуют также разнообразные ацил-КоА [[Жирные кислоты|жирных кислот]], которые играют большую роль в качестве субстратов для реакций синтеза [[Липиды|липидов]]. |
||
== См. также == |
== См. также == |
||
* [[Витамин |
* [[Пантотеновая кислота|Витамин B{{sub|5}}]] |
||
== Примечания == |
== Примечания == |
||
| Строка 113: | Строка 113: | ||
== Литература == |
== Литература == |
||
* Филиппович, Ю. Б. Основы биохимии: Учеб. для хим. и биол. спец. пед. ун-тов и ин-тов / Ю. |
* ''Филиппович, Ю. Б.'' Основы [[Биохимия|биохимии]]: Учеб. для хим. и биол. спец. пед. ун-тов и ин-тов / Ю. Б. Филиппович. — 4-е изд., перераб. и доп. — М.: «Агар», 1999. — 512 с., ил. |
||
* Березов, Т. Т. Биологическая химия: Учебник / Т. |
* ''Березов, Т. Т.'' Биологическая химия: Учебник / Т. Т. Березов, Б. Ф. Коровкин. — 3-е изд., перераб. и доп. — М.: [[Медицина]], 1998. — 704 с., ил. |
||
* Овчинников, Ю. А. Биоорганическая химия / Ю. |
* ''[[Овчинников, Юрий Анатольевич|Овчинников, Ю. А.]]'' Биоорганическая [[химия]] / Ю. А. Овчинников. — М.: Просвещение, 1987. — 815 с., ил. |
||
* [[Племенков, Виталий Владимирович|Племенков, В. В.]] Введение в химию природных соединений / В. |
* ''[[Племенков, Виталий Владимирович|Племенков, В. В.]]'' Введение в химию природных соединений / В. В. Племенков. — Казань: КГУ, 2001. — 376 с. |
||
{{внешние ссылки}} |
|||
{{Кофакторы ферментов}} |
{{Кофакторы ферментов}} |
||
[[Категория:Коферменты]] |
[[Категория:Коферменты]] |
||
Текущая версия от 23:20, 13 сентября 2024
| Кофермент A | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
'"`UNIQ--nowiki-00000000-QINU`"' |
| Традиционные названия | кофермент A |
| Хим. формула | C21H36N7O16P3S |
| Физические свойства | |
| Молярная масса | 767,534 ± 0,031 г/моль |
| Классификация | |
| Рег. номер CAS | 85-61-0 |
| PubChem | 68163312 |
| Рег. номер EINECS | 201-619-0 |
| SMILES | |
| InChI |
|
| ChEBI | 15346 |
| ChemSpider | 79067 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Кофермент A (коэнзим A, КоA, СоА, HSKoA) — кофермент ацетилирования; один из важнейших коферментов, принимающий участие в реакциях переноса ацильных групп при синтезе и окислении жирных кислот и окислении пирувата в цикле лимонной кислоты.[1]
Строение
[править | править код]Молекула кофермента A состоит из остатка адениловой кислоты (1), связанной пирофосфатной группой (2) с остатком пантоевой кислоты (3), которая в свою очередь связана амидной связью с аминокислотой β-аланином (4) (эти две группы представляют собой остаток пантотеновой кислоты), соединённой амидной связью с остатком β-меркаптоэтаноламина (5).
Биосинтез
[править | править код]Кофермент A синтезируется в пять этапов из пантотеновой кислоты (витамина B5) и цистеина:
- Пантотеновая кислота фосфорилируется в 4'-фосфопантотенат с помощью фермента пантотенаткиназы
- Цистеин присоединяется к 4'-фосфопантотенату с помощью фермента фосфопантотеноилцистеинсинтетазы с образованием 4'-фосфо-N-пантотеноилцистеина
- 4'-фосфо-N-пантотеноилцистеин декарбоксилируется с образованием 4'-фосфопантотеина с помощью фермента фосфопантотеноилцистеиндекарбоксилазы
- 4'-фосфопантотеин с адениловой кислотой формирует дефосфо-КоA под действием фермента фосфопантотеинаденилтрансферазы
- Наконец, дефосфо-КоA фосфорилируется АТФ в кофермент A с помощью фермента дефосфокоэнзимкиназы.
Биохимическая роль
[править | править код]С КоА связан ряд биохимических реакций, лежащих в основе окисления и синтеза жирных кислот, биосинтеза жиров, окислительных превращений продуктов распада углеводов. Во всех случаях КоA действует в качестве промежуточного звена, связывающего и переносящего кислотные остатки на другие вещества. При этом кислотные остатки в составе соединения с КоA подвергаются тем или иным превращениям, либо передаются без изменений на определённые метаболиты.
История открытия
[править | править код]Впервые кофермент был выделен из печени голубя в 1947 году Ф. Липманом[2]. Структура кофермента A была определена в начале 1950-х годов Ф. Линеном в Институте Листера в Лондоне. Полный синтез КоA осуществил в 1961 году X. Корана.
Список ацил-КоA
[править | править код]Из природных соединений выделены и идентифицированы различные ацильные производные кофермента A:
Ацил-КоA из карбоновых кислот:
- Ацетил-КоА
- Пропионил-КоА
- Ацетоацетил-КоА
- Кумарол-КоА
- Бутирил-КоА
Ацил-КоА из дикарбоновых кислот:
- Малонил-КоА
- Сукцинил-КоА
- Гидроксиметилглютарил-КоА
- Пименил-КоА
Ацил-КоА из карбоциклических кислот:
- Бензоил-КоА
- Фенилацетил-КоА
Существуют также разнообразные ацил-КоА жирных кислот, которые играют большую роль в качестве субстратов для реакций синтеза липидов.
См. также
[править | править код]Примечания
[править | править код]Литература
[править | править код]- Филиппович, Ю. Б. Основы биохимии: Учеб. для хим. и биол. спец. пед. ун-тов и ин-тов / Ю. Б. Филиппович. — 4-е изд., перераб. и доп. — М.: «Агар», 1999. — 512 с., ил.
- Березов, Т. Т. Биологическая химия: Учебник / Т. Т. Березов, Б. Ф. Коровкин. — 3-е изд., перераб. и доп. — М.: Медицина, 1998. — 704 с., ил.
- Овчинников, Ю. А. Биоорганическая химия / Ю. А. Овчинников. — М.: Просвещение, 1987. — 815 с., ил.
- Племенков, В. В. Введение в химию природных соединений / В. В. Племенков. — Казань: КГУ, 2001. — 376 с.