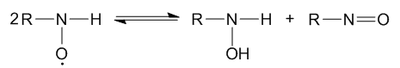Нитроксильные радикалы: различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
FlankerFF (обсуждение | вклад) |
|||
| (не показаны 32 промежуточные версии 13 участников) | |||
| Строка 1: | Строка 1: | ||
'''Нитроксильные радикалы''' — органические [[Свободные радикалы|радикалы]], содержащие нитроксильную группу N-O·. Впервые открыты в |
'''Нитроксильные радикалы''' — органические [[Свободные радикалы|радикалы]], содержащие нитроксильную группу N-O·. Впервые открыты в 1951 г.<ref>A. N. Holden, W. A. Yager and F. R. Merity, ''J. Chem. Phys.'', '''19''', 1319 (1951)</ref> Первый синтез соединения 2,2,6,6-тетраметил-4-пиперидон-1-оксил (4-оксо-TEMPO) был выполнен О.Л. Лебедевым в 1959 г.<ref>O. L. Lebedev, M. I. Khidekel and G. A. Razuvaev, ''Doklady Akademii Nauk SSSR'', '''140''', 1327-1329 (1961)</ref> |
||
== Классификация и номенклатура == |
== Классификация и номенклатура == |
||
| Строка 5: | Строка 5: | ||
Нитроксильные радикалы являются представителями различных рядов: [[пиперидин]]а, [[пирролин]]а, [[пирролидин]]а, [[пиперазин]]а, [[изоиндолин]]а, [[карболин]]а, [[азетидин]]а, [[имидазолин]]а и др. |
Нитроксильные радикалы являются представителями различных рядов: [[пиперидин]]а, [[пирролин]]а, [[пирролидин]]а, [[пиперазин]]а, [[изоиндолин]]а, [[карболин]]а, [[азетидин]]а, [[имидазолин]]а и др. |
||
Один из способов наименования радикалов исходит из названия исходного вещества, к которому добавляется окончание «оксил» с указанием места расположения этой группы (например, 2,2,6,6-тетраметилпиперидин-1-оксил). Согласно другому способу за основу принимается нитроксильная группа — к названию заместителей добавляется окончание «нитроксил», например, (C<sub>6</sub>H<sub>5</sub>)<sub>2</sub>NO· - дифенилнитроксил. |
Один из способов наименования радикалов исходит из названия исходного вещества, к которому добавляется окончание «оксил» с указанием места расположения этой группы (например, 2,2,6,6-тетраметилпиперидин-1-оксил (TEMPO), 3-карбамоил-2,2,5,5-тетраметилпирролидин-1-оксил (PCM), 3-карбокси-2,2,5,5-тетраметилпирролидин-1-оксил (PCA)). Согласно другому способу, за основу принимается нитроксильная группа — к названию заместителей добавляется окончание «нитроксил», например, (C<sub>6</sub>H<sub>5</sub>)<sub>2</sub>NO· - дифенилнитроксил. |
||
== Строение нитроксильной связи == |
== Строение нитроксильной связи == |
||
| Строка 13: | Строка 13: | ||
[[Файл:Nitroxyl bond.png|200px]] |
[[Файл:Nitroxyl bond.png|200px]] |
||
Неспаренный электрон находится на разрыхляющей π*-орбитали, образованной из 2p<sub>z</sub>-орбиталей |
Неспаренный электрон находится на разрыхляющей π*-орбитали, образованной из 2p<sub>z</sub>-орбиталей атомов азота и кислорода. Гибридизация связей атома азота близка к sp<sup>2</sup>. В ди-''трет''.алкилнитроксилах неспаренный электрон практически равномерно локализован на атомах N и O. При замене алкильного радикала на арильный спиновая плотность на атоме азота значительно уменьшается, а на атоме кислорода почти не меняется. |
||
== Стабильные нитроксильные радикалы == |
== Стабильные нитроксильные радикалы == |
||
Нитроксильные радикалы, которые характеризуются наличием стерических затруднений вблизи N-O группы (например, обусловленные третичными атомами углерода), отличаются высокой стабильностью и могут быть выделены в свободном состоянии: |
Нитроксильные радикалы, которые характеризуются наличием [[Стерические затруднения|стерических затруднений]] вблизи N-O группы (например, обусловленные третичными атомами углерода), отличаются высокой стабильностью и могут быть выделены в свободном состоянии: |
||
[[Файл:Nitroxyl samples.png]] |
[[Файл:Nitroxyl samples.png]] |
||
Стабильность этих веществ зависит от степени делокализации неспаренного электрона, а также от стерических затруднений в их молекулах. Некоторые |
Стабильность этих веществ зависит от степени делокализации неспаренного электрона, а также от стерических затруднений в их молекулах. Некоторые нитроксильные радикалы могут храниться годами без разложения. |
||
Стабильные нитроксильные радикалы являются полярными окрашенными веществами, твёрдые или жидкие. Газообразным является только ди-(трифторметил)нитроксил (CF<sub>3</sub>)<sub>2</sub>NO·. |
Стабильные нитроксильные радикалы являются полярными окрашенными веществами, твёрдые или жидкие. Газообразным является только ди-(трифторметил)нитроксил (CF<sub>3</sub>)<sub>2</sub>NO·. |
||
Как и все радикалы, нитроксильные радикалы имеют спектр [[Электронный парамагнитный резонанс|ЭПР]]. В их спектре наблюдается триплетное расщепление, которое обусловлено сверхтонким взаимодействием неспаренного электрона радикала с ядром атома азота <sup>14</sup>N. Константа сверхтонкого расщепления a<sub>N</sub> меняется от 0,65-1,1 для ацил(''трет''.бутил)нитроксила до 2,4-2,8 для алкоксиарилнитроксилов. g-Фактор нитроксильных радикалов находится в |
Как и все радикалы, нитроксильные радикалы имеют спектр [[Электронный парамагнитный резонанс|ЭПР]]. В их спектре наблюдается триплетное расщепление, которое обусловлено сверхтонким взаимодействием неспаренного электрона радикала с ядром атома азота <sup>14</sup>N. Константа сверхтонкого расщепления a<sub>N</sub> меняется от 0,65-1,1 для ацил(''трет''.бутил)нитроксила до 2,4-2,8 для алкоксиарилнитроксилов. g-Фактор нитроксильных радикалов находится в диапазоне 2,005-2,006. |
||
== Синтез нитроксильных радикалов == |
== Синтез нитроксильных радикалов == |
||
| Строка 32: | Строка 32: | ||
Окисление замещённых [[гидроксиламин]]ов приводит к образованию нитроксильных радикалов: |
Окисление замещённых [[гидроксиламин]]ов приводит к образованию нитроксильных радикалов: |
||
[[Файл:Nitroxyl synthesis1.png]] |
[[Файл:Nitroxyl synthesis1.png|250px]] |
||
Реакция протекает очень легко - даже при стоянии на воздухе. |
Реакция протекает очень легко - даже при стоянии на воздухе. |
||
=== Окисление аминов === |
=== Окисление аминов === |
||
Это наиболее распространённый способ синтеза, по которому был получен широкий ряд нитроксильных радикалов - производных циклических аминов. Наиболее удобными окислителями являются пероксид водорода в присутствии солей [[вольфрамовая кислота|вольфрамовой кислоты]] и надкислоты |
Это наиболее распространённый способ синтеза, по которому был получен широкий ряд нитроксильных радикалов - производных циклических аминов. Наиболее удобными окислителями являются пероксид водорода в присутствии солей [[вольфрамовая кислота|вольфрамовой кислоты]] и надкислоты: |
||
[[Файл:Nitroxyl synthesis3.png|300px]] |
|||
В качестве окислителей можно использовать также [[органические гидропероксиды]], [[озон]] |
|||
=== Восстановление нитрозосоединений === |
=== Восстановление нитрозосоединений === |
||
Взаимодействие нитросоединений с такими восстановителями, как гидроксиламины, [[тиолы]] может приводить к нитроксильным радикалам: |
Взаимодействие нитрозо- и нитросоединений с такими восстановителями, как гидроксиламины, [[тиолы]] может приводить к нитроксильным радикалам: |
||
| ⚫ | |||
| ⚫ | |||
== |
== Свойства == |
||
=== Диспропорционирование === |
|||
| ⚫ | Нитроксильные радикалы могут быть использованы в |
||
Диспропорционирование нитроксильных радикалов происходит в том случае, если на нитроксильной группе высокая спиновая плотность неспаренного электрона не делокализована на соседних группах. При этом образуются замещённый гидроксиламин и нитрозосоединение: |
|||
[[Файл:Nitroxyl dispropor.png|400px]] |
|||
== |
=== Окисление === |
||
Окисление нитроксильных радикалов протекает только сильными окислителями (Cl<sub>2</sub>, SbCl<sub>5</sub>, SnCl<sub>4</sub>). Продуктом реакции являются оксоаммониевые соли: |
|||
[[Файл:Nitroxyl reaction1.png|400px]] |
|||
=== Другие реакции === |
|||
Помимо реакций по N-O группе нитроксильные радикалы вступают в реакции по другим функциональным группам молекулы, не затрагивающие свободной валентности, что позволяет получать модифицированные нитроксильные радикалы. |
|||
== Применение == |
|||
| ⚫ | Нитроксильные радикалы могут быть использованы в [[метод спиновых меток|методе спиновых меток]] (например, они образуются в реакции 2-метил-2-нитрозопропана со свободным радикалом и имеют время жизни, достаточное для определения a<sub>N</sub> и g-фактора и идентификации как полученного нитроксильного, так и исходного свободного радикала): |
||
[[Файл:Nitroxyl spintrap.png|400px]] |
|||
== Литература == |
|||
* ''Меди — Полимерные''// Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1992. — Т. 3. — 639 с. |
|||
== Примечания == |
|||
* {{книга |автор = Розанцев Э.Г., Шолле В.Д. |часть = |заглавие = Органическая химия свободных радикалов |оригинал = |ссылка = |ответственный = |издание = |место = М.|издательство = Химия|год = 1979|том = |страницы = |страниц = 344|серия = |isbn = |тираж = 3200}} |
|||
* {{книга |автор = |часть = |заглавие = Нитроксильные радикалы: синтез, химия, приложения|оригинал = |ссылка = |ответственный = Розанцев Э.Г., Жданов Р.И.|издание = |место = М.|издательство = Наука|год = 1987|том = |страницы = |страниц = 271|серия = |isbn = |тираж = 800}} |
|||
== Ссылки == |
|||
<references /> |
|||
== См. также == |
|||
* [[Нитроксильные радикалы имидазолинового ряда]] |
|||
[[Категория:Азотсодержащие органические соединения]] |
|||
{{редактирую|1=[[special:contributions/FlankerFF|FlankerFF]]|2=2 октября 2009}} |
|||
Текущая версия от 10:53, 23 сентября 2024
Нитроксильные радикалы — органические радикалы, содержащие нитроксильную группу N-O·. Впервые открыты в 1951 г.[1] Первый синтез соединения 2,2,6,6-тетраметил-4-пиперидон-1-оксил (4-оксо-TEMPO) был выполнен О.Л. Лебедевым в 1959 г.[2]
Классификация и номенклатура
[править | править код]Нитроксильные радикалы являются представителями различных рядов: пиперидина, пирролина, пирролидина, пиперазина, изоиндолина, карболина, азетидина, имидазолина и др.
Один из способов наименования радикалов исходит из названия исходного вещества, к которому добавляется окончание «оксил» с указанием места расположения этой группы (например, 2,2,6,6-тетраметилпиперидин-1-оксил (TEMPO), 3-карбамоил-2,2,5,5-тетраметилпирролидин-1-оксил (PCM), 3-карбокси-2,2,5,5-тетраметилпирролидин-1-оксил (PCA)). Согласно другому способу, за основу принимается нитроксильная группа — к названию заместителей добавляется окончание «нитроксил», например, (C6H5)2NO· - дифенилнитроксил.
Строение нитроксильной связи
[править | править код]Нитроксильная группа содержит трёхэлектронную связь:
Неспаренный электрон находится на разрыхляющей π*-орбитали, образованной из 2pz-орбиталей атомов азота и кислорода. Гибридизация связей атома азота близка к sp2. В ди-трет.алкилнитроксилах неспаренный электрон практически равномерно локализован на атомах N и O. При замене алкильного радикала на арильный спиновая плотность на атоме азота значительно уменьшается, а на атоме кислорода почти не меняется.
Стабильные нитроксильные радикалы
[править | править код]Нитроксильные радикалы, которые характеризуются наличием стерических затруднений вблизи N-O группы (например, обусловленные третичными атомами углерода), отличаются высокой стабильностью и могут быть выделены в свободном состоянии:
Стабильность этих веществ зависит от степени делокализации неспаренного электрона, а также от стерических затруднений в их молекулах. Некоторые нитроксильные радикалы могут храниться годами без разложения.
Стабильные нитроксильные радикалы являются полярными окрашенными веществами, твёрдые или жидкие. Газообразным является только ди-(трифторметил)нитроксил (CF3)2NO·.
Как и все радикалы, нитроксильные радикалы имеют спектр ЭПР. В их спектре наблюдается триплетное расщепление, которое обусловлено сверхтонким взаимодействием неспаренного электрона радикала с ядром атома азота 14N. Константа сверхтонкого расщепления aN меняется от 0,65-1,1 для ацил(трет.бутил)нитроксила до 2,4-2,8 для алкоксиарилнитроксилов. g-Фактор нитроксильных радикалов находится в диапазоне 2,005-2,006.
Синтез нитроксильных радикалов
[править | править код]Окисление гидроксиламинов
[править | править код]Окисление замещённых гидроксиламинов приводит к образованию нитроксильных радикалов:
Реакция протекает очень легко - даже при стоянии на воздухе.
Окисление аминов
[править | править код]Это наиболее распространённый способ синтеза, по которому был получен широкий ряд нитроксильных радикалов - производных циклических аминов. Наиболее удобными окислителями являются пероксид водорода в присутствии солей вольфрамовой кислоты и надкислоты:
В качестве окислителей можно использовать также органические гидропероксиды, озон
Восстановление нитрозосоединений
[править | править код]Взаимодействие нитрозо- и нитросоединений с такими восстановителями, как гидроксиламины, тиолы может приводить к нитроксильным радикалам:
Свойства
[править | править код]Диспропорционирование
[править | править код]Диспропорционирование нитроксильных радикалов происходит в том случае, если на нитроксильной группе высокая спиновая плотность неспаренного электрона не делокализована на соседних группах. При этом образуются замещённый гидроксиламин и нитрозосоединение:
Окисление
[править | править код]Окисление нитроксильных радикалов протекает только сильными окислителями (Cl2, SbCl5, SnCl4). Продуктом реакции являются оксоаммониевые соли:
Другие реакции
[править | править код]Помимо реакций по N-O группе нитроксильные радикалы вступают в реакции по другим функциональным группам молекулы, не затрагивающие свободной валентности, что позволяет получать модифицированные нитроксильные радикалы.
Применение
[править | править код]Нитроксильные радикалы могут быть использованы в методе спиновых меток (например, они образуются в реакции 2-метил-2-нитрозопропана со свободным радикалом и имеют время жизни, достаточное для определения aN и g-фактора и идентификации как полученного нитроксильного, так и исходного свободного радикала):
Литература
[править | править код]- Меди — Полимерные// Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1992. — Т. 3. — 639 с.
- Розанцев Э.Г., Шолле В.Д. Органическая химия свободных радикалов. — М.: Химия, 1979. — 344 с. — 3200 экз.
- Нитроксильные радикалы: синтез, химия, приложения / Розанцев Э.Г., Жданов Р.И.. — М.: Наука, 1987. — 271 с. — 800 экз.
Ссылки
[править | править код]- ↑ A. N. Holden, W. A. Yager and F. R. Merity, J. Chem. Phys., 19, 1319 (1951)
- ↑ O. L. Lebedev, M. I. Khidekel and G. A. Razuvaev, Doklady Akademii Nauk SSSR, 140, 1327-1329 (1961)