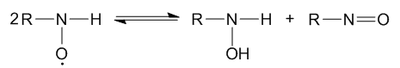Нитроксильные радикалы: различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
EmausBot (обсуждение | вклад) м Перемещение 1 интервики-ссылки в Викиданные (d:Q4321634) |
|||
| (не показано 8 промежуточных версий 7 участников) | |||
| Строка 13: | Строка 13: | ||
[[Файл:Nitroxyl bond.png|200px]] |
[[Файл:Nitroxyl bond.png|200px]] |
||
Неспаренный электрон находится на разрыхляющей π*-орбитали, образованной из 2p<sub>z</sub>-орбиталей атомов азота и кислорода. Гибридизация связей атома азота близка к sp<sup>2</sup>. В ди-''трет''.алкилнитроксилах неспаренный электрон практически равномерно локализован на атомах N и O. При замене алкильного радикала на арильный спиновая плотность на |
Неспаренный электрон находится на разрыхляющей π*-орбитали, образованной из 2p<sub>z</sub>-орбиталей атомов азота и кислорода. Гибридизация связей атома азота близка к sp<sup>2</sup>. В ди-''трет''.алкилнитроксилах неспаренный электрон практически равномерно локализован на атомах N и O. При замене алкильного радикала на арильный спиновая плотность на атоме азота значительно уменьшается, а на атоме кислорода почти не меняется. |
||
== Стабильные нитроксильные радикалы == |
== Стабильные нитроксильные радикалы == |
||
Нитроксильные радикалы, которые характеризуются наличием стерических затруднений вблизи N-O группы (например, обусловленные третичными атомами углерода), отличаются высокой стабильностью и могут быть выделены в свободном состоянии: |
Нитроксильные радикалы, которые характеризуются наличием [[Стерические затруднения|стерических затруднений]] вблизи N-O группы (например, обусловленные третичными атомами углерода), отличаются высокой стабильностью и могут быть выделены в свободном состоянии: |
||
[[Файл:Nitroxyl samples.png]] |
[[Файл:Nitroxyl samples.png]] |
||
| Строка 43: | Строка 43: | ||
[[Файл:Nitroxyl synthesis3.png|300px]] |
[[Файл:Nitroxyl synthesis3.png|300px]] |
||
В качестве окислителей можно использовать также [[гидропероксиды]], [[озон]] |
В качестве окислителей можно использовать также [[органические гидропероксиды]], [[озон]] |
||
=== Восстановление нитрозосоединений === |
=== Восстановление нитрозосоединений === |
||
Взаимодействие нитросоединений с такими восстановителями, как гидроксиламины, [[тиолы]] может приводить к нитроксильным радикалам: |
Взаимодействие нитрозо- и нитросоединений с такими восстановителями, как гидроксиламины, [[тиолы]] может приводить к нитроксильным радикалам: |
||
[[Файл:Nitroxyl synthesis2.png|500px]] |
[[Файл:Nitroxyl synthesis2.png|500px]] |
||
| Строка 70: | Строка 71: | ||
== Применение == |
== Применение == |
||
Нитроксильные радикалы могут быть использованы в |
Нитроксильные радикалы могут быть использованы в [[метод спиновых меток|методе спиновых меток]] (например, они образуются в реакции 2-метил-2-нитрозопропана со свободным радикалом и имеют время жизни, достаточное для определения a<sub>N</sub> и g-фактора и идентификации как полученного нитроксильного, так и исходного свободного радикала): |
||
[[Файл:Nitroxyl spintrap.png|400px]] |
[[Файл:Nitroxyl spintrap.png|400px]] |
||
| Строка 77: | Строка 78: | ||
* ''Меди — Полимерные''// Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1992. — Т. 3. — 639 с. |
* ''Меди — Полимерные''// Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1992. — Т. 3. — 639 с. |
||
* {{книга |автор = Розанцев Э.Г., Шолле В.Д. |часть = |заглавие = Органическая химия свободных радикалов |оригинал = |ссылка = |ответственный = |издание = |место = М.|издательство = Химия|год = 1979|том = |страницы = |страниц = 344|серия = |isbn = |тираж = |
* {{книга |автор = Розанцев Э.Г., Шолле В.Д. |часть = |заглавие = Органическая химия свободных радикалов |оригинал = |ссылка = |ответственный = |издание = |место = М.|издательство = Химия|год = 1979|том = |страницы = |страниц = 344|серия = |isbn = |тираж = 3200}} |
||
* {{книга |автор = |часть = |заглавие = Нитроксильные радикалы: синтез, химия, приложения|оригинал = |ссылка = |ответственный = Розанцев Э.Г., Жданов Р.И.|издание = |место = М.|издательство = Наука|год = 1987|том = |страницы = |страниц = 271|серия = |isbn = |тираж = 800}} |
* {{книга |автор = |часть = |заглавие = Нитроксильные радикалы: синтез, химия, приложения|оригинал = |ссылка = |ответственный = Розанцев Э.Г., Жданов Р.И.|издание = |место = М.|издательство = Наука|год = 1987|том = |страницы = |страниц = 271|серия = |isbn = |тираж = 800}} |
||
| Строка 87: | Строка 88: | ||
* [[Нитроксильные радикалы имидазолинового ряда]] |
* [[Нитроксильные радикалы имидазолинового ряда]] |
||
[[Категория: |
[[Категория:Азотсодержащие органические соединения]] |
||
[[Категория:Соединения азота]] |
|||
Текущая версия от 10:53, 23 сентября 2024
Нитроксильные радикалы — органические радикалы, содержащие нитроксильную группу N-O·. Впервые открыты в 1951 г.[1] Первый синтез соединения 2,2,6,6-тетраметил-4-пиперидон-1-оксил (4-оксо-TEMPO) был выполнен О.Л. Лебедевым в 1959 г.[2]
Классификация и номенклатура
[править | править код]Нитроксильные радикалы являются представителями различных рядов: пиперидина, пирролина, пирролидина, пиперазина, изоиндолина, карболина, азетидина, имидазолина и др.
Один из способов наименования радикалов исходит из названия исходного вещества, к которому добавляется окончание «оксил» с указанием места расположения этой группы (например, 2,2,6,6-тетраметилпиперидин-1-оксил (TEMPO), 3-карбамоил-2,2,5,5-тетраметилпирролидин-1-оксил (PCM), 3-карбокси-2,2,5,5-тетраметилпирролидин-1-оксил (PCA)). Согласно другому способу, за основу принимается нитроксильная группа — к названию заместителей добавляется окончание «нитроксил», например, (C6H5)2NO· - дифенилнитроксил.
Строение нитроксильной связи
[править | править код]Нитроксильная группа содержит трёхэлектронную связь:
Неспаренный электрон находится на разрыхляющей π*-орбитали, образованной из 2pz-орбиталей атомов азота и кислорода. Гибридизация связей атома азота близка к sp2. В ди-трет.алкилнитроксилах неспаренный электрон практически равномерно локализован на атомах N и O. При замене алкильного радикала на арильный спиновая плотность на атоме азота значительно уменьшается, а на атоме кислорода почти не меняется.
Стабильные нитроксильные радикалы
[править | править код]Нитроксильные радикалы, которые характеризуются наличием стерических затруднений вблизи N-O группы (например, обусловленные третичными атомами углерода), отличаются высокой стабильностью и могут быть выделены в свободном состоянии:
Стабильность этих веществ зависит от степени делокализации неспаренного электрона, а также от стерических затруднений в их молекулах. Некоторые нитроксильные радикалы могут храниться годами без разложения.
Стабильные нитроксильные радикалы являются полярными окрашенными веществами, твёрдые или жидкие. Газообразным является только ди-(трифторметил)нитроксил (CF3)2NO·.
Как и все радикалы, нитроксильные радикалы имеют спектр ЭПР. В их спектре наблюдается триплетное расщепление, которое обусловлено сверхтонким взаимодействием неспаренного электрона радикала с ядром атома азота 14N. Константа сверхтонкого расщепления aN меняется от 0,65-1,1 для ацил(трет.бутил)нитроксила до 2,4-2,8 для алкоксиарилнитроксилов. g-Фактор нитроксильных радикалов находится в диапазоне 2,005-2,006.
Синтез нитроксильных радикалов
[править | править код]Окисление гидроксиламинов
[править | править код]Окисление замещённых гидроксиламинов приводит к образованию нитроксильных радикалов:
Реакция протекает очень легко - даже при стоянии на воздухе.
Окисление аминов
[править | править код]Это наиболее распространённый способ синтеза, по которому был получен широкий ряд нитроксильных радикалов - производных циклических аминов. Наиболее удобными окислителями являются пероксид водорода в присутствии солей вольфрамовой кислоты и надкислоты:
В качестве окислителей можно использовать также органические гидропероксиды, озон
Восстановление нитрозосоединений
[править | править код]Взаимодействие нитрозо- и нитросоединений с такими восстановителями, как гидроксиламины, тиолы может приводить к нитроксильным радикалам:
Свойства
[править | править код]Диспропорционирование
[править | править код]Диспропорционирование нитроксильных радикалов происходит в том случае, если на нитроксильной группе высокая спиновая плотность неспаренного электрона не делокализована на соседних группах. При этом образуются замещённый гидроксиламин и нитрозосоединение:
Окисление
[править | править код]Окисление нитроксильных радикалов протекает только сильными окислителями (Cl2, SbCl5, SnCl4). Продуктом реакции являются оксоаммониевые соли:
Другие реакции
[править | править код]Помимо реакций по N-O группе нитроксильные радикалы вступают в реакции по другим функциональным группам молекулы, не затрагивающие свободной валентности, что позволяет получать модифицированные нитроксильные радикалы.
Применение
[править | править код]Нитроксильные радикалы могут быть использованы в методе спиновых меток (например, они образуются в реакции 2-метил-2-нитрозопропана со свободным радикалом и имеют время жизни, достаточное для определения aN и g-фактора и идентификации как полученного нитроксильного, так и исходного свободного радикала):
Литература
[править | править код]- Меди — Полимерные// Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1992. — Т. 3. — 639 с.
- Розанцев Э.Г., Шолле В.Д. Органическая химия свободных радикалов. — М.: Химия, 1979. — 344 с. — 3200 экз.
- Нитроксильные радикалы: синтез, химия, приложения / Розанцев Э.Г., Жданов Р.И.. — М.: Наука, 1987. — 271 с. — 800 экз.
Ссылки
[править | править код]- ↑ A. N. Holden, W. A. Yager and F. R. Merity, J. Chem. Phys., 19, 1319 (1951)
- ↑ O. L. Lebedev, M. I. Khidekel and G. A. Razuvaev, Doklady Akademii Nauk SSSR, 140, 1327-1329 (1961)