Диметилсульфат: различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
Djem92 (обсуждение | вклад) |
м правильное оформление ударений |
||
| (не показано 37 промежуточных версий 22 участников) | |||
| Строка 1: | Строка 1: | ||
{{Вещество |
{{Вещество |
||
| картинка = |
| картинка = Dimethyl_sulfate.svg |
||
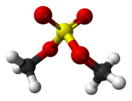
| картинка3D = Dimethyl-sulfate-from-xtal-3D-balls.png |
| картинка3D = Dimethyl-sulfate-from-xtal-3D-balls.png |
||
| картинка малая = |
| картинка малая = |
||
| наименование = |
| наименование = Диметилсульфат |
||
| сокращения = |
| сокращения = |
||
| традиционные названия = |
| традиционные названия = Диметилсульфат, диметиловый эфир серной кислоты |
||
| |
| рац. формула = <small><chem>(CH3)2SO4</chem></small> |
||
| молярная масса =126 |
| молярная масса =126,13 |
||
| темп. плавления =-32 |
| темп. плавления =-32 |
||
| темп. кипения =188 с разложением |
| темп. кипения =188 (с разложением) |
||
| темп. разложения = |
| темп. разложения = |
||
| темп. вспышки = 83 |
| темп. вспышки = 83 |
||
| тройная точка = |
| тройная точка = |
||
| критическая точка = |
| критическая точка = |
||
| плотность =1 |
| плотность =1,33 |
||
| состояние = жидкость |
| состояние = жидкость |
||
| динамическая вязкость =1,60 |
| динамическая вязкость =1,60 |
||
| Строка 32: | Строка 32: | ||
| RTECS = |
| RTECS = |
||
| ЕС = |
| ЕС = |
||
| ПДК = 0,1 мг/м3 |
|||
| ЛД50 = |
| ЛД50 = 140 мг/кг |
||
| токсичность = |
| токсичность = Класс опасности 2 |
||
| угол Брюстера = |
| угол Брюстера = |
||
| показатель преломления = 1,3874 |
| показатель преломления = 1,3874 |
||
}} |
}} |
||
'''Диметилсульфа́т''' — [[Химическое соединение|органическое химическое соединение]], [[сложный эфир]] [[метанол]]а и [[Серная кислота|серной кислоты]] с формулой <small><chem>(CH3)2SO4</chem></small>, принятая сокращённая формула <small><chem>Me2SO4</chem></small>. |
|||
'''Диметилсульфат''' — химическое соединение, органический сульфат с формулой (CH<sub>3</sub>)<sub>2</sub>SO<sub>4</sub>. Впервые получен в начале XIX века. Как и все алкилирующие реагенты диметилсульфат токсичен и канцерогенен. В то же время он широко применяется как [[метилирование|метилирующий]] агент в органическом синтезе. В некоторых случаях может быть заменён метиловым эфиром [[трифторметансульфоновая кислота|трифторметансульфоновой кислоты]] (CF<sub>3</sub>SO<sub>3</sub>CH<sub>3</sub>). |
|||
Впервые получен в начале XIX века. |
|||
Широко применяется как [[метилирование|метилирующий]] реагент в [[Органический синтез|органическом синтезе]]. В некоторых случаях может быть заменён метиловым [[Сложный эфир|эфир]]ом [[трифторметансульфоновая кислота|трифторметансульфоновой кислоты]] <small><chem>CF3SO3CH3</chem></small>, или [[иодметан]]ом. |
|||
Как и все [[Алкилирование|алкилирующие реагенты]], диметилсульфат в высоких концентрациях токсичен и проявляет [[Канцерогены|канцерогенные свойства]]. |
|||
== Получение == |
== Получение == |
||
Для получения диметилсульфата |
Для получения диметилсульфата используются различные методы. Простейший — [[этерификация]] серной кислоты с метанолом: |
||
: <chem>2 CH3OH + H2SO4 -> (CH3)2SO4 + 2 H2O</chem>. |
|||
:: 2 CH<sub>3</sub>OH + H<sub>2</sub>SO<sub>4</sub> → (CH<sub>3</sub>)<sub>2</sub>SO<sub>4</sub> + 2 H<sub>2</sub>O |
|||
Другой возможный способ включает в себя дистилляцию метилсерной кислоты в вакууме (перегонка 60 % олеум с метанолом): |
Другой возможный способ включает в себя дистилляцию метилсерной кислоты в вакууме (перегонка 60 % [[олеум]]а с метанолом): |
||
:: 2 CH<sub>3</sub>HSO<sub>4</sub> → H<sub>2</sub>SO<sub>4</sub> + (CH<sub>3</sub>)<sub>2</sub>SO<sub>4</sub> |
|||
: <chem>2 CH3HSO4 -> H2SO4 + (CH3)2SO4</chem>. |
|||
| ⚫ | |||
:: CH<sub>3</sub>ONO + (CH<sub>3</sub>)OSO<sub>2</sub>Cl → (CH<sub>3</sub>)<sub>2</sub>SO<sub>4</sub> + [[Нитрозил хлорид|NOCl]] |
|||
| ⚫ | |||
| ⚫ | |||
:: (CH<sub>3</sub>)<sub>2</sub>O + SO<sub>3</sub> → (CH<sub>3</sub>)<sub>2</sub>SO<sub>4</sub> |
|||
: <chem>CH3ONO + CH3OSO2Cl -> (CH3)2SO4 + NOCl</chem>. |
|||
| ⚫ | |||
:: 2CH<sub>3</sub>OH + HOSO<sub>2</sub>Cl → (CH<sub>3</sub>)<sub>2</sub>SO<sub>4</sub> + HCl↑ + H<sub>2</sub>O <ref>Препаративная органическая химия. М., Госхимиздат, 1959, стр. 399</ref> |
|||
| ⚫ | |||
: <chem>(CH3)2O + SO3 -> (CH3)2SO4</chem>. |
|||
| ⚫ | |||
: <chem>2 CH3OH + HOSO2Cl -> (CH3)2SO4 + HCl + H2O</chem>. |
|||
== Физические свойства == |
== Физические свойства == |
||
| ⚫ | |||
Может быть перегнан при 140—150 °C и давлении примерно 15 мм рт. ст. |
|||
| ⚫ | |||
== Химические свойства == |
== Химические свойства == |
||
Растворим в [[метанол]]е, [[этанол]]е, [[этиловый эфир|этиловом эфире]], [[дихлорметан]]е, [[ацетон]]е, [[хлороформ]]е, [[нитробензол]]е, также реакции иногда ведут в воде. |
Растворим в [[метанол]]е, [[этанол]]е, [[этиловый эфир|этиловом эфире]], [[дихлорметан]]е, [[ацетон]]е, [[хлороформ]]е, [[нитробензол]]е, также реакции иногда ведут в воде. |
||
Со взрывом реагирует с [[аммиак]]ом и [[ |
Со взрывом реагирует с [[аммиак]]ом и [[амины|аминами]]. Реакции растворов аминов дает соответственно вещества с большим содержанием метильных групп при азоте, третичные амины дают четвертичные соли. При этом первая метильная группа уходит значительно быстрее второй. Он также алкилирует [[фенол]]ы и [[тиолы]]. Считается, что реакции идут по S<sub>N</sub>2 механизму. |
||
При этом первая метильная группа уходит значительно быстрее второй. Он также алкилирует фенолы и тиолы. Считается, что реакции идут по S<sub>N</sub>2 механизму. |
|||
Несмотря на высокую эффективность диметилсульфата, из-за токсичности и высокой стоимости |
Несмотря на высокую эффективность диметилсульфата для алкилирования, из-за токсичности и высокой стоимости его часто заменяют. Так при О-алкилировании используют [[иодметан]]. [[Диметилкарбонат]] менее токсичен чем иные реагенты, поэтому может успешно быть заменить их при N-алкилировании. В целом токсичность алкилирующих агентов прямо [[корреляция|коррелирует]] с их способностью к алкилированию. |
||
== Применение == |
== Применение == |
||
Широко применяется в органическом синтезе для метилирования различных веществ: фенолов, аминов, некоторых [[гетероциклические соединения|гетероциклических соединений]] [[пурин]]ового ряда, таких как мочевая кислота и других. Так же применяется для получения [[нитрометан]]а: |
Широко применяется в органическом синтезе для метилирования различных веществ: фенолов, [[Амины|аминов]], некоторых [[гетероциклические соединения|гетероциклических соединений]] [[пурин]]ового ряда, таких как [[мочевая кислота]] и других. Так же применяется для получения [[нитрометан]]а: |
||
: <chem>2 NaNO2 + (CH3)2SO4 -> 2CH3NO2 + Na2SO4</chem>. |
|||
=== Метилирование по углероду === |
=== Метилирование по углероду === |
||
С-Н кислоты метилируются диметилсульфатом в [[протонный растворитель|апротонных растворителях]] |
С-Н кислоты метилируются диметилсульфатом в [[протонный растворитель|апротонных растворителях]]. |
||
=== Метилирование по кислороду === |
=== Метилирование по кислороду === |
||
Чаще всего диметилсульфат используется для метилирования фенолов. Некоторые простые спирты также могут быть |
Чаще всего диметилсульфат используется для метилирования фенолов. Некоторые простые спирты также могут быть метилированы, как, например, [[2-Метилпропанол-2|трет-бутанол]] в [[Трет-Бутилметиловый эфир|трет-бутилметиловый эфир]]. |
||
:: <math>\mathsf{2(CH_3)_3COH + (CH_3)_2SO_4 \rightarrow 2(CH_3)_3COCH_3 + H_2SO_4}</math> |
|||
: <chem>2(CH3)3COH + (CH3)2SO4 -> 2 (CH3)3COCH3 + H2SO4</chem>. |
|||
Алкоголяты легко метилируются |
[[Алкоголяты]] легко метилируются, например<ref name=dupont>{{Cite web |url=http://www.dupont.com/dms/overview.html |title=Dupont product information |accessdate=2009-05-02 |archiveurl=https://web.archive.org/web/20081119162010/http://www.dupont.com/dms/overview.html |archivedate=2008-11-19 |deadlink=yes }}</ref>: |
||
: <chem>RO- Na+ + (CH3)2SO4 -> ROCH3 + Na(CH3)SO4</chem>. |
|||
Метилирование сахаров диметилсульфатом называется |
Метилирование сахаров диметилсульфатом называется [[Метилирование по Хаворту|метилированием по Хаворту]]<ref>''Haworth W. N.'' J. Chem. Soc., 107, 13 ('''1915''').</ref><ref>Химическая энциклопедия Т1, М 1988 стр 64</ref>. |
||
=== Метилирование по азоту === |
=== Метилирование по азоту === |
||
Диметилсульфат используется как для получения [[четвертичные соли|четвертичных солей]] так и |
Диметилсульфат используется как для получения [[четвертичные соли|четвертичных солей]] так и [[Амины|третичных аминов]]. |
||
: <chem>C6H5CH=NC4H9 + (CH3)2SO4 -> C6H5CH=N^{+}(CH3)C4H9 + CH3OSO3^{-}</chem>. |
|||
Кватернизованные аммониевые соли жирных кислот используют как ПАВ так и в качестве смягчителя тканей |
Кватернизованные аммониевые соли [[Жирные кислоты|жирных кислот]] используют как [[Поверхностно-активное вещество|поверхностно-активных веществ]] (ПАВ) так и в качестве смягчителя тканей<ref name=dupont/>: |
||
:: CH<sub>3</sub>(C<sub>6</sub>H<sub>4</sub>)NH<sub>2</sub> + (CH<sub>3</sub>O)<sub>2</sub>SO<sub>2</sub> (in NaHCO<sub>3</sub> aq.) → CH<sub>3</sub>(C<sub>6</sub>H<sub>4</sub>)N(CH<sub>3</sub>)<sub>2</sub> + Na(CH<sub>3</sub>)SO<sub>4</sub> |
|||
: <chem>CH3(C6H4)NH2 + (CH3)2SO4 ->[\ce{NaHCO_3 + H_2O}] CH3(C6H4)N(CH3)2 + Na(CH3)SO4</chem>. |
|||
=== Метилирование по сере === |
=== Метилирование по сере === |
||
Так же как и метилирование спиртов, алкилируются |
Так же как и метилирование спиртов, алкилируются [[тиоляты]], но с большей скоростью<ref name=dupont/>: |
||
:: RS<sup>−</sup>Na<sup>+</sup> + (CH<sub>3</sub>O)<sub>2</sub>SO<sub>2</sub> → RSCH<sub>3</sub> + Na(CH<sub>3</sub>)SO<sub>4</sub> |
|||
: <chem>RS^-Na^+ + (CH3)2SO4 -> RSCH3 + Na(CH3)SO4</chem>, |
|||
| ⚫ | |||
:: p-CH<sub>3</sub>C<sub>6</sub>H<sub>4</sub>SO<sub>2</sub>Na + (CH<sub>3</sub>O)<sub>2</sub>SO<sub>2</sub> → p-CH<sub>3</sub>C<sub>6</sub>H<sub>4</sub>SO<sub>2</sub>CH<sub>3</sub> + Na(CH<sub>3</sub>)SO<sub>4</sub> |
|||
| ⚫ | |||
| ⚫ | |||
:: RC(O)SH + (CH<sub>3</sub>O)<sub>2</sub>SO<sub>2</sub> → RC(O)S(CH<sub>3</sub>) + HOSO<sub>3</sub>CH<sub>3</sub> |
|||
: <chem>p-CH3C6H4SO2Na + (CH3)2SO4 -> p-CH3C6H4SO2CH3 + Na(CH3)SO4</chem>. |
|||
| ⚫ | |||
: <chem>RC(O)SH + (CH3)2SO4 -> RC(O)S(CH3) + HOSO3CH3</chem>. |
|||
=== Другие применения === |
=== Другие применения === |
||
Диметилсульфат может вызвать специфические расщепление [[гуанин]]а в [[ДНК]] путём разрушения [[имидазол]]ьного |
Диметилсульфат может вызвать специфические расщепление [[гуанин]]а в [[ДНК]] путём разрушения [[имидазол]]ьного [[Гетероциклические соединения|гетероцикла]]<ref name=Streitwieser>''Streitwieser A., Heathcock C. H. and Kosower E. M.'' Introduction to Organic Chemistry. Prentice-Hall Inc. 1992. p. 1169</ref>. Этот процесс может быть использован для определения последовательности [[Азотистые основания|азотистых оснований]] в [[ДНК]] и других применениях. |
||
Диметилсульфат используется для картирования одноцепочечных фрагментов ДНК. Метод основан на различии скорости метилирования фрагментов [[цитозин]]а в составе одно- и двуцепочечных [[нуклеиновые кислоты|нуклеиновых кислот]]<ref name="Kirkegaard">{{статья|автор=K. |
Диметилсульфат используется для картирования одноцепочечных фрагментов ДНК. Метод основан на различии скорости метилирования фрагментов [[цитозин]]а в составе одно- и двуцепочечных [[нуклеиновые кислоты|нуклеиновых кислот]]<ref name="Kirkegaard">{{статья|автор=Kirkegaard K., Buc H., Spassky A., and Wang J. C.|заглавие=Mapping of single-stranded regions in duplex DNA at the sequence level: single-strand-specific cytosine methylation in RNA polymerase-promoter complexes|ссылка=http://www.pnas.org/content/80/9/2544.abstract|язык=en|издание=[[PNAS]]|год=1983|volume=80|issue=9|pages=2544-2548|pmid=6573669|archivedate=2015-09-24|archiveurl=https://web.archive.org/web/20150924164909/http://www.pnas.org/content/80/9/2544.abstract}}</ref>. |
||
== Токсикология и безопасность == |
== Токсикология и безопасность == |
||
Высокотоксичное вещество с кожно-резорбтивным воздействием, ЛД<sub>50</sub> |
Высокотоксичное вещество с кожно-[[Резорбтивное действие|резорбтивным]] воздействием, [[ЛД50|ЛД<sub>50</sub>]] {{nobr|140 мг/кг}} (мыши, перорально). |
||
Пары диметилсульфата оказывают сильное раздражающее и прижигающее воздействие на слизистые оболочки дыхательных путей и глаз (воспалительные явления, отёки, поражения дыхательных путей, [[ |
Пары диметилсульфата оказывают сильное раздражающее и прижигающее воздействие на слизистые оболочки дыхательных путей и глаз (воспалительные явления, отёки, поражения дыхательных путей, [[конъюнктивит]])<ref name="A">Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. Изд. 7-е, пер. и доп. В трех томах. Том III. Органические вещества. Под ред. засл. деят. науки проф. Н. В. Лазарева и докт. мед. наук Э. Н. Левиной. Л., «Химия», 1976. 592 стр., 27 табл., библиография 1850 названий.</ref>. |
||
Оказывает также общее токсическое действие, особенно на [[ЦНС]]. Жидкий диметилсульфат при попадании на кожу вызывает [[ожог]]и и долго незаживающие [[Язва|язвы]], в высоких концентрациях омертвение (некроз). Токсичность обусловлена продуктами гидролиза, которые включают [[метанол]] и [[Серная кислота|серную кислоту]]. |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | Особенно опасно поражение глаз (возможна потеря зрения). В |
||
| ⚫ | |||
== См. также == |
|||
* [[Метилирование]] |
|||
Является сильным [[канцероген]]ом, проявляет мутагенные эффекты. Канцерогенный и мутагенный эффекты обусловлены метилированием [[ДНК]]. |
|||
* [[Сульфонаты]] |
|||
* [[Алкилирование]] |
|||
== Примечания == |
== Примечания == |
||
| Строка 124: | Строка 141: | ||
== Литература == |
== Литература == |
||
* Сьютер Ч. |
* ''Сьютер Ч.'' Химия органических соединений серы. Пер. с англ., ч. 1, М., 1950, с. 61—74. |
||
== Ссылки == |
== Ссылки == |
||
* [ |
* [www.xumuk.ru/encyklopedia/1347.html www.xumuk.ru] |
||
{{спам-ссылки|1= |
|||
* www.xumuk.ru |
|||
}} |
|||
[[Категория:Сложные эфиры неорганических кислот]] |
[[Категория:Сложные эфиры неорганических кислот]] |
||
[[Категория:Метилирующие реагенты]] |
|||
[[Категория:Сераорганические соединения]] |
|||
[[Категория:Канцерогены]] |
|||
[[Категория:Мутагены]] |
|||
Текущая версия от 06:14, 26 сентября 2024
| Диметилсульфат | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Диметилсульфат | ||
| Традиционные названия | Диметилсульфат, диметиловый эфир серной кислоты | ||
| Хим. формула | C2H6O4S | ||
| Рац. формула | |||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 126,13 г/моль | ||
| Плотность | 1,33 г/см³ | ||
| Динамическая вязкость | 1,60 Па·с | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -32 °C | ||
| • кипения | 188 (с разложением) °C | ||
| • разложения | 370 ± 1 ℉[1] | ||
| • вспышки | 83 °C | ||
| Давление пара | 0,1 ± 0,1 мм рт.ст. | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | гидролизуется | ||
| Оптические свойства | |||
| Показатель преломления | 1,3874 | ||
| Структура | |||
| Дипольный момент | 10,92 Д | ||
| Классификация | |||
| Рег. номер CAS | 77-78-1 | ||
| PubChem | 6497 | ||
| Рег. номер EINECS | 201-058-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | WS8225000 | ||
| ChEBI | 59050 | ||
| ChemSpider | 6252 | ||
| Безопасность | |||
| Предельная концентрация | 0,1 мг/м3 | ||
| ЛД50 | 140 мг/кг | ||
| Токсичность | Класс опасности 2 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Диметилсульфа́т — органическое химическое соединение, сложный эфир метанола и серной кислоты с формулой , принятая сокращённая формула .
Впервые получен в начале XIX века.
Широко применяется как метилирующий реагент в органическом синтезе. В некоторых случаях может быть заменён метиловым эфиром трифторметансульфоновой кислоты , или иодметаном.
Как и все алкилирующие реагенты, диметилсульфат в высоких концентрациях токсичен и проявляет канцерогенные свойства.
Получение
[править | править код]Для получения диметилсульфата используются различные методы. Простейший — этерификация серной кислоты с метанолом:
- .
Другой возможный способ включает в себя дистилляцию метилсерной кислоты в вакууме (перегонка 60 % олеума с метанолом):
- .
Метилнитрит и метилхлорсульфонат также образуют диметисульфат:
- .
В США производится коммерчески с 20-х годов XX века в непрерывном процессе реакции диметилового эфира и триоксида серы:
- .
Ещё один способ получения диметилсульфата — реакция хлорсульфоновой кислоты с метанолом[2]:
- .
Физические свойства
[править | править код]Представляет собой бесцветную маслянистую жидкость, малорастворимую в воде. Чистый диметилсульфат не имеет запаха. Примеси могут придавать ему слабый запах чеснока.
Может быть перегнан при 140—150 °C и давлении примерно 15 мм рт. ст.
Химические свойства
[править | править код]Растворим в метаноле, этаноле, этиловом эфире, дихлорметане, ацетоне, хлороформе, нитробензоле, также реакции иногда ведут в воде. Со взрывом реагирует с аммиаком и аминами. Реакции растворов аминов дает соответственно вещества с большим содержанием метильных групп при азоте, третичные амины дают четвертичные соли. При этом первая метильная группа уходит значительно быстрее второй. Он также алкилирует фенолы и тиолы. Считается, что реакции идут по SN2 механизму.
Несмотря на высокую эффективность диметилсульфата для алкилирования, из-за токсичности и высокой стоимости его часто заменяют. Так при О-алкилировании используют иодметан. Диметилкарбонат менее токсичен чем иные реагенты, поэтому может успешно быть заменить их при N-алкилировании. В целом токсичность алкилирующих агентов прямо коррелирует с их способностью к алкилированию.
Применение
[править | править код]Широко применяется в органическом синтезе для метилирования различных веществ: фенолов, аминов, некоторых гетероциклических соединений пуринового ряда, таких как мочевая кислота и других. Так же применяется для получения нитрометана:
- .
Метилирование по углероду
[править | править код]С-Н кислоты метилируются диметилсульфатом в апротонных растворителях.
Метилирование по кислороду
[править | править код]Чаще всего диметилсульфат используется для метилирования фенолов. Некоторые простые спирты также могут быть метилированы, как, например, трет-бутанол в трет-бутилметиловый эфир.
- .
Алкоголяты легко метилируются, например[3]:
- .
Метилирование сахаров диметилсульфатом называется метилированием по Хаворту[4][5].
Метилирование по азоту
[править | править код]Диметилсульфат используется как для получения четвертичных солей так и третичных аминов.
- .
Кватернизованные аммониевые соли жирных кислот используют как поверхностно-активных веществ (ПАВ) так и в качестве смягчителя тканей[3]:
- .
Метилирование по сере
[править | править код]Так же как и метилирование спиртов, алкилируются тиоляты, но с большей скоростью[3]:
- ,
например[6]:
- .
Этот метод был использован для получения тиоэфиров:
- .
Другие применения
[править | править код]Диметилсульфат может вызвать специфические расщепление гуанина в ДНК путём разрушения имидазольного гетероцикла[7]. Этот процесс может быть использован для определения последовательности азотистых оснований в ДНК и других применениях.
Диметилсульфат используется для картирования одноцепочечных фрагментов ДНК. Метод основан на различии скорости метилирования фрагментов цитозина в составе одно- и двуцепочечных нуклеиновых кислот[8].
Токсикология и безопасность
[править | править код]Высокотоксичное вещество с кожно-резорбтивным воздействием, ЛД50 140 мг/кг (мыши, перорально).
Пары диметилсульфата оказывают сильное раздражающее и прижигающее воздействие на слизистые оболочки дыхательных путей и глаз (воспалительные явления, отёки, поражения дыхательных путей, конъюнктивит)[9].
Оказывает также общее токсическое действие, особенно на ЦНС. Жидкий диметилсульфат при попадании на кожу вызывает ожоги и долго незаживающие язвы, в высоких концентрациях омертвение (некроз). Токсичность обусловлена продуктами гидролиза, которые включают метанол и серную кислоту.
Скрытый период при лёгких отравлениях составляет до 15 часов, при отравлениях средней тяжести — до 5 часов, при тяжёлых — до 2—3 часов[9].
Особенно опасно поражение глаз (возможна потеря зрения). В тяжёлых случаях отравления наблюдается кома, паралич и смерть в течение 3—4 дней[9].
Является сильным канцерогеном, проявляет мутагенные эффекты. Канцерогенный и мутагенный эффекты обусловлены метилированием ДНК.
Примечания
[править | править код]- ↑ http://www.cdc.gov/niosh/npg/npgd0229.html
- ↑ Препаративная органическая химия. М., Госхимиздат, 1959, стр. 399
- ↑ 1 2 3 Dupont product information. Дата обращения: 2 мая 2009. Архивировано из оригинала 19 ноября 2008 года.
- ↑ Haworth W. N. J. Chem. Soc., 107, 13 (1915).
- ↑ Химическая энциклопедия Т1, М 1988 стр 64
- ↑ Fieser L. F. and Fieser M. Reagents for Organic Synthesis. John Wiley & Sons, Inc. 1967. p. 295
- ↑ Streitwieser A., Heathcock C. H. and Kosower E. M. Introduction to Organic Chemistry. Prentice-Hall Inc. 1992. p. 1169
- ↑ Kirkegaard K., Buc H., Spassky A., and Wang J. C. Mapping of single-stranded regions in duplex DNA at the sequence level: single-strand-specific cytosine methylation in RNA polymerase-promoter complexes (англ.) // PNAS. — 1983. — Vol. 80. — P. 2544-2548. — PMID 6573669. Архивировано 24 сентября 2015 года.
- ↑ 1 2 3 Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. Изд. 7-е, пер. и доп. В трех томах. Том III. Органические вещества. Под ред. засл. деят. науки проф. Н. В. Лазарева и докт. мед. наук Э. Н. Левиной. Л., «Химия», 1976. 592 стр., 27 табл., библиография 1850 названий.
Литература
[править | править код]- Сьютер Ч. Химия органических соединений серы. Пер. с англ., ч. 1, М., 1950, с. 61—74.
Ссылки
[править | править код]- [www.xumuk.ru/encyklopedia/1347.html www.xumuk.ru]
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |













![{\displaystyle {\ce {CH3(C6H4)NH2 + (CH3)2SO4 ->[{\ce {NaHCO_3 + H_2O}}] CH3(C6H4)N(CH3)2 + Na(CH3)SO4}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/0c5a32f0be6e4b8dbc0aff9a05380d5116817581)


