Фтор: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
→Токсикология: Токсикология:Был добавлен W к рейтингу фтор(NFPA) Метки: с мобильного устройства из мобильной версии |
43K1C7 (обсуждение | вклад) м откат правок 93.171.32.115 (обс.) к версии 43K1C7 Метка: откат |
||
| (не показано 35 промежуточных версий 25 участников) | |||
| Строка 12: | Строка 12: | ||
| радиус атома = 73 |
| радиус атома = 73 |
||
| энергия ионизации 1 = 1680,0 (17,41) |
| энергия ионизации 1 = 1680,0 (17,41) |
||
| группа = 17 (устар. |
| группа = 17 (устар. VIIA) |
||
| период = 2 |
| период = 2 |
||
| блок = <br>[[p-элементы|p-элемент]] |
| блок = <br>[[p-элементы|p-элемент]] |
||
| Строка 21: | Строка 21: | ||
| электродный потенциал = 2,87 В |
| электродный потенциал = 2,87 В |
||
| степени окисления = −1, 0 |
| степени окисления = −1, 0 |
||
| плотность = Газ: 1,696{{sup|0}} г/л<br>Жидкость.: 1,516{{sup|−188}} г/см |
| плотность = Газ: 1,696{{sup|0}} г/л<br>Жидкость.: 1,516{{sup|−188}} г/см³, <br>Твердая фаза: 1,7{{sup|−228}} г/см³<ref name="ХЭ">{{Химическая энциклопедия|автор= Раков Э. Г.|статья=Фтор|т=5|с=197—199}}</ref> или 1,810{{sup|−225}}<ref name=ivl19/> |
||
| теплоёмкость = 31,34<ref name="ХЭ"/> |
| теплоёмкость = 31,34<ref name="ХЭ"/> |
||
| теплопроводность = 0,028 |
| теплопроводность = 0,028 |
||
| Строка 28: | Строка 28: | ||
| температура кипения = 85,03 [[Кельвин|К]] (−188,12 °C)<ref name="ХЭ"/> |
| температура кипения = 85,03 [[Кельвин|К]] (−188,12 °C)<ref name="ХЭ"/> |
||
| теплота испарения = (F—F) 6,544 |
| теплота испарения = (F—F) 6,544 |
||
| критическая точка К=144,4 |
| критическая точка К = 144,4 |
||
| критическая точка МПа=5,215 |
| критическая точка МПа = 5,215 |
||
| молярный объём = 22,4{{e|3}} |
| молярный объём = 22,4{{e|3}} |
||
| структура решётки = Моноклинная ({{math|α}}-фтор);<br> Кубическая ({{math|β}}-фтор)<ref name=ivl19/> |
| структура решётки = Моноклинная ({{math|α}}-фтор);<br> Кубическая ({{math|β}}-фтор)<ref name=ivl19/> |
||
| параметры решётки = {{math|α}}-фтор: {{nobr|1={{math|β}} = 102,088(18)°}}; {{nobr|1={{math|''a''}} = 5,4780(12) Å}}; {{nobr|1={{math|''b''}} = 3,2701(7) Å}}; {{nobr|1={{math|''c''}} = 7,2651(17) Å}}<ref name=ivl19/>.<br>{{math|β}}-фтор: {{nobr|1={{math|''a''}} = 5,5314(15)}}<ref name=ivl19/> |
| параметры решётки = {{math|α}}-фтор: {{nobr|1={{math|β}} = 102,088(18)°}}; {{nobr|1={{math|''a''}} = 5,4780(12) Å}}; {{nobr|1={{math|''b''}} = 3,2701(7) Å}}; {{nobr|1={{math|''c''}} = 7,2651(17) Å}}<ref name=ivl19/>.<br>{{math|β}}-фтор: {{nobr|1={{math|''a''}} = 5,5314(15)}}<ref name=ivl19/> |
||
| отношение c/a = |
| отношение c/a = |
||
| температура Дебая = |
| температура Дебая = |
||
| регистрационный номер CAS = 7782-41-4 |
| регистрационный номер CAS = 7782-41-4 |
||
| давление нп 1 = 38 |
|||
| давление нп 10 = 44 |
|||
| давление нп 100 = 50 |
|||
| давление нп 1 k = 58 |
|||
| давление нп 10 k = 69 |
|||
| давление нп 100 k = 85 |
|||
| тройная точка К = 53.48 |
|||
| тройная точка кПа = 90 |
|||
}} |
}} |
||
{{Элемент периодической системы|align=center|fontsize=100%|number=9}} |
{{Элемент периодической системы|align=center|fontsize=100%|number=9}} |
||
''' |
'''Фтор''' ([[Химические знаки|химический символ]] — '''F''', {{lang-old-ru|флюор}}; от {{lang-la|Fluorum}}) — [[химический элемент]] [[Галогены|17-й группы]] (по [[Короткая форма периодической системы элементов|устаревшей классификации]] — главной подгруппы седьмой группы, VIIA) [[Второй период периодической системы|второго периода]] [[периодическая система химических элементов|периодической системы химических элементов]] [[Менделеев, Дмитрий Иванович|Д. И. Менделеева]], с [[атомный номер|атомным номером]] 9. |
||
Является самым химически активным [[неметалл]]ом и сильнейшим окислителем. Фтор относится к группе [[Галогены|галогенов]] и является самым лёгким элементом из этой группы. |
Является самым химически активным [[неметалл]]ом и сильнейшим окислителем. Фтор относится к группе [[Галогены|галогенов]] и является самым лёгким элементом из этой группы. |
||
Как [[простое вещество]] (при [[Нормальные условия|нормальных условиях]]) фтор — это двухатомный [[газ]] (формула — F<sub>2</sub>) бледно-жёлтого цвета с резким [[запах]]ом, напоминающим [[озон]] или [[хлор]]. При [[Криогеника|криогенных]] температурах представляет собой жёлтую жидкость |
Как [[простое вещество]] (при [[Нормальные условия|нормальных условиях]]) фтор — это двухатомный [[газ]] (формула — F<sub>2</sub>) бледно-жёлтого (в толстых слоях — зеленовато-жёлтого) цвета с резким [[запах]]ом, напоминающим [[озон]] или [[хлор]]. При [[Криогеника|криогенных]] температурах представляет собой жёлтую жидкость или бледно-жёлтые кристаллы. |
||
Чрезвычайно [[Токсичность|токсичен]]. Обладает исключительно высокой [[Коррозия|коррозионной]] активностью. |
Чрезвычайно [[Токсичность|токсичен]]. Обладает исключительно высокой [[Коррозия|коррозионной]] активностью. |
||
| Строка 48: | Строка 56: | ||
== История == |
== История == |
||
Первое соединение фтора — [[флюорит]] (плавиковый шпат) [[Кальций|Ca]]F<sub>2</sub> — описано в конце [[XV век]]а под названием «флюор». В [[1771 |
Первое соединение фтора — [[флюорит]] (плавиковый шпат) [[Кальций|Ca]]F<sub>2</sub> — описано в конце [[XV век]]а под названием «флюор». В [[1771 год]]у [[Шееле, Карл Вильгельм|Карл Шееле]] получил [[плавиковая кислота|плавиковую кислоту]]. При обработке минерала флюорита CaF<sub>2</sub> [[Серная кислота|серной кислотой]] он выделил [[Фтороводород|HF]] в виде водного раствора. Это событие рассматривается в истории [[Химия|химии]] как открытие фтора. Аналогию с [[хлор]]ом предложил в 1810 году [[Ампер, Андре-Мари|Андре Ампер]], его поддержал [[Дэви, Гемфри|Гемфри Дэви]]. Дэви изучил растворения стекла в плавиковой кислоте. |
||
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в [[1810 |
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в [[1810 год]]у, а выделен в свободном виде лишь 76 лет спустя [[Муассан, Анри|Анри Муассаном]] в [[1886 год]]у [[электролиз]]ом жидкого безводного [[Фтористый водород|фтористого водорода]], содержащего примесь [[Гидрофторид калия|кислого фторида калия KHF<sub>2</sub>]]. |
||
=== Происхождение названия === |
=== Происхождение названия === |
||
Название «фтор» (от {{lang-grc|φθόριος}} 'разрушительный'), предложенное [[Ампер, Андре-Мари|Андре Ампером]] в [[1816 |
Название «фтор» (от {{lang-grc|φθόριος}} — ''разрушительный''), предложенное [[Ампер, Андре-Мари|Андре Ампером]] в [[1816 год]]у<ref>[https://gallica.bnf.fr/ark:/12148/bpt6k6568584z/f30.image Annales de chimie et de physique | 1816 | Gallica<!-- Заголовок добавлен ботом -->]</ref>, употребляется в русском, греческом и некоторых других языках. Во многих же других странах приняты названия, производные от старинных названий минерала флюорита CaF<sub>2</sub>, которые в свою очередь происходят от его способности понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть ({{lang-la|fluere}} — течь): например, тот же Ампер в письме [[Дэви, Гемфри|Дэви]] от [[6 августа]] [[1812 год|1812]] предложил слово ''fluorine'', благодаря адресату письма прочно вошедшее в [[английский язык]]. |
||
== Распространение в природе == |
== Распространение в природе == |
||
| Строка 69: | Строка 77: | ||
|} |
|} |
||
В природе значительные скопления фтора содержатся, в основном, в минерале |
В природе значительные скопления фтора содержатся, в основном, в минерале [[флюорит]]е (CaF<sub>2</sub>), содержащем по массе {{nobr|51,3%}} Ca и {{nobr|48,7 %}} F. [[Кларковое число|Кларк]] в земной коре {{nobr|650 г/т.}} |
||
Из растений относительно богаты фтором [[чечевица]] и [[Лук (растение)|лук]]. |
Из растений относительно богаты фтором [[чечевица]] и [[Лук (растение)|лук]]. |
||
| Строка 78: | Строка 86: | ||
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и сильно ядовит. |
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и сильно ядовит. |
||
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 |
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C)<ref name="ХЭ"/>. Это связано с тем, что фтор не имеет [[D-орбиталь|d-подуровня]] и не способен образовывать {{нп5|Дельта-связь|полуторные связи|en|Delta bond}}, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)<ref>''Ахметов Н. С.'' Общая и неорганическая химия.</ref>. |
||
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета<ref name=jor64b/><ref name=mey68/>. |
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета<ref name=jor64b/><ref name=mey68/>. |
||
| Строка 88: | Строка 96: | ||
Атомы фтора в соединениях могут проявлять [[степень окисления]], равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым [[Электроотрицательность|электроотрицательным]] элементом. |
Атомы фтора в соединениях могут проявлять [[степень окисления]], равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым [[Электроотрицательность|электроотрицательным]] элементом. |
||
Квантовохимический терм атома фтора — <sup>2</sup>P<sub>3/2</sub>. |
Квантовохимический [[Спектральный терм|терм]] атома фтора — <sup>2</sup>P<sub>3/2</sub>. |
||
==== Строение молекулы ==== |
==== Строение молекулы ==== |
||
| Строка 98: | Строка 106: | ||
[[Файл:Alpha-fluorine-unit-cell-B-3D-balls.png|thumb|244x244px|Кристаллическая структура {{math|α}}-фтора (стабильная при атмосферном давлении)]] |
[[Файл:Alpha-fluorine-unit-cell-B-3D-balls.png|thumb|244x244px|Кристаллическая структура {{math|α}}-фтора (стабильная при атмосферном давлении)]] |
||
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении: |
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении: |
||
* {{math|α}}-фтор, непрозрачный, твёрдый и хрупкий<ref name=mey68/>, существует при температуре ниже 45,6 K, кристаллическая решётка {{Крист|синг=1|гр=''C'' 2/''c''|a=0,54780(12)|b=0,32701(7)|c=0,72651(17)|beta=102,088(18)|Z=4|d=1,98|рп=1}} с объёмом элементарной ячейки 0,12726(5) нм |
* {{math|α}}-фтор, непрозрачный, твёрдый и хрупкий<ref name=mey68/>, существует при температуре ниже 45,6 K, кристаллическая решётка {{Крист|синг=1|гр=''C'' 2/''c''|a=0,54780(12)|b=0,32701(7)|c=0,72651(17)|beta=102,088(18)|Z=4|d=1,98|рп=1}} с объёмом элементарной ячейки 0,12726(5) нм³ (при 10 К)<ref name=ХЭ/><ref name=ivl19>{{cite doi|10.1002/chem.201805298}}</ref><ref name=mey68>{{cite doi|10.1063/1.1670323}}</ref><ref>{{cite doi|10.1016/0022-4596(70)90074-5}}</ref>; |
||
* {{math|β}}-фтор, прозрачный, менее плотный и твёрдый<ref name=mey68/>, существует в интервале температур от {{nobr|45,6 К}} до точки плавления {{nobr|53,53 K}}, кристаллическая решётка {{Крист|синг=пк|гр=''Pm''{{overline|3}}''n''|a=0,65314(15)|Z=8|d=1,81|рп=1}} с объёмом элементарной ячейки {{nobr|0,27862(11) нм |
* {{math|β}}-фтор, прозрачный, менее плотный и твёрдый<ref name=mey68/>, существует в интервале температур от {{nobr|45,6 К}} до точки плавления {{nobr|53,53 K}}, кристаллическая решётка {{Крист|синг=пк|гр=''Pm''{{overline|3}}''n''|a=0,65314(15)|Z=8|d=1,81|рп=1}} с объёмом элементарной ячейки {{nobr|0,27862(11) нм³}} (при {{nobr|48 К}}), решётка изотипична {{math|γ}}-фазе [[кислород|O<sub>2</sub>]] и {{math|δ}}-фазе [[азот|N<sub>2</sub>]]<ref name=ХЭ/><ref name=ivl19/>. В раннем (но единственном проведённом до 2019 года) эксперименте по изучению структуры {{math|β}}-фтора рентгенографическая плотность кристалла была оценена как {{nobr|1,70(5) г/см³}}<ref name=jor64b>{{cite doi|10.1107/S0365110X6400202X}}</ref><ref name=jor64a>{{cite doi|10.1063/1.1725957}}</ref>, и эта плотность твёрдого фтора цитируется в большинстве справочников. Более точное современное измерение даёт {{nobr|1,8104(12) г/см³}}<ref name=ivl19/>. |
||
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза [[Ромбическая сингония|ромбической сингонии]] у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы {{math|α}}-фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет {{nobr|0,1404(12) |
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза [[Ромбическая сингония|ромбической сингонии]] у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы {{math|α}}-фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет {{nobr|0,1404(12) нм}}<ref name=ivl19/>. |
||
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву<ref name=mey68/>. |
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву<ref name=mey68/>. |
||
| Строка 112: | Строка 120: | ||
! Изотоп !! Относительная масса, [[Атомная единица массы|а. е. м.]] !! Период полураспада !! Тип распада !! Ядерный спин !! Ядерный магнитный момент |
! Изотоп !! Относительная масса, [[Атомная единица массы|а. е. м.]] !! Период полураспада !! Тип распада !! Ядерный спин !! Ядерный магнитный момент |
||
|- |
|- |
||
| <sup>17</sup>F || 17,0020952 || 64,5 c || [[Бета-распад|β<sup>+</sup>-распад]] в [[Кислород-17|<sup>17</sup>O]] |
| <sup>17</sup>F || 17,0020952 || 64,5 c || [[Бета-распад|β<sup>+</sup>-распад]] в [[Кислород-17|<sup>17</sup>O]]|| 5/2 || 4,722 |
||
|- |
|- |
||
| <sup>18</sup>F || 18,000938 || 1,83 часа || β<sup>+</sup>-распад в <sup>18</sup>O || 1 || |
| <sup>18</sup>F || 18,000938 || 1,83 часа || β<sup>+</sup>-распад в <sup>18</sup>O || 1 || |
||
| Строка 135: | Строка 143: | ||
Образует соединения со всеми химическими элементами, кроме [[гелий|гелия]] и [[неон]]а. Известно лишь два соединения с [[аргон]]ом, существующих только при температуре ниже температуры кипения водорода, и только одно из них содержит фтор — [[гидрофторид аргона|гидрофторид аргона HArF]]<ref>[http://www.sciencemag.org/cgi/content/full/sci;295/5563/2242 Science Magazine: Sign In | Science/AAAS]</ref>. |
Образует соединения со всеми химическими элементами, кроме [[гелий|гелия]] и [[неон]]а. Известно лишь два соединения с [[аргон]]ом, существующих только при температуре ниже температуры кипения водорода, и только одно из них содержит фтор — [[гидрофторид аргона|гидрофторид аргона HArF]]<ref>[http://www.sciencemag.org/cgi/content/full/sci;295/5563/2242 Science Magazine: Sign In | Science/AAAS]</ref>. |
||
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с [[водород]]ом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 {{Градус Цельсия}}), в магниевых сосудах для начала реакции нужен небольшой нагрев. |
К воздействию фтора при комнатной температуре устойчивы некоторые металлы (в компактном виде) за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Fe, Ni; однако эти же металлы в виде мелкого порошка бурно реагируют даже с жидким фтором<ref name=gre98>{{книга|автор=Greenwood N. N., Earnshaw A. |часть=|заглавие=Chemistry of the Elements|оригинал= |ссылка=|издание=2nd Ed. |ответственный=|место=|издательство=Butterworth Heinemann |год=1998 |том=|страницы=804—821 |страниц=1341 |isbn=978-0-7506-3365-9|тираж=|язык=en}}</ref>. Контакт фтора с [[водород]]ом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 {{Градус Цельсия}}), в магниевых сосудах для начала реакции нужен небольшой нагрев. |
||
Почти все простые вещества энергично реагируют со фтором; к исключениям относятся только [[гелий]], [[неон]], [[аргон]], [[азот]] и [[кислород]]<ref name=kar2000/>. Криптон взаимодействует со фтором в электрическом разряде<ref name=kar2000/>. При комнатной температуре фтор не реагирует с сухим [[Сульфат калия|сульфатом калия]], [[Углекислый газ|углекислым газом]] и [[Закись азота|закисью азота]]. Без примеси [[фтороводород]]а при комнатной температуре не действует на стекло. Не реагирует с [[тетрафторметан]]ом и другими [[перфторуглероды|насыщенными фторуглеродами]]. |
|||
В атмосфере фтора горят даже [[вода]], [[платина]] и [[ксенон]]<ref name=kar2000>{{книга|автор=Карапетьянц М. Х., Дракин С. И.|часть=|заглавие=Общая и неорганическая химия. Учебник для вузов|оригинал=|ссылка=https://books.google.com/books?id=axL7AgAAQBAJ&pg=PA458|издание=Изд. 4-е, стереотипное|ответственный=|место=М|издательство=Химия|год=2000|том=|страницы=458|страниц=|isbn=|тираж=|язык=ru|access-date=2024-07-01|archive-date=2024-07-01|archive-url=https://web.archive.org/web/20240701092354/https://books.google.com/books?id=axL7AgAAQBAJ&pg=PA458|url-status=live}}</ref>. |
|||
В атмосфере фтора горят даже [[вода]] и [[платина]]. |
|||
Фтор способен вытеснять другие галогены |
Фтор способен вытеснять другие галогены из их солей: |
||
: <chem>2NaBr + F2 -> 2NaF + Br2 ^</chem>, |
: <chem>2NaBr + F2 -> 2NaF + Br2 ^</chem>, |
||
| Строка 154: | Строка 162: | ||
: <chem>2F2 + 2H2O -> 4HF ^ + O2 ^</chem>, |
: <chem>2F2 + 2H2O -> 4HF ^ + O2 ^</chem>, |
||
: <chem>12F2 + 11H2O -> 19HF ^ + H2O2 + HOF ^ + O2 ^ + O3 ^ + OF2 ^ + O2F2 ^</chem> |
: <chem>12F2 + 11H2O -> 19HF ^ + H2O2 + HOF ^ + O2 ^ + O3 ^ + OF2 ^ + O2F2 ^</chem> |
||
Высокая энергия связи H-F позволяет осуществляться реакциям [[гидрид]]ов со фтором, где образуется фтороводород (кроме вышеупомянутой воды, со фтором реагируют [[Аммиак|NH<sub>3</sub>]], [[диборан|B<sub>2</sub>H<sub>6</sub>]], [[Моносилан|SiH<sub>4</sub>]], [[Гидрид алюминия|AlH<sub>3</sub>]] и т.д.)<ref name=kar2000/>. |
|||
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например: |
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например: |
||
| Строка 162: | Строка 172: | ||
Фтор также способен окислять в электрическом разряде [[кислород]], образуя [[Фторид кислорода(II)|дифторид кислорода]] OF<sub>2</sub> и [[диоксидифторид]] O<sub>2</sub>F<sub>2</sub>. Под давлением или при облучении ультрафиолетом реагирует с [[криптон]]ом и [[ксенон]]ом с образованием фторидов благородных газов. |
Фтор также способен окислять в электрическом разряде [[кислород]], образуя [[Фторид кислорода(II)|дифторид кислорода]] OF<sub>2</sub> и [[диоксидифторид]] O<sub>2</sub>F<sub>2</sub>. Под давлением или при облучении ультрафиолетом реагирует с [[криптон]]ом и [[ксенон]]ом с образованием фторидов благородных газов. |
||
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание [[эксимер]]ных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора<ref>Энциклопедический словарь юного химика. Для среднего и старшего возраста. Москва, Педагогика-Пресс. 1999 |
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание [[эксимер]]ных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора<ref>Энциклопедический словарь юного химика. Для среднего и старшего возраста. Москва, Педагогика-Пресс. 1999 год.</ref>. Элементы в соединениях со фтором часто проявляют высшие степени окисления<ref name=kar2000/>. |
||
== Получение == |
== Получение == |
||
| Строка 172: | Строка 182: | ||
=== Лабораторный метод === |
=== Лабораторный метод === |
||
* В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из [[Фторид кальция|фторида кальция]] со смазкой из [[Оксид свинца(II)|оксида свинца(II)]] и [[глицерин]]а. |
* В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из [[Фторид кальция|фторида кальция]] со смазкой из [[Оксид свинца(II)|оксида свинца(II)]] и [[глицерин]]а. |
||
* В 1986 |
* В 1986 году, во время подготовки к конференции по поводу празднования 100-летия первого получения свободного фтора, {{iw|Кристе. Карл|Карл Кристе|en|Karl O. Christe}} открыл<ref>{{cite doi|10.1021/ic00241a001}}</ref> способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K<sub>2</sub>MnF<sub>6</sub> и [[Фторид сурьмы(V)|SbF<sub>5</sub>]] при 150 °C<ref name=gre98/><ref>{{книга|автор=Гринвуд Н., Эрншо А.|часть=|заглавие=Химия элементов|ссылка=|издание=|ответственный=|место=М.|издательство=БИНОМ. Лаборатория знаний|год=2008|том=2|страницы=147—148, 169 — химический синтез фтора|страниц=|isbn=|тираж=}}</ref>: |
||
:: <chem>2K2MnF6 + 4SbF5 -> 4KSbF6 + 2MnF3 + F2 ^</chem> |
:: <chem>2K2MnF6 + 4SbF5 -> 4KSbF6 + 2MnF3 + F2 ^</chem> |
||
: Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора. |
: Он основан на вытеснении слабой [[Кислота Льюиса|кислоты Льюиса]] [MnF<sub>4</sub>] из её соли K<sub>2</sub>MnF<sub>6</sub> более сильной кислотой Льюиса SbF<sub>5</sub>. Образовавшийся [[тетрафторид марганца|тетрафторид марганца MnF<sub>4</sub>]] термодинамически неустойчив и спонтанно разлагается до [[трифторид марганца|MnF<sub>3</sub>]] с выделением элементарного фтора. Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора. |
||
* Также для лабораторного получения фтора можно использовать нагрев [[фторид кобальта(III)|фторида кобальта(III)]] до 300 |
* Также для лабораторного получения фтора можно использовать нагрев [[фторид кобальта(III)|фторида кобальта(III)]] до 300 °C, разложение фторидов серебра и некоторые другие способы. |
||
=== Промышленный метод === |
=== Промышленный метод === |
||
Промышленное производство фтора осуществляется [[электролиз]]ом расплава кислого фторида калия KF·2HF (часто с добавлениями [[Фторид лития|фторида лития]]), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 |
Промышленное производство фтора осуществляется [[электролиз]]ом расплава кислого фторида калия KF·2HF (часто с добавлениями [[Фторид лития|фторида лития]]), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным [[катод]]ом и угольным [[анод]]ом. |
||
== Хранение == |
== Хранение == |
||
| Строка 195: | Строка 205: | ||
* [[Гексафтороалюминат натрия|гексафтороалюмината натрия]] — электролита для получения [[Алюминий|алюминия]] путём [[электролиз]]а; |
* [[Гексафтороалюминат натрия|гексафтороалюмината натрия]] — электролита для получения [[Алюминий|алюминия]] путём [[электролиз]]а; |
||
* [[фториды|фторидов]] металлов (например, [[Вольфрам|W]] и [[Ванадий|V]]), которые обладают некоторыми полезными свойствами. |
* [[фториды|фторидов]] металлов (например, [[Вольфрам|W]] и [[Ванадий|V]]), которые обладают некоторыми полезными свойствами. |
||
* Фтористые соединения используются в электролитах литиевых аккумуляторов для создания диэлектрического слоя между катодом и анодом. |
|||
=== Ракетная техника === |
=== Ракетная техника === |
||
| Строка 219: | Строка 230: | ||
| опасность для здоровья = 4 |
| опасность для здоровья = 4 |
||
| огнеопасность = 0 |
| огнеопасность = 0 |
||
| реакционноспособность = 4 |
|||
| реакционоспособность = 4 |
|||
| прочее = W+OX}} |
| прочее = W+OX}} |
||
|} |
|} |
||
| Строка 225: | Строка 236: | ||
[[Файл:Hazard O.svg|80px|right]] |
[[Файл:Hazard O.svg|80px|right]] |
||
[[Файл:Hazard N.svg|80px|right]] |
[[Файл:Hazard N.svg|80px|right]] |
||
Фтор представляет собой чрезвычайно агрессивное химическое вещество. Сильно ядовит, является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у |
Фтор представляет собой чрезвычайно агрессивное химическое вещество. Сильно ядовит, является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у [[фтороводород]]а. Фтор — «судорожный яд», как и значительное число его соединений. Обладает кумулятивным действием. В организм проникает главным образом ингаляционным и пероральным путями. Характерные проявления интоксикации при ингаляционном воздействии сводятся к болезненности и жжению в области носа, глотки, за грудиной, кровотечению из носа, сухому кашлю. Возможен спазм гортани и бронхиальной мускулатуры. При осмотре обнаруживаются гиперемия, отёчность и некрозы слизистых оболочек носоглотки, изъязвления и даже прободения носовой перегородки. Слизистые дыхательных путей также некротизируются и покрываются жёлтыми корочками. |
||
При лёгких ингаляционных отравлениях фтором и его соединениями, как правило, ограничиваются развитием ринофаринголарингита и трахеобронхита на фоне общей слабости, утомляемости, лабильности пульса и АД. — отравление «маскируется» под «простуду», что затрудняет своевременную диагностику и лечение. |
При лёгких ингаляционных отравлениях фтором и его соединениями, как правило, ограничиваются развитием ринофаринголарингита и трахеобронхита на фоне общей слабости, утомляемости, лабильности пульса и АД. — отравление «маскируется» под «простуду», что затрудняет своевременную диагностику и лечение. |
||
| Строка 231: | Строка 242: | ||
При поражениях фтором и его соединениями средней тяжести диагностируются глубокие бронхиты, и, с задержкой, пневмонии; а также судороги и гепатиты. |
При поражениях фтором и его соединениями средней тяжести диагностируются глубокие бронхиты, и, с задержкой, пневмонии; а также судороги и гепатиты. |
||
В случае тяжёлых отравлений |
В случае тяжёлых отравлений развиваются поражение тканей и токсический отёк лёгких, коматозное состояние, судороги. |
||
Резорбтивное действие объясняется возможностью фтора вступать в свободно-радикальные реакции с тканями организма — осаждение кальция из сыворотки крови и тканевой жидкости в форме фторида, приводящие к глубоким нарушениям в обмене веществ, замедлению свёртываемости крови, нарушению кислотно-основного соотношения крови, нарушению нервно-мышечной проводимости, увеличению проницаемости сосудистых стенок. Кроме того, фтор нарушает функционирование ряда ферментных систем, взаимодействуя с магнием, марганцем, железом, цинком, входящих, как и кальция, в состав энзимов, являясь их активаторами или ингибиторами. Отравления фтором нарушает активность ферментов, использующих микроэлементы в качестве кофакторов, например снижается активность Энолазы (нарушение гликолиза и синтеза макроэргов), аденозинтрифосфатазы, глутаминсинтетазы. |
Резорбтивное действие объясняется возможностью фтора вступать в свободно-радикальные реакции с тканями организма — осаждение кальция из сыворотки крови и тканевой жидкости в форме фторида, приводящие к глубоким нарушениям в обмене веществ, замедлению свёртываемости крови, нарушению кислотно-основного соотношения крови, нарушению нервно-мышечной проводимости, увеличению проницаемости сосудистых стенок. Кроме того, фтор нарушает функционирование ряда ферментных систем, взаимодействуя с магнием, марганцем, железом, цинком, входящих, как и кальция, в состав энзимов, являясь их активаторами или ингибиторами. Отравления фтором нарушает активность ферментов, использующих микроэлементы в качестве кофакторов, например снижается активность Энолазы (нарушение гликолиза и синтеза макроэргов), аденозинтрифосфатазы, глутаминсинтетазы. |
||
Ожоги глаз и кожных покровов наблюдаются при непосредственном контакте с фтором. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0, |
Ожоги глаз и кожных покровов наблюдаются при непосредственном контакте с фтором. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15—0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены [[конъюнктивит]]ы или [[экзема век]]<ref>''Н. В. Лазарев, И. Д. Гадаскина.'' «Вредные вещества в промышленности». Том 3, страница 19.</ref>. |
||
Фтор депонируется в костях и медленно, в течение нескольких лет, выводится из организма почками и кишечником. |
Фтор депонируется в костях и медленно, в течение нескольких лет, выводится из организма почками и кишечником. |
||
Текущая версия от 20:27, 4 ноября 2024
| Фтор | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Кислород | Неон → | |||||||||||||||
| |||||||||||||||
| Внешний вид простого вещества | |||||||||||||||
 Жидкий фтор |
|||||||||||||||
| Свойства атома | |||||||||||||||
| Название, символ, номер | Фтор/Fluorum (F), 9 | ||||||||||||||
| Группа, период, блок |
17 (устар. VIIA), 2, p-элемент |
||||||||||||||
| Атомная масса (молярная масса) |
18,998403163(6)[1] а. е. м. (г/моль) | ||||||||||||||
| Электронная конфигурация |
[He] 2s22p5 1s22s22p5 |
||||||||||||||
| Радиус атома | 73 пм | ||||||||||||||
| Химические свойства | |||||||||||||||
| Ковалентный радиус | 72 пм | ||||||||||||||
| Радиус иона | (−1e)133 пм | ||||||||||||||
| Электроотрицательность | 3,98 (шкала Полинга) | ||||||||||||||
| Электродный потенциал | 2,87 В | ||||||||||||||
| Степени окисления | −1, 0 | ||||||||||||||
| Энергия ионизации (первый электрон) |
1680,0 (17,41) кДж/моль (эВ) | ||||||||||||||
| Термодинамические свойства простого вещества | |||||||||||||||
| Плотность (при н. у.) |
Газ: 1,6960 г/л Жидкость.: 1,516−188 г/см³, Твердая фаза: 1,7−228 г/см³[2] или 1,810−225[3] г/см³ |
||||||||||||||
| Температура плавления | 53,53 К (−219,70 °C)[2] | ||||||||||||||
| Температура кипения | 85,03 К (−188,12 °C)[2] | ||||||||||||||
| Тройная точка | 53,48 К (−219,67°C), 90 кПа | ||||||||||||||
| Критическая точка | 144,4 К, 5,215 МПа | ||||||||||||||
| Мол. теплота плавления | (F—F) 0,5104 кДж/моль | ||||||||||||||
| Мол. теплота испарения | (F—F) 6,544 кДж/моль | ||||||||||||||
| Молярная теплоёмкость | 31,34[2] Дж/(K·моль) | ||||||||||||||
| Молярный объём | 22,4⋅103 см³/моль | ||||||||||||||
|
|||||||||||||||
| Кристаллическая решётка простого вещества | |||||||||||||||
| Структура решётки |
Моноклинная (α-фтор); Кубическая (β-фтор)[3] |
||||||||||||||
| Параметры решётки |
α-фтор: β = 102,088(18)°; a = 5,4780(12) Å; b = 3,2701(7) Å; c = 7,2651(17) Å[3]. β-фтор: a = 5,5314(15)[3] |
||||||||||||||
| Прочие характеристики | |||||||||||||||
| Теплопроводность | (300 K) 0,028 Вт/(м·К) | ||||||||||||||
| Номер CAS | 7782-41-4 | ||||||||||||||
| 9 | Фтор
|
| 1s² 2s² 2p⁵ | |
Фтор (химический символ — F, устар. «флюор»; от лат. Fluorum) — химический элемент 17-й группы (по устаревшей классификации — главной подгруппы седьмой группы, VIIA) второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 9.
Является самым химически активным неметаллом и сильнейшим окислителем. Фтор относится к группе галогенов и является самым лёгким элементом из этой группы.
Как простое вещество (при нормальных условиях) фтор — это двухатомный газ (формула — F2) бледно-жёлтого (в толстых слоях — зеленовато-жёлтого) цвета с резким запахом, напоминающим озон или хлор. При криогенных температурах представляет собой жёлтую жидкость или бледно-жёлтые кристаллы.
Чрезвычайно токсичен. Обладает исключительно высокой коррозионной активностью.
История
[править | править код]Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 году Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
[править | править код]Название «фтор» (от др.-греч. φθόριος — разрушительный), предложенное Андре Ампером в 1816 году[4], употребляется в русском, греческом и некоторых других языках. Во многих же других странах приняты названия, производные от старинных названий минерала флюорита CaF2, которые в свою очередь происходят от его способности понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть (лат. fluere — течь): например, тот же Ампер в письме Дэви от 6 августа 1812 предложил слово fluorine, благодаря адресату письма прочно вошедшее в английский язык.
Распространение в природе
[править | править код]Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание, % |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека[5] | 0,01 |
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF2), содержащем по массе 51,3% Ca и 48,7 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Физические свойства
[править | править код]При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и сильно ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C)[2]. Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи[англ.], в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)[6].
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета[7][8].
Электронное строение
[править | править код]
Электронная конфигурация атома фтора: 1s22s22p5.
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2.
Строение молекулы
[править | править код]
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллы
[править | править код]
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
- α-фтор, непрозрачный, твёрдый и хрупкий[8], существует при температуре ниже 45,6 K, кристаллическая решётка моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 0,54780(12) нм, b = 0,32701(7) нм, c = 0,72651(17) нм, β = 102,088(18)°, Z = 4, d = 1,98 г/см3 с объёмом элементарной ячейки 0,12726(5) нм³ (при 10 К)[2][3][8][9];
- β-фтор, прозрачный, менее плотный и твёрдый[8], существует в интервале температур от 45,6 К до точки плавления 53,53 K, кристаллическая решётка кубической сингонии (примитивная решётка), пространственная группа Pm3n, параметры ячейки a = 0,65314(15) нм, Z = 8, d = 1,81 г/см3 с объёмом элементарной ячейки 0,27862(11) нм³ (при 48 К), решётка изотипична γ-фазе O2 и δ-фазе N2[2][3]. В раннем (но единственном проведённом до 2019 года) эксперименте по изучению структуры β-фтора рентгенографическая плотность кристалла была оценена как 1,70(5) г/см³[7][10], и эта плотность твёрдого фтора цитируется в большинстве справочников. Более точное современное измерение даёт 1,8104(12) г/см³[3].
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α-фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм[3].
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву[8].
Изотопный состав
[править | править код]Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31 и один ядерный изомер — 18mF. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
[править | править код]| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4,722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2,094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
[править | править код]Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Химические свойства
[править | править код]Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом.
Образует соединения со всеми химическими элементами, кроме гелия и неона. Известно лишь два соединения с аргоном, существующих только при температуре ниже температуры кипения водорода, и только одно из них содержит фтор — гидрофторид аргона HArF[11].
К воздействию фтора при комнатной температуре устойчивы некоторые металлы (в компактном виде) за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Fe, Ni; однако эти же металлы в виде мелкого порошка бурно реагируют даже с жидким фтором[12]. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
Почти все простые вещества энергично реагируют со фтором; к исключениям относятся только гелий, неон, аргон, азот и кислород[13]. Криптон взаимодействует со фтором в электрическом разряде[13]. При комнатной температуре фтор не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло. Не реагирует с тетрафторметаном и другими насыщенными фторуглеродами.
В атмосфере фтора горят даже вода, платина и ксенон[13].
Фтор способен вытеснять другие галогены из их солей:
- ,
- .
Реакция между щелочами и фтором:
- .
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
- ,
Высокая энергия связи H-F позволяет осуществляться реакциям гидридов со фтором, где образуется фтороводород (кроме вышеупомянутой воды, со фтором реагируют NH3, B2H6, SiH4, AlH3 и т.д.)[13].
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
- ,
- .
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора[14]. Элементы в соединениях со фтором часто проявляют высшие степени окисления[13].
Получение
[править | править код]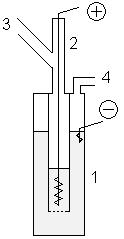
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод
[править | править код]- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия первого получения свободного фтора, Карл Кристе[англ.] открыл[15] способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C[12][16]:
- Он основан на вытеснении слабой кислоты Льюиса [MnF4] из её соли K2MnF6 более сильной кислотой Льюиса SbF5. Образовавшийся тетрафторид марганца MnF4 термодинамически неустойчив и спонтанно разлагается до MnF3 с выделением элементарного фтора. Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
- Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленный метод
[править | править код]Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хранение
[править | править код]Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно, потому что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции со фтором[17]).
Применение
[править | править код]Фтор используется для получения:
- фреонов — широко распространённых хладагентов;
- фторопластов — химически инертных и негорючих полимеров;
- фторкаучуков — химически инертных и негорючих эластомеров;
- элегаза SF6 — газообразного изолятора, применяемого в высоковольтной электротехнике;
- гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;
- гексафтороалюмината натрия — электролита для получения алюминия путём электролиза;
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами.
- Фтористые соединения используются в электролитах литиевых аккумуляторов для создания диэлектрического слоя между катодом и анодом.
Ракетная техника
[править | править код]Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих видов ракетного топлива. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
[править | править код]Фторированные углеводороды (например перфтордекалин) применяются в медицине как кровезаменители. Существует множество медицинских препаратов, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.). Фториды натрия, калия и др. в строго дозированных микроколичествах применяются для профилактики кариеса (см. ниже).
Биологическая и физиологическая роль
[править | править код]Фтор является жизненно необходимым для организма элементом[18][19]. Основным источником поступления фтора в организм человека является питьевая вода[20]. В организме человека преобладающая концентрация фтора содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г[2]. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг[2]. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес, пародонтоз, флюороз (крапчатость эмали) и остеосаркома. Также избыточное потребление фтора может приводить к поражениям костной системы[21][22].
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова), употреблять фторированную воду (до концентрации 1 мг/л) или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %[23].
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Токсикология
[править | править код]


Фтор представляет собой чрезвычайно агрессивное химическое вещество. Сильно ядовит, является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Фтор — «судорожный яд», как и значительное число его соединений. Обладает кумулятивным действием. В организм проникает главным образом ингаляционным и пероральным путями. Характерные проявления интоксикации при ингаляционном воздействии сводятся к болезненности и жжению в области носа, глотки, за грудиной, кровотечению из носа, сухому кашлю. Возможен спазм гортани и бронхиальной мускулатуры. При осмотре обнаруживаются гиперемия, отёчность и некрозы слизистых оболочек носоглотки, изъязвления и даже прободения носовой перегородки. Слизистые дыхательных путей также некротизируются и покрываются жёлтыми корочками.
При лёгких ингаляционных отравлениях фтором и его соединениями, как правило, ограничиваются развитием ринофаринголарингита и трахеобронхита на фоне общей слабости, утомляемости, лабильности пульса и АД. — отравление «маскируется» под «простуду», что затрудняет своевременную диагностику и лечение.
При поражениях фтором и его соединениями средней тяжести диагностируются глубокие бронхиты, и, с задержкой, пневмонии; а также судороги и гепатиты.
В случае тяжёлых отравлений развиваются поражение тканей и токсический отёк лёгких, коматозное состояние, судороги.
Резорбтивное действие объясняется возможностью фтора вступать в свободно-радикальные реакции с тканями организма — осаждение кальция из сыворотки крови и тканевой жидкости в форме фторида, приводящие к глубоким нарушениям в обмене веществ, замедлению свёртываемости крови, нарушению кислотно-основного соотношения крови, нарушению нервно-мышечной проводимости, увеличению проницаемости сосудистых стенок. Кроме того, фтор нарушает функционирование ряда ферментных систем, взаимодействуя с магнием, марганцем, железом, цинком, входящих, как и кальция, в состав энзимов, являясь их активаторами или ингибиторами. Отравления фтором нарушает активность ферментов, использующих микроэлементы в качестве кофакторов, например снижается активность Энолазы (нарушение гликолиза и синтеза макроэргов), аденозинтрифосфатазы, глутаминсинтетазы.
Ожоги глаз и кожных покровов наблюдаются при непосредственном контакте с фтором. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15—0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век[24].
Фтор депонируется в костях и медленно, в течение нескольких лет, выводится из организма почками и кишечником.
См. также
[править | править код]Литература
[править | править код]- Рысс И. Г. Химия фтора и его неорганических соединений. М. Госхимиздат, 1966 г. — 718 с.
- Некрасов Б. В. Основы общей химии. (издание третье, том 1) М. Химия, 1973 г. — 656 с.
- Военная Токсикология, Радиология и Медицинская Защита. Учебник. ВМА им. С. М. Кирова. Ленинград, 1987 г. — 356с.
Примечания
[править | править код]- ↑ Meija J. et al. Atomic weights of the elements 2013 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2016. — Vol. 88, no. 3. — P. 265–291. — doi:10.1515/pac-2015-0305. Архивировано 31 марта 2016 года.
- ↑ 1 2 3 4 5 6 7 8 9 Раков Э. Г. Фтор // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 197—199. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- ↑ 1 2 3 4 5 6 7 8 Ivlev S. I. et al. The Crystal Structures of α‐ and β‐F2 Revisited (англ.) // Chemistry – A European Journal. — 2019. — Vol. 25. — Iss. 13. — P. 3310—3317. — doi:10.1002/chem.201805298.
- ↑ Annales de chimie et de physique | 1816 | Gallica
- ↑ Главным образом в эмали зубов.
- ↑ Ахметов Н. С. Общая и неорганическая химия.
- ↑ 1 2 Jordan T. H., Streib W. D., Smith H. W., Lipscomb W. N. Single-crystal studies of β-F2 and of γ-O2 (англ.) // Acta Crystallographica. — 1964. — Vol. 17, no. 6. — P. 777—778. — ISSN 0365-110X. — doi:10.1107/S0365110X6400202X.
- ↑ 1 2 3 4 5 Meyer L., Barrett C. S., Greer S. C. Crystal Structure of α‐Fluorine (англ.) // The Journal of Chemical Physics. — 1968. — Vol. 49, no. 4. — P. 1902—1907. — ISSN 0021-9606. — doi:10.1063/1.1670323.
- ↑ Pauling L., Keaveny I., Robinson A. B. The crystal structure of α-fluorine (англ.) // Journal of Solid State Chemistry. — 1970. — Vol. 2, no. 2. — P. 225—227. — ISSN 0022-4596. — doi:10.1016/0022-4596(70)90074-5.
- ↑ Jordan T. H., Streib W. E., Lipscomb W. N. Single‐Crystal X‐Ray Diffraction Study of β‐Fluorine (англ.) // The Journal of Chemical Physics. — 1964. — Vol. 41, no. 3. — P. 760—764. — ISSN 0021-9606. — doi:10.1063/1.1725957.
- ↑ Science Magazine: Sign In | Science/AAAS
- ↑ 1 2 Greenwood N. N., Earnshaw A. Chemistry of the Elements (англ.). — 2nd Ed.. — Butterworth Heinemann, 1998. — P. 804—821. — 1341 p. — ISBN 978-0-7506-3365-9.
- ↑ 1 2 3 4 5 Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. Учебник для вузов. — Изд. 4-е, стереотипное. — М.: Химия, 2000. — С. 458. Архивировано 1 июля 2024 года.
- ↑ Энциклопедический словарь юного химика. Для среднего и старшего возраста. Москва, Педагогика-Пресс. 1999 год.
- ↑ Christe K. O. Chemical synthesis of elemental fluorine (англ.) // Inorganic Chemistry. — 1986. — Vol. 25, no. 21. — P. 3721—3722. — ISSN 0020-1669. — doi:10.1021/ic00241a001.
- ↑ Гринвуд Н., Эрншо А. Химия элементов. — М.: БИНОМ. Лаборатория знаний, 2008. — Т. 2. — С. 147—148, 169 — химический синтез фтора.
- ↑ Фтор в Популярной библиотеке химических элементов. Дата обращения: 25 марта 2007. Архивировано 30 сентября 2007 года.
- ↑ Янин Е.П. Биогеохимическая роль и эколого-гигиеническое значение фтора. — Журнал «Проблемы окружающей среды и природных ресурсов» Всероссийского института научной и технической информации РАН (Москва), номер 4, С. 20-108, 2009.
- ↑ Wada Osamu. What are Trace Elements? Their deficiency and excess states. med.or.jp. JMAJ, Vol. 47, No. 8 (2004). Дата обращения: 28 марта 2021. Архивировано 29 марта 2017 года.
- ↑ Канатникова Н.В., Захарченко Г.Л. Физиологическая роль фтора и его содержание в питьевой воде Орловской области. cyberleninka.ru. Журанал «Здоровье населения и среда обитания», номер 5(206), С. 40-43 (2010). Дата обращения: 28 марта 2021.
- ↑ По данным National Toxicology Program
- ↑ Синицына О.О., Плитман С.И., Амплеева Г.П., Гильденскиольд О.А., Ряшенцева Т.М. Эссенциальные элементы и их нормирование в питьевой воде. cyberleninka.ru. Журнал Анализ риска здоровью, номер 3, С. 30-36 (2020). Дата обращения: 28 марта 2021.
- ↑ Справочник потребителя. Дата обращения: 29 апреля 2020. Архивировано 26 февраля 2021 года.
- ↑ Н. В. Лазарев, И. Д. Гадаскина. «Вредные вещества в промышленности». Том 3, страница 19.
Ссылки
[править | править код]- Информация о Перфторане
- Кровезаменитель Перфторан // Вестник РАН, 1997, том 67, N 11, с. 998—1013.