Винилхлорид: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
Secalinum (обсуждение | вклад) |
РобоСтася (обсуждение | вклад) м косметические изменения |
||
| (не показано 37 промежуточных версий 16 участников) | |||
| Строка 50: | Строка 50: | ||
| диапазон прозрачности = |
| диапазон прозрачности = |
||
| показатель преломления = 1,3700 (при 20 °C)<ref name="sch2">{{cite web | |
| показатель преломления = 1,3700 (при 20 °C)<ref name="sch2">{{cite web |date=2009-03-31 |url=http://chemanalytica.com/book/novyy_spravochnik_khimika_i_tekhnologa/01_osnovnye_svoystva_neorganicheskikh_organicheskikh_i_elementoorganicheskikh_soedineniy/5500 |title=Таблица органических соединений |work=Новый справочник химика и технолога. Основные свойства неорганических, органических и элементоорганических соединений |publisher=ChemAnalitica.com |accessdate=2009-10-27 |archive-date=2015-06-06 |archive-url=https://web.archive.org/web/20150606220325/http://chemanalytica.com/book/novyy_spravochnik_khimika_i_tekhnologa/01_osnovnye_svoystva_neorganicheskikh_organicheskikh_i_elementoorganicheskikh_soedineniy/5500 |deadlink=no }}</ref> |
||
| угол Брюстера = |
| угол Брюстера = |
||
| Строка 56: | Строка 56: | ||
| координационная геометрия = |
| координационная геометрия = |
||
| кристаллическая структура = |
| кристаллическая структура = |
||
| дипольный момент = 1,44<ref name="d">{{cite web | |
| дипольный момент = 1,44<ref name="d">{{cite web |date=2009-04-01 |url=http://chemanalytica.com/book/novyy_spravochnik_khimika_i_tekhnologa/12_obshchie_svedeniya/6106 |title=Дипольные моменты некоторых веществ |work=Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность |publisher=ChemAnalitica.com |accessdate=2009-09-21 |archive-date=2011-07-08 |archive-url=https://web.archive.org/web/20110708141707/http://chemanalytica.com/book/novyy_spravochnik_khimika_i_tekhnologa/12_obshchie_svedeniya/6106 |deadlink=no }}</ref> |
||
| CAS = 75-01-4 |
| CAS = 75-01-4 |
||
| Строка 103: | Строка 103: | ||
: <chem>C2H2 + HCl -> CH2=CH-Cl</chem> |
: <chem>C2H2 + HCl -> CH2=CH-Cl</chem> |
||
Компания |
Компания Greisheim Electron, где работал учёный, [[Патент|запатентовала]] в Германии этот метод и материал, получавшийся в результате полимеризации, однако не смогла найти ему практическое применение. Только в [[1933 год]]у после исследований американского учёного {{не переведено 2|Симон, Уолдо|Уолдо Симона|en|Waldo Semon}} ([[1926 год]]) компанией B.F. Goodrich был получен патент<ref>{{cite web |
||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = 1933-10-10 |
||
|url = http://www.freepatentsonline.com/1929453.pdf |
|url = http://www.freepatentsonline.com/1929453.pdf |
||
|title = Unated States Patens 1929453. Synthetic rubber-like composition and method of making same |
|title = Unated States Patens 1929453. Synthetic rubber-like composition and method of making same |
||
| Строка 221: | Строка 221: | ||
== Физические свойства == |
== Физические свойства == |
||
Винилхлорид при [[Нормальные условия|нормальных условиях]] представляет собой бесцветный газ со слабым сладковатым запахом, напоминающим запах [[хлороформ]]а<ref name="bse" />. Порог ощущения запаха в воздухе составляет приблизительно 3000 частей на миллион<ref name="mmg">{{cite web| author =| authorlink =| |
Винилхлорид при [[Нормальные условия|нормальных условиях]] представляет собой бесцветный газ со слабым сладковатым запахом, напоминающим запах [[хлороформ]]а<ref name="bse" />. Порог ощущения запаха в воздухе составляет приблизительно 3000 частей на миллион<ref name="mmg">{{cite web| author =| authorlink =| date =| url =http://www.atsdr.cdc.gov/MHMI/mmg20.html| title =Medical Management Guidelines for Vinyl Chloride| format =| work =| publisher =Agency for Toxic Substances and Disease Registry (ATSDR)| accessdate =2009-11-02| lang =en| description =| archiveurl =https://www.webcitation.org/6160jANyG?url=http://www.atsdr.cdc.gov/MHMI/mmg20.html| archivedate =2011-08-21}}</ref>. Малорастворим в воде (около 0,95 масс.% при 15—85 °С<ref>{{статья |
||
| автор = DeLassus Ph. T., Schmidt D. D. |
| автор = DeLassus Ph. T., Schmidt D. D. |
||
| заглавие = Solubilities of vinyl chloride and vinylidene chloride in water |
| заглавие = Solubilities of vinyl chloride and vinylidene chloride in water |
||
| Строка 304: | Строка 304: | ||
Атом хлора в винилхлориде очень инертен, что связано с влиянием двойной связи, поэтому [[реакции замещения]], связанные с ним, для винилхлорида не характерны. В то же время именно это свойство позволяет относительно легко отщеплять от него молекулу [[хлороводород]]а. |
Атом хлора в винилхлориде очень инертен, что связано с влиянием двойной связи, поэтому [[реакции замещения]], связанные с ним, для винилхлорида не характерны. В то же время именно это свойство позволяет относительно легко отщеплять от него молекулу [[хлороводород]]а. |
||
Для [[Химическая промышленность|химической промышленности]] первостепенное значение имеет реакция [[полимеризация|полимеризации]] винилхлорида, выступающая в качестве основного крупнотоннажного метода [[Химический синтез|синтеза]] [[поливинилхлорид]]а и его [[Сополимеры|сополимеров]]. |
|||
Наибольший интерес представляет реакция [[полимеризация|полимеризации]] винилхлорида, имеющая огромное практическое значение. |
|||
=== Реакции присоединения по двойной связи === |
=== Реакции присоединения по двойной связи === |
||
| Строка 314: | Строка 314: | ||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = 1994-05-24 |
||
|url = http://www.freepatentsonline.com/5315052.pdf |
|url = http://www.freepatentsonline.com/5315052.pdf |
||
|title = Unated States Patens 5315052. Concurrent production of trichloroethane isomers |
|title = Unated States Patens 5315052. Concurrent production of trichloroethane isomers |
||
| Строка 430: | Строка 430: | ||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = 1993-03-22 |
||
|url = http://www.freepatentsonline.com/5345018.pdf |
|url = http://www.freepatentsonline.com/5345018.pdf |
||
|title = Unated States Patens 5345018. Method for preparing 1-chloro-1-iodoethane |
|title = Unated States Patens 5345018. Method for preparing 1-chloro-1-iodoethane |
||
| Строка 454: | Строка 454: | ||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = 1978-12-19 |
||
|url = http://www.freepatentsonline.com/4130592.pdf |
|url = http://www.freepatentsonline.com/4130592.pdf |
||
|title = Unated States Patens 4130592. Method for the preparation of chloroacetaldehydedimethyl acetal |
|title = Unated States Patens 4130592. Method for the preparation of chloroacetaldehydedimethyl acetal |
||
| Строка 522: | Строка 522: | ||
|номер = 1 |
|номер = 1 |
||
|страницы = 51—60 |
|страницы = 51—60 |
||
}}{{Недоступная ссылка|date= |
}}{{Недоступная ссылка|date=2020-03|bot=InternetArchiveBot }}</ref>: |
||
: <chem>CH2=CH-Cl{} + CCl4 -> CCl3-CH2-CHCl2</chem> |
: <chem>CH2=CH-Cl{} + CCl4 -> CCl3-CH2-CHCl2</chem> |
||
| Строка 546: | Строка 546: | ||
Винилхлорид вступает в фотохимическую [[реакции синхронного присоединения|реакцию [2+2] циклоприсоединения]] к 1-изохинолону<ref>{{статья |
Винилхлорид вступает в фотохимическую [[реакции синхронного присоединения|реакцию [2+2] циклоприсоединения]] к 1-изохинолону<ref>{{статья |
||
| |
|автор = Chiba T., Takada Y., Kaneko C., Kiichi F., Tsuda Y. |
||
| |
|заглавие = Cycloadditions in Syntheses. LII. Stereochemical Pathways of 1-Isoquinolone-Chloroehylene Photo[2+2]cycloaddition: Determination of Regio- and Stereostructures of the Products and Explanation for Their Formation |
||
| |
|ссылка = http://ci.nii.ac.jp/naid/110003628270/en |
||
| |
|язык = en |
||
| |
|издание = Chemical & Pharmaceutical Bulletin |
||
| |
|тип = |
||
| |
|год = 1990 |
||
| |
|том = 38 |
||
| |
|номер = 12 |
||
| |
|страницы = 3317—3325 |
||
|archivedate = 2016-03-04 |
|||
|archiveurl = https://web.archive.org/web/20160304221041/http://ci.nii.ac.jp/naid/110003628270/en |
|||
}}</ref>: |
}}</ref>: |
||
: [[Файл:Vinyl-chloride-cycloaddition-to-isoquinolone.png|450 px|Реакция [2+2] циклоприсоединения винилхлорида к 1-изохинолону]] |
: [[Файл:Vinyl-chloride-cycloaddition-to-isoquinolone.png|450 px|Реакция [2+2] циклоприсоединения винилхлорида к 1-изохинолону]] |
||
=== Реакции замещения по атому |
=== Реакции замещения по атому [[хлор]]а === |
||
Традиционные [[реакции замещения]], типичные для многих галогенуглеводородов, для винилхлорида не доступны. Обычно под действием [[основание (химия)|оснований]], особенно при нагревании, вместо замещения протекают [[полимеризация|реакции полимеризации]] или [[реакции элиминирования|элиминирования]]<ref name="traven" />. |
Традиционные [[реакции замещения]], типичные для многих галогенуглеводородов, для винилхлорида не доступны. Обычно под действием [[основание (химия)|оснований]], особенно при нагревании, вместо замещения протекают [[полимеризация|реакции полимеризации]] или [[реакции элиминирования|элиминирования]]<ref name="traven" />. |
||
| Строка 725: | Строка 727: | ||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = 1992-09-23 |
||
|url = http://www.freepatentsonline.com/5312984.pdf |
|url = http://www.freepatentsonline.com/5312984.pdf |
||
|title = Unated States Patens 5312984. Amidation of vinyl chloride with dimethylamine using a supported palladium catalyst |
|title = Unated States Patens 5312984. Amidation of vinyl chloride with dimethylamine using a supported palladium catalyst |
||
| Строка 746: | Строка 748: | ||
Механизм полимеризации носит [[реакции радикального присоединения|радикальный характер]] и схематично может быть представлен следующим образом<ref name="kmpvc">{{книга |
Механизм полимеризации носит [[реакции радикального присоединения|радикальный характер]] и схематично может быть представлен следующим образом<ref name="kmpvc">{{книга |
||
|автор |
|автор = Kun Si |
||
|часть |
|часть = |
||
|заглавие |
|заглавие = Kinetics and Mechanism of Vinyl Chloride Polymerization: Effects of Additives on Polymerization Rate, Molecular Weight, and Defect Concentration in the Polymer |
||
|оригинал |
|оригинал = |
||
|ссылка |
|ссылка = http://etd.ohiolink.edu/send-pdf.cgi/Si%20Kun.pdf?acc_num=case1168382967 |
||
|ответственный |
|ответственный = |
||
|издание |
|издание = |
||
|место |
|место = Cleveland |
||
|издательство |
|издательство = Case Western Reserve University |
||
|год |
|год = 2007 |
||
|том |
|том = |
||
|pages |
|pages = |
||
|allpages |
|allpages = 381 |
||
|серия |
|серия = |
||
|isbn |
|isbn = |
||
|тираж |
|тираж = |
||
|url-status = dead |
|||
}}</ref>: |
}}</ref>: |
||
| Строка 815: | Строка 818: | ||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = 1938-11-22 |
||
|url = http://www.freepatentsonline.com/2137664.pdf |
|url = http://www.freepatentsonline.com/2137664.pdf |
||
|title = Unated States Patens 2137664. Alpha, beta-dihalogenethylketones |
|title = Unated States Patens 2137664. Alpha, beta-dihalogenethylketones |
||
| Строка 841: | Строка 844: | ||
|номер = 4 |
|номер = 4 |
||
|страницы = 1243—1244 |
|страницы = 1243—1244 |
||
}}{{Недоступная ссылка|date= |
}}{{Недоступная ссылка|date=2018-09|bot=InternetArchiveBot }}</ref>: |
||
: <math>\mathsf{CH_2\!\!=\!\!CH\!\!-\!\!Cl+2ROH\ \xrightarrow{PdCl_2}\ CH_3\!\!-\!\!CH(OR)_2+HCl}</math> |
: <math>\mathsf{CH_2\!\!=\!\!CH\!\!-\!\!Cl+2ROH\ \xrightarrow{PdCl_2}\ CH_3\!\!-\!\!CH(OR)_2+HCl}</math> |
||
| Строка 860: | Строка 863: | ||
|номер = 10 |
|номер = 10 |
||
|страницы = 2385—2388 |
|страницы = 2385—2388 |
||
}}{{Недоступная ссылка|date= |
}}{{Недоступная ссылка|date=2018-09|bot=InternetArchiveBot }}</ref>: |
||
: <math>\mathsf{CH_2\!\!=\!\!CH\!\!-\!\!Cl+O_3+2CH_3OH\rightarrow CH_3OCH_2OOH_{\ (1)}+CO+HCl}</math> |
: <math>\mathsf{CH_2\!\!=\!\!CH\!\!-\!\!Cl+O_3+2CH_3OH\rightarrow CH_3OCH_2OOH_{\ (1)}+CO+HCl}</math> |
||
| Строка 951: | Строка 954: | ||
== Промышленное производство: технологические аспекты == |
== Промышленное производство: технологические аспекты == |
||
На 2010 год существуют три основных способа получения винилхлорида, реализованные в промышленных масштабах<ref name="vcprod">{{cite web| author =| authorlink =| |
На 2010 год существуют три основных способа получения винилхлорида, реализованные в промышленных масштабах<ref name="vcprod">{{cite web| author =| authorlink =| date =2009-04-01| url =http://chemanalytica.com/book/novyy_spravochnik_khimika_i_tekhnologa/06_syre_i_produkty_promyshlennosti_organicheskikh_i_neorganicheskikh_veshchestv_chast_II/5065| title =Производство винилхлорида| format =| work =| publisher =Новый справочник химика и технолога. Сырьё и продукты промышленности органических и неорганических веществ (часть II)| accessdate =2009-11-03| lang =| description =| archive-date =2014-08-20| archive-url =https://web.archive.org/web/20140820092907/http://chemanalytica.com/book/novyy_spravochnik_khimika_i_tekhnologa/06_syre_i_produkty_promyshlennosti_organicheskikh_i_neorganicheskikh_veshchestv_chast_II/5065| deadlink =no}}</ref>: |
||
* '''[[Винилхлорид#Каталитическое газофазное гидрохлорирование ацетилена|каталитическое газофазное гидрохлорирование ацетилена]]'''; |
* '''[[Винилхлорид#Каталитическое газофазное гидрохлорирование ацетилена|каталитическое газофазное гидрохлорирование ацетилена]]'''; |
||
* '''[[Винилхлорид#Комбинированный метод на основе этилена и ацетилена|комбинированный метод на основе этилена и ацетилена]]'''; |
* '''[[Винилхлорид#Комбинированный метод на основе этилена и ацетилена|комбинированный метод на основе этилена и ацетилена]]'''; |
||
| Строка 997: | Строка 1000: | ||
[[Файл:VCM-from-acetylene.png|750 px|center|Схематичное изображение процесса каталитического газофазного гидрохлорирования ацетилена]] |
[[Файл:VCM-from-acetylene.png|750 px|center|Схематичное изображение процесса каталитического газофазного гидрохлорирования ацетилена]] |
||
По состоянию на [[1967 год]], доля метода каталитического газофазного гидрохлорирования ацетилена в производственных мощностях по выпуску винилхлорида в [[США]] составляла 32,3 % (405,6 тыс. тонн)<ref name="map" />. В |
По состоянию на [[1967 год]], доля метода каталитического газофазного гидрохлорирования ацетилена в производственных мощностях по выпуску винилхлорида в [[США]] составляла 32,3 % (405,6 тыс. тонн)<ref name="map" />. В 2001 году американская химическая корпорация Borden остановила своё последнее производство на основе ацетилена в [[Луизиана|Луизиане]]<ref name="iars" />. Помимо экономических соображений, метод каталитического гидрохлорирования ацетилена является экологически небезопасным, так как используемая в производстве ртуть, несмотря на рециркуляцию, неизбежно с газообразными отходами и сточными водами попадает в окружающую среду. В 2002 году в России такие выбросы составили около 31 кг<ref name="amrrf" />. |
||
Метод каталитического гидрохлорирования ацетилена на |
Метод каталитического гидрохлорирования ацетилена на 2010 год широко распространён только в [[Китай|Китае]] из-за богатых запасов [[Каменный уголь|угля]], наличия дешёвой гидроэлектроэнергии, а также [[Товарный дефицит|дефицита]] [[природный газ|природного газа]], являющегося главным сырьём для производства [[этилен]]а<ref name="vcmec">{{cite web |
||
|author = Benyahia F. |
|author = Benyahia F. |
||
|authorlink = |
|authorlink = |
||
| |
|date = |
||
|url = http://www.nt.ntnu.no/users/skoge/prost/proceedings/gas-processing-doha-2009/fscommand/po06.pdf |
|url = http://www.nt.ntnu.no/users/skoge/prost/proceedings/gas-processing-doha-2009/fscommand/po06.pdf |
||
|title = The VCM Process Economics: Global and Raw Material Impacts |
|title = The VCM Process Economics: Global and Raw Material Impacts |
||
| Строка 1018: | Строка 1021: | ||
|author = Linak E. |
|author = Linak E. |
||
|authorlink = |
|authorlink = |
||
| |
|date = 2009-06 |
||
|url = http://www.sriconsulting.com/CEH/Public/Reports/696.6000/ |
|url = http://www.sriconsulting.com/CEH/Public/Reports/696.6000/ |
||
|title = Vinyl Chloride Monomer (VCM) |
|title = Vinyl Chloride Monomer (VCM) |
||
| Строка 1064: | Строка 1067: | ||
==== Общее описание метода ==== |
==== Общее описание метода ==== |
||
На 2010 год самым современным и наиболее эффективным с экономической точки зрения является сбалансированный процесс окислительного хлорирования этилена. В |
На 2010 год самым современным и наиболее эффективным с экономической точки зрения является сбалансированный процесс окислительного хлорирования этилена. В 2006 году более 95 % винилхлорида было произведено этим методом<ref name="iars">{{книга |
||
|автор |
|автор = |
||
|часть |
|часть = |
||
|заглавие |
|заглавие = 1,3-Butadiene, Ethylene Oxide and Vinyl Halides (Vinyl Fluoride, Vinyl Chloride and Vinyl Bromide) |
||
|оригинал |
|оригинал = |
||
|ссылка |
|ссылка = http://monographs.iarc.fr/ENG/Monographs/vol97/mono97.pdf |
||
|ответственный |
|ответственный = |
||
|издание |
|издание = IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 97 |
||
|место |
|место = Lyon |
||
|издательство |
|издательство = International Agency for Research on Cancer |
||
|год |
|год = 2008 |
||
|том |
|том = |
||
|pages |
|pages = |
||
|allpages |
|allpages = 311—323 |
||
|серия |
|серия = |
||
|isbn |
|isbn = 978-92-832-1297-3 |
||
|тираж |
|тираж = |
||
|archivedate = 2011-09-10 |
|||
|archiveurl = https://web.archive.org/web/20110910133029/http://monographs.iarc.fr/ENG/Monographs/vol97/mono97.pdf |
|||
}}</ref>. |
}}</ref>. |
||
| Строка 1131: | Строка 1136: | ||
Краткое описание стадий процесса: |
Краткое описание стадий процесса: |
||
* ''Прямое хлорирование этилена''<ref>{{cite web| author =| authorlink =| |
* ''Прямое хлорирование этилена''<ref>{{cite web| author =| authorlink =| date =| url =http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_EDC_Direct_Chlorination_Process_using_boiling_reactor_technology_and_Direct_Chlorination_C| title =EDC DIRECT CHLORINATION Process using Boiling Reactor Technology and DIRECT CHLORINATION Catalyst| format =| work =VinTec Licensing Activities| publisher =Vinnolit GmbH| accessdate =2009-11-09| lang =en| description =| archiveurl =https://www.webcitation.org/6160niEGW?url=http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_EDC_Direct_Chlorination_Process_using_boiling_reactor_technology_and_Direct_Chlorination_C| archivedate =2011-08-21}}</ref>: |
||
: Реакция хлорирования этилена протекает в жидкой фазе в среде дихлорэтана при температуре 50—125 °С в присутствии специального усовершенствованного (по сравнению с FeCl<sub>3</sub>) комплексного катализатора, препятствующего образованию побочных продуктов, не расходующегося в процессе синтеза и остающегося в реакторном объёме. Благодаря этому образующийся дихлорэтан не требует очистки (чистота достигает 99,9 % и более) и напрямую поступает на стадию [[пиролиз]]а. |
: Реакция хлорирования этилена протекает в жидкой фазе в среде дихлорэтана при температуре 50—125 °С в присутствии специального усовершенствованного (по сравнению с FeCl<sub>3</sub>) комплексного катализатора, препятствующего образованию побочных продуктов, не расходующегося в процессе синтеза и остающегося в реакторном объёме. Благодаря этому образующийся дихлорэтан не требует очистки (чистота достигает 99,9 % и более) и напрямую поступает на стадию [[пиролиз]]а. |
||
* ''Процесс оксихлорирования этилена''<ref>{{cite web| author =| authorlink =| |
* ''Процесс оксихлорирования этилена''<ref>{{cite web| author =| authorlink =| date =| url =http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_EDC_Oxychlorination_Process| title =EDC OXYCHLORINATION Process| format =| work =VinTec Licensing Activities| publisher =Vinnolit GmbH| accessdate =2009-11-09| lang =en| description =| archiveurl =https://www.webcitation.org/6160oXtJW?url=http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_EDC_Oxychlorination_Process| archivedate =2011-08-21}}</ref>: |
||
: Процесс оксихлорирования — [[экзотермическая реакция]], сопровождающаяся выделением большого количества тепла (ΔH = −238 кДж/моль) и проходящая в присутствии кислорода (преимущественно) или воздуха. Реакционная газовая смесь разогревается до температуры свыше 210 °C, а выделяемое тепло реакции используется для образования пара. Степень [[Конверсия (химия)|конверсии]] этилена достигает 99 %, а чистота получаемого дихлорэтана — 99,5 %. |
: Процесс оксихлорирования — [[экзотермическая реакция]], сопровождающаяся выделением большого количества тепла (ΔH = −238 кДж/моль) и проходящая в присутствии кислорода (преимущественно) или воздуха. Реакционная газовая смесь разогревается до температуры свыше 210 °C, а выделяемое тепло реакции используется для образования пара. Степень [[Конверсия (химия)|конверсии]] этилена достигает 99 %, а чистота получаемого дихлорэтана — 99,5 %. |
||
* ''Процесс дистилляции дихлорэтана''<ref>{{cite web| author =| authorlink =| |
* ''Процесс дистилляции дихлорэтана''<ref>{{cite web| author =| authorlink =| date =| url =http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_EDC_Distillation| title =EDC DISTILLATION| format =| work =VinTec Licensing Activities| publisher =Vinnolit GmbH| accessdate =2009-11-09| lang =en| description =| archiveurl =https://www.webcitation.org/6160pKTGy?url=http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_EDC_Distillation| archivedate =2011-08-21}}</ref>: |
||
: Дистилляция требуется для дихлорэтана, образующегося в процессе оксихлорирования, а также непрореагировавшего (возвратного) дихлорэтана со стадии пиролиза. Вода и низкокипящие компоненты удаляются в осушающей колонне. Кубовый остаток в дальнейшем поступает на стадию регенерации. |
: Дистилляция требуется для дихлорэтана, образующегося в процессе оксихлорирования, а также непрореагировавшего (возвратного) дихлорэтана со стадии пиролиза. Вода и низкокипящие компоненты удаляются в осушающей колонне. Кубовый остаток в дальнейшем поступает на стадию регенерации. |
||
* ''Пиролиз дихлорэтана''<ref>{{cite web| author =| authorlink =| |
* ''Пиролиз дихлорэтана''<ref>{{cite web| author =| authorlink =| date =| url =http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_EDC_Cracking_Process| title =EDC CRACKING Process| format =| work =VinTec Licensing Activities| publisher =Vinnolit GmbH| accessdate =2009-11-09| lang =en| description =| archiveurl =https://www.webcitation.org/6160q2yWP?url=http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_EDC_Cracking_Process| archivedate =2011-08-21}}</ref>: |
||
: Пиролиз дихлорэтана производится в специальных печах (операционный период — до 2 лет) при температуре 480 °C; при этом теплота процесса используется для испарения и нагрева. |
: Пиролиз дихлорэтана производится в специальных печах (операционный период — до 2 лет) при температуре 480 °C; при этом теплота процесса используется для испарения и нагрева. |
||
* ''Дистилляция винилхлорида''<ref>{{cite web| author =| authorlink =| |
* ''Дистилляция винилхлорида''<ref>{{cite web| author =| authorlink =| date =| url =http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_VCM_Distillation| title =VCM DISTILLATION| format =| work =VinTec Licensing Activities| publisher =Vinnolit GmbH| accessdate =2009-11-09| lang =en| description =| archiveurl =https://www.webcitation.org/6160qlglm?url=http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_VCM_Distillation| archivedate =2011-08-21}}</ref>: |
||
: Продукты пиролиза, состоящие, в основном, из дихлорэтана, винилхлорида и хлороводорода, направляются в узел дистилляции. Хлороводород возвращается в отделение оксихлорирования, винилхлорид удаляется через верхнюю часть колонны, а кубовый остаток, состоящий из непрореагировавшего дихлорэтана, возвращается в процесс дистилляции после удаления побочных продуктов. |
: Продукты пиролиза, состоящие, в основном, из дихлорэтана, винилхлорида и хлороводорода, направляются в узел дистилляции. Хлороводород возвращается в отделение оксихлорирования, винилхлорид удаляется через верхнюю часть колонны, а кубовый остаток, состоящий из непрореагировавшего дихлорэтана, возвращается в процесс дистилляции после удаления побочных продуктов. |
||
* ''Регенерация побочных продуктов''<ref>{{cite web| author =| authorlink =| |
* ''Регенерация побочных продуктов''<ref>{{cite web| author =| authorlink =| date =| url =http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_By-product_Recovery_Process| title =BY-PRODUCT RECOVERY Process| format =| work =VinTec Licensing Activities| publisher =Vinnolit GmbH| accessdate =2009-11-09| lang =en| description =| archiveurl =https://www.webcitation.org/6160rS1bf?url=http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_By-product_Recovery_Process| archivedate =2011-08-21}}</ref>: |
||
: Жидкие и газообразные побочные продукты полностью сжигаются при температуре 1100—1200 °С, образуя хлороводород, который после очистки возвращается в процесс оксихлорирования; попутно за счёт высокой температуры продуцируется также пар среднего давления. |
: Жидкие и газообразные побочные продукты полностью сжигаются при температуре 1100—1200 °С, образуя хлороводород, который после очистки возвращается в процесс оксихлорирования; попутно за счёт высокой температуры продуцируется также пар среднего давления. |
||
| Строка 1153: | Строка 1158: | ||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = |
||
|url = http://www.uhde.eu/cgi-bin/byteserver.pl/archive/upload/uhde_brochures_pdf_en_8.00.pdf |
|url = http://www.uhde.eu/cgi-bin/byteserver.pl/archive/upload/uhde_brochures_pdf_en_8.00.pdf |
||
|title = Vinyl chloride and polyvinyl chloride |
|title = Vinyl chloride and polyvinyl chloride |
||
| Строка 1209: | Строка 1214: | ||
Процесс проходил при 450—550 °C и давлении 1 МПа; степень конверсии этана достигала 65—70 %<ref name="pp2" />. Метод впоследствии был оптимизирован компанией [[ICI]], которая снизила температурный диапазон проведения синтеза и предложила другой катализатор<ref name="pp2" />. |
Процесс проходил при 450—550 °C и давлении 1 МПа; степень конверсии этана достигала 65—70 %<ref name="pp2" />. Метод впоследствии был оптимизирован компанией [[ICI]], которая снизила температурный диапазон проведения синтеза и предложила другой катализатор<ref name="pp2" />. |
||
В мае 1998 года компания [[EVC International|EVC International NV]] ([[Нидерланды]]) запустила опытный проект мощностью 1000 тонн в год на заводе в [[Вильгельмсхафен]]е ([[Германия]]) с целью опробирования и последующего продвижения на рынке запатентованного процесса окислительного хлорирования этана, или '''Ethane-to-VCM-Process'''. Предполагалось, что этот проект будет технологическим прорывом и станет началом работы над полномасштабным заводом, который, как ожидалось, будет запущен в 2003 году<ref name="hco">{{cite web| author =| authorlink =| |
В мае 1998 года компания [[EVC International|EVC International NV]] ([[Нидерланды]]) запустила опытный проект мощностью 1000 тонн в год на заводе в [[Вильгельмсхафен]]е ([[Германия]]) с целью опробирования и последующего продвижения на рынке запатентованного процесса окислительного хлорирования этана, или '''Ethane-to-VCM-Process'''. Предполагалось, что этот проект будет технологическим прорывом и станет началом работы над полномасштабным заводом, который, как ожидалось, будет запущен в 2003 году<ref name="hco">{{cite web| author =| authorlink =| date =1999-09-09| url =http://www.hydrocarbononline.com/article.mvc/New-VCM-Plant-Will-Use-Ethane-0001?VNETCOOKIE=NO| title =New VCM Plant Will Use Ethane| format =| work =| publisher =Hydrocarbon Online| accessdate =2009-11-11| lang =en| description =| archiveurl =https://www.webcitation.org/6160sz9gb?url=http://www.hydrocarbononline.com/article.mvc/New-VCM-Plant-Will-Use-Ethane-0001?VNETCOOKIE=NO| archivedate =2011-08-21}}</ref>. |
||
По данным производителя, температура процесса составляет менее 500 °C, степень конверсии сырья — 100 % по хлору, 99 % по кислороду и более чем 90 % по этану; выход винилхлорида превышает 90 %<ref name="hco" />. |
По данным производителя, температура процесса составляет менее 500 °C, степень конверсии сырья — 100 % по хлору, 99 % по кислороду и более чем 90 % по этану; выход винилхлорида превышает 90 %<ref name="hco" />. |
||
В сентябре 1999 года EVC подписала с компанией [[Bechtel Group|Bechtel Group, Inc.]] ([[США]]) соглашение о постройке полноценного производства в Вильгельмсхафене, однако из-за финансовых проблем проект не был осуществлён<ref>{{cite web| author =| authorlink =| |
В сентябре 1999 года EVC подписала с компанией [[Bechtel Group|Bechtel Group, Inc.]] ([[США]]) соглашение о постройке полноценного производства в Вильгельмсхафене, однако из-за финансовых проблем проект не был осуществлён<ref>{{cite web| author =| authorlink =| date =| url =http://www.chemicals-technology.com/projects/wilhelmshaven/| title =Wilhelmshaven VCM Facility, Germany| format =| work =Industry Projects| publisher =Сhemicals-technology.com| accessdate =2009-11-11| lang =en| description =| archiveurl =https://www.webcitation.org/6160tgN7X?url=http://www.chemicals-technology.com/projects/wilhelmshaven/| archivedate =2011-08-21}}</ref>. |
||
После поглощения в 2001 году<ref>{{cite web| author =| authorlink =| |
После поглощения в 2001 году<ref>{{cite web| author =| authorlink =| date =| url =http://www.ineos.com/abo_his.html| title =History| format =| work =| publisher =INEOS| accessdate =2009-11-02| lang =en| description =| archiveurl =https://www.webcitation.org/6160udtuo?url=http://www.ineos.com/abo_his.html| archivedate =2011-08-21}}</ref> корпорацией [[INEOS]] компании EVC дальнейшая судьба проекта '''Ethane-to-VCM-Process''' не известна<ref>{{книга |
||
|автор = Spitz P. H. |
|автор = Spitz P. H. |
||
|часть = |
|часть = |
||
| Строка 1239: | Строка 1244: | ||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = 1977-12-02 |
||
|url = http://www.freepatentsonline.com/4300005.pdf |
|url = http://www.freepatentsonline.com/4300005.pdf |
||
|title = Unated States Patens 4300005. Preparation of vinyl chloride |
|title = Unated States Patens 4300005. Preparation of vinyl chloride |
||
| Строка 1269: | Строка 1274: | ||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = 2005-01-24 |
||
|url = http://www.freepatentsonline.com/20060167325.pdf |
|url = http://www.freepatentsonline.com/20060167325.pdf |
||
|title = Unated States Patens 20060167325. Method for producing vinyl chloride monomer |
|title = Unated States Patens 20060167325. Method for producing vinyl chloride monomer |
||
| Строка 1292: | Строка 1297: | ||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = 2015-01 |
||
|url = https://www.ihs.com/products/vinyl-chloride-monomer-chemical-economics-handbook.html |
|url = https://www.ihs.com/products/vinyl-chloride-monomer-chemical-economics-handbook.html |
||
|title = Vinyl Chloride Monomer (VCM) |
|title = Vinyl Chloride Monomer (VCM) |
||
| Строка 1304: | Строка 1309: | ||
|archivedate = 2017-01-18 |
|archivedate = 2017-01-18 |
||
|deadlink = no |
|deadlink = no |
||
}}</ref>, уступая лишь [[этилен]]у (123 млн тонн в 2010 году<ref>{{cite web| author =| authorlink =| |
}}</ref>, уступая лишь [[этилен]]у (123 млн тонн в 2010 году<ref>{{cite web| author =| authorlink =| date =2011-01| url =http://chemical.ihs.com/WP/Public/Reports/ethylene/| title =Ethylene| format =| work =WP Report| publisher =IHS| accessdate =2012-01-17| lang =en| description =| archiveurl =https://www.webcitation.org/64uVEQJdE?url=http://chemical.ihs.com/WP/Public/Reports/ethylene/| archivedate =2012-01-23}}</ref>), [[пропилен]]у (77 млн тонн в 2010 году<ref>{{cite web| author =| authorlink =| date =2011-01| url =http://chemical.ihs.com/WP/Public/Reports/propylene/| title =Propylene| format =| work =WP Report| publisher =IHS| accessdate =2012-01-17| lang =en| description =| archiveurl =https://www.webcitation.org/64uVF06tG?url=http://chemical.ihs.com/WP/Public/Reports/propylene/| archivedate =2012-01-23}}</ref>), [[метанол]]у (48—49 млн тонн в 2010 году<ref>{{cite web| author =| authorlink =| date =2011-01| url =http://chemical.ihs.com/WP/Public/Reports/methanol/| title =Methanol| format =| work =WP Report| publisher =IHS| accessdate =2012-01-17| lang =en| description =| archiveurl =https://www.webcitation.org/64uVFZeHR?url=http://chemical.ihs.com/WP/Public/Reports/methanol/| archivedate =2012-01-23}}</ref>), [[терефталевая кислота|терефталевой кислоте]] (42 млн тонн в 2008 году<ref>{{cite web| author =| authorlink =| date =2011-01| url =http://chemical.ihs.com/WP/Public/Reports/tpa/| title =Terephthalic Acid (TPA)| format =| work =WP Report| publisher =IHS| accessdate =2012-01-17| lang =en| description =| archiveurl =https://www.webcitation.org/64uVG7dDn?url=http://chemical.ihs.com/WP/Public/Reports/tpa/| archivedate =2012-01-23}}</ref>), [[бензол]]у (40 млн тонн в 2010 году<ref>{{cite web| author =| authorlink =| date =2011-01| url =http://chemical.ihs.com/WP/Public/Reports/benzene/| title =Benzene| format =| work =WP Report| publisher =IHS| accessdate =2012-01-17| lang =en| description =| archiveurl =https://www.webcitation.org/64uVGcgqU?url=http://chemical.ihs.com/WP/Public/Reports/benzene/| archivedate =2012-01-23}}</ref>). Производство винилхлорида является третьим после [[полиэтилен]]а и [[окись этилена|окиси этилена]] по значимости направлением использования этилена как важнейшего химического сырья и составляет 11,9 % его мирового потребления (по данным на 2008 год)<ref>{{cite web| author =| authorlink =| date =2009-01| url =http://www.sriconsulting.com/WP/Public/Reports/ethylene/| title =Ethylene| format =| work =WP Report| publisher =SRI Consulting| accessdate =2009-10-05| lang =en| description =| archiveurl =https://www.webcitation.org/615s6YLZh?url=http://www.sriconsulting.com/WP/Public/Reports/ethylene/| archivedate =2011-08-21}}</ref>. Мировые мощности по производству винилхлорида по состоянию на 2022 год составляли около '''60 млн тонн''' |
||
<ref>{{cite web |
|||
|author = |
|||
|authorlink = |
|||
|date = 2022-09-15 |
|||
|url = https://mcgroup.co.uk/news/20220915/vinyl-chloride-market-trends-dynamics.html |
|||
|title = Vinyl Chloride Market: Trends & Dynamics |
|||
|format = |
|||
|work = |
|||
|publisher = Merchant Research and Consulting Ltd. |
|||
|accessdate = |
|||
|lang = en |
|||
|description = |
|||
|archiveurl = https://web.archive.org/web/20231208061711/https://mcgroup.co.uk/news/20220915/vinyl-chloride-market-trends-dynamics.html |
|||
|archivedate = 2023-12-08 |
|||
|deadlink = no |
|||
|url-status = live |
|||
}}</ref>. |
|||
Мировое производство винилхлорида в [[2010 год]]у составило около '''35 млн тонн'''<ref name="ihs">{{cite web| author =| authorlink =| date =2011-01| url =http://chemical.ihs.com/WP/Public/Reports/vcm/| title =Vinyl Chloride Monomer (VCM)| format =| work =WP Report| publisher =IHS| accessdate =2012-01-17| lang =en| description =| archiveurl =https://www.webcitation.org/64uVHAdID?url=http://chemical.ihs.com/WP/Public/Reports/vcm/| archivedate =2012-01-23}}</ref> (36,7 млн тонн в [[2008 год]]у<ref name="sri">{{cite web| author =| authorlink =| date =2009-01| url =http://www.sriconsulting.com/WP/Public/Reports/vcm/| title =Vinyl Chloride Monomer| format =| work =WP Report| publisher =SRI Consulting| accessdate =2009-10-28| lang =en| description =| archiveurl =https://www.webcitation.org/615s9WYq3?url=http://www.sriconsulting.com/WP/Public/Reports/vcm/| archivedate =2011-08-21}}</ref>), что составляет 70 % всех мировых производственных мощностей (в [[2007 год]]у — 90 %, [[2008 год]]у — 85 %). По прогнозным данным компании [http://chemical.ihs.com/ IHS], текущее потребление винилхлорида в период с 2010 по 2015 гг. будет расти в размере 4,4 % в год и 4,2 % в последующие пять лет (с 2015 по 2020 г.)<ref name="ihs" />. |
|||
По состоянию на [[1997 год|1997]] и конец [[2004 год]]а мировые мощности по производству винилхлорида по регионам выглядят следующим образом: |
По состоянию на [[1997 год|1997]] и конец [[2004 год]]а мировые мощности по производству винилхлорида по регионам выглядят следующим образом: |
||
{|class="wikitable collapsible" width=95% |
{|class="wikitable collapsible" width=95% |
||
| Строка 1312: | Строка 1334: | ||
!align="center" width=33%| Мощность на 2004 год, тыс. тонн<ref name="pvc" /> |
!align="center" width=33%| Мощность на 2004 год, тыс. тонн<ref name="pvc" /> |
||
|- |
|- |
||
|'''Северная Америка''' <br |
|'''Северная Америка''' <br> [[США]]<br> [[Канада]] <br> [[Мексика]] |
||
|align="center" | '''7385'''<br |
|align="center" | '''7385'''<br>6741<br>374<br>270 |
||
|align="center" | '''8988'''<br |
|align="center" | '''8988'''<br>8018 <br>500<br>470 |
||
|- |
|- |
||
|'''Южная Америка''' <br |
|'''Южная Америка''' <br> [[Бразилия]]<br> [[Аргентина]]<br> [[Венесуэла]] |
||
|align="center" | '''880'''<br |
|align="center" | '''880'''<br>540<br>160<br>180 |
||
|align="center" | '''1035'''<br |
|align="center" | '''1035'''<br>655<br>230<br>150 |
||
|- |
|- |
||
|'''Западная Европа''' <br |
|'''Западная Европа''' <br> [[Бельгия]]<br> [[Франция]]<br> [[Германия]]<br> [[Италия]]<br> [[Нидерланды]]<br> [[Норвегия]]<br> [[Испания]]<br> [[Швеция]]<br> [[Великобритания]] |
||
|align="center" | '''6409'''<br |
|align="center" | '''6409'''<br>1010<br>1205<br>1710<br>620<br>520<br>470<br>399<br>115<br>360 |
||
|align="center" | '''6495'''<br |
|align="center" | '''6495'''<br>880<br>1205<br>2015<br>440<br>600<br>470<br>465<br>120<br>300 |
||
|- |
|- |
||
|'''Восточная и Центральная Европа''' <br |
|'''Восточная и Центральная Европа''' <br> [[Россия]] и страны [[СНГ]]<br> [[Чехия]] и [[Словакия]]<br> [[Югославия]] (бывшая)<br> [[Венгрия]]<br> [[Польша]]<br> [[Румыния]] |
||
|align="center" | '''2342'''<br |
|align="center" | '''2342'''<br>1085<br>217<br>260<br>185<br>325<br>270 |
||
|align="center" | '''2011'''<br |
|align="center" | '''2011'''<br>884<br>217<br>160<br>255<br>300<br>200 |
||
|- |
|- |
||
|'''Африка''' <br |
|'''Африка''' <br> [[Алжир]]<br> [[Египет]]<br> [[Ливия]]<br> [[Марокко]]<br> [[ЮАР]] |
||
|align="center" | '''405'''<br |
|align="center" | '''405'''<br>40<br>100<br>62<br>38<br>165 |
||
|align="center" | '''408'''<br |
|align="center" | '''408'''<br>40<br>100<br>62<br>38<br>168 |
||
|- |
|- |
||
|'''Ближний Восток''' <br |
|'''Ближний Восток''' <br> [[Иран]]<br> [[Израиль]]<br> [[Катар]]<br> [[Саудовская Аравия]]<br> [[Турция]] |
||
|align="center" | '''862'''<br |
|align="center" | '''862'''<br>213<br>110<br>—<br>360<br>179 |
||
|align="center" | '''1092'''<br |
|align="center" | '''1092'''<br>240<br>—<br>300<br>400<br>152 |
||
|- |
|- |
||
|'''Азия<ref group="К">По состоянию на 2010 год, одним из крупных производителей винилхлорида является не упомянутая в этой таблице [[Малайзия]]. [http://www.mitco.com.my/ppPlants01.html Завод компании Petronas] {{Wayback|url=http://www.mitco.com.my/ppPlants01.html |date=20100609041416 }} имеет мощность 400 тыс. тонн/год.</ref>''' <br |
|'''Азия<ref group="К">По состоянию на 2010 год, одним из крупных производителей винилхлорида является не упомянутая в этой таблице [[Малайзия]]. [http://www.mitco.com.my/ppPlants01.html Завод компании Petronas] {{Wayback|url=http://www.mitco.com.my/ppPlants01.html |date=20100609041416 }} имеет мощность 400 тыс. тонн/год.</ref>''' <br> [[Китай]]<br> [[Индия]]<br> [[Индонезия]]<br> [[Япония]]<br> [[Северная Корея]]<br> [[Южная Корея]]<br> [[Пакистан]]<br> [[Филиппины]]<br> [[Тайвань (провинция Китайской Народной Республики)|Тайвань]]<br> [[Таиланд]] |
||
|align="center" | '''7145'''<br |
|align="center" | '''7145'''<br>1356<br>610<br>150<br>2965<br>24<br>755<br>5<br>10<br>1030<br>240 |
||
|align="center" | '''13082'''<br |
|align="center" | '''13082'''<br>4436<br>845<br>500<br>3260<br>24<br>1520<br>—<br>—<br>1870<br>627 |
||
|- |
|- |
||
|'''Австралия и Океания''' <br |
|'''Австралия и Океания''' <br> [[Австралия]] |
||
|align="center" | '''36'''<br |
|align="center" | '''36'''<br>36 |
||
|align="center" | '''—'''<br |
|align="center" | '''—'''<br>— |
||
|- |
|- |
||
|'''ИТОГО''' |
|'''ИТОГО''' |
||
| Строка 1349: | Строка 1371: | ||
|} |
|} |
||
Крупнейшим производителем винилхлорида в мире (по объёму производственных мощностей) являются [[США]]: '''8,24 млн тонн''' по данным на 2003 год<ref name="the-innovation-group">{{cite web |
|||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = |
||
|url = http://www.the-innovation-group.com/ChemProfiles/Vinyl%20Chloride.htm |
|url = http://www.the-innovation-group.com/ChemProfiles/Vinyl%20Chloride.htm |
||
|title = Vinyl Chloride |
|title = Vinyl Chloride |
||
| Строка 1364: | Строка 1386: | ||
|archive-url = https://web.archive.org/web/20090727114102/http://www.the-innovation-group.com/ChemProfiles/Vinyl%20Chloride.htm |
|archive-url = https://web.archive.org/web/20090727114102/http://www.the-innovation-group.com/ChemProfiles/Vinyl%20Chloride.htm |
||
|deadlink = no |
|deadlink = no |
||
}}</ref> (для сравнения — в |
}}</ref> (для сравнения — в 1967 году мощности составляли 1,26 млн тонн, а в 1960 году всего 0,67 млн тонн<ref name="map">{{статья |
||
|автор = Turov Y. Y., Parshina G. A. |
|автор = Turov Y. Y., Parshina G. A. |
||
|заглавие = Manufacture of analogous products on acetylene and olefins base in the US |
|заглавие = Manufacture of analogous products on acetylene and olefins base in the US |
||
| Строка 1375: | Строка 1397: | ||
|номер = 7 |
|номер = 7 |
||
|страницы = 548—551 |
|страницы = 548—551 |
||
}}{{Недоступная ссылка|date= |
}}{{Недоступная ссылка|date=2020-03|bot=InternetArchiveBot }}</ref>). |
||
Крупнейшие производители США и Канады по объёму производственных мощностей по данным на |
Крупнейшие производители США и Канады по объёму производственных мощностей по данным на 2003 год<ref name="the-innovation-group" />: |
||
* |
* [[Dow Chemical]] — 2,4 млн тонн (2006 год)<ref name="dow">{{cite web| author =| authorlink =| date =| url =http://www.dow.com/productsafety/finder/vcm.htm| title =Product Safety Assessment: Vinyl Chloride Monomer| format =| work =Product Safety| publisher =Dow Chemical| accessdate =2009-11-06| lang =en| description =| archiveurl =https://www.webcitation.org/6160wYnb9?url=http://www.dow.com/productsafety/finder/vcm.htm| archivedate =2011-08-21}}</ref>; |
||
* |
* [[Occidental Petroleum|Occidental Chemical Corporation]] — 1,68 млн тонн; |
||
* |
* [[Georgia Gulf Corporation|Georgia Gulf]] — 1,18 млн тонн; |
||
* |
* [[Oxymar]] — 1,04 млн тонн; |
||
* |
* [[Formosa Plastics Group]] — 1,00 млн тонн. |
||
В |
В 1997 году крупнейшими мировыми компаниями-производителями (42 % всего суммарного объёма мировых производственных мощностей) были<ref>{{cite web| author =Tickner J.A.| authorlink =| date =1998-06-19| url =http://www.ecologycenter.org/iptf/plastic_types/TrendsinWorldPVC(GP).htm| title =Trends in World PVC Industry Expansion A Greenpeace White Paper| format =| work =| publisher =Ecology Center| accessdate =| lang =en| description =| archiveurl =https://www.webcitation.org/6164EA7uS?url=http://www.ecologycenter.org/iptf/plastic_types/TrendsinWorldPVC(GP).htm| archivedate =2011-08-21}}</ref>: |
||
* |
* [[Dow Chemical]] — 1906 тыс. тонн; |
||
* |
* [[Formosa Plastics Group]] — 1643 тыс. тонн; |
||
* |
* [[EVC]] — 1370 тыс. тонн; |
||
* |
* [[Solvay]] — 1193 тыс. тонн; |
||
* |
* [[The Geon Company]] — 1088 тыс. тонн; |
||
* |
* [[Occidental Petroleum|Occidental Chemical Corporation]] — 1020 тыс. тонн; |
||
* |
* [[Elf-Atochem]] — 803 тыс. тонн; |
||
* |
* [[Georgia Gulf]] — 726 тыс. тонн; |
||
* |
* [[Norsk Hydro]] — 595 тыс. тонн; |
||
* |
* [[Tosoli Corporation]] — 570 тыс. тонн. |
||
По состоянию на |
По состоянию на 2005 год крупнейшими мировыми компаниями-производителями являются (перечислены в порядке убывания)<ref>{{cite web |
||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = 2006-07 |
||
|url = http://www.sriconsulting.com/nl/Public/2006July.pdf |
|url = http://www.sriconsulting.com/nl/Public/2006July.pdf |
||
|title = Chemical Industries Newsletter |
|title = Chemical Industries Newsletter |
||
| Строка 1411: | Строка 1433: | ||
|archivedate = 2011-08-21 |
|archivedate = 2011-08-21 |
||
}}</ref>: |
}}</ref>: |
||
* |
* [[Formosa Plastics Group]]; |
||
* |
* [[Dow Chemical]]; |
||
* |
* [[Occidental Petroleum|Occidental Chemical Corporation]]; |
||
* |
* [[Solvay]]; |
||
* |
* [[Georgia Gulf Corporation|Georgia Gulf]]; |
||
* |
* [[Ineos]]; |
||
* |
* [[Tosoh]]; |
||
* |
* [[Total Petrochemicals]]; |
||
* |
* [[LG Chem]]; |
||
* |
* [[Shin-Etsu Chemical]]. |
||
=== Производство винилхлорида в России === |
=== Производство винилхлорида в России === |
||
Вклад [[Химическая промышленность России|России]] в мировое производство винилхлорида довольно скромный: около 1,5 % от годового глобального выпуска и место во второй двадцатке стран-производителей (по состоянию на 2008 год). При этом технологическое оснащение серьёзно отстаёт от мирового: почти 30 % мощностей используют устаревшую ацетиленовую технологию. |
|||
Производство винилхлорида в России практически полностью (более 99 % всего объёма) ориентировано на выпуск поливинилхлорида, являясь при этом одним из крупнейших направлений потребления [[хлор]]а в российской химической промышленности (18 % по данным на 2004 год)<ref>{{cite web| author =| authorlink =| date =2004-08-23| url =http://www.fas.gov.ru/news/n_1097.shtml| title =Справка о состоянии «хлорной» отрасли химической промышленности России. Подготовлено Российским Центром «Хлорбезопасность»| format =| work =| publisher =Федеральная Антимонопольная Служба РФ| accessdate =2009-10-27| lang =| description =| archiveurl =https://web.archive.org/web/20110812063545/http://fas.gov.ru/fas-news/fas-news_1097.html| archivedate =2011-08-12| deadlink =yes}}</ref>. |
|||
Вклад России в мировое производство винилхлорида довольно скромный: около 1,5 % от годового глобального выпуска и место во второй двадцатке стран-производителей (по состоянию на 2008 год). При этом технологическое оснащение серьёзно отстаёт от мирового: почти 30 % мощностей используют устаревшую ацетиленовую технологию. |
|||
Производство винилхлорида в России практически полностью (более 99 % всего объёма) ориентировано на выпуск поливинилхлорида, являясь при этом одним из крупнейших направлений потребления [[хлор]]а в российской химической промышленности (18 % по данным на 2004 год)<ref>{{cite web| author =| authorlink =| datepublished =2004-08-23| url =http://www.fas.gov.ru/news/n_1097.shtml| title =Справка о состоянии «хлорной» отрасли химической промышленности России. Подготовлено Российским Центром «Хлорбезопасность»| format =| work =| publisher =Федеральная Антимонопольная Служба РФ| accessdate =2009-10-27| lang =| description =| archiveurl =https://web.archive.org/web/20110812063545/http://fas.gov.ru/fas-news/fas-news_1097.html| archivedate =2011-08-12| deadlink =yes}}</ref>. |
|||
По состоянию на 2009 год производство винилхлорида в России осуществляется на следующих предприятиях: |
По состоянию на 2009 год производство винилхлорида в России осуществляется на следующих предприятиях: |
||
{|class="standard" |
{|class="standard" |
||
! Наименование |
! Наименование |
||
| Строка 1443: | Строка 1463: | ||
| [[Саянск|г. Саянск]], [[Иркутская область]] |
| [[Саянск|г. Саянск]], [[Иркутская область]] |
||
|align="center"| [[Винилхлорид#Сбалансированный по хлору метод на основе этилена|СХМЭ]] |
|align="center"| [[Винилхлорид#Сбалансированный по хлору метод на основе этилена|СХМЭ]] |
||
|align="center"| 270,0<ref>{{cite web| author =| authorlink =| |
|align="center"| 270,0<ref>{{cite web| author =| authorlink =| date =| url =http://www.sibvinyl.ru/about/history.aspx| title =История компании| format =| work =| publisher =ОАО «Саянскхимпласт»| accessdate =2009-11-08| lang =| description =| archiveurl =https://www.webcitation.org/6164Gedfj?url=http://www.sibvinyl.ru/about/history.aspx| archivedate =2011-08-21}}</ref> |
||
|align="center"| 250,0<ref group="К" name="pvcp">В пересчёте на поливинилхлорид.</ref><ref>{{cite web| author =| authorlink =| |
|align="center"| 250,0<ref group="К" name="pvcp">В пересчёте на поливинилхлорид.</ref><ref>{{cite web| author =| authorlink =| date =| url =http://www.sibvinyl.ru/docs/YearReport_2009.pdf| title =Годовой отчёт Открытого акционерного общества «Саянскхимпласт» 2008 год| format =pdf| work =| publisher =ОАО «Саянскхимпласт»| accessdate =2009-12-01| lang =| description =| archiveurl =https://www.webcitation.org/6164I1NlR?url=http://www.sibvinyl.ru/docs/YearReport_2009.pdf| archivedate =2011-08-21}}</ref> |
||
|- |
|- |
||
| [[Каустик (компания)|ОАО «Каустик»]] |
| [[Каустик (компания)|ОАО «Каустик»]] |
||
| Строка 1456: | Строка 1476: | ||
|align="center"| [[Винилхлорид#Комбинированный метод на основе этилена и ацетилена|КМЭА]] |
|align="center"| [[Винилхлорид#Комбинированный метод на основе этилена и ацетилена|КМЭА]] |
||
|align="center"| 100,0<ref group="К">Ориентировочное значение, рассчитанное исходя из данных по фактическому выпуску винилхлорида и производственной мощности по выпуску ПВХ.</ref> |
|align="center"| 100,0<ref group="К">Ориентировочное значение, рассчитанное исходя из данных по фактическому выпуску винилхлорида и производственной мощности по выпуску ПВХ.</ref> |
||
|align="center"| 96,3<ref>{{cite web| author =| authorlink =| |
|align="center"| 96,3<ref>{{cite web| author =| authorlink =| date =| url =http://www.plastkard.ru/| title =Официальный сайт Открытого акционерного общества «Пласткард»| format =| work =| publisher =ОАО «Пласткард»| accessdate =2009-11-08| lang =| description =| archiveurl =https://web.archive.org/web/20110923144640/http://www.plastkard.ru/| archivedate =2011-09-23| deadlink =yes}}</ref> |
||
|- |
|- |
||
| [[Сибур|ОАО «Сибур-Нефтехим»]] (завод «Капролактам») |
| [[Сибур|ОАО «Сибур-Нефтехим»]] (завод «Капролактам») |
||
| [[Дзержинск (Россия)|г. Дзержинск]], [[Нижегородская область]] |
| [[Дзержинск (Россия)|г. Дзержинск]], [[Нижегородская область]] |
||
|align="center"| [[Винилхлорид#Сбалансированный по хлору метод на основе этилена|СХМЭ]] |
|align="center"| [[Винилхлорид#Сбалансированный по хлору метод на основе этилена|СХМЭ]] |
||
|align="center"| 90,0<ref name="sibur"> |
|align="center"| 90,0<ref name="sibur">{{книга |
||
{{книга |
|||
|автор = |
|автор = |
||
|заглавие = Годовой отчёт ОАО «Сибур-Нефтехим» за 2008 год |
|заглавие = Годовой отчёт ОАО «Сибур-Нефтехим» за 2008 год |
||
| Строка 1471: | Строка 1490: | ||
|год = 2009 |
|год = 2009 |
||
|том = |
|том = |
||
|страниц = 58 |
|страниц = 58 |
||
|страницы = |
|страницы = |
||
|isbn = |
|isbn = |
||
|archivedate = 2012-01-06 |
|||
|archiveurl = https://web.archive.org/web/20120106064855/http://www.sibur-nn.ru/?id=803 |
|||
}}</ref> |
}}</ref> |
||
|align="center"| 78,5<ref name="sibur" /> |
|align="center"| 78,5<ref name="sibur" /> |
||
| Строка 1490: | Строка 1511: | ||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = |
||
|url = http://www.vocco.ru/images/stories/god_ot08.zip |
|url = http://www.vocco.ru/images/stories/god_ot08.zip |
||
|title = Годовой отчёт за 2008 год Волгоградского открытого акционерного общества «Химпром» |
|title = Годовой отчёт за 2008 год Волгоградского открытого акционерного общества «Химпром» |
||
| Строка 1515: | Строка 1536: | ||
|} |
|} |
||
В сентябре 2014 года компанией ООО «[[Русвинил|РусВинил]]» было осуществлено торжественное открытие нового комплекса по производству ПВХ (включая и производство винилхлорида) в [[Кстовский район Нижегородской области|Кстовском районе Нижегородской области]] мощностью 330 тыс. тонн в год<ref>{{cite web|url=http://rusvinyl.ru/ru/44/?nid=103&a=entry.show|title=В присутствии Президента РФ состоялось торжественное открытие производственного комплекса «РусВинил»|author=|authorlink=|work=|description=|date=|format=|publisher=rusvinyl.ru|lang=ru|accessdate=2018-04-05|archiveurl=https://web.archive.org/web/20180405214443/http://rusvinyl.ru/ru/44/?nid=103&a=entry.show|archivedate=2018-04-05|deadlink=no}}</ref>. Учредителями совместного предприятия стали компания «[[Сибур]]» и бельгийская компания [[SolVin]] — совместная дочерняя компания международной химико-фармацевтической группы [[Solvay]] и немецкого концерна [[BASF]]<ref>{{cite web| author =| authorlink =| date =2009-06-24| url =http://www.r52.ru/index.phtml?rid=12&fid=10&sid=6&nid=32203| title =Нижегородское правительство, Администрация Кстовского района и «Русвинил» 24 июня заключат соглашение о сотрудничестве| format =| work =| publisher =Р52.РУ| accessdate =2009-11-08| lang =| description =| archiveurl =https://web.archive.org/web/20110809075014/http://www.r52.ru/index.phtml?rid=12| archivedate =2011-08-09| deadlink =yes}}</ref>. |
|||
=== Производство винилхлорида на Украине === |
=== Производство винилхлорида на Украине === |
||
По состоянию на 2018 год, единственным действующим производителем винилхлорида на [[Украина|Украине]] является ООО «Карпатнефтехим» ([[Калуш|г. Калуш]]), входящий до февраля 2017 года в состав российской группы [[Лукойл]]<ref group="К">По данным издательства "Коммерсантъ" по состоянию на 01.01.2018 актив принадлежит украинским предпринимателям: Ильхаму Мамедову через Xedrian Holding Ltd (Кипр) и Techinservice Limited (Великобритания) Игорю Щуцкому.</ref>. Производство осуществляется прямым хлорированием этилена; мощность производства — 370 тыс. тонн в год<ref>{{cite web| author =| authorlink =| |
По состоянию на 2018 год, единственным действующим производителем винилхлорида на [[Украина|Украине]] является ООО «Карпатнефтехим» ([[Калуш|г. Калуш]]), входящий до февраля 2017 года в состав российской группы [[Лукойл]]<ref group="К">По данным издательства "Коммерсантъ" по состоянию на 01.01.2018 актив принадлежит украинским предпринимателям: Ильхаму Мамедову через Xedrian Holding Ltd (Кипр) и Techinservice Limited (Великобритания) Игорю Щуцкому.</ref>. Производство осуществляется прямым хлорированием этилена; мощность производства — 370 тыс. тонн в год<ref>{{cite web| author =| authorlink =| date =| url =http://www.lukoil.ru/static.asp?id=91| title =ООО «Карпатнефтехим» (ЗАО «ЛУКОР»)| format =| work =| publisher =ОАО «Лукойл»| accessdate =2009-11-08| lang =| description =| archiveurl =https://web.archive.org/web/20070608100615/http://www.lukoil.ru/static.asp?id=91| archivedate =2007-06-08| deadlink =yes}}</ref>. |
||
== Применение == |
== Применение == |
||
Более 99 % всего производимого в мире винилхлорида (в 2020 году) было использовано для дальнейшего производства [[поливинилхлорид|ПВХ]]<ref>{{cite web| author =| authorlink =| date =| url =https://ihsmarkit.com/products/vinyl-chloride-monomer-chemical-economics-handbook.html| title =Vinyl Chloride Monomer (VCM) Uses and Market Data| format =| work =| publisher =ICIS.com| accessdate =2022-06-28| lang =en| description =| archiveurl =https://web.archive.org/web/20220707011425/https://ihsmarkit.com/products/vinyl-chloride-monomer-chemical-economics-handbook.html| archivedate =2022-07-07| deadlink =no}}</ref>. |
|||
Более половины мирового производства ПВХ (57 % по состоянию на 2009 год) сосредоточено в Азии, причём 20 % в Китае<ref name="deloitte" />. |
|||
=== Производство поливинилхлорида === |
|||
Крупнейшим потребителем винилхлорида в мире является [[Химическая промышленность КНР|Китай]]: около 30 % всего мирового производства; на втором месте США и Канада, приблизительно с 20 % (по состоянию на 2008 год)<ref name="linak" />. |
|||
В 2020 году более 99 % всего производимого в мире винилхлорида было использовано для дальнейшего производства [[поливинилхлорид|ПВХ]]<ref>{{cite web| author =| authorlink =| datepublished =| url =https://ihsmarkit.com/products/vinyl-chloride-monomer-chemical-economics-handbook.html| title =Vinyl Chloride Monomer (VCM) Uses and Market Data| format =| work =| publisher =ICIS.com| accessdate =2022-06-28| lang =en| description =| archiveurl =| archivedate =}}</ref>. В 2021 году мировые мощности по производству поливинилхлорида (ПВХ) составляли 60,27 млн тонн в год.<ref name="globaldata">{{cite web |
|||
|author = |
|||
|authorlink = |
|||
|datepublished = 2022-05-10 |
|||
|url = https://www.globaldata.com/store/report/polyvinyl-chloride-market-analysis/ |
|||
|title = Polyvinyl Chloride Industry Installed Capacity and Capital Expenditure (CapEx) Forecast by Region and Countries including details of All Active Plants, Planned and Announced Projects, 2022-2026 |
|||
|format = |
|||
|work = Petrochemicals |
|||
|publisher = GlobalData |
|||
|accessdate = 2022-06-28 |
|||
|lang = en |
|||
|description = |
|||
|archiveurl = |
|||
|archivedate = |
|||
}}</ref> |
|||
В [[2009 год]]у совокупные глобальные мощности по выпуску поливинилхлорида составляли около 48 млн тонн, а его мировое производство и потребление − 29,92 млн тонн, что соответствует уровню загрузки 62 %<ref name="deloitte">{{cite web |
|||
|author = |
|||
|authorlink = |
|||
|datepublished = 2011 |
|||
|url = http://www.deloitte.com/assets/Dcom-Russia/Local%20Assets/Documents/Energy%20and%20Resources/dttl_PVC-markets-of-Europe-and-South-EastAsia_RU.pdf |
|||
|title = Анализ рентабельности и стоимости производства ПВХ в Европе и Юго-Восточной Азии |
|||
|format = pdf |
|||
|work = Консалтинг, Нефтегазовая практика, 2010 год |
|||
|publisher = Делойт и Туш Риджинал Консалтинг Сервисис Лимитед |
|||
|accessdate = 2013-02-03 |
|||
|lang = en |
|||
|description = |
|||
|archiveurl = https://www.webcitation.org/6EziMP93v?url=http://www.deloitte.com/assets/Dcom-Russia/Local%20Assets/Documents/Energy%20and%20Resources/dttl_PVC-markets-of-Europe-and-South-EastAsia_RU.pdf |
|||
|archivedate = 2013-03-09 |
|||
}}</ref>. |
|||
Крупнейшими компаниями в индустрии ПВХ по состоянию на 2021 год являются [[Shin-Etsu Chemical|Shin-Etsu Chemical Co Ltd]] (Япония), Westlake Corp (США), [[Formosa Plastics Group]] (Тайвань), Sinochem Holdings Corp Ltd (Китай), Hubei Yihua Group Co Ltd (Китай), Ineos Ltd (Великобритания), [[Occidental Petroleum|Occidental Petroleum Corp]] (США), Orbia Advance Corp SAB de CV (Мексика), LG Chem Ltd. (Южная Корея) и Shaanxi Coal and Chemical Industry Group Co Ltd.<ref name="globaldata"></ref> |
|||
Более половины мирового производства ПВХ (57 % по состоянию на [[2009 год]]) сосредоточено в Азии, причём 20 % в Китае<ref name="deloitte" />. Крупнейшими мировыми производителями поливинилхлорида в [[2001 год]]у были компании ''[[Shin-Etsu]]'' ([[Япония]]) — 2,75 млн тонн, ''[[Formosa Plastics]]'' ([[Тайвань (провинция Китайской Республики)|Тайвань]]) — 2,63 млн тонн и ''[[OxyVinyls]]'' ([[США]]) — 2,01 млн тонн<ref>{{книга |
|||
|автор = Pritchard G. |
|||
|заглавие = PVC — World Markets and Prospects |
|||
|ответственный = Rapra Market Report |
|||
|ссылка = |
|||
|место = |
|||
|издательство = Rapra Technology Limited |
|||
|год = 2002 |
|||
|том = |
|||
|pages = 5 |
|||
|allpages = |
|||
|isbn = 1-85957-311-8 |
|||
}}</ref>. В [[2011 год]]у производственные мощности крупнейших мировых производителей ПВХ составляли<ref>{{статья |
|||
| автор = Attenberger P. |
|||
| заглавие = Polyvinyl Chloride (PVC) |
|||
| ссылка = |
|||
| язык = en |
|||
| издание = Kunststoffe International |
|||
| тип = |
|||
| год = 2011 |
|||
| том = |
|||
| номер = 10 |
|||
| страницы = 7—10 |
|||
}}</ref>: |
|||
* ''[[Shin-Etsu]]'' ([[Япония]]) — 3,69 млн тонн; |
|||
* ''[[Formosa Plastics]]'' ([[Тайвань (провинция Китайской Республики)|Тайвань]]) — 3,30 млн тонн; |
|||
* ''[[Solvay]]'' ([[Бельгия]]) — 2,60 млн тонн; |
|||
* ''[[LG Chem]]'' ([[Южная Корея]]) — 2,31 млн тонн; |
|||
* ''[[Kerling]]'' ([[Великобритания]]) — 1,99 млн тонн. |
|||
Объём производства ПВХ в России в [[2008 год]]у составил 578,3 тыс. тонн (−1,4 % по отношению к [[2007 год]]у), суммарная мощность производства ПВХ составляет 635,8 тыс. тонн<ref name="kaustik">{{cite web| author =| authorlink =| datepublished =| url =http://www.kaus.ru/win/download/202/| title =Годовой отчёт Открытого Акционерного Общества «Каустик» за 2008 год| format =pdf| work =| publisher =ОАО «Каустик»| accessdate =2009-11-08| lang =| description =| archiveurl =https://www.webcitation.org/6164QZiw8?url=http://www.kaus.ru/win/download/202/| archivedate =2011-08-21}}</ref>. |
|||
В настоящий момент существуют четыре принципиально различных технологии полимеризации винилхлорида (перечислены в порядке убывания распространения)<ref name="kmpvc" />: |
В настоящий момент существуют четыре принципиально различных технологии полимеризации винилхлорида (перечислены в порядке убывания распространения)<ref name="kmpvc" />: |
||
| Строка 1622: | Строка 1580: | ||
==== Chisso PVC Process ==== |
==== Chisso PVC Process ==== |
||
[[Chisso|Корпорация |
[[Chisso|Корпорация Chisso]] — лидер японской полимерной промышленности — разработала современную технологию суспензионного производства поливинилхлорида: '''Chisso PVC Process'''. Особенности метода — получение высококачественного продукта с использованием безопасной и безвредной для окружающей среды технологии, низкие начальные [[инвестиция|инвестиции]] и низкие операционные издержки. |
||
Chisso PVC Process лицензирован на 19 предприятиях по всему миру, суммарная мощность — свыше '''1,5 млн тонн в год'''<ref>{{cite web| author =| authorlink =| |
Chisso PVC Process лицензирован на 19 предприятиях по всему миру, суммарная мощность — свыше '''1,5 млн тонн в год'''<ref>{{cite web| author =| authorlink =| date =| url =http://www.chisso.co.jp/english/international/pvc.html| title =Chisso PVC Process| format =| work =| publisher =Chisso Corporation| accessdate =2009-11-03| lang =en| description =| deadlink =404| archiveurl =https://web.archive.org/web/20080422020215/http://www.chisso.co.jp/english/international/pvc.html| archivedate =2008-04-22}}</ref>. |
||
==== Vinnolit Suspension PVC Process ==== |
==== Vinnolit Suspension PVC Process ==== |
||
Метод суспензионной полимеризации винилхлорида был изобретён и запатентован в [[1935 год]]у компанией |
Метод суспензионной полимеризации винилхлорида был изобретён и запатентован в [[1935 год]]у компанией [[Wacker Chemie|Wacker Chemie GmbH]], одним из прежних учредителей компании Vinnolit. После многократных усовершенствований '''Vinnolit Suspension PVC Process''' стал одним из современных и очень экономически эффективных процессов для производства поливинилхлорида во всём мире<ref name="vspvcp">{{cite web| author =| authorlink =| date =| url =http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_Suspension-PVC_Process| title =SUSPENSION-PVC Process| format =| work =VinTec Licensing Activities| publisher =Vinnolit GmbH & Co. KG| accessdate =2009-11-05| lang =en| description =| archiveurl =https://www.webcitation.org/6164R9OO5?url=http://www.vinnolit.de/vinnolit.nsf/id/DE_VinTec_Suspension-PVC_Process| archivedate =2011-08-21}}</ref>. |
||
Реакция полимеризации осуществляется периодическим способом в реакторах объёмом около 170 м³, при этом особенность конструкции позволяет эффективно удалять тепло из реакционной смеси без использования обратного холодильника или воды для охлаждения, тем самым обеспечивая высокую производительность. Кроме того, особенности технологии позволяют получить готовый продукт с минимальным содержанием непрореагировавшего винилхлорида без применения температурной дегазации, сохраняя тем самым структуру полимера<ref name="vspvcp" />. |
Реакция полимеризации осуществляется периодическим способом в реакторах объёмом около 170 м³, при этом особенность конструкции позволяет эффективно удалять тепло из реакционной смеси без использования обратного холодильника или воды для охлаждения, тем самым обеспечивая высокую производительность. Кроме того, особенности технологии позволяют получить готовый продукт с минимальным содержанием непрореагировавшего винилхлорида без применения температурной дегазации, сохраняя тем самым структуру полимера<ref name="vspvcp" />. |
||
| Строка 1652: | Строка 1610: | ||
: <chem>CH2=CHCl{} + Cl2{} + H2O -> CH2Cl-CHO{} + 2 HCl</chem> |
: <chem>CH2=CHCl{} + Cl2{} + H2O -> CH2Cl-CHO{} + 2 HCl</chem> |
||
До середины 1970-х годов винилхлорид использовался как хладагент, [[пропеллант]] для аэрозольных баллонов и компонент для некоторых видов косметики<ref>{{cite web | author = | authorlink = | |
До середины 1970-х годов винилхлорид использовался как хладагент, [[пропеллант]] для аэрозольных баллонов и компонент для некоторых видов косметики<ref>{{cite web | author = | authorlink = | date = | url = http://www.atsdr.cdc.gov/toxprofiles/phs20.html | title = Public Health Statement for Vinyl Chloride | format = | work = | publisher = Agency for Toxic Substances and Disease Registry (ATSDR) | accessdate = 2009-11-04 | lang = en | description = | archiveurl = https://www.webcitation.org/6164Rw2FB?url=http://www.atsdr.cdc.gov/toxprofiles/phs20.html | archivedate = 2011-08-21 }}</ref>. |
||
== Огне- и пожароопасность == |
== Огне- и пожароопасность == |
||
Вещество является чрезвычайно огнеопасным, его смеси с воздухом взрывоопасны; при горении выделяет раздражающие, токсичные и коррозионно-активные вещества<ref group="К">Основными продуктами горения винилхлорида являются [[диоксид углерода|углекислый]] и [[монооксид углерода|угарный газ]], а также [[хлороводород]].</ref><ref>{{cite web| author =| authorlink =| |
Вещество является чрезвычайно огнеопасным, его смеси с воздухом взрывоопасны; при горении выделяет раздражающие, токсичные и коррозионно-активные вещества<ref group="К">Основными продуктами горения винилхлорида являются [[диоксид углерода|углекислый]] и [[монооксид углерода|угарный газ]], а также [[хлороводород]].</ref><ref>{{cite web| author =| authorlink =| date =| url =http://www.safework.ru/ilo/ICSC/cards/view/?0082| title =Винилхлорид| format =| work =ICSC / Международные карты Химической Безопасности| publisher =Институт промышленной безопасности, охраны труда и социального партнерства| accessdate =2009-11-05| lang =en| description =| archive-date =2011-08-21| archive-url =https://archive.today/20110821061220/http://www.safework.ru/ilo/ICSC/cards/view/?0082| deadlink =no}}</ref>, среди которых, в частности, обнаруживается крайне ядовитый [[фосген]]<ref name="hrg">{{cite web| author =| authorlink =| date =| url =http://ull.chemistry.uakron.edu/erd/Chemicals/8000/7231.html| title =Vinyl chloride| format =| work =| publisher =Hardy Research Group, Department of Chemistry, The University of Akron| accessdate =2009-11-05| lang =en| description =| archiveurl =https://www.webcitation.org/6164THFxa?url=http://ull.chemistry.uakron.edu/erd/Chemicals/8000/7231.html| archivedate =2011-08-21}}</ref>. |
||
[[Температура вспышки]]: −78 °C<ref name="iuclid">{{cite web| author =| authorlink =| |
[[Температура вспышки]]: −78 °C<ref name="iuclid">{{cite web| author =| authorlink =| date =2000-02-19| url =http://ecb.jrc.ec.europa.eu/IUCLID-DataSheets/75014.pdf| title =IUCLID Dataset. Vinyl Chloride| format =pdf| work =| publisher =European Commission's Joint Research Centre| accessdate =2009-10-27| lang =| description =| deadlink =unknown-host}}{{Недоступная ссылка|date=2018-06|bot=InternetArchiveBot }}</ref>; [[температура самовоспламенения]]: 472 °С<ref name="pvc">{{книга |
||
|автор = Cowfer J.A. |
|автор = Cowfer J.A. |
||
|часть = Part 2. Vinyl Chloride Monomer |
|часть = Part 2. Vinyl Chloride Monomer |
||
| Строка 1702: | Строка 1660: | ||
== Физиологическое действие == |
== Физиологическое действие == |
||
Винилхлорид очень токсичен. Оказывает комплексное токсическое воздействие на организм человека, вызывая поражение [[центральная нервная система|ЦНС]], костной системы, системное поражение соединительной ткани, мозга, сердца. Поражает печень, вызывая ангиосаркому. Вызывает иммунные изменения и опухоли, оказывает [[канцероген]]ное, [[мутаген]]ное и [[тератоген]]ное действие<ref>{{cite web| author =| authorlink =| |
Винилхлорид очень токсичен. Оказывает комплексное токсическое воздействие на организм человека, вызывая поражение [[центральная нервная система|ЦНС]], костной системы, системное поражение соединительной ткани, мозга, сердца. Поражает печень, вызывая ангиосаркому. Вызывает иммунные изменения и опухоли, оказывает [[канцероген]]ное, [[мутаген]]ное и [[тератоген]]ное действие<ref>{{cite web| author =| authorlink =| date =| url =http://chemanalytica.com/book/novyy_spravochnik_khimika_i_tekhnologa/11_radioaktivnye_veshchestva_vrednye_veshchestva_gigienicheskie_normativy/5172| title =Хлорпроизводные непредельных алифатических углеводородов| format =| work =Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы| publisher =ChemAnalitica.com| accessdate =2009-11-05| lang =| description =| archive-date =2012-06-04| archive-url =https://web.archive.org/web/20120604115039/http://chemanalytica.com/book/novyy_spravochnik_khimika_i_tekhnologa/11_radioaktivnye_veshchestva_vrednye_veshchestva_gigienicheskie_normativy/5172| deadlink =no}}</ref>. |
||
Многие исследования сообщают, что воздействие винилхлорида на человека вызывает образование злокачественных новообразований в различных тканях и органах, включая печень (опухоли, помимо ангиосаркомы), мозг, лёгкие, [[Лимфатическая система|лимфатическую]] и гематопоэтическую систему (органы и ткани, вовлечённые в кровообразование)<ref>{{книга|автор=|часть=|заглавие=Overall Evaluations of Carcinogenicity: An Updating of IARC Monographs, Volumes 1 to 42, Supplement 7|оригинал=|ссылка= |
Многие исследования сообщают, что воздействие винилхлорида на человека вызывает образование злокачественных новообразований в различных тканях и органах, включая печень (опухоли, помимо ангиосаркомы), мозг, лёгкие, [[Лимфатическая система|лимфатическую]] и гематопоэтическую систему (органы и ткани, вовлечённые в кровообразование)<ref>{{книга|автор=|часть=|заглавие=Overall Evaluations of Carcinogenicity: An Updating of IARC Monographs, Volumes 1 to 42, Supplement 7|оригинал=|ссылка=http://monographs.iarc.fr/ENG/Monographs/suppl7/suppl7.pdf|ответственный=|издание=|место=Lyon|издательство=lnternational Agency for Research on Cancer|год=1987|том=|pages=373—376|allpages=|серия=|isbn=92-832-1411-0|тираж=|archivedate=2008-03-06|archiveurl=https://web.archive.org/web/20080306134819/http://monographs.iarc.fr/ENG/Monographs/suppl7/suppl7.pdf}} {{Cite web |url=http://monographs.iarc.fr/ENG/Monographs/suppl7/Suppl7.pdf |title=Архивированная копия |access-date=2009-11-13 |archive-date=2008-03-06 |archive-url=https://web.archive.org/web/20080306134819/http://monographs.iarc.fr/ENG/Monographs/suppl7/Suppl7.pdf |deadlink=unfit }}</ref>. При этом употребление [[этанол]]а только усиливает канцерогенный эффект винилхлорида<ref>{{cite web |
||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = |
||
|url = http://ntp.niehs.nih.gov/ntp/roc/eleventh/profiles/s186viny.pdf |
|url = http://ntp.niehs.nih.gov/ntp/roc/eleventh/profiles/s186viny.pdf |
||
|title = Vinyl Chloride CAS No. 75-01-4 |
|title = Vinyl Chloride CAS No. 75-01-4 |
||
| Строка 1720: | Строка 1678: | ||
}}</ref>. |
}}</ref>. |
||
Хроническая [[интоксикация]] винилхлоридом носит название «винилхлоридной болезни»<ref>{{cite web| author =| authorlink =| |
Хроническая [[интоксикация]] винилхлоридом носит название «винилхлоридной болезни»<ref>{{cite web| author =| authorlink =| date =| url =http://www.med-site.net/article5244911.html| title =Винилхлорид| format =| work =Отравления профессиональные| publisher =Медицинский портал MedSite| accessdate =2009-11-02| lang =| description =| archive-date =2008-12-05| archive-url =https://web.archive.org/web/20081205055243/http://www.med-site.net/article5244911.html| deadlink =no}}</ref>. |
||
Физиологическое воздействие винилхлорида на людей имеет преимущественно ингаляционный характер, причём его опасная концентрация в воздухе (1 часть на миллион<ref group="К">Речь идёт о предельно допустимой концентрации винилхлорида в рабочей зоне при длительном воздействии (TLV-TWA) — нормативе, принятом в США.</ref>) ниже предела его обнаружения человеком посредством [[обоняние|обоняния]] (3000 частей на миллион)<ref name="mmg" />. Концентрация в размере 8000 частей на миллион вызывает головокружение, а при уровне 20000 частей на миллион появляется сонливость, потеря координации, визуальные и слуховые отклонения, дезориентация, тошнота, головная боль, синдром жжения конечностей<ref name="mmg" />. Продолжительное воздействие более высоких концентраций винилхлорида может вызвать смерть из-за [[паралич]]а центральной нервной системы и остановки дыхания<ref name="mmg" />. |
Физиологическое воздействие винилхлорида на людей имеет преимущественно ингаляционный характер, причём его опасная концентрация в воздухе (1 часть на миллион<ref group="К">Речь идёт о предельно допустимой концентрации винилхлорида в рабочей зоне при длительном воздействии (TLV-TWA) — нормативе, принятом в США.</ref>) ниже предела его обнаружения человеком посредством [[обоняние|обоняния]] (3000 частей на миллион)<ref name="mmg" />. Концентрация в размере 8000 частей на миллион вызывает головокружение, а при уровне 20000 частей на миллион появляется сонливость, потеря координации, визуальные и слуховые отклонения, дезориентация, тошнота, головная боль, синдром жжения конечностей<ref name="mmg" />. Продолжительное воздействие более высоких концентраций винилхлорида может вызвать смерть из-за [[паралич]]а центральной нервной системы и остановки дыхания<ref name="mmg" />. Газ тяжелее воздуха и может вызвать удушье в плохо проветриваемых или замкнутых помещениях<ref name="mmg" />. |
||
В организме человека винилхлорид биотрансформируется преимущественно [[ферменты|ферментами]] печени, при этом основным его [[метаболит]]ом, выводящимся с мочой, является [[тиодигликолевая кислота]]<ref name="inchem">{{cite web| author =| authorlink =| |
В организме человека винилхлорид биотрансформируется преимущественно [[ферменты|ферментами]] печени, при этом основным его [[метаболит]]ом, выводящимся с мочой, является [[тиодигликолевая кислота]]<ref name="inchem">{{cite web| author =| authorlink =| date =| url =http://www.inchem.org/documents/pims/chemical/pim558.htm| title =Vinyl chloride| format =| work =| publisher =International Programme on Chemical Safety (IPCS)| accessdate =2009-10-26| lang =en| description =| archiveurl =https://www.webcitation.org/6164VQYy5?url=http://www.inchem.org/documents/pims/chemical/pim558.htm| archivedate =2011-08-21}}</ref>. |
||
Метаболический путь винилхлорида в организме человека представлен на рисунке<ref>{{статья |
Метаболический путь винилхлорида в организме человека представлен на рисунке<ref>{{статья |
||
| Строка 1737: | Строка 1695: | ||
|номер = 4 |
|номер = 4 |
||
|страницы = 299—316 |
|страницы = 299—316 |
||
}}{{Недоступная ссылка|date= |
}}{{Недоступная ссылка|date=2018-09|bot=InternetArchiveBot }}</ref>: |
||
[[Файл:Metabolism-vc.png|600 px|center|Метаболический путь винилхлорида в организме человека.]] |
[[Файл:Metabolism-vc.png|600 px|center|Метаболический путь винилхлорида в организме человека.]] |
||
| Строка 1743: | Строка 1701: | ||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = 2006-12 |
||
|url = http://www.chem.unep.ch/irptc/sids/OECDSIDS/VINYLCHL.pdf |
|url = http://www.chem.unep.ch/irptc/sids/OECDSIDS/VINYLCHL.pdf |
||
|title = Vinyl Chloride |
|title = Vinyl Chloride |
||
| Строка 1763: | Строка 1721: | ||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = |
||
|url = http://www.atsdr.cdc.gov/toxguides/toxguide-20.pdf |
|url = http://www.atsdr.cdc.gov/toxguides/toxguide-20.pdf |
||
|title = ToxGuide<sup>TM</sup> for Vinyl Chloride |
|title = ToxGuide<sup>TM</sup> for Vinyl Chloride |
||
| Строка 1807: | Строка 1765: | ||
Основные гигиенические нормативы для винилхлорида: |
Основные гигиенические нормативы для винилхлорида: |
||
[[Россия]]<ref>{{cite web| author =| authorlink =| |
[[Россия]]<ref>{{cite web| author =| authorlink =| date =| url =http://chemanalytica.com/book/novyy_spravochnik_khimika_i_tekhnologa/11_radioaktivnye_veshchestva_vrednye_veshchestva_gigienicheskie_normativy/5023| title =Гигиенические нормативы (ПДК, ОБУВ, ОДУ) химических веществ в воздухе рабочей зоны, атмосферном воздухе населенных мест, воде водоемов| format =| work =Новый справочник химика и технолога. Вредные химические вещества. Радиоактивные вещества. Гигиенические нормативы| publisher =ChemAnalitica.com| accessdate =2009-09-21| lang =| description =| archive-date =2014-08-20| archive-url =https://web.archive.org/web/20140820080501/http://chemanalytica.com/book/novyy_spravochnik_khimika_i_tekhnologa/11_radioaktivnye_veshchestva_vrednye_veshchestva_gigienicheskie_normativy/5023| deadlink =no}}</ref>: |
||
* [[ПДК]] максимально разовая в воздухе рабочей зоны: 5 мг/м³; |
* [[ПДК]] максимально разовая в воздухе рабочей зоны: 5 мг/м³; |
||
* ПДК среднесменная в воздухе рабочей зоны |
* ПДК среднесменная в воздухе рабочей зоны:1 мг/м³; |
||
* [[класс опасности]] для рабочей зоны: 1 (чрезвычайно опасное); |
* [[класс опасности]] для рабочей зоны: 1 (чрезвычайно опасное); |
||
* особенность токсического действия на организм: K ([[канцероген]]); |
* особенность токсического действия на организм: K ([[канцероген]]); |
||
* ПДК среднесуточная в атмосферном воздухе населённых мест = 0,01 мг/м³; |
* ПДК среднесуточная в атмосферном воздухе населённых мест = 0,01 мг/м³; |
||
* класс опасности для населённых пунктов: 1 (чрезвычайно опасное); |
* класс опасности для населённых пунктов: 1 (чрезвычайно опасное); |
||
* лимитирующий показатель воздействия: резорбтивный |
* лимитирующий показатель воздействия: резорбтивный; |
||
* ПДК в воде = 0,005 мг/м³ |
* ПДК в воде = 0,005 мг/м³. |
||
[[Великобритания]]: |
[[Великобритания]]: |
||
* предельно допустимая концентрация (''Maximum Exposure Limits, MEL'')<ref group="К">Определяется исходя из однократного воздействия в течение 8 часов.</ref>: 7 [[Миллионная доля|ppm]]<ref>{{cite web| author =| authorlink =| |
* предельно допустимая концентрация (''Maximum Exposure Limits, MEL'')<ref group="К">Определяется исходя из однократного воздействия в течение 8 часов.</ref>: 7 [[Миллионная доля|ppm]]<ref>{{cite web| author =| authorlink =| date =| url =http://msds.chem.ox.ac.uk/mels.html| title =Maximum Exposure Limits| format =| work =| publisher =The Physical and Theoretical Chemistry Laboratory Oxford University| accessdate =2009-10-26| lang =en| description =| archiveurl =https://www.webcitation.org/6164WrDN3?url=http://msds.chem.ox.ac.uk/mels.html| archivedate =2011-08-21}}</ref>. |
||
[[США]]: |
[[США]]: |
||
* предельно допустимая концентрация в рабочей зоне при длительном воздействии (''[[:en:TLV|Threshold Limit Value — Time Weighted Average, TLV-TWA]]'')<ref group="К">Определяется исходя из постоянного воздействия в течение 8-часового рабочего дня, 40 часов в неделю.</ref>: 1 ppm<ref name="airliquide">{{cite web |
* предельно допустимая концентрация в рабочей зоне при длительном воздействии (''[[:en:TLV|Threshold Limit Value — Time Weighted Average, TLV-TWA]]'')<ref group="К">Определяется исходя из постоянного воздействия в течение 8-часового рабочего дня, 40 часов в неделю.</ref>: 1 ppm<ref name="airliquide">{{cite web |
||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = |
||
|url = http://encyclopedia.airliquide.com/sds/en/125_AL_EN.pdf |
|url = http://encyclopedia.airliquide.com/sds/en/125_AL_EN.pdf |
||
|title = Safety Data Sheet. Vinyl Chloride |
|title = Safety Data Sheet. Vinyl Chloride |
||
| Строка 1840: | Строка 1798: | ||
|author = |
|author = |
||
|authorlink = |
|authorlink = |
||
| |
|date = 2008-12 |
||
|url = http://www.atsdr.cdc.gov/mrls/pdfs/atsdr_mrls_december_2008.pdf |
|url = http://www.atsdr.cdc.gov/mrls/pdfs/atsdr_mrls_december_2008.pdf |
||
|title = Minimal Risk Levels (MRLs) |
|title = Minimal Risk Levels (MRLs) |
||
| Строка 1857: | Строка 1815: | ||
== Обращение, хранение и транспортировка == |
== Обращение, хранение и транспортировка == |
||
Винилхлорид хранится вдали от источников тепла и огня в жидком виде при температуре −14…22 °C в больших сферических металлических [[заземление|заземлённых]] ёмкостях с небольшой добавкой стабилизатора (например, [[гидрохинон]]). Ёмкости должны быть оснащены самозапорными клапанами, устройствами контроля давления и искрогасителями. Контейнер с веществом должен находиться в хорошо проветриваемых условиях при внешней температуре ниже 50 °C. Необходимо избегать контакта с [[медь]]ю, любыми источниками огня или тепла, [[окислители|окислителями]], [[гидроксид натрия|каустической содой]] и активными металлами. Стабилизированный хлористый винил транспортируется в жидком виде в охлаждаемых стальных цистернах, которые предварительно должны быть тщательно высушены и продуты [[азот]]ом<ref name="airliquide" /><ref>{{cite web| author =| authorlink =| |
Винилхлорид хранится вдали от источников тепла и огня в жидком виде при температуре −14…22 °C в больших сферических металлических [[заземление|заземлённых]] ёмкостях с небольшой добавкой стабилизатора (например, [[гидрохинон]]). Ёмкости должны быть оснащены самозапорными клапанами, устройствами контроля давления и искрогасителями. Контейнер с веществом должен находиться в хорошо проветриваемых условиях при внешней температуре ниже 50 °C. Необходимо избегать контакта с [[медь]]ю, любыми источниками огня или тепла, [[окислители|окислителями]], [[гидроксид натрия|каустической содой]] и активными металлами. Стабилизированный хлористый винил транспортируется в жидком виде в охлаждаемых стальных цистернах, которые предварительно должны быть тщательно высушены и продуты [[азот]]ом<ref name="airliquide" /><ref>{{cite web| author =| authorlink =| date =| url =http://www.sabic.com/me/en/productsandservices/chemicals/vcm.aspx| title =VCM (Vinyl Chloride Monomer)| format =| work =Chemicals| publisher =Saudi Basic Industries Corporation (SABIC)| accessdate =2009-12-07| lang =en| description =| archiveurl =https://www.webcitation.org/6164Xj6DI?url=http://www.sabic.com/me/en/productsandservices/chemicals/vcm.aspx| archivedate =2011-08-21}}</ref>. |
||
=== Авария в Огайо === |
|||
{{main|Крушение поезда в Огайо (2023)}} |
|||
[[Файл:2023 Ohio train derailment.jpg |thumb |При горении винилхлорида образуется [[фосген]].]] |
|||
3 февраля 2023 в США близ города [[Ист-Палестайн]] в штате [[Огайо]] сошёл с рельсов поезд, перевозивший винилхлорид. Компания Norfolk Southern, которой принадлежали химикаты, была вынуждена сжечь содержимое цистерн, итогом мероприятия стали гигантское грибовидное облако над штатом, гибель животных и отравление воды в реке [[Огайо (река)|Огайо]]<ref>[https://rg.ru/2023/02/15/krushenie-poezda-s-himikatami-v-ogajo-pochemu-amerikanskie-smi-s-opozdaniem-zametili-ekologicheskuiu-katastrofu.html Крушение поезда с химикатами в Огайо: почему американские СМИ с опозданием заметили экологическую катастрофу] {{Wayback|url=https://rg.ru/2023/02/15/krushenie-poezda-s-himikatami-v-ogajo-pochemu-amerikanskie-smi-s-opozdaniem-zametili-ekologicheskuiu-katastrofu.html |date=20230215095557 }} // Российская газета</ref><ref>[https://iz.ru/1471800/andrei-kuzmak/oblako-v-sharakh-ot-katastrofy-v-ogaio-popytalis-otvlech-kitaiskim-zondom Облако в шарах: от катастрофы в Огайо попытались отвлечь китайским зондом. Белый дом обвиняют в попытке манипулировать американским обществом] {{Wayback|url=https://iz.ru/1471800/andrei-kuzmak/oblako-v-sharakh-ot-katastrofy-v-ogaio-popytalis-otvlech-kitaiskim-zondom |date=20230217225922 }} // [[Известия]], 18 февраля 2023</ref>. |
|||
== См. также == |
== См. также == |
||
| Строка 1870: | Строка 1833: | ||
== Использованная литература и источники == |
== Использованная литература и источники == |
||
{{примечания|2 |
{{примечания|2|refs= |
||
<ref name="kaustik">{{cite web| author =| authorlink =| date =| url =http://www.kaus.ru/win/download/202/| title =Годовой отчёт Открытого Акционерного Общества «Каустик» за 2008 год| format =pdf| work =| publisher =ОАО «Каустик»| accessdate =2009-11-08| lang =| description =| archiveurl =https://www.webcitation.org/6164QZiw8?url=http://www.kaus.ru/win/download/202/| archivedate =2011-08-21}}</ref> |
|||
<ref name="deloitte">{{cite web |
|||
|author = |
|||
|authorlink = |
|||
|date = 2011 |
|||
|url = http://www.deloitte.com/assets/Dcom-Russia/Local%20Assets/Documents/Energy%20and%20Resources/dttl_PVC-markets-of-Europe-and-South-EastAsia_RU.pdf |
|||
|title = Анализ рентабельности и стоимости производства ПВХ в Европе и Юго-Восточной Азии |
|||
|format = pdf |
|||
|work = Консалтинг, Нефтегазовая практика, 2010 год |
|||
|publisher = Делойт и Туш Риджинал Консалтинг Сервисис Лимитед |
|||
|accessdate = 2013-02-03 |
|||
|lang = en |
|||
|description = |
|||
|archiveurl = https://www.webcitation.org/6EziMP93v?url=http://www.deloitte.com/assets/Dcom-Russia/Local%20Assets/Documents/Energy%20and%20Resources/dttl_PVC-markets-of-Europe-and-South-EastAsia_RU.pdf |
|||
|archivedate = 2013-03-09 |
|||
}}</ref> |
|||
}} |
|||
== Литература и прочие внешние источники == |
== Литература и прочие внешние источники == |
||
| Строка 2072: | Строка 2055: | ||
| автор = Barrio-Lage G. A., Parsons F. Z., Narbaitz R. M., Lorenzo P. A., Archer H. E. |
| автор = Barrio-Lage G. A., Parsons F. Z., Narbaitz R. M., Lorenzo P. A., Archer H. E. |
||
| заглавие = Enhanced Anaerobic Biodegradation Iof Vintyl Chloride in Ground Water |
| заглавие = Enhanced Anaerobic Biodegradation Iof Vintyl Chloride in Ground Water |
||
| ссылка = |
| ссылка = https://archive.org/details/sim_environmental-toxicology-and-chemistry_1990_9_4/page/403 |
||
| язык = en |
| язык = en |
||
| издание = Environmental Toxicology and Chemistry |
| издание = Environmental Toxicology and Chemistry |
||
| Строка 2128: | Строка 2111: | ||
|номер = 4 |
|номер = 4 |
||
|страницы = 299—316 |
|страницы = 299—316 |
||
}}{{Недоступная ссылка|date= |
}}{{Недоступная ссылка|date=2018-09|bot=InternetArchiveBot }} |
||
:# {{статья |
:# {{статья |
||
| автор = Hartmans S., De Bont J. A. |
| автор = Hartmans S., De Bont J. A. |
||
| Строка 2141: | Строка 2124: | ||
| страницы = 3878—3880 |
| страницы = 3878—3880 |
||
}} |
}} |
||
:# {{cite web| author =| authorlink =| |
:# {{cite web| author =| authorlink =| date =2000-02-19| url =http://ecb.jrc.ec.europa.eu/IUCLID-DataSheets/75014.pdf| title =IUCLID Dataset. Vinyl Chloride| format =pdf| work =| publisher =European Commission's Joint Research Centre| accessdate =2009-10-27| lang =en| description =| deadlink =unknown-host}}{{Недоступная ссылка|date=2018-06|bot=InternetArchiveBot }} |
||
:# {{статья |
:# {{статья |
||
| автор = Plugge H., Safe S. |
| автор = Plugge H., Safe S. |
||
| заглавие = Vinyl chloride metabolism — A review |
| заглавие = Vinyl chloride metabolism — A review |
||
| ссылка = |
| ссылка = https://archive.org/details/sim_chemosphere_1977_6/page/309 |
||
| язык = en |
| язык = en |
||
| издание = Chemosphere |
| издание = Chemosphere |
||
Текущая версия от 21:39, 18 ноября 2024
| Винилхлорид | |||
|---|---|---|---|
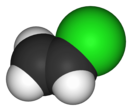 | |||
| Общие | |||
| Систематическое наименование |
хлорэтилен | ||
| Традиционные названия | винилхлорид, хлористый винил | ||
| Хим. формула | CH2=CHCl | ||
| Рац. формула | C2H3Cl | ||
| Физические свойства | |||
| Состояние | бесцветный газ | ||
| Молярная масса | 62,498 г/моль | ||
| Плотность | 0,9106 (при 20 °C) [1]; 0,9730 (при −15 °C)[2] | ||
| Энергия ионизации | 9,99 ± 0 эВ[5][6] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −153,8 °C[2] | ||
| • кипения | −13,8[2] °C | ||
| Пределы взрываемости | 3,6 ± 0,1 об.%[5] | ||
| Критическая точка | 158,4 °C; 5,34 МПа[3] | ||
| Мол. теплоёмк. | 0,858 (25 °C)[3] Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −37,26[3] кДж/моль | ||
| Давление пара | 337 кПа (20 °C)[3] | ||
| Оптические свойства | |||
| Показатель преломления | 1,3700 (при 20 °C)[1] | ||
| Структура | |||
| Дипольный момент | 1,44[4] | ||
| Классификация | |||
| Рег. номер CAS | 75-01-4 | ||
| PubChem | 6338 | ||
| Рег. номер EINECS | 200-831-0 | ||
| SMILES | |||
| InChI | |||
| RTECS | KU9625000 | ||
| ChEBI | 28509 | ||
| ChemSpider | 6098 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Винилхлори́д (хло́ристый вини́л, хлорвини́л, хлорэтиле́н, хлорэте́н, этиленхлори́д) — органическое вещество; бесцветный газ со слабым сладковатым запахом, имеющий формулу C2H3Cl и представляющий собой простейшее хлорпроизводное этилена. Вещество является чрезвычайно огне- и взрывоопасным, выделяя при горении токсичные вещества: угарный газ, хлороводород, фосген[7]. Винилхлорид — сильный яд, оказывающий на человека канцерогенное, мутагенное и тератогенное действие.
Промышленное производство винилхлорида входит в первую десятку производства крупнейших многотоннажных продуктов основного органического синтеза; при этом почти весь производимый объём используется для дальнейшего синтеза поливинилхлорида (ПВХ), мономером которого и является винилхлорид.
По мнению издания The 100 Most Important Chemical Compounds (Greenwood Press, 2007)[8], винилхлорид входит в сотню самых важных химических соединений.
История открытия
[править | править код]Впервые винилхлорид был получен профессором химии Гиссенского университета Юстусом Либихом в 1830-х годах действием на дихлорэтан спиртового раствора гидроксида калия[9]:
Ученик Либиха, французский химик Анри Виктор Реньо, в 1835 году подтвердил открытие Либиха, впервые опубликовав об этом статью в издании Annales de chimie et de physique[9]. Он же впервые обнаружил, что под действием света вещество превращается в белый порошок. Однако приоритет изобретения поливинилхлорида признаю́т за немецким химиком Эугеном Бауманном, который в 1872 году открыл и описал процесс фотополимеризации винилхлорида[10].
Первое упоминание соединения «винилхлорид» было сделано немецким химиком Кольбе в 1854 году[11].
В 1912 году немецкий химик Фриц Клатте (нем. Fritz Klatte) получил винилхлорид по реакции ацетилена с хлороводородом[12]:
Компания Greisheim Electron, где работал учёный, запатентовала в Германии этот метод и материал, получавшийся в результате полимеризации, однако не смогла найти ему практическое применение. Только в 1933 году после исследований американского учёного Уолдо Симона (англ. Waldo Semon) (1926 год) компанией B.F. Goodrich был получен патент[13] и разработано первое промышленное производство винилхлорида[9]. К 1939 году началось коммерческое производство винилхлорида с целью выпуска ПВХ для военных нужд[11].
До середины XIX века учёные ошибочно считали, что структура винилхлорида описывается формулой C4H3Cl (этилену приписывалась формула C4H4)[14]. Только после работ Эмиля Эрленмейера (1862 год), предположившего наличие в этилене двойной связи, учёные пришли к современному представлению о строении винилхлорида.
Из русских учёных исследованием полимеризации винилхлорида и возможностей его коммерческого использования занимался Иван Остромысленский (начало XX века)[15].
Строение молекулы
[править | править код]
В молекуле винилхлорида связь C−Cl более короткая и более прочная, чем аналогичная связь в молекуле хлорэтана, что связано с p,π–сопряжением π-орбиталей кратной связи с неподелённой электронной парой атома хлора[16].
В таблице представлены сравнительные значения длин и энергии связей (C−Hal)[17], а также дипольных моментов в молекуле винилхлорида и некоторых хлоралканов:
| Соединение | Энергия связи C−Cl, кДж/моль[18] |
Длина связи C−Cl, нм[16] | Дипольный момент [молекулы], 10−30 Кл·м[4] |
|---|---|---|---|
| CH2=CHCl | 374,89 | 0,169 | 4,80 |
| CH3−CH2Cl | 336,39 | 0,179 | 6,66 |
| CH3Cl | 349,78 | 0,176 | 6,19 |
Смещение электронной плотности в молекуле винилхлорида от атома хлора в сторону двойной связи, благодаря эффекту сопряжения (+M-эффект), действует одновременно с сильным электроноакцепторным индуктивным эффектом атома хлора (−I-эффект), однако влияние последнего сильнее (−I > +M), поэтому галоген несёт на себе небольшой отрицательный заряд (см. рисунок)[19].
Физические свойства
[править | править код]Винилхлорид при нормальных условиях представляет собой бесцветный газ со слабым сладковатым запахом, напоминающим запах хлороформа[2]. Порог ощущения запаха в воздухе составляет приблизительно 3000 частей на миллион[20]. Малорастворим в воде (около 0,95 масс.% при 15—85 °С[21]), легко растворим в спирте, хлороформе и дихлорэтане, растворим в диэтиловом эфире[1].
Некоторые физические константы винилхлорида[3]:
- температура кипения: −13,8 °C;
- температура плавления: −153,8 °C[К 1];
- относительная плотность при −20 °C[К 2]: 0,983;
- относительная плотность при 20 °C: 0,911 (жидкость);
- плотность по воздуху: 2,17;
- показатель преломления при 10 °C: 1,4046;
- критическая температура: 158,4 °C;
- критическое давление: 5,34 МПа;
- критическая плотность: 0,370 г/см³;
- вязкость жидкости при −40 °C: 0,334 мПа·с;
- вязкость газа при 20 °C: 10,71 мкПа·с;
- поверхностное натяжение при −20 °C: 22,3 мН/м;
- теплоёмкость жидкости при −20 °C: 1,146 кДж/(кг·К);
- теплоёмкость газа при 25 °C: 0,858 кДж/(кг·К);
- теплопроводность жидкости при 20 °C: 0,138 Вт/(м·К);
- стандартная энтальпия образования, ΔH°298: −37,26 кДж/моль;
- стандартная энтропия образования, S°298: 263,98 Дж/(моль·K);
- теплота испарения при температуре кипения, ΔHисп.: 332,7 кДж/кг;
- теплота сгорания, ΔH°сгор.: −1198,1 кДж/моль.
Согласно исследованиям американских учёных[22], плотность винилхлорида в диапазоне температур от точки кипения до 60 °C с точностью 0,1 % выражается следующим уравнением
где d — плотность, г/см³; t — температура, °С.
Ими же была получена зависимость, связывающая упругость пара винилхлорида с температурой:
где p — давление, атм; T — температура, K.
Химические свойства
[править | править код]Винилхлорид — активное химическое соединение, чьи химические свойства определяются как наличием двойной связи, так и атома хлора.
Подобно алкенам, винилхлорид вступает в реакции присоединения по кратной связи, при этом атом хлора выступает в роли электронакцепторного заместителя, тем самым снижая реакционную способность соединения в реакциях электрофильного присоединения и повышая реакционную способность соединения в реакциях нуклеофильного присоединения.
Атом хлора в винилхлориде очень инертен, что связано с влиянием двойной связи, поэтому реакции замещения, связанные с ним, для винилхлорида не характерны. В то же время именно это свойство позволяет относительно легко отщеплять от него молекулу хлороводорода.
Для химической промышленности первостепенное значение имеет реакция полимеризации винилхлорида, выступающая в качестве основного крупнотоннажного метода синтеза поливинилхлорида и его сополимеров.
Реакции присоединения по двойной связи
[править | править код]Хлористый винил легко реагирует с хлором как в жидкой, так и газовой фазе, образуя 1,1,2-трихлорэтан:
При этом реакция может иметь как ионный (катализатор FeCl3), так и радикальный характер (в присутствии инициаторов свободных радикалов, например, органических перекисей)[23]. Присоединение хлора также можно осуществить посредством фотохимической инициации[24] или при нагревании реакционной смеси свыше 250 °C в присутствии небольших количеств кислорода[25].
Винилхлорид присоединяет галогенводороды по двойной связи в соответствии с правилом Марковникова только в присутствии катализаторов (хлорид железа (III), хлорид цинка и др.) при повышенной температуре, образуя 1,1-дигалогеналканы[26]:
Фтористый водород реагирует с винилхлоридом в газовой фазе только при повышенном давлении (1—1,5 МПа)[27]:
Фтористый водород реагирует с винилхлоридом в жидкой фазе в присутствии катализатора хлорида олова (IV) с замещением атома хлора на фтор с получением 1,1 — дифторэтана (фреона R152a) — озонобезопасного хладагента[28][29]:
В присутствии перекисей присоединение идёт иначе (только для HCl и HBr)[30]:
Йодистый водород присоединяется к винихлориду в присутствии каталитического количества йода с образованием 1-хлор-1-иодэтана[31]:
С водным раствором хлора винилхлорид реагирует, образуя хлорацетальдегид:
Если реакцию проводить в растворе метанола, образуется хлорацеталь[32]:
Под действием ультрафиолетового облучения винилхлорид реагирует с сероводородом (катализатор — диалкилдитиоэфиры), образуя отравляющее вещество иприт[33]:
В присутствии галогенидов некоторых металлов (FeCl3, AlCl3 и пр.) винилхлорид конденсируется с хлорэтаном, образуя 1,1,3-трихлорбутан; с 2-хлорпропаном — 1,1-дихлор-3-метилбутан[34]:
С четырёххлористым углеродом в присутствии CuCl/C4H9NH2 или RuCl2(PPh3)3 в качестве катализатора с высоким выходом образует 1,1,1,3,3-пентахлорпропан[35]:
В реакции Принса с участием винилхлорида образуется 3,3-дихлорпропанол-1 и 2,3-дихлорпропанол[25]:
Вступает в реакцию Фриделя-Крафтса с бензолом в присутствии хлорида алюминия, образуя 1,1-дифенилэтан[36]:
Винилхлорид вступает в фотохимическую реакцию [2+2] циклоприсоединения к 1-изохинолону[37]:
Реакции замещения по атому хлора
[править | править код]Традиционные реакции замещения, типичные для многих галогенуглеводородов, для винилхлорида не доступны. Обычно под действием оснований, особенно при нагревании, вместо замещения протекают реакции полимеризации или элиминирования[16].
Тем не менее, в присутствии солей палладия можно осуществить нуклеофильное замещение по атому хлора: таким образом удаётся получить винилалкоголяты, а также простые и сложные виниловые эфиры[25][38]:
Реакцию замещения с алкоголятом натрия можно провести и без катализатора в достаточно жёстких условиях: при длительном нагревании в закрытом автоклаве при температуре около 100 °C[39]:
Реакцию аминирования также можно провести в присутствии палладиевого катализатора[40]:
Реакция с аммиаком в газовой фазе при 50 °C в присутствии амальгамы натрия приводит к азиридину[41]:
В обычных условиях винилхлорид не образует реактивы Гриньяра, однако в среде тетрагидрофурана удалось получить винилмагнийгалогениды (реактивы Нормана)[42][43]:
В дальнейшем винилмагнийхлорид можно использовать для синтеза широкого спектра винилпроизводных, например:
По аналогии с магнием можно получить и другие винилметаллорганические соединения, например, винилкалий[44]:
Взаимодействие винилхлорида с металлическим мелкодисперсным литием в присутствии натрия (2 %) в среде тетрагидрофурана приводит к виниллитию[45]:
Взаимодействием винилхлорида с 2-тиенилмагнийбромидом в присутствии хлорида кобальта можно получить 2-винилтиофен[46]:
Винилхлорид вступает в реакцию с диметиламином и CO в присутствии палладиевого катализатора с образованием N,N-диметилакриламида[47]:
Реакция полимеризации
[править | править код]В отсутствие кислорода и света при обычных условиях чистый винилхлорид может существовать достаточно долго, не претерпевая каких-либо изменений; однако появление свободных радикалов, вызываемое как фотохимически, так и термохимически, приводит к его быстрой полимеризации.
Механизм полимеризации носит радикальный характер и схематично может быть представлен следующим образом[48]:
Первый этап: действие инициатора[К 3] — образование свободных радикалов и зарождение цепи.
Второй этап: развитие полимеризации — образование полимерных цепочек.
В процессе образования полимера возможно разветвление цепи[К 4], а также образование ненасыщенных фрагментов:
Третий этап: завершение полимеризации.
Прочие реакции
[править | править код]Почти с количественным выходом можно получить бутадиен из винилхлорида в среде диметилформамид-вода в присутствии комплексного смешанного катализатора[49]:
Винилхлорид в реакциях с хлорангидридами карбоновых кислот в присутствии хлорида алюминия образует дихлоркетоны и хлорвинилкетоны[50]:
В присутствии хлоридов палладия (PdCl2), родия (RhCl3•3H2O) или рутения (RuCl3•3H2O) винилхлорид вступает в реакцию со спиртами, образуя ацетали[51]:
Окисление винихлорида неорганическими окислителями в зависимости от условий реакции и выбора окислителя приводит к образованию хлорацетальдегида или формальдегида, более глубокое окисление — монооксиду или диоксиду углерода, хлороводороду и воде:
Озонолиз винилхлорида в среде метанола при температуре −78 °C с высоким выходом приводит к метоксиметилгидропероксиду (1), который можно в дальнейшем превратить в метиловый эфир муравьиной кислоты (2) и диметоксиметан (метилаль) (3)[52]:
Восстановление винилхлорида возможно по трём различным направлениям в зависимости от выбора агента и условий реакции[53]:
- до этилена:
- до этилхлорида:
- до этана:
Под действием сильных оснований винилхлорид способен отщеплять хлористый водород, образуя ацетилен:
Винилхлорид термически довольно устойчивое соединение, заметное разложение которого происходит при нагревании свыше 550 °C. Пиролиз винилхлорида при 680 °C с 35 % выходом приводит к смеси продуктов, содержащих ацетилен, хлороводород, хлоропрен и винилацетилен[9].
Лабораторные методы получения
[править | править код]В лабораторных условиях винилхлорид получают дегидрохлорированием 1,2-дихлорэтана или 1,1-дихлорэтана спиртовым раствором гидроксида натрия или калия при нагревании[54]:
Другой метод — пропускание ацетилена через концентрированный раствор соляной кислоты в присутствии хлорида ртути — в лабораторной практике используется редко:
Ещё одним альтернативным вариантом может служить каталитическая дегидратация этиленхлоргидрина[19]:
Наконец, винилхлорид можно получить при взаимодействии ацетальдегида с пентахлоридом фосфора[55]:
Промышленное производство: технологические аспекты
[править | править код]На 2010 год существуют три основных способа получения винилхлорида, реализованные в промышленных масштабах[56]:
- каталитическое газофазное гидрохлорирование ацетилена;
- комбинированный метод на основе этилена и ацетилена;
- сбалансированный по хлору метод на основе этилена.
Последний метод является самой современной, распространённой и экономически наиболее эффективной технологией производства, однако первые два способа, хоть и являются устаревшими, до сих пор существуют на многих предприятиях, ориентированных (по разным причинам) на использование дорогостоящего ацетилена[56].
Существует также сравнительно новый способ, пока не получивший распространения и реализованный в виде пилотного проекта в 1998 году на одном предприятии в Германии — окислительное хлорирование этана.
Каталитическое газофазное гидрохлорирование ацетилена
[править | править код]Метод каталитического гидрохлорирования ацетилена, в котором ацетилен получался реакцией карбида кальция с водой, был первым коммерческим процессом получения винилхлорида.
Химия процесса выглядит следующим образом:
- Получение ацетилена:
- Гидрохлорирование ацетилена:
Краткое описание технологии производства[57]:
Произведённый, очищенный и осушенный ацетилен (содержание влаги не более 1,5 г/м³) смешивают с очищенным и высушенным хлороводородом в соотношении примерно 1,0:1,1. Эта смесь газов подаётся в верхнюю часть трубчатого реактора, трубы которого заполнены катализатором, представляющим собой активированный уголь, пропитанный двухлористой ртутью HgCl2 (10—15 %). Реактор изготавливается из углеродистой стали; высота труб составляет 3—6 метров, диаметр 50—80 м. Температура в области реакции 150—180 °C. После реактора реакционные газы подаются в специальную колонну, орошаемую соляной кислотой для извлечения двухлористой ртути. После первой абсорбционной колонны реакционные газы подаются в следующую, где орошаются водой и раствором щёлочи для отделения хлороводорода, ацетальдегида и углекислого газа. После этого газы охлаждаются в конденсаторе для удаления воды и подаются на ректификацию для удаления высококипящих примесей. Полученный винилхлорид на последней стадии пропускается через колонну, заполненную твёрдым едким натром для полного обезвоживания и нейтрализации.
Ниже представлено схематичное изображение процесса:

По состоянию на 1967 год, доля метода каталитического газофазного гидрохлорирования ацетилена в производственных мощностях по выпуску винилхлорида в США составляла 32,3 % (405,6 тыс. тонн)[58]. В 2001 году американская химическая корпорация Borden остановила своё последнее производство на основе ацетилена в Луизиане[59]. Помимо экономических соображений, метод каталитического гидрохлорирования ацетилена является экологически небезопасным, так как используемая в производстве ртуть, несмотря на рециркуляцию, неизбежно с газообразными отходами и сточными водами попадает в окружающую среду. В 2002 году в России такие выбросы составили около 31 кг[57].
Метод каталитического гидрохлорирования ацетилена на 2010 год широко распространён только в Китае из-за богатых запасов угля, наличия дешёвой гидроэлектроэнергии, а также дефицита природного газа, являющегося главным сырьём для производства этилена[60].
C 2003 по 2008 год метод вновь вызвал к себе интерес из-за значительного роста мировых цен на нефть и газ, однако экономический кризис 2008 года вновь сделал метод прямого окислительного хлорирования этилена наиболее привлекательным с экономической точки зрения[61].
Комбинированный метод на основе этилена и ацетилена
[править | править код]Комбинированный метод на основе этилена и ацетилена заключается в совмещении реакции хлорирования этилена и последующей деструкции дихлорэтана с реакцией гидрохлорирования ацетилена и использованием для последней хлороводорода со стадии термического разложения[62].
Химия процесса[62]:
Метод позволил заменить половину ацетилена на более дешёвый этилен, а также утилизировать хлороводород, тем самым доведя почти до 100 % полезное использование хлора[62].
Сбалансированный по хлору метод на основе этилена
[править | править код]Общее описание метода
[править | править код]На 2010 год самым современным и наиболее эффективным с экономической точки зрения является сбалансированный процесс окислительного хлорирования этилена. В 2006 году более 95 % винилхлорида было произведено этим методом[59].
В основанном на этилене процессе винилхлорид получается пиролизом дихлорэтана, который, в свою очередь, синтезируется каталитической реакцией хлора с этиленом. Хлороводород, получаемый в результате дегидрохлорирования дихлорэтана, вступает в реакцию с кислородом и этиленом в присутствии медного катализатора, образуя дихлорэтан и тем самым уменьшая расход элементарного хлора, используемого для прямого хлорирования этилена. Этот процесс известен как оксихлорирование. Для получения товарного продукта винилхлорид очищают дистилляцией, а побочные хлорорганические продукты либо выделяют для получения растворителей, либо подвергают термодеструкции для вовлечения хлороводорода снова в процесс[59].
Химия процесса выглядит следующим образом[25][56]:
- Хлорирование этилена:
- механизм стадии:
- Термическое дегидрохлорирование дихлорэтана:
- механизм стадии:
- Окислительное хлорирование этилена:
- механизм стадии:
При такой схеме производства распределение этилена происходит примерно поровну между стадиями прямого и окислительного хлорирования.
Vinnolit VCM Process
[править | править код]Одной из самых распространённых технологий производства винилхлорида в мире является Vinnolit VCM Process, лицензируемый немецкой компанией Vinnolit GmbH & Co.: начиная с 1964 года в мире установлено приблизительно 5,5 млн тонн мощностей по выпуску винилхлорида по этому процессу[63].
Ниже представлено схематичное изображение процесса:
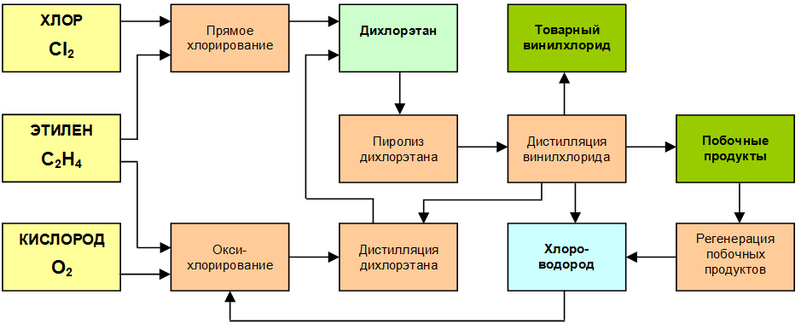
Краткое описание стадий процесса:
- Прямое хлорирование этилена[64]:
- Реакция хлорирования этилена протекает в жидкой фазе в среде дихлорэтана при температуре 50—125 °С в присутствии специального усовершенствованного (по сравнению с FeCl3) комплексного катализатора, препятствующего образованию побочных продуктов, не расходующегося в процессе синтеза и остающегося в реакторном объёме. Благодаря этому образующийся дихлорэтан не требует очистки (чистота достигает 99,9 % и более) и напрямую поступает на стадию пиролиза.
- Процесс оксихлорирования этилена[65]:
- Процесс оксихлорирования — экзотермическая реакция, сопровождающаяся выделением большого количества тепла (ΔH = −238 кДж/моль) и проходящая в присутствии кислорода (преимущественно) или воздуха. Реакционная газовая смесь разогревается до температуры свыше 210 °C, а выделяемое тепло реакции используется для образования пара. Степень конверсии этилена достигает 99 %, а чистота получаемого дихлорэтана — 99,5 %.
- Процесс дистилляции дихлорэтана[66]:
- Дистилляция требуется для дихлорэтана, образующегося в процессе оксихлорирования, а также непрореагировавшего (возвратного) дихлорэтана со стадии пиролиза. Вода и низкокипящие компоненты удаляются в осушающей колонне. Кубовый остаток в дальнейшем поступает на стадию регенерации.
- Пиролиз дихлорэтана[67]:
- Пиролиз дихлорэтана производится в специальных печах (операционный период — до 2 лет) при температуре 480 °C; при этом теплота процесса используется для испарения и нагрева.
- Дистилляция винилхлорида[68]:
- Продукты пиролиза, состоящие, в основном, из дихлорэтана, винилхлорида и хлороводорода, направляются в узел дистилляции. Хлороводород возвращается в отделение оксихлорирования, винилхлорид удаляется через верхнюю часть колонны, а кубовый остаток, состоящий из непрореагировавшего дихлорэтана, возвращается в процесс дистилляции после удаления побочных продуктов.
- Регенерация побочных продуктов[69]:
- Жидкие и газообразные побочные продукты полностью сжигаются при температуре 1100—1200 °С, образуя хлороводород, который после очистки возвращается в процесс оксихлорирования; попутно за счёт высокой температуры продуцируется также пар среднего давления.
Расчётный материально-энергетический баланс процесса (на 1000 кг винихлорида)[63]:
- Этилен: 460 кг;
- Хлор: 585 кг;
- Кислород: 139 кг;
- Пар: 125 кг;
- Электроэнергия: 120 кВт·ч;
- Вода: 150 м³.
Метод окислительного хлорирования этана
[править | править код]Идея использовать этан для синтеза винилхлорида была реализована в 1965—1967 годах на опытном производстве компаний The Lummus Co. и Armstrong Cork Co. Технология прямого оксихлорирования в присутствии хлорида меди (I) получила название Transcat Process[70].
Химия процесса[70]:
Процесс проходил при 450—550 °C и давлении 1 МПа; степень конверсии этана достигала 65—70 %[70]. Метод впоследствии был оптимизирован компанией ICI, которая снизила температурный диапазон проведения синтеза и предложила другой катализатор[70].
В мае 1998 года компания EVC International NV (Нидерланды) запустила опытный проект мощностью 1000 тонн в год на заводе в Вильгельмсхафене (Германия) с целью опробирования и последующего продвижения на рынке запатентованного процесса окислительного хлорирования этана, или Ethane-to-VCM-Process. Предполагалось, что этот проект будет технологическим прорывом и станет началом работы над полномасштабным заводом, который, как ожидалось, будет запущен в 2003 году[71].
По данным производителя, температура процесса составляет менее 500 °C, степень конверсии сырья — 100 % по хлору, 99 % по кислороду и более чем 90 % по этану; выход винилхлорида превышает 90 %[71].
В сентябре 1999 года EVC подписала с компанией Bechtel Group, Inc. (США) соглашение о постройке полноценного производства в Вильгельмсхафене, однако из-за финансовых проблем проект не был осуществлён[72].
После поглощения в 2001 году[73] корпорацией INEOS компании EVC дальнейшая судьба проекта Ethane-to-VCM-Process не известна[74].
Альтернативные методы производства винилхлорида
[править | править код]Компанией Monsanto в 1977 году был предложен одностадийный метод получения винилхлорида с выходом до 85 % из этана под действием смеси хлороводорода и кислорода при температуре 400—650 °С в присутствии катализатора (галогенид меди и фосфат калия)[75]:
В 1980 году советскими учёными был запатентован альтернативный метод получения винилхлорида газофазным хлорированием смеси, содержащей этан и этилен, при температуре 350—500 °С, отвечающий следующей химической модели:
Побочными продуктами реакции являются хлорэтан, 1,1-дихлорэтан, винилиденхлорид и др. галогенпроизводные.
Одним из самых последних разработанных методов производства (2005 год) является способ получения винихлорида взаимодействием метилхлорида и метиленхлорида в газовой фазе при температуре 300—500 °С, давлении от 0,1 до 1 МПа, в присутствии катализаторов (активный оксид или фосфат алюминия, алюмосиликаты, хлорид цинка с оксидом алюминия)[76]:
Все перечисленные способы получения винилхлорида[К 5] или не были реализованы в промышленности, или не вышли из стадии экспериментального производства.
Промышленное производство: экономические аспекты
[править | править код]Информация в этой статье или некоторых её разделах устарела. |
Мировое производство винилхлорида
[править | править код]Винилхлорид входит в ТОП 20 крупнейших по объёму продуктов мирового нефтехимического производства[77], уступая лишь этилену (123 млн тонн в 2010 году[78]), пропилену (77 млн тонн в 2010 году[79]), метанолу (48—49 млн тонн в 2010 году[80]), терефталевой кислоте (42 млн тонн в 2008 году[81]), бензолу (40 млн тонн в 2010 году[82]). Производство винилхлорида является третьим после полиэтилена и окиси этилена по значимости направлением использования этилена как важнейшего химического сырья и составляет 11,9 % его мирового потребления (по данным на 2008 год)[83]. Мировые мощности по производству винилхлорида по состоянию на 2022 год составляли около 60 млн тонн [84]. Мировое производство винилхлорида в 2010 году составило около 35 млн тонн[85] (36,7 млн тонн в 2008 году[86]), что составляет 70 % всех мировых производственных мощностей (в 2007 году — 90 %, 2008 году — 85 %). По прогнозным данным компании IHS, текущее потребление винилхлорида в период с 2010 по 2015 гг. будет расти в размере 4,4 % в год и 4,2 % в последующие пять лет (с 2015 по 2020 г.)[85]. По состоянию на 1997 и конец 2004 года мировые мощности по производству винилхлорида по регионам выглядят следующим образом:
| Регион | Мощность на 1997 год, тыс. тонн[25] | Мощность на 2004 год, тыс. тонн[9] |
|---|---|---|
| Северная Америка США Канада Мексика |
7385 6741 374 270 |
8988 8018 500 470 |
| Южная Америка Бразилия Аргентина Венесуэла |
880 540 160 180 |
1035 655 230 150 |
| Западная Европа Бельгия Франция Германия Италия Нидерланды Норвегия Испания Швеция Великобритания |
6409 1010 1205 1710 620 520 470 399 115 360 |
6495 880 1205 2015 440 600 470 465 120 300 |
| Восточная и Центральная Европа Россия и страны СНГ Чехия и Словакия Югославия (бывшая) Венгрия Польша Румыния |
2342 1085 217 260 185 325 270 |
2011 884 217 160 255 300 200 |
| Африка Алжир Египет Ливия Марокко ЮАР |
405 40 100 62 38 165 |
408 40 100 62 38 168 |
| Ближний Восток Иран Израиль Катар Саудовская Аравия Турция |
862 213 110 — 360 179 |
1092 240 — 300 400 152 |
| Азия[К 6] Китай Индия Индонезия Япония Северная Корея Южная Корея Пакистан Филиппины Тайвань Таиланд |
7145 1356 610 150 2965 24 755 5 10 1030 240 |
13082 4436 845 500 3260 24 1520 — — 1870 627 |
| Австралия и Океания Австралия |
36 36 |
— — |
| ИТОГО | 25 464 | 33 111 |
Крупнейшим производителем винилхлорида в мире (по объёму производственных мощностей) являются США: 8,24 млн тонн по данным на 2003 год[87] (для сравнения — в 1967 году мощности составляли 1,26 млн тонн, а в 1960 году всего 0,67 млн тонн[58]).
Крупнейшие производители США и Канады по объёму производственных мощностей по данным на 2003 год[87]:
- Dow Chemical — 2,4 млн тонн (2006 год)[88];
- Occidental Chemical Corporation — 1,68 млн тонн;
- Georgia Gulf — 1,18 млн тонн;
- Oxymar — 1,04 млн тонн;
- Formosa Plastics Group — 1,00 млн тонн.
В 1997 году крупнейшими мировыми компаниями-производителями (42 % всего суммарного объёма мировых производственных мощностей) были[89]:
- Dow Chemical — 1906 тыс. тонн;
- Formosa Plastics Group — 1643 тыс. тонн;
- EVC — 1370 тыс. тонн;
- Solvay — 1193 тыс. тонн;
- The Geon Company — 1088 тыс. тонн;
- Occidental Chemical Corporation — 1020 тыс. тонн;
- Elf-Atochem — 803 тыс. тонн;
- Georgia Gulf — 726 тыс. тонн;
- Norsk Hydro — 595 тыс. тонн;
- Tosoli Corporation — 570 тыс. тонн.
По состоянию на 2005 год крупнейшими мировыми компаниями-производителями являются (перечислены в порядке убывания)[90]:
- Formosa Plastics Group;
- Dow Chemical;
- Occidental Chemical Corporation;
- Solvay;
- Georgia Gulf;
- Ineos;
- Tosoh;
- Total Petrochemicals;
- LG Chem;
- Shin-Etsu Chemical.
Производство винилхлорида в России
[править | править код]Вклад России в мировое производство винилхлорида довольно скромный: около 1,5 % от годового глобального выпуска и место во второй двадцатке стран-производителей (по состоянию на 2008 год). При этом технологическое оснащение серьёзно отстаёт от мирового: почти 30 % мощностей используют устаревшую ацетиленовую технологию.
Производство винилхлорида в России практически полностью (более 99 % всего объёма) ориентировано на выпуск поливинилхлорида, являясь при этом одним из крупнейших направлений потребления хлора в российской химической промышленности (18 % по данным на 2004 год)[91].
По состоянию на 2009 год производство винилхлорида в России осуществляется на следующих предприятиях:
| Наименование | Регион | Технология производства[К 7] | Производственная мощность, тыс. тонн/год | Произведено в 2008 году, тыс. тонн |
|---|---|---|---|---|
| ОАО «Саянскхимпласт» | г. Саянск, Иркутская область | СХМЭ | 270,0[92] | 250,0[К 8][93] |
| ОАО «Каустик» | г. Стерлитамак, Республика Башкортостан | СХМЭ | 165,0[94] | 165,0[К 8][94] |
| ОАО «Пласткард» | г. Волгоград | КМЭА | 100,0[К 9] | 96,3[95] |
| ОАО «Сибур-Нефтехим» (завод «Капролактам») | г. Дзержинск, Нижегородская область | СХМЭ | 90,0[96] | 78,5[96] |
| ОАО «НАК Азот» | г. Новомосковск, Тульская область | КГА | 45,0[57] | нет данных[К 10] |
| ВОАО «Химпром» | г. Волгоград | КГА | 27,0[57] | 21,7[К 8][97] |
| ООО «Усольехимпром» | г. Усолье-Сибирское, Иркутская область | КГА | 26,0[57] | < 20,0 |
| Итого | 723,0 | 620,0—650,0 | ||
В сентябре 2014 года компанией ООО «РусВинил» было осуществлено торжественное открытие нового комплекса по производству ПВХ (включая и производство винилхлорида) в Кстовском районе Нижегородской области мощностью 330 тыс. тонн в год[98]. Учредителями совместного предприятия стали компания «Сибур» и бельгийская компания SolVin — совместная дочерняя компания международной химико-фармацевтической группы Solvay и немецкого концерна BASF[99].
Производство винилхлорида на Украине
[править | править код]По состоянию на 2018 год, единственным действующим производителем винилхлорида на Украине является ООО «Карпатнефтехим» (г. Калуш), входящий до февраля 2017 года в состав российской группы Лукойл[К 11]. Производство осуществляется прямым хлорированием этилена; мощность производства — 370 тыс. тонн в год[100].
Применение
[править | править код]Более 99 % всего производимого в мире винилхлорида (в 2020 году) было использовано для дальнейшего производства ПВХ[101]. Более половины мирового производства ПВХ (57 % по состоянию на 2009 год) сосредоточено в Азии, причём 20 % в Китае[102]. Крупнейшим потребителем винилхлорида в мире является Китай: около 30 % всего мирового производства; на втором месте США и Канада, приблизительно с 20 % (по состоянию на 2008 год)[61].
В настоящий момент существуют четыре принципиально различных технологии полимеризации винилхлорида (перечислены в порядке убывания распространения)[48]:
- суспензионная полимеризация: полимеризация винихлорида в каплях эмульсии, полученной диспергированием мономера в воде, в присутствии стабилизатора эмульсии и мономер-растворимого инициатора полимеризации;
- Типичный массовый состав для суспензионной полимеризации:
- винилхлорид — 33,3 %;
- вода — 66,6 %;
- инициатор (например, органический пероксид) — 0,015 %;
- стабилизатор (например, поливиниловый спирт) — 0,005 %.
- дисперсионная полимеризация: полимеризация винилхлорида в воде в присутствии ПАВ и водорастворимых инициаторов (персульфат калия, персульфат аммония, перкарбонат натрия, пероксиуксусная кислота, пероксид водорода и гидропероксид кумола и пр.) с образованием стабильных дисперсий из очень маленьких частиц;
- полимеризация в массе: третий по важности метод, заключающийся в полимеризации винилхлорида в объёме целиком, без добавок воды, ПАВ, растворителей или иных вспомогательных компонентов (за исключением мономер-растворимых инициаторов, таких, как ди-(2-этилгексанол)пероксид, 3,5,5-триметилгексанолпероксид, ди-(трет-бутил)пероксиоксалат, ди-2-бутоксиэтилпероксидикарбонат, ди-4-хлорбутилпероксидикарбонат, азобис(изобутиронитрил), азобис-(циклогексилкарбонитрил));
- полимеризация в растворе: наиболее редкий и специфический метод, применяемый для получения сополимеров, используемых в создании полимерных покрытий.
В мире наиболее распространён метод суспензионной полимеризации (80 % всего объёма производства[48]), причём наиболее современными и популярными являются следующие технологии[103]:
- Chisso PVC Process;
- Vinnolit Suspension PVC Process.
Chisso PVC Process
[править | править код]Корпорация Chisso — лидер японской полимерной промышленности — разработала современную технологию суспензионного производства поливинилхлорида: Chisso PVC Process. Особенности метода — получение высококачественного продукта с использованием безопасной и безвредной для окружающей среды технологии, низкие начальные инвестиции и низкие операционные издержки.
Chisso PVC Process лицензирован на 19 предприятиях по всему миру, суммарная мощность — свыше 1,5 млн тонн в год[104].
Vinnolit Suspension PVC Process
[править | править код]Метод суспензионной полимеризации винилхлорида был изобретён и запатентован в 1935 году компанией Wacker Chemie GmbH, одним из прежних учредителей компании Vinnolit. После многократных усовершенствований Vinnolit Suspension PVC Process стал одним из современных и очень экономически эффективных процессов для производства поливинилхлорида во всём мире[105].
Реакция полимеризации осуществляется периодическим способом в реакторах объёмом около 170 м³, при этом особенность конструкции позволяет эффективно удалять тепло из реакционной смеси без использования обратного холодильника или воды для охлаждения, тем самым обеспечивая высокую производительность. Кроме того, особенности технологии позволяют получить готовый продукт с минимальным содержанием непрореагировавшего винилхлорида без применения температурной дегазации, сохраняя тем самым структуру полимера[105].
Прочие направления использования
[править | править код]Около 1 % винилхлорида используется для получения сополимеров с винилацетатом и другими мономерами[59].
Не более 1 % винилхлорида применяют для органического синтеза следующих соединений[106]:
До середины 1970-х годов винилхлорид использовался как хладагент, пропеллант для аэрозольных баллонов и компонент для некоторых видов косметики[107].
Огне- и пожароопасность
[править | править код]Вещество является чрезвычайно огнеопасным, его смеси с воздухом взрывоопасны; при горении выделяет раздражающие, токсичные и коррозионно-активные вещества[К 12][108], среди которых, в частности, обнаруживается крайне ядовитый фосген[109].
Температура вспышки: −78 °C[110]; температура самовоспламенения: 472 °С[9]. Пределы воспламенения в воздухе: 3,6—33 %[111].
Гашение пламени при горении винилхлорида производят только после остановки подачи газа, при этом используют воду на максимально возможном от очага возгорания расстоянии, создавая плотную туманоподобную завесу, а также охлаждая горячие поверхности[109].
Физиологическое действие
[править | править код]Винилхлорид очень токсичен. Оказывает комплексное токсическое воздействие на организм человека, вызывая поражение ЦНС, костной системы, системное поражение соединительной ткани, мозга, сердца. Поражает печень, вызывая ангиосаркому. Вызывает иммунные изменения и опухоли, оказывает канцерогенное, мутагенное и тератогенное действие[113].
Многие исследования сообщают, что воздействие винилхлорида на человека вызывает образование злокачественных новообразований в различных тканях и органах, включая печень (опухоли, помимо ангиосаркомы), мозг, лёгкие, лимфатическую и гематопоэтическую систему (органы и ткани, вовлечённые в кровообразование)[114]. При этом употребление этанола только усиливает канцерогенный эффект винилхлорида[115].
Хроническая интоксикация винилхлоридом носит название «винилхлоридной болезни»[116].
Физиологическое воздействие винилхлорида на людей имеет преимущественно ингаляционный характер, причём его опасная концентрация в воздухе (1 часть на миллион[К 14]) ниже предела его обнаружения человеком посредством обоняния (3000 частей на миллион)[20]. Концентрация в размере 8000 частей на миллион вызывает головокружение, а при уровне 20000 частей на миллион появляется сонливость, потеря координации, визуальные и слуховые отклонения, дезориентация, тошнота, головная боль, синдром жжения конечностей[20]. Продолжительное воздействие более высоких концентраций винилхлорида может вызвать смерть из-за паралича центральной нервной системы и остановки дыхания[20]. Газ тяжелее воздуха и может вызвать удушье в плохо проветриваемых или замкнутых помещениях[20].
В организме человека винилхлорид биотрансформируется преимущественно ферментами печени, при этом основным его метаболитом, выводящимся с мочой, является тиодигликолевая кислота[111].
Метаболический путь винилхлорида в организме человека представлен на рисунке[117]:
Острый токсический эффект винилхлорида для различных животных[118]:
- Крысы: ЛД50 (англ. LD50) ⩾ 400 мг/кг (перорально);
- Крысы: ЛК50 (англ. LC50) = 390 000 мг/м³ (ингаляционно);
- Мыши: ЛК50 (англ. LC50) = 294 000 мг/м³ (ингаляционно).
Воздействие на окружающую среду
[править | править код]В окружающей среде винилхлорид появляется исключительно вследствие его выбросов во время производства и переработки. По оценке специалистов, более 99 % выброса винилхлорида остаётся в воздухе[118], где происходит его фотохимическая деградация под воздействием гидроксил-радикалов; при этом период его полураспада составляет 18 часов[119] (по другим данным, это время составляет 2,2—2,7 дней[118]).
С поверхности почвы винилхлорид быстро испаряется, однако может мигрировать в её глубь через грунтовые воды[119]. В растениях и животных не накапливается[119].
В почве и воде винилхлорид подвергается аэробной биодеградации (преимущественно до CO2) под воздействием микроорганизмов, например, рода Микобактерии (Mycobacterium)[120]; биораспад в грунтовых водах может носить и анаэробный характер, причём его продуктами являются метан, этилен, углекислый газ и вода[121].
Исследования показывают, что в почве и воде под действием микроорганизмов винилхлорид разлагается на 30 % в течение 40 дней и на 99 % в течение 108 дней[118].
Гигиенические нормативы
[править | править код]Основные гигиенические нормативы для винилхлорида:
- ПДК максимально разовая в воздухе рабочей зоны: 5 мг/м³;
- ПДК среднесменная в воздухе рабочей зоны:1 мг/м³;
- класс опасности для рабочей зоны: 1 (чрезвычайно опасное);
- особенность токсического действия на организм: K (канцероген);
- ПДК среднесуточная в атмосферном воздухе населённых мест = 0,01 мг/м³;
- класс опасности для населённых пунктов: 1 (чрезвычайно опасное);
- лимитирующий показатель воздействия: резорбтивный;
- ПДК в воде = 0,005 мг/м³.
США:
- предельно допустимая концентрация в рабочей зоне при длительном воздействии (Threshold Limit Value — Time Weighted Average, TLV-TWA)[К 16]: 1 ppm[124];
- допустимый предел воздействия (Permissible Exposure Limit, PEL):1 ppm[112];
- уровень минимального риска (Minimal Risk Levels, MRL)[125]:
- острое ингаляционное воздействие: 0,5 ppm;
- разовое пероральное воздействие: 0,03 ppm;
- хроническое пероральное воздействие: 0,003 мг/кг в день.
Обращение, хранение и транспортировка
[править | править код]Винилхлорид хранится вдали от источников тепла и огня в жидком виде при температуре −14…22 °C в больших сферических металлических заземлённых ёмкостях с небольшой добавкой стабилизатора (например, гидрохинон). Ёмкости должны быть оснащены самозапорными клапанами, устройствами контроля давления и искрогасителями. Контейнер с веществом должен находиться в хорошо проветриваемых условиях при внешней температуре ниже 50 °C. Необходимо избегать контакта с медью, любыми источниками огня или тепла, окислителями, каустической содой и активными металлами. Стабилизированный хлористый винил транспортируется в жидком виде в охлаждаемых стальных цистернах, которые предварительно должны быть тщательно высушены и продуты азотом[124][126].
Авария в Огайо
[править | править код]
3 февраля 2023 в США близ города Ист-Палестайн в штате Огайо сошёл с рельсов поезд, перевозивший винилхлорид. Компания Norfolk Southern, которой принадлежали химикаты, была вынуждена сжечь содержимое цистерн, итогом мероприятия стали гигантское грибовидное облако над штатом, гибель животных и отравление воды в реке Огайо[127][128].
См. также
[править | править код]Примечания
[править | править код]- ↑ Значение приведено по Винилхлорид // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.. По-видимому, данные в «Химической энциклопедии» (−158,4 °C) не вполне корректны. В российской и зарубежной научной литературе приводится значение −153,8 °C или близкое к нему (±0,1 °C).
- ↑ Плотность вещества, отнесённая к плотности воды при температуре 4 °C.
- ↑ В качестве инициатора для примера рассматривается органический пероксид.
- ↑ Представлен один из возможных вариантов.
- ↑ Приведённые в статье альтернативные методы не являются исчерпывающими.
- ↑ По состоянию на 2010 год, одним из крупных производителей винилхлорида является не упомянутая в этой таблице Малайзия. Завод компании Petronas Архивная копия от 9 июня 2010 на Wayback Machine имеет мощность 400 тыс. тонн/год.
- ↑ Сокращения:
- КГА — каталитическое газофазное гидрохлорирование ацетилена;
- КМЭА — комбинированный метод на основе этилена и ацетилена;
- СХМЭ — сбалансированный по хлору метод на основе этилена.
- ↑ 1 2 3 В пересчёте на поливинилхлорид.
- ↑ Ориентировочное значение, рассчитанное исходя из данных по фактическому выпуску винилхлорида и производственной мощности по выпуску ПВХ.
- ↑ На официальном web-сайте компании Архивная копия от 16 сентября 2009 на Wayback Machine упоминание о производстве винилхлорида или ПВХ отсутствует.
- ↑ По данным издательства "Коммерсантъ" по состоянию на 01.01.2018 актив принадлежит украинским предпринимателям: Ильхаму Мамедову через Xedrian Holding Ltd (Кипр) и Techinservice Limited (Великобритания) Игорю Щуцкому.
- ↑ Основными продуктами горения винилхлорида являются углекислый и угарный газ, а также хлороводород.
- ↑ Расшифровка обозначений:
- синий цвет — опасность для здоровья;
- красный цвет — пожароопасность;
- жёлтый цвет — химическая активность.
- ↑ Речь идёт о предельно допустимой концентрации винилхлорида в рабочей зоне при длительном воздействии (TLV-TWA) — нормативе, принятом в США.
- ↑ Определяется исходя из однократного воздействия в течение 8 часов.
- ↑ Определяется исходя из постоянного воздействия в течение 8-часового рабочего дня, 40 часов в неделю.
Использованная литература и источники
[править | править код]- ↑ 1 2 3 Таблица органических соединений. Новый справочник химика и технолога. Основные свойства неорганических, органических и элементоорганических соединений. ChemAnalitica.com (31 марта 2009). Дата обращения: 27 октября 2009. Архивировано 6 июня 2015 года.
- ↑ 1 2 3 4 Винилхлорид // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ 1 2 3 4 5 Ю. А. Трегер. Винилхлорид // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 373—374. — 624 с.
- ↑ 1 2 Дипольные моменты некоторых веществ. Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalitica.com (1 апреля 2009). Дата обращения: 21 сентября 2009. Архивировано 8 июля 2011 года.
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0658.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Vinyl Chloride | Medical Management Guidelines | Toxic Substance Portal | ATSDR. wwwn.cdc.gov. Дата обращения: 24 октября 2021. Архивировано 24 октября 2021 года.
- ↑ Myers, Rusty L.; Myers, Richard L. The 100 most important chemical compounds: a reference guide (англ.). — Westport, Conn: Greenwood Press, 2007. — ISBN 0-313-33758-6.
- ↑ 1 2 3 4 5 6 Cowfer J.A. Part 2. Vinyl Chloride Monomer // PVC Handbook / Wilkes C.E., Summers J.W., Daniels C.A.. — 1 st ed. — Munich: Carl Hanser Verlag, 2005. — P. 19—56. — ISBN 1-56990-379-4.
- ↑ History of PVC (англ.). PVC Awareness Project. Дата обращения: 26 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Lawrie Lloyd. Handbook of Industrial Catalysts. — Springer Science+Business Media, LLC, 2011. — P. 268. — 512 p. — ISBN 978-0-387-24682-6.
- ↑ Poly(vinyl chloride) (англ.). Polymer science learning center. The University of Southern Mississippi, The Department of Polymer Science. Дата обращения: 27 октября 2009. Архивировано 19 декабря 2010 года.
- ↑ Unated States Patens 1929453. Synthetic rubber-like composition and method of making same (англ.) (pdf). FreePatentsOnline (10 октября 1933). Дата обращения: 2 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Berthelot M. Chimie organique fondée sur la synthèse. — Paris: Mallet-Bachelier, 1860. — P. 219.
- ↑ Synthetic plastics (англ.). Timeline. Plastics Historical Society. Дата обращения: 27 октября 2009. Архивировано 13 августа 2006 года.
- ↑ 1 2 3 Травень В. Ф. Органическая химия: Учебник для вузов: В 2 т / В. Ф. Травень. — М.: ИКЦ «Академкнига», 2004. — Т. 1. — С. 583; 640—641. — ISBN 5-94628-171-2.
- ↑ Длину и энергию кратной связи в винилхлориде см. в Химическая энциклопедия /И. Л. Кнунянц (Гл. ред.).
- ↑ Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону / Отв. ред. В. Н. Кондратьев. — М.: Наука, 1974. — С. 88.
- ↑ 1 2 Нейланд О. Я. Органическая химия: Учеб. для хим. вузов. — М.: Высшая школа, 1990. — С. 240. — ISBN 5-06-001471-1.
- ↑ 1 2 3 4 5 Medical Management Guidelines for Vinyl Chloride (англ.). Agency for Toxic Substances and Disease Registry (ATSDR). Дата обращения: 2 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ DeLassus Ph. T., Schmidt D. D. Solubilities of vinyl chloride and vinylidene chloride in water (англ.) // Journal of Chemical & Engineering Data. — 1981. — Vol. 26, no. 3. — P. 274—276.
- ↑ Dana L. I., Burdick J. N., Jenkins A. C. Some Pysical Properties of Vinyl Chloride (англ.) // Journal of the American Chemical Society. — 1927. — Vol. 49, no. 11. — P. 2801—2806.
- ↑ Unated States Patens 5315052. Concurrent production of trichloroethane isomers (англ.) (pdf). FreePatentsOnline (24 мая 1994). Дата обращения: 29 октября 2009. Архивировано 21 августа 2011 года.
- ↑ Ayscough P. B., Cocker A. J., Dainton F. S., Hirst S. Photochlorination studies. Part 8.—Competitive photochlorination in mixtures of cis-1, 2-dichloroethylene with (a) vinyl chloride and (b) trichloroethylene (англ.) // Transactions of the Faraday Society. — 1962. — Vol. 58. — P. 318—325.
- ↑ 1 2 3 4 5 Vinyl Chloride // Kirk-Othmer Encyclopedia of Chemical Technology. Elastomers, synthetic to Expert Systems. — 4th edition. — New York: John Wiley & Sons, 1994. — P. 413—425.
- ↑ Rinker R. G., Corcoran W. H. Catalytic Addition of Hydrogen Chloride to Vinyl Chloride (англ.) // Industrial & Engineering Chemistry Fundamentals. — 1967. — Vol. 6, no. 3. — P. 333—338.
- ↑ Шепард У., Шартс К. Органическая химия фтора = Organic Flourine Chemistry / Пер. с англ., под ред. академика И. Л. Кнунянца. — М.: Мир, 1972. — С. 59.
- ↑ Промышленные фторорганические продукты: справочное издание / Б. Н. Максимов, В. Г. Барабанов, И. Л. Серушкин и др.. — 2-е, перераб. и доп.. — СПб.: «Химия», 1996. — 544 с. — ISBN 5-7245-1043-X.
- ↑ Н. С. Верещагина, А. Н. Голубев, А. С. Дедов, В. Ю. Захаров. Российский химический журнал. Журнал Российского химического общества им. Д. И. Менделеева. — 2000. — Т. XLIV, выпуск 2. — С. 110—114.
- ↑ Kharasch M. S., Hannum C. W. The Peroxide Effect in the Addition of Reagents to Unsaturated Compounds. IV. The Addition of Halogen Acids to Vinyl Chloride (англ.) // Journal of the American Chemical Society. — 1934. — Vol. 56, no. 3. — P. 712—714.
- ↑ Unated States Patens 5345018. Method for preparing 1-chloro-1-iodoethane (англ.) (pdf). FreePatentsOnline (22 марта 1993). Дата обращения: 29 октября 2009. Архивировано 21 августа 2011 года.
- ↑ Unated States Patens 4130592. Method for the preparation of chloroacetaldehydedimethyl acetal (англ.) (pdf). FreePatentsOnline (19 декабря 1978). Дата обращения: 29 октября 2009. Архивировано 21 августа 2011 года.
- ↑ Франке З. Химия отравляющих веществ / Пер. с нем.. — М.: Химия, 1973. — Т. 1. — С. 147—148.
- ↑ Schmerling L. Condensation of Saturated Halides with Unsaturated Compounds. II. The Condensation of Alkyl Halides with Monohaloölefins1 (англ.) // Journal of the American Chemical Society. — 1946. — Vol. 68, no. 8. — P. 1650—1654.
- ↑ Kotora M., Hájekand M. Addition of tetrachloromethane to halogenated ethenes catalyzed by transition metal complexes (англ.) // Journal of Molecular Catalysis. — 1992. — Vol. 77, no. 1. — P. 51—60. (недоступная ссылка)
- ↑ Davidson J. M., Lowy A. Reactions of Vinyl Chloride and Benzene in the Presence of Aluminium Chloride (англ.) // Journal of the American Chemical Society. — 1929. — Vol. 51, no. 10. — P. 2978—2982.
- ↑ Chiba T., Takada Y., Kaneko C., Kiichi F., Tsuda Y. Cycloadditions in Syntheses. LII. Stereochemical Pathways of 1-Isoquinolone-Chloroehylene Photo[2+2cycloaddition: Determination of Regio- and Stereostructures of the Products and Explanation for Their Formation] (англ.) // Chemical & Pharmaceutical Bulletin. — 1990. — Vol. 38, no. 12. — P. 3317—3325. Архивировано 4 марта 2016 года.
- ↑ Henry P. M. Catalysis by metal complexes // Palladium catalyzed oxidation of hydrocarbons. — Dordrecht: D.Riedel Publishing Company, 1980. — P. 86. — ISBN 90-277-0986-6.
- ↑ Schildknecht C. E., Zoss A. O., McKinley C. Vinyl Alkyl Ethers (англ.) // Industrial & Engineering Chemistry. — 1947. — Vol. 39, no. 2. — P. 180—186.
- ↑ Дядченко В. П., Трушков И. В., Брусова Г. П. Часть 3 // Синтетические методы органической химии. — М.: МГУ им. Ломоносова, Химический факультет, 2004. — С. 47.
- ↑ Hatch L.F. Amination // Encyclopedia of Chemical Processing and Design: Volume 3 — Aluminum to Asphalt: Design / Edited by John J. McKetta, William A. Cunningham. — New York: Marcel Dekker, Inc, 1977. — P. 140—141. — ISBN 0-824-72453-4.
- ↑ Вацуро К. В., Мищенко Г. Л. 428. Норман (Normant) // Именные реакции в органичнеской химии. — М.: Химия, 1976. — С. 299.
- ↑ Ramsdem H.E., Leebrick J.R., Rosenberg S.D., Miller E.H., Walburn J.J., Balint A.E., Cserr R. Preparation of Vinylmagnesium Chloride and Some Homologs (англ.) // The Journal of Organic Chemistry. — 1957. — Vol. 22, no. 12. — P. 1602—1605.
- ↑ Anderson R., Silverman M., Ritter D. Vinyl-Alkali Metal Compounds (англ.) // The Journal of Organic Chemistry. — 1958. — Vol. 23, no. 5. — P. 750.
- ↑ West R., Glaze W. Direct Preparation of Vinyllithium (англ.) // The Journal of Organic Chemistry. — 1961. — Vol. 26, no. 6. — P. 2096.
- ↑ Strassburg R. W., Gregg R. A., Walling Ch. Substituted Styrenes. II. The Preparation of p-Iodo-, p-Nitro- and p-Dimethylaminostyrene and α-Vinylthiophene (англ.) // Journal of the American Chemical Society. — 1947. — Vol. 69, no. 9. — P. 2141—2143.
- ↑ Unated States Patens 5312984. Amidation of vinyl chloride with dimethylamine using a supported palladium catalyst (англ.) (pdf). FreePatentsOnline (23 сентября 1992). Дата обращения: 29 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 Kun Si. Kinetics and Mechanism of Vinyl Chloride Polymerization: Effects of Additives on Polymerization Rate, Molecular Weight, and Defect Concentration in the Polymer. — Cleveland: Case Western Reserve University, 2007. — 381 p.
- ↑ Jones F. N. Butadiene from vinyl chloride. Platinum(II)-catalyzed coupling of vinyl halides (англ.) // The Journal of Organic Chemistry. — 1967. — Vol. 32, no. 5. — P. 1667—1668.
- ↑ Unated States Patens 2137664. Alpha, beta-dihalogenethylketones (англ.) (pdf). FreePatentsOnline (22 ноября 1938). Дата обращения: 1 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Misono A., Uchida Y., Furuhata K. Formation of Acetals from Vinyl Chloride and Alcohols Catalyzed by Transition Metal Chlorides (англ.) // Bulletin of the Chemical Society of Japan. — 1970. — Vol. 43, no. 4. — P. 1243—1244. (недоступная ссылка)
- ↑ Gerhard M., Griesbaum K. Ozonolysis of vinyl chloride in methanol: a convenient entry to methoxymethylhydroperoxide and its chemistry (англ.) // Canadian journal of chemistry. — 1983. — Vol. 61, no. 10. — P. 2385—2388. (недоступная ссылка)
- ↑ Hudlický M. Reductions in Organic Chemistry. — Chichester: Ellis Horwood Limited, 1984. — P. 66—67. — ISBN 0-85312-345-4.
- ↑ Шелит Х. Хлористый винил // Пер. с англ./под ред. проф. В.В.Коршака Мономеры. Сборник статей. — М.: Издательство иностранной литературы, 1951. — Т. 1. — С. 190—208.
- ↑ Mарч Дж. Органическая химия. Реакции, механизмы и структура. Углубленный курс для университетов и химических вузов: в 4 томах = Advanced organic chemistry. Reactions, Mechanisms and Structure / Пер. с англ., под редакцией И.П.Белецкой. — М.: «Мир», 1988. — Т. 3. — С. 353—354.
- ↑ 1 2 3 Производство винилхлорида. Новый справочник химика и технолога. Сырьё и продукты промышленности органических и неорганических веществ (часть II) (1 апреля 2009). Дата обращения: 3 ноября 2009. Архивировано 20 августа 2014 года.
- ↑ 1 2 3 4 5 Production of Vinyl Chloride Monomer (VCM) // Assessment of Mercury Releases from the Russian Federation / Arctic Council Action Plan to Eliminate Pollution of the Arctic (ACAP), Russian Federal Service for Environmental, Technological and Atomic Supervision & Danish Environmental Protection Agency. — Copenhagen: Danish EPA, 2005. — P. 62—64.
- ↑ 1 2 Turov Y. Y., Parshina G. A. Manufacture of analogous products on acetylene and olefins base in the US (англ.) // Chemistry and Technology of Fuels and Oils. — 1968. — Vol. 4, no. 7. — P. 548—551. (недоступная ссылка)
- ↑ 1 2 3 4 1,3-Butadiene, Ethylene Oxide and Vinyl Halides (Vinyl Fluoride, Vinyl Chloride and Vinyl Bromide). — IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 97. — Lyon: International Agency for Research on Cancer, 2008. — 311—323 p. — ISBN 978-92-832-1297-3. Архивировано 10 сентября 2011 года.
- ↑ Benyahia F. The VCM Process Economics: Global and Raw Material Impacts (англ.) (pdf). Proceedings of the 1st Annual Gas Processing Symposium. Norvegian University of Science and Technology. Дата обращения: 2 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Linak E. Vinyl Chloride Monomer (VCM) (англ.). CEH Report. SRI Consulting (июнь 2009). Дата обращения: 5 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. — 4-е изд., перераб. и доп. — М.: Химия, 1988. — С. 140—141. — ISBN 5-7245-0008-6.
- ↑ 1 2 Vinyl chloride and polyvinyl chloride (англ.) (pdf). Publications. Uhde GmbH. Дата обращения: 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ EDC DIRECT CHLORINATION Process using Boiling Reactor Technology and DIRECT CHLORINATION Catalyst (англ.). VinTec Licensing Activities. Vinnolit GmbH. Дата обращения: 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ EDC OXYCHLORINATION Process (англ.). VinTec Licensing Activities. Vinnolit GmbH. Дата обращения: 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ EDC DISTILLATION (англ.). VinTec Licensing Activities. Vinnolit GmbH. Дата обращения: 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ EDC CRACKING Process (англ.). VinTec Licensing Activities. Vinnolit GmbH. Дата обращения: 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ VCM DISTILLATION (англ.). VinTec Licensing Activities. Vinnolit GmbH. Дата обращения: 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ BY-PRODUCT RECOVERY Process (англ.). VinTec Licensing Activities. Vinnolit GmbH. Дата обращения: 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 4 Chauvel A., Lefebvre G. Petrochemical processes 2. Major Oxygenated, Chlorinated and Nitrated Derivatives. — 2nd Edition. — Paris: Editions Technip, 1989. — P. 184—187. — ISBN 2-7108-0563-4.
- ↑ 1 2 New VCM Plant Will Use Ethane (англ.). Hydrocarbon Online (9 сентября 1999). Дата обращения: 11 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Wilhelmshaven VCM Facility, Germany (англ.). Industry Projects. Сhemicals-technology.com. Дата обращения: 11 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ History (англ.). INEOS. Дата обращения: 2 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Spitz P. H. The chemical industry at the millenium: maturity, restructuring, and globalization. — Philadelphia: Chemical Heritage Foundation, 2003. — P. 77. — ISBN 0-941901-34-3.
- ↑ Unated States Patens 4300005. Preparation of vinyl chloride (англ.) (pdf). FreePatentsOnline (2 декабря 1977). Дата обращения: 3 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Unated States Patens 20060167325. Method for producing vinyl chloride monomer (англ.) (pdf). FreePatentsOnline (24 января 2005). Дата обращения: 3 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Vinyl Chloride Monomer (VCM) (англ.). Chemical Economics Handbook. IHS Markit (январь 2015). Дата обращения: 18 января 2017. Архивировано 18 января 2017 года.
- ↑ Ethylene (англ.). WP Report. IHS (январь 2011). Дата обращения: 17 января 2012. Архивировано 23 января 2012 года.
- ↑ Propylene (англ.). WP Report. IHS (январь 2011). Дата обращения: 17 января 2012. Архивировано 23 января 2012 года.
- ↑ Methanol (англ.). WP Report. IHS (январь 2011). Дата обращения: 17 января 2012. Архивировано 23 января 2012 года.
- ↑ Terephthalic Acid (TPA) (англ.). WP Report. IHS (январь 2011). Дата обращения: 17 января 2012. Архивировано 23 января 2012 года.
- ↑ Benzene (англ.). WP Report. IHS (январь 2011). Дата обращения: 17 января 2012. Архивировано 23 января 2012 года.
- ↑ Ethylene (англ.). WP Report. SRI Consulting (январь 2009). Дата обращения: 5 октября 2009. Архивировано 21 августа 2011 года.
- ↑ Vinyl Chloride Market: Trends & Dynamics (англ.). Merchant Research and Consulting Ltd. (15 сентября 2022). Архивировано 8 декабря 2023 года.
- ↑ 1 2 Vinyl Chloride Monomer (VCM) (англ.). WP Report. IHS (январь 2011). Дата обращения: 17 января 2012. Архивировано 23 января 2012 года.
- ↑ Vinyl Chloride Monomer (англ.). WP Report. SRI Consulting (январь 2009). Дата обращения: 28 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Vinyl Chloride (англ.). The Innovation Group. Дата обращения: 5 ноября 2009. Архивировано 27 июля 2009 года.
- ↑ Product Safety Assessment: Vinyl Chloride Monomer (англ.). Product Safety. Dow Chemical. Дата обращения: 6 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Tickner J.A. Trends in World PVC Industry Expansion A Greenpeace White Paper (англ.). Ecology Center (19 июня 1998). Архивировано 21 августа 2011 года.
- ↑ Chemical Industries Newsletter (англ.) (pdf). SRI Consulting (июль 2006). Дата обращения: 12 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Справка о состоянии «хлорной» отрасли химической промышленности России. Подготовлено Российским Центром «Хлорбезопасность». Федеральная Антимонопольная Служба РФ (23 августа 2004). Дата обращения: 27 октября 2009. Архивировано из оригинала 12 августа 2011 года.
- ↑ История компании. ОАО «Саянскхимпласт». Дата обращения: 8 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Годовой отчёт Открытого акционерного общества «Саянскхимпласт» 2008 год (pdf). ОАО «Саянскхимпласт». Дата обращения: 1 декабря 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Годовой отчёт Открытого Акционерного Общества «Каустик» за 2008 год (pdf). ОАО «Каустик». Дата обращения: 8 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Официальный сайт Открытого акционерного общества «Пласткард». ОАО «Пласткард». Дата обращения: 8 ноября 2009. Архивировано из оригинала 23 сентября 2011 года.
- ↑ 1 2 Годовой отчёт ОАО «Сибур-Нефтехим» за 2008 год. — ОАО «Сибур-Нефтехим», 2009. — 58 с. Архивировано 6 января 2012 года.
- ↑ Годовой отчёт за 2008 год Волгоградского открытого акционерного общества «Химпром» (doc). ВОАО «Химпром». Дата обращения: 1 декабря 2009. Архивировано 4 марта 2016 года.
- ↑ В присутствии Президента РФ состоялось торжественное открытие производственного комплекса «РусВинил». rusvinyl.ru. Дата обращения: 5 апреля 2018. Архивировано 5 апреля 2018 года.
- ↑ Нижегородское правительство, Администрация Кстовского района и «Русвинил» 24 июня заключат соглашение о сотрудничестве. Р52.РУ (24 июня 2009). Дата обращения: 8 ноября 2009. Архивировано из оригинала 9 августа 2011 года.
- ↑ ООО «Карпатнефтехим» (ЗАО «ЛУКОР»). ОАО «Лукойл». Дата обращения: 8 ноября 2009. Архивировано из оригинала 8 июня 2007 года.
- ↑ Vinyl Chloride Monomer (VCM) Uses and Market Data (англ.). ICIS.com. Дата обращения: 28 июня 2022. Архивировано 7 июля 2022 года.
- ↑ Анализ рентабельности и стоимости производства ПВХ в Европе и Юго-Восточной Азии (англ.) (pdf). Консалтинг, Нефтегазовая практика, 2010 год. Делойт и Туш Риджинал Консалтинг Сервисис Лимитед (2011). Дата обращения: 3 февраля 2013. Архивировано 9 марта 2013 года.
- ↑ Bloch H. P., Godse A. Compressors and modern process applications. — John Wiley and Sons, 2006. — P. 322. — ISBN 978-0-471-72792-7.
- ↑ Chisso PVC Process (англ.). Chisso Corporation. Дата обращения: 3 ноября 2009. Архивировано 22 апреля 2008 года.
- ↑ 1 2 SUSPENSION-PVC Process (англ.). VinTec Licensing Activities. Vinnolit GmbH & Co. KG. Дата обращения: 5 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Weissermel K., Arpe H.-J. Industrial organic chemistry. — Fourth, Comletely Revised Edition. — Weinheim: Wiley-VCH, 2003. — P. 223—226. — ISBN 3-527-30578-5.
- ↑ Public Health Statement for Vinyl Chloride (англ.). Agency for Toxic Substances and Disease Registry (ATSDR). Дата обращения: 4 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Винилхлорид (англ.). ICSC / Международные карты Химической Безопасности. Институт промышленной безопасности, охраны труда и социального партнерства. Дата обращения: 5 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Vinyl chloride (англ.). Hardy Research Group, Department of Chemistry, The University of Akron. Дата обращения: 5 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ IUCLID Dataset. Vinyl Chloride (pdf). European Commission's Joint Research Centre (19 февраля 2000). Дата обращения: 27 октября 2009. (недоступная ссылка)
- ↑ 1 2 Vinyl chloride (англ.). International Programme on Chemical Safety (IPCS). Дата обращения: 26 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Spencer A. B., Colonna G. R. Nfpa Guide to Hazardous Materials. — Quincy: National Fire Protection Association, 2003. — P. 165. — ISBN 0-87765-558-8.
- ↑ Хлорпроизводные непредельных алифатических углеводородов. Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы. ChemAnalitica.com. Дата обращения: 5 ноября 2009. Архивировано 4 июня 2012 года.
- ↑ Overall Evaluations of Carcinogenicity: An Updating of IARC Monographs, Volumes 1 to 42, Supplement 7. — Lyon: lnternational Agency for Research on Cancer, 1987. — P. 373—376. — ISBN 92-832-1411-0. Архивировано 6 марта 2008 года. Архивированная копия. Дата обращения: 13 ноября 2009. Архивировано 6 марта 2008 года.
- ↑ Vinyl Chloride CAS No. 75-01-4 (англ.) (pdf). National Institutes of Health within the U.S. Department of Health and Human Services. Дата обращения: 12 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Винилхлорид. Отравления профессиональные. Медицинский портал MedSite. Дата обращения: 2 ноября 2009. Архивировано 5 декабря 2008 года.
- ↑ Fazlul H. Molecular Modelling Analysis of the Metabolism of Vinyl Chloride (англ.) // Journal of Pharmacology and Toxicology. — 2006. — Vol. 1, no. 4. — P. 299—316. (недоступная ссылка)
- ↑ 1 2 3 4 Vinyl Chloride (англ.) (pdf). OECD Initial Assessment Reports For High Production Volume Chemicals including Screening Information Datasets (SIDS). UNEP Chemicals (декабрь 2006). Дата обращения: 5 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 ToxGuideTM for Vinyl Chloride (англ.) (pdf). Agency for Toxic Substances and Disease Registry (ATSDR). Дата обращения: 2 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Davis J.W., Carpenter C.L. Aerobic Biodegradation of Vinyl Chloride in Groundwater Samples (англ.) // Applied and Enviromental Microbiology. — 1990. — Vol. 56, no. 12. — P. 3878—3880.
- ↑ Barrio-Lage G. A., Parsons F. Z., Narbaitz R. M., Lorenzo P. A., Archer H. E. Enhanced Anaerobic Biodegradation Iof Vintyl Chloride in Ground Water (англ.) // Environmental Toxicology and Chemistry. — 1990. — Vol. 9, no. 4. — P. 403—415.
- ↑ Гигиенические нормативы (ПДК, ОБУВ, ОДУ) химических веществ в воздухе рабочей зоны, атмосферном воздухе населенных мест, воде водоемов. Новый справочник химика и технолога. Вредные химические вещества. Радиоактивные вещества. Гигиенические нормативы. ChemAnalitica.com. Дата обращения: 21 сентября 2009. Архивировано 20 августа 2014 года.
- ↑ Maximum Exposure Limits (англ.). The Physical and Theoretical Chemistry Laboratory Oxford University. Дата обращения: 26 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Safety Data Sheet. Vinyl Chloride (англ.) (pdf). Gas Encyclopaedia. Air Liquide. Дата обращения: 28 октября 2009. Архивировано 7 апреля 2009 года.
- ↑ Minimal Risk Levels (MRLs) (англ.) (pdf). Agency for Toxic Substances and Disease Registry (ATSDR) (декабрь 2008). Дата обращения: 4 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ VCM (Vinyl Chloride Monomer) (англ.). Chemicals. Saudi Basic Industries Corporation (SABIC). Дата обращения: 7 декабря 2009. Архивировано 21 августа 2011 года.
- ↑ Крушение поезда с химикатами в Огайо: почему американские СМИ с опозданием заметили экологическую катастрофу Архивная копия от 15 февраля 2023 на Wayback Machine // Российская газета
- ↑ Облако в шарах: от катастрофы в Огайо попытались отвлечь китайским зондом. Белый дом обвиняют в попытке манипулировать американским обществом Архивная копия от 17 февраля 2023 на Wayback Machine // Известия, 18 февраля 2023
Литература и прочие внешние источники
[править | править код]Монографии
[править | править код]- Флид М. Р., Трегер Ю. А. Винилхлорид: химия и технология. В 2 книгах. — М.: Калвис, 2008. — 584 с. — ISBN 978-5-89530-019-0.
Химия, промышленное производство и применение винилхлорида
[править | править код]- Елфимова С. Н., Яковенко Д. Ю. Вариант модернизации технологии получения винилхлорида из 1,2-дихлорэтана // Альманах современной науки и образования, Тамбов: Грамота. — 2011. — № 5 (48). — С. 69—70. Архивировано 16 июля 2014 года.
- Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. — 4-е изд., перераб. и доп. — М.: «Химия», 1988. — С. 126—127; 140—141; 146—152. — ISBN 5-7245-0008-6.
- Технология производства винилхлорида и поливинилхлорида (pdf) 34. Uhde GmbH (30 мая 2012). Дата обращения: 15 июля 2014. Архивировано из оригинала 16 июля 2014 года.
- Флид М. Р. Состояние и перспективы развития производства винилхлорида − мономера для получения ПВХ (pdf). Дата обращения: 15 июля 2014. Архивировано из оригинала 23 сентября 2015 года.
- Юкельсон И. И. Технология основного органического синтеза. — М.: «Химия», 1968. — С. 299—310.
- Barnes A. W. Vinyl Chloride and the Production of PVC (англ.) // Proceeding of the Royal Society of Medicine. — 1976. — Vol. 69, no. 4. — P. 277—281.
- Cowfer J. A. Part 2. Vinyl Chloride Monomer // PVC Handbook / Wilkes C. E., Summers J. W., Daniels C. A.. — 1 st ed. — Minich: Carl Hanser Verlag, 2005. — P. 19-56. — ISBN 1-56990-379-4.
- Kun Si. Vinyl Chloride Polymerization in presence of Organic Additives: New Kinetics and Mechanism of Vinyl Chloride Polymerization and Correlation between Structural defects and Dehydrochlorination of Polyvinyl Chloride. — VDM Verlag, 2010. — 288 p. — ISBN 978-3-6392-1368-3.
- Naqvi M. K., Kulshreshtha A. K. Vinyl Chloride Manufacture: Technology Trends and an Energy Economic Perspective (англ.) // Polymer-Plastics Technology and Engineering. — 1995. — Vol. 34, no. 2. — P. 213—226.
- Saeki Y., Emura T. Technical progresses for PVC production (англ.) // Progress in Polymer Science. — 2002. — Vol. 27, no. 10. — P. 2055—2131.
- Sittig M. Vinyl Chloride and PVC Manufacture: Process and Environmental Aspects (Pollution Technology Review). — Noyes Data Corporation, 1978. — 350 p. — ISBN 978-0815507079.
- Vinyl Chloride // Kirk-Othmer Encyclopedia of Chemical Technology. Elastomers, synthetic to Expert Systems. — 4-th edition. — New York: John Wiley & Sons, 1994. — P. 413-425.
Физиологическое воздействие винилхлорида
[править | править код]- Могиленкова Л. А. Воздействие винилхлорида на состояние здоровья работающих в производственных условиях (обзор) // Профилактическая медицина. — 2011. — Т. 11, июнь. — С. 558—571.
- Barrio-Lage G. A., Parsons F. Z., Narbaitz R. M., Lorenzo P. A., Archer H. E. Enhanced Anaerobic Biodegradation Iof Vintyl Chloride in Ground Water (англ.) // Environmental Toxicology and Chemistry. — 1990. — Vol. 9, no. 4. — P. 403—415.
- 1,3-Butadiene, Ethylene Oxide and Vinyl Halides (Vinyl Fluoride, Vinyl Chloride and Vinyl Bromide). — IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 97. — Lyon: International Agency for Research on Cancer, 2008. — 525 p. — ISBN 978-92-832-1297-3.
- Environmental Health Criteria 215. Vinyl Chloride. — Geneva: World Health Organization, 1999. — 382 p. — ISBN 92-4-157215-9.
- Fazlul H. Molecular Modelling Analysis of the Metabolism of Vinyl Chloride (англ.) // Journal of Pharmacology and Toxicology. — 2006. — Vol. 1, no. 4. — P. 299—316. (недоступная ссылка)
- Hartmans S., De Bont J. A. Aerobic Vinyl Chloride Metabolism in Mycobacterium aurum LI (англ.) // Applied and Enviromental Microbiology. — 1992. — Vol. 58, no. 4. — P. 3878—3880.
- IUCLID Dataset. Vinyl Chloride (англ.) (pdf). European Commission's Joint Research Centre (19 февраля 2000). Дата обращения: 27 октября 2009. (недоступная ссылка)
- Plugge H., Safe S. Vinyl chloride metabolism — A review (англ.) // Chemosphere. — 1977. — Vol. 6, no. 6. — P. 309—325.
- Selikoff I. J., Hammond E. C. Toxicity of Vinyl Chloride — Polyvinyl Chloride. — Annals of New York Academy of Sciences. — New York: New York Academy of Sciences, 1975. — P. 337.
- Toxicological profile for vinyl chloride. — Agency for Toxic Substances and Disease Registry U.S. Public Health Service, 2006. — 328 p.
- Vinyl Chloride (BUA Report) / Gesellschaft Deutscher Chemiker Advisory Committee. — Wiley-VCH Verlag GmbH, 1992. — 99 p. — ISBN 978-3527285242.
- Vinyl Chloride in Drinking-water / Background document for development of WHO Guidelines for Drinking-water Quality. — World Health Organization, 2004. — 23 p.
- Vinyl chloride: health and safety guide / International Program on Chemical Safety, United Nations Environment Programme, International Labour Organisation, World Health Organization, Inter-Organization Programme for the Sound Management of Chemicals. — Geneva: World Health Organization, 1999. — 28 p. — ISBN 92-4-151109-5.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |










![{\displaystyle {\ce {CH2=CHCl{}+ 2 HF ->[{\ce {SnCl4}}] CH3-CHF2{}+ HCl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/ba7f6f18c056267dfe322003a88ad6871887538c)
![{\displaystyle {\ce {CH2=CH-Cl{}+ HBr ->[{\ce {ROOH}}] CH2Br-CH2Cl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/92265af5c2de414633c6447920fb4e45bc7c348b)
![{\displaystyle {\ce {CH2=CH-Cl{}+ HI ->[{\ce {I_2}}] CH3-CH(I)Cl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/fe166bfa3ac1dccbc563eb52a87f39dd51a9b707)

![{\displaystyle {\ce {CH2=CH-Cl{}+ HClO -> [ClCH2-CH(OH)Cl] -> ClCH2-CHO{}+ HCl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/1bfd3f64698b8ba85f0becc7d2bd7607c82c13fa)
![{\displaystyle {\ce {CH2=CH-Cl{}+Cl2{}+CH3OH->ClCH2-CH(OCH3)Cl{}+HCl->[+~{\ce {CH3OH}}]ClCH2-CH(OCH3)2{}+HCl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/8452a89be50ada7b0d0eee417a6edbcb1b89e872)








![Реакция [2+2] циклоприсоединения винилхлорида к 1-изохинолону](/upwiki/wikipedia/commons/thumb/c/c6/Vinyl-chloride-cycloaddition-to-isoquinolone.png/450px-Vinyl-chloride-cycloaddition-to-isoquinolone.png)
![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+CH_{3}COONa\ {\xrightarrow[{CH_{3}COOH}]{PdCl_{2}}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!OCOCH_{3}+NaCl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/1e0dca5b981978525bcc34a6792133d3c09bae6b)
![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+C_{2}H_{5}ONa\ {\xrightarrow[{C_{2}H_{5}OH}]{100\ ^{o}C}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!OC_{2}H_{5}+NaCl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/82162f9cc9f5bad24489b2997394b469faae271c)
![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+HNRR'\ {\xrightarrow[{t-BuONa,\ C_{6}H_{5}CH_{3},\ 70-90\ ^{o}C}]{PdCl_{2},\ [o-CH_{3}(C_{6}H_{4})]_{3}P}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!NRR'+HCl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/404a60a5ee715c9051adb58901d3d69dd2b49438)
![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+NH_{3}\ {\xrightarrow[{Na-Hg}]{50\ ^{o}C}}\ (CH_{2}\!\!-\!\!CH_{2})NH+HCl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/bcb8d913978449e907e875a11a554388707bc58f)
![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+Mg\ {\xrightarrow[{THF}]{40-50\ ^{o}C}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!MgCl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/d503588f404f4a7e6c127e4d4d4dba2b57227a4a)

![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+2K\ {\xrightarrow[{THF}]{Na,\ 0\ ^{o}C}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!K+KCl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/90c653578ca9d49c738a3e2d22cee948f08a892f)
![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+2Li\ {\xrightarrow[{THF}]{Na,\ 0-10\ ^{o}C}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!Li+LiCl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/bd2d256c4d1bca7ac6c997b6a022d34956d0c116)













![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+R\!\!-\!\!COCl\ {\xrightarrow {AlCl_{3}}}\ CH_{2}Cl\!\!-\!\!CHCl\!\!-\!\!C(O)R{\xrightarrow[{-HCl}]{\ }}CHCl\!\!=\!\!CHC\!\!-\!\!C(O)R}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/8c0c7734dc0545f11322b1593dec2a71027ec757)

![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+5[O]\ \xrightarrow {KMnO_{4},\ H_{2}O\ ,\ ^{o}t} \ 2CO_{2}+H_{2}O+HCl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/0f84d5bf185cd352c85955d22a307ebd0cdba58c)





![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+2H_{2}\ {\xrightarrow[{-HCl}]{Ni_{Reney},\ KOH}}\ CH_{3}\!\!-\!\!CH_{3}}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/f762b76b49d67598c4e89b67e4754b5442ed93f7)






























![{\displaystyle {\ce {CH2=CHCl{}+ HCl ->[{\ce {FeCl3}}] CH3-CHCl2}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/21d585a0103dbd87f24b4ce3157351eb71b42211)
![{\displaystyle {\ce {CH3-CHCl2{}+Cl2->[{\text{370—400 °C}}]CH3-CCl3{}+HCl}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/bf7b36880fd2595f8a7aa3be2705518d3d769e5d)


