Фторид серы(VI): различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
MBHbot (обсуждение | вклад) |
По ссылке в УФН всё есть. История к получению, если нет отдельного раздела. |
||
| (не показано 17 промежуточных версий 14 участников) | |||
| Строка 66: | Строка 66: | ||
| СГС = {{СГС|Восклицательный знак|Баллон}} |
| СГС = {{СГС|Восклицательный знак|Баллон}} |
||
}} |
}} |
||
''' |
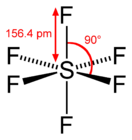
'''Гексафтори́д се́ры''' (также '''элега́з''' или '''шестифто́ристая се́ра''', '''SF<sub>6</sub>''') — неорганическое вещество, при [[Стандартные условия|стандартных условиях]] представляет собой тяжёлый [[газ]] (в {{num|5|раз}} тяжелее [[воздух]]а). Применяется в электротехнике. |
||
== Методы получения == |
== Методы получения == |
||
| Строка 74: | Строка 74: | ||
Также гексафторид серы образуется при разложении сложных фторидов серы: |
Также гексафторид серы образуется при разложении сложных фторидов серы: |
||
: <math>\mathsf{S_2F_{10} \rightarrow SF_6 + SF_4}</math> |
: <math>\mathsf{S_2F_{10} \rightarrow SF_6 + SF_4}</math> |
||
Соединение было впервые получено и описано в 1900 году [[Муассан, Анри|Анри Муассаном]] в ходе работ по изучению химии [[фтор]]а. |
|||
== Физико-химические свойства == |
== Физико-химические свойства == |
||
Практически бесцветный газ, без запаха и вкуса. |
Практически бесцветный газ, без запаха и вкуса. |
||
Обладает высоким [[Электрический пробой|пробивным]] напряжением ({{num|89|кВ/см}} — примерно в {{num|3|раза}} выше, чем у [[воздух]]а при нормальном давлении). |
|||
Охлаждение газа при атмосферном давлении приводит к конденсации в бесцветное твёрдое вещество при −63,8 °C. Твёрдый гексафторид серы может быть расплавлен под давлением при −{{nobr|50,8 °C}}. Параметры [[Тройная точка|тройной точки]]: {{nobr|{{math|''t''}} {{=}} −50,8 °C}}, {{nobr|{{math|''P''}} {{=}} 2,3 атм}}<ref name=opa75/>. |
|||
В твёрдой фазе при {{nobr|{{math|''T''}} {{=}} 94,30 К}} — происходит эндотермическое фазовое превращение<ref name=opa75/>. |
|||
| ⚫ | |||
Плотность элегаза при температуре {{num|20|°C}} и давлении {{num|753.5|мм рт. ст.}} составляет {{num|6.093|кг/м³}}<ref name=opa75/>. |
|||
Твёрдый гексафторид серы имеет плотность 2,683 г/см<sup>3</sup> при −195 °C, 2,51 г/см<sup>3</sup> при −50 °C<ref name=opa75/>. |
|||
| ⚫ | |||
[[Поверхностное натяжение]] жидкого гексафторида серы составляет 11,63 мН/м (−50 °C), 8,02 мН/м (−20 °C)<ref name=opa75/>. |
|||
[[Вязкость]] газообразного элегаза несколько ниже вязкости воздуха: 15,37 мкПа·с (+22,5 °C), 18,71 мкПа·с (+100 °C)<ref name=opa75/>. |
|||
[[Коэффициент теплопроводности]], Вт/(м·К): 1,32 (ж., +20 °C), 1,36 (ж., +30 °C), 1,43 (ж., +50 °C)<ref name=opa75/>, 0,0138 (г., +27,5 °C, 1 атм.)<ref>{{cite doi|10.1007/BF00500026}}</ref>. |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
=== Термодинамические величины === |
=== Термодинамические величины === |
||
| Строка 90: | Строка 110: | ||
| [[Энтропия образования]] || 291,6 Дж/(моль·К) |
| [[Энтропия образования]] || 291,6 Дж/(моль·К) |
||
|- |
|- |
||
| [[Теплоёмкость]] || 97,15 Дж/(моль·К)<ref name="Air Liquide">{{cite web |url=http://encyclopedia.airliquide.com/Encyclopedia.asp?GasID=34 |title=Sulfur hexafluoride |publisher=Air Liquide Gas Encyclopedia |accessdate=22 |
| [[Теплоёмкость]] || 97,15 Дж/(моль·К)<ref name="Air Liquide">{{cite web |url=http://encyclopedia.airliquide.com/Encyclopedia.asp?GasID=34 |title=Sulfur hexafluoride |publisher=Air Liquide Gas Encyclopedia |accessdate=2013-02-22 |archive-date=2012-03-31 |archive-url=https://web.archive.org/web/20120331215233/http://encyclopedia.airliquide.com/Encyclopedia.asp?GasID=34 |deadlink=no }}</ref> |
||
|- |
|- |
||
| [[Теплопроводность]] || 12,058 мВт/(м·К)<ref name="Air Liquide" /> |
| [[Теплопроводность]] || 12,058 мВт/(м·К)<ref name="Air Liquide" /> |
||
|- |
|- |
||
| [[Критическая точка (термодинамика)|Критическая температура]] || 318, |
| [[Критическая точка (термодинамика)|Критическая температура]] || 318,697...318,712 К (45,547...45,562 °С)<ref name=opa75/> |
||
|- |
|- |
||
| [[Критическое давление]] || 3,71 МПа |
| [[Критическое давление]] || 3,71 МПа (по разным данным, от 37,113 до 38,27 атм<ref name=opa75/>) |
||
|- |
|||
| [[Критический объём]] || 198,0 см<sup>3</sup>/моль<ref name=opa75/> |
|||
|- |
|||
| [[Критическая плотность]] || 0,73...0,7517 г/см<sup>3</sup><ref name=opa75/> |
|||
|- |
|||
| [[Теплота плавления]] || 1,1...1,39 ккал/моль<ref name=opa75/> |
|||
|- |
|||
| [[Теплота сублимации]] (при −63,8 °C) || 5,64...5,57 ккал/моль<ref name=opa75/> |
|||
|} |
|} |
||
== Химические свойства == |
== Химические свойства == |
||
Гексафторид серы — достаточно инертное соединение, не реагирует с |
Гексафторид серы — достаточно инертное соединение, наименее активное химически среди всех фторидов серы, не реагирует с чистой водой из-за кинетических факторов. Не реагирует также с растворами [[Соляная кислота|HCl]], [[Гидроксид натрия|NaOH]] и [[Аммиак|NH<sub>3</sub>]], однако при действии [[Окислительно-восстановительные реакции|восстановителей]] могут протекать некоторые реакции. Не взаимодействует с [[Галогены|галогенами]], [[фосфор]]ом, [[мышьяк]]ом, [[углерод]]ом, [[Кремний|кремнием]], [[бор (элемент)|бором]], [[медь]]ю и [[серебро]]м при температуре красного каления. Не подвергается воздействию нагретых [[Оксид меди(II)|CuO]], [[Хромат свинца(II)|PbCrO<sub>4</sub>]] и расплавленного [[Гидроксид калия|KOH]]<ref name=opa75>{{статья|автор=Опаловский А. А., Лобков Е. У.|заглавие=Гексафторид серы|издание=Успехи химии|год=1975|том=44|выпуск=2|страницы=193—213|ссылка=http://www.uspkhim.ru/php/paper_rus.phtml?journal_id=rc&paper_id=2249&year_id=1975&volume=44&issue_id=2&fpage=193&lpage=213|doi=10.1070/RC1975v044n02ABEH002249|arxiv=|язык=ru|archivedate=2022-04-01|archiveurl=https://web.archive.org/web/20220401054002/https://www.uspkhim.ru/php/paper_rus.phtml?journal_id=rc&paper_id=2249&year_id=1975&volume=44&issue_id=2&fpage=193&lpage=213}}</ref>, но при температуре выше +300°C реагирует с водой под избыточным давлением. Реакцию следует проводить при температуре не выше +370°C: |
||
| ⚫ | |||
| ⚫ | |||
Взаимодействие с металлическим [[Натрий|натрием]] проходит только при нагревании, однако уже при 64 °C взаимодействует с раствором натрия в [[аммиак]]е: |
Взаимодействие с металлическим [[Натрий|натрием]] проходит только при нагревании последнего до температуры кипения, однако уже при 64 °C взаимодействует с раствором натрия в [[аммиак]]е: : <math>\mathsf{SF_6 + 8Na \rightarrow Na_2S + 6NaF}</math> |
||
| ⚫ | |||
Гексафторид серы реагирует с [[Литий|литием]] [[Экзотермическая реакция|с выделением большого количества тепла]]: |
Гексафторид серы реагирует с [[Литий|литием]] [[Экзотермическая реакция|с выделением большого количества тепла]]: |
||
| Строка 111: | Строка 138: | ||
При этом продукты реакции — элементарная [[сера]] и [[фторид лития]] — имеют меньший объём, чем исходные вещества, что нашло применение в некоторых экзотических [[Тепловой двигатель|тепловых двигателях]] (см. [[#Mark 50|ниже]]). |
При этом продукты реакции — элементарная [[сера]] и [[фторид лития]] — имеют меньший объём, чем исходные вещества, что нашло применение в некоторых экзотических [[Тепловой двигатель|тепловых двигателях]] (см. [[#Mark 50|ниже]]). |
||
С [[водород]]ом и [[кислород]]ом гексафторид не реагирует. Однако |
С [[водород]]ом и [[кислород]]ом гексафторид не реагирует. Однако при сильном нагревании (до 400 °C) SF<sub>6</sub> взаимодействует с [[сероводород]]ом, а при 30 °C — с [[иодоводород]]ом: |
||
: <math>\mathsf{2SF_6 + 6H_2S \rightarrow S_8 + 12HF}</math> |
: <math>\mathsf{2SF_6 + 6H_2S \rightarrow S_8 + 12HF}</math> |
||
: <math>\mathsf{SF_6 + 8HI \rightarrow 6HF + H_2S + 4I_2}</math> |
: <math>\mathsf{SF_6 + 8HI \rightarrow 6HF + H_2S + 4I_2}</math> |
||
| Строка 122: | Строка 149: | ||
* как технологическая среда в электронной и металлургической промышленности; |
* как технологическая среда в электронной и металлургической промышленности; |
||
* в системах газового [[пожаротушение|пожаротушения]] в качестве пожаротушащего вещества; |
* в системах газового [[пожаротушение|пожаротушения]] в качестве пожаротушащего вещества; |
||
* как [[Холодильный агент|хладагент]] благодаря высокой [[Теплоёмкость|теплоёмкости]], низкой [[Теплопроводность|теплопроводности]] и низкой [[Вязкость|вязкости]]<ref name=elegas> |
* как [[Холодильный агент|хладагент]] благодаря высокой [[Теплоёмкость|теплоёмкости]], низкой [[Теплопроводность|теплопроводности]] и низкой [[Вязкость|вязкости]]<ref name=elegas>{{Cite web |url=http://chemindustry.ru/rus/chemicals/Sulfur_Hexafluoride.php |title=Применение шестифтористой серы |access-date=2007-04-20 |archive-date=2007-12-17 |archive-url=https://web.archive.org/web/20071217005838/http://chemindustry.ru/rus/chemicals/Sulfur_Hexafluoride.php |deadlink=no }}</ref>; |
||
* для улучшения звукоизоляции в стеклопакетах; |
* для улучшения звукоизоляции в стеклопакетах; |
||
* в полупроводниковой промышленности для плазмохимического травления кремния; |
* в полупроводниковой промышленности для плазмохимического травления кремния; |
||
* как окислитель в некоторых экзотических [[Тепловой двигатель|тепловых двигателях]] — например, в {{якорь2|Mark 50|текст=[[Паровая турбина|паротурбинной установке]] американской малогабаритной 324-мм противолодочной [[торпеда|торпеды]] [[Mark 50 (торпеда)|Mark{{nbsp}}50]], где он используется для окисления металлического [[Литий|лития]]}}. |
* как окислитель в некоторых экзотических [[Тепловой двигатель|тепловых двигателях]] — например, в {{якорь2|Mark 50|текст=[[Паровая турбина|паротурбинной установке]] американской малогабаритной 324-мм противолодочной [[торпеда|торпеды]] [[Mark 50 (торпеда)|Mark{{nbsp}}50]], где он используется для окисления металлического [[Литий|лития]]}}. |
||
При вдыхании наблюдается эффект пониженной тональности голоса, противоположный действию [[гелий|гелия]]<ref name=voice>[https://www.youtube.com/watch?v=52UAEQfMTtU Фрагмент передачи «Разрушители мифов»]</ref>. |
|||
=== Применение в электротехнике === |
=== Применение в электротехнике === |
||
Название «элегаз» шестифтористая сера получила от сокращения «электрический газ». Уникальные свойства элегаза были открыты в [[Союз Советских Социалистических Республик|СССР]], его применение также началось в Советском Союзе. В 30-х годах известный учёный [[Гохберг, Борис Михайлович|Б. М. Гохберг]] в [[Физико-технический институт имени А. Ф. Иоффе РАН|ЛФТИ]] исследовал электрические свойства ряда газов и обратил внимание на некоторые свойства шестифтористой серы SF<sub>6</sub> (элегаза)<ref>{{Статья |автор=[[Гохберг, Борис Михайлович|Гохберг Б. М.]] |заглавие=Ленинградский физико-технический институт Академии наук СССР |ссылка=http://ufn.ru/ufn40/ufn40_5/Russian/r405b.pdf |язык=ru |издание=Успехи физических наук |год=1940 |выпуск=1 |том=XXIV |страницы=11-20 }} См. стр. 16-17, раздел «Электрическая прочность газов»</ref>. Потребность в элегазе появилась в стране в начале 1980-х годов и была связана с разработкой и освоением электрооборудования для передач постоянного тока сверхвысокого напряжения. Его промышленное производство в РФ было освоено в 1998 году на [[Кирово-Чепецкий химический комбинат#Освоение элегаза|Кирово-Чепецком химическом комбинате]]<ref>{{книга |автор = Уткин В. В. |заглавие = Завод у двуречья. Кирово-Чепецкий химический комбинат имени Б. П. Константинова: строительство, развитие, люди |том = 4 (1973—1992), часть 1 |место = Киров |издательство = ОАО «Дом печати — Вятка» |год = 2007 |страницы = 66—67 |страниц = 144 |isbn = 978-5-85271-293-6| тираж = 1000 |ref=Уткин, т. 4/1}}</ref>. |
Название «элегаз» шестифтористая сера получила от сокращения «электрический газ». Уникальные свойства элегаза были открыты в [[Союз Советских Социалистических Республик|СССР]], его применение также началось в Советском Союзе. В 30-х годах известный учёный [[Гохберг, Борис Михайлович|Б. М. Гохберг]] в [[Физико-технический институт имени А. Ф. Иоффе РАН|ЛФТИ]] исследовал электрические свойства ряда газов и обратил внимание на некоторые свойства шестифтористой серы SF<sub>6</sub> (элегаза)<ref>{{Статья |автор=[[Гохберг, Борис Михайлович|Гохберг Б. М.]] |заглавие=Ленинградский физико-технический институт Академии наук СССР |ссылка=http://ufn.ru/ufn40/ufn40_5/Russian/r405b.pdf |язык=ru |издание=Успехи физических наук |год=1940 |выпуск=1 |том=XXIV |страницы=11-20 |archivedate=2016-03-04 |archiveurl=https://web.archive.org/web/20160304070634/http://ufn.ru/ufn40/ufn40_5/Russian/r405b.pdf }} См. стр. 16-17, раздел «Электрическая прочность газов»</ref>. Потребность в элегазе появилась в стране в начале 1980-х годов и была связана с разработкой и освоением электрооборудования для передач постоянного тока сверхвысокого напряжения. Его промышленное производство в РФ было освоено в 1998 году на [[Кирово-Чепецкий химический комбинат#Освоение элегаза|Кирово-Чепецком химическом комбинате]]<ref>{{книга |автор = Уткин В. В. |заглавие = Завод у двуречья. Кирово-Чепецкий химический комбинат имени Б. П. Константинова: строительство, развитие, люди |том = 4 (1973—1992), часть 1 |место = Киров |издательство = ОАО «Дом печати — Вятка» |год = 2007 |страницы = 66—67 |страниц = 144 |isbn = 978-5-85271-293-6| тираж = 1000 |ref=Уткин, т. 4/1}}</ref>. |
||
Электрическая прочность при атмосферном давлении и зазоре 1 см составляет 89 кВ/см. Характерным является очень большой коэффициент теплового расширения и высокая плотность. Это важно для энергетических установок, в которых проводится охлаждение каких-либо частей устройства, так как при большом коэффициенте теплового расширения легко образуется конвективный поток, уносящий тепло<ref>{{cite web|url=http://sermir.narod.ru/tryd/Posob/gazy.htm|author=Коробейников С.М., д.ф.м.н., профессор.|title=Диэлектрические материалы. 4.1.2. Электроотрицательные газы, применение газообразных диэлектриков.|accessdate=2011-06-02|lang=ru}}</ref>. |
Электрическая прочность при атмосферном давлении и зазоре 1 см составляет 89 кВ/см. Характерным является очень большой коэффициент теплового расширения и высокая плотность. Это важно для энергетических установок, в которых проводится охлаждение каких-либо частей устройства, так как при большом коэффициенте теплового расширения легко образуется конвективный поток, уносящий тепло<ref>{{cite web|url=http://sermir.narod.ru/tryd/Posob/gazy.htm|author=Коробейников С.М., д.ф.м.н., профессор.|title=Диэлектрические материалы. 4.1.2. Электроотрицательные газы, применение газообразных диэлектриков.|accessdate=2011-06-02|lang=ru|archive-date=2014-10-06|archive-url=https://web.archive.org/web/20141006124423/http://sermir.narod.ru/tryd/Posob/gazy.htm|deadlink=no}}</ref>. |
||
В центре молекулы элегаза расположен атом серы, а на равном расстоянии от него в вершинах правильного октаэдра располагаются шесть атомов фтора. Это определяет высокую эффективность захвата электронов молекулами, их относительно |
В центре молекулы элегаза расположен атом серы, а на равном расстоянии от него в вершинах правильного октаэдра располагаются шесть атомов фтора. Это определяет высокую эффективность захвата электронов молекулами, их относительно небольшую длину свободного пробега и слабую реакционную способность. Поэтому элегаз обладает высокой электрической прочностью. |
||
Элегаз безвреден в смеси с воздухом. Однако вследствие нарушения технологии производства элегаза или его разложения в аппарате под действием электрических разрядов ([[Электрическая дуга|дугового]], [[Коронный разряд|коронного]], [[Частичные разряды|частичных]]), в элегазе могут возникать чрезвычайно активные в химическом отношении и вредные для человека примеси, а также различные твёрдые соединения, оседающие на стенах конструкции. Интенсивность образования таких примесей зависит от наличия в элегазе примесей кислорода и особенно паров воды. |
Элегаз безвреден в смеси с воздухом. Однако вследствие нарушения технологии производства элегаза или его разложения в аппарате под действием электрических разрядов ([[Электрическая дуга|дугового]], [[Коронный разряд|коронного]], [[Частичные разряды|частичных]]), в элегазе могут возникать чрезвычайно активные в химическом отношении и вредные для человека примеси, а также различные твёрдые соединения, оседающие на стенах конструкции. Интенсивность образования таких примесей зависит от наличия в элегазе примесей кислорода и особенно паров воды. |
||
| Строка 140: | Строка 165: | ||
Некоторое количество элегаза в электротехнической аппаратуре также разлагается в процессе нормальной работы. Например, коммутация тока {{num|31.5|кА}} в выключателе {{num|110|кВ}} приводит к разложению 5—7{{nbsp}}см³ элегаза на {{num|1|кДж}} выделяемой в дуге энергии. |
Некоторое количество элегаза в электротехнической аппаратуре также разлагается в процессе нормальной работы. Например, коммутация тока {{num|31.5|кА}} в выключателе {{num|110|кВ}} приводит к разложению 5—7{{nbsp}}см³ элегаза на {{num|1|кДж}} выделяемой в дуге энергии. |
||
Стоимость элегаза довольно высока, однако он нашёл достаточно широкое применение в технике, особенно в высоковольтной электротехнике. Он прежде всего используется как [[диэлектрик]], то есть в качестве основной изоляции для [[Комплектное распределительное устройство|комплектных распределительных устройств]], высоковольтных измерительных трансформаторов тока и напряжения и др<ref>{{Cite web |url=http://zva.uran.biz.ua/ru/articleelegaz/ |title=ЗВА :: Измерительные трансформаторы с газовой изоляцией |accessdate=2009-12-16 |archiveurl=https://web.archive.org/web/20110527203753/http://zva.uran.biz.ua/ru/articleelegaz/ |archivedate=2011-05-27 |deadlink=yes }}</ref>. Также элегаз используется как среда дугогашения в [[Элегазовый силовой выключатель|высоковольтных выключателях]]<ref> |
Стоимость элегаза довольно высока, однако он нашёл достаточно широкое применение в технике, особенно в высоковольтной электротехнике. Он прежде всего используется как [[диэлектрик]], то есть в качестве основной изоляции для [[Комплектное распределительное устройство|комплектных распределительных устройств]], высоковольтных измерительных трансформаторов тока и напряжения и др<ref>{{Cite web |url=http://zva.uran.biz.ua/ru/articleelegaz/ |title=ЗВА :: Измерительные трансформаторы с газовой изоляцией |accessdate=2009-12-16 |archiveurl=https://web.archive.org/web/20110527203753/http://zva.uran.biz.ua/ru/articleelegaz/ |archivedate=2011-05-27 |deadlink=yes }}</ref>. Также элегаз используется как среда дугогашения в [[Элегазовый силовой выключатель|высоковольтных выключателях]]<ref>{{Cite web |url=http://electricalschool.info/main/visokovoltny/359-jelegaz-i-ego-svojjstva.html |title=Применение SF<sub>6</sub> в высоковольтной электронике. |access-date=2009-07-09 |archive-date=2009-07-15 |archive-url=https://web.archive.org/web/20090715042535/http://electricalschool.info/main/visokovoltny/359-jelegaz-i-ego-svojjstva.html |deadlink=no }}</ref>. |
||
Основные преимущества элегаза перед его основным «конкурентом», [[трансформаторное масло|трансформаторным маслом]], это: |
Основные преимущества элегаза перед его основным «конкурентом», [[трансформаторное масло|трансформаторным маслом]], это: |
||
| Строка 155: | Строка 180: | ||
=== Вредное воздействие === |
=== Вредное воздействие === |
||
{{mainref|<ref> |
{{mainref|<ref>{{Cite web |url=http://elegas.ru/elegaz_opt.htm |title=Элегаз. Свойства |access-date=2012-07-17 |archive-date=2012-01-06 |archive-url=https://web.archive.org/web/20120106082622/http://elegas.ru/elegaz_opt.htm |deadlink=no }}</ref>}} |
||
По степени воздействия на организм человека относится к малоопасным химическим веществам ([[класс опасности]] IV согласно ГОСТ 12.1.007-76). |
По степени воздействия на организм человека относится к малоопасным химическим веществам ([[класс опасности]] IV согласно ГОСТ 12.1.007-76). |
||
| Строка 162: | Строка 187: | ||
Потенциал разрушения озонового слоя ODP = 0. |
Потенциал разрушения озонового слоя ODP = 0. |
||
Сильнейший известный парниковый газ, потенциал глобального потепления GWP = {{num|24900}}. Из-за небольших объёмов изготовления вклад в глобальное потепление не превышает 0,2 %. Регламентируется [[Киотский протокол|Киотским протоколом]]. |
Сильнейший известный парниковый газ, [[потенциал глобального потепления]] GWP = {{num|24900}}. Из-за небольших объёмов изготовления вклад в глобальное потепление не превышает 0,2 %. Регламентируется [[Киотский протокол|Киотским протоколом]]. |
||
== Дополнительная информация == |
|||
| ⚫ | Если наполнить гексафторидом серы открытый сверху сосуд (так как газ тяжелее воздуха, то он не будет «выливаться» из сосуда) и поместить туда лёгкую лодочку, сделанную, например, из фольги, то лодочка будет держаться на поверхности и не «утонет». Этот опыт был показан в передаче «[[Разрушители легенд]]» как фокус с «прозрачной водой»<ref name="ship">{{Cite web|url=https://www.youtube.com/watch?t=416&v=i0q6qBJRZF8|title=Фрагмент передачи «Разрушители мифов»|access-date=2022-12-20|archive-date=2022-12-20|archive-url=https://web.archive.org/web/20221220073803/https://www.youtube.com/watch?t=416&v=i0q6qBJRZF8|url-status=live}}</ref>. |
||
Также высокая плотность газа приводит к комичному эффекту при его вдыхании — голос становится очень низким и грубым, подобно голосу [[Дарт Вейдер|Дарта Вейдера]]. Опыт также демонстрировался в «Разрушителях легенд»<ref name="voice">{{Cite web|url=https://www.youtube.com/watch?v=T35VYJ-VELk|title=Фрагмент передачи «Разрушители мифов»|archive-url=https://web.archive.org/web/20170606050127/https://www.youtube.com/watch?v=52UAEQfMTtU|archive-date=2017-06-06|access-date=2022-12-20|deadlink=no}}</ref>. Аналогичный эффект создаёт и [[ксенон]]. А [[гелий]], который в 6 раз легче воздуха, при вдыхании, наоборот, создаёт тонкий и писклявый голос. |
|||
== Интересные факты == <!--Это стандартное название раздела с несортированной информацией--> |
|||
| ⚫ | |||
== Примечания == |
== Примечания == |
||
| Строка 178: | Строка 205: | ||
[[Категория:Фториды серы]] |
[[Категория:Фториды серы]] |
||
[[Категория:Гексафториды|С]] |
|||
[[Категория:Хладагенты]] |
[[Категория:Хладагенты]] |
||
[[Категория:Изоляционные материалы]] |
[[Категория:Изоляционные материалы]] |
||
[[Категория:Парниковые газы]] |
[[Категория:Парниковые газы]] |
||
[[Категория:Газы]] |
|||
{{спам-ссылки|1= |
{{спам-ссылки|1= |
||
Текущая версия от 23:38, 14 декабря 2024
| Фторид серы(VI) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Фторид серы(VI) | ||
| Традиционные названия | гексафторид серы, шестифтористая сера, элегаз | ||
| Хим. формула | SF6 | ||
| Рац. формула | SF6 | ||
| Физические свойства | |||
| Состояние | газ | ||
| Молярная масса | 146,06 г/моль | ||
| Плотность |
Газ: 6,164 г/л Жидкость: 1,33 г/см³ |
||
| Энергия ионизации | 19,3 ± 0,1 эВ[1] и 15,33 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −50,8 °C | ||
| • сублимации | −83 ± 1 ℉[1] и −63,8 °C[2] | ||
| • кипения |
сублимация при −63,9 °C |
||
| Мол. теплоёмк. | 97,15 Дж/(моль·К) | ||
| Теплопроводность | 0,012058 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | −1219 кДж/моль | ||
| Давление пара | 21,5 ± 0,1 атм[1] | ||
| Структура | |||
| Координационная геометрия | октаэдрическая | ||
| Кристаллическая структура | орторомбическая | ||
| Дипольный момент | 0 Д | ||
| Классификация | |||
| Рег. номер CAS | 2551-62-4 | ||
| PubChem | 17358 | ||
| Рег. номер EINECS | 219-854-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | WS4900000 | ||
| ChEBI | 30496 | ||
| Номер ООН | 1080 | ||
| ChemSpider | 16425 | ||
| Безопасность | |||
| Токсичность | малотоксичен или нетоксичен | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Гексафтори́д се́ры (также элега́з или шестифто́ристая се́ра, SF6) — неорганическое вещество, при стандартных условиях представляет собой тяжёлый газ (в 5 раз тяжелее воздуха). Применяется в электротехнике.
Методы получения
[править | править код]Возможно получать гексафторид серы из простых веществ:
Также гексафторид серы образуется при разложении сложных фторидов серы:
Соединение было впервые получено и описано в 1900 году Анри Муассаном в ходе работ по изучению химии фтора.
Физико-химические свойства
[править | править код]Практически бесцветный газ, без запаха и вкуса.
Обладает высоким пробивным напряжением (89 кВ/см — примерно в 3 раза выше, чем у воздуха при нормальном давлении).
Охлаждение газа при атмосферном давлении приводит к конденсации в бесцветное твёрдое вещество при −63,8 °C. Твёрдый гексафторид серы может быть расплавлен под давлением при −50,8 °C. Параметры тройной точки: t = −50,8 °C, P = 2,3 атм[3].
В твёрдой фазе при T = 94,30 К — происходит эндотермическое фазовое превращение[3].
Плохо растворим в воде (1 объём в 200 объёмах воды), этаноле и диэтиловом эфире[4], хорошо растворим в нитрометане.
Плотность элегаза при температуре 20 °C и давлении 753,5 мм рт. ст. составляет 6,093 кг/м³[3].
Твёрдый гексафторид серы имеет плотность 2,683 г/см3 при −195 °C, 2,51 г/см3 при −50 °C[3].
Относительная диэлектрическая проницаемость — 1,0021. Полное число степеней свободы молекулы элегаза равно 21, из них три степени свободы — в поступательном движении, три — во вращательном, а остальные — в колебательном. Диаметр молекулы равен 5,33 Å.
Поверхностное натяжение жидкого гексафторида серы составляет 11,63 мН/м (−50 °C), 8,02 мН/м (−20 °C)[3].
Вязкость газообразного элегаза несколько ниже вязкости воздуха: 15,37 мкПа·с (+22,5 °C), 18,71 мкПа·с (+100 °C)[3].
Коэффициент теплопроводности, Вт/(м·К): 1,32 (ж., +20 °C), 1,36 (ж., +30 °C), 1,43 (ж., +50 °C)[3], 0,0138 (г., +27,5 °C, 1 атм.)[5].
В составе молекулы 21,95 % серы и 78,05 % фтора по массе.
Термодинамические величины
[править | править код]| Свойство | Значение при н. у. (газ) |
|---|---|
| Энтальпия образования | −1219 кДж/моль |
| Энтропия образования | 291,6 Дж/(моль·К) |
| Теплоёмкость | 97,15 Дж/(моль·К)[6] |
| Теплопроводность | 12,058 мВт/(м·К)[6] |
| Критическая температура | 318,697...318,712 К (45,547...45,562 °С)[3] |
| Критическое давление | 3,71 МПа (по разным данным, от 37,113 до 38,27 атм[3]) |
| Критический объём | 198,0 см3/моль[3] |
| Критическая плотность | 0,73...0,7517 г/см3[3] |
| Теплота плавления | 1,1...1,39 ккал/моль[3] |
| Теплота сублимации (при −63,8 °C) | 5,64...5,57 ккал/моль[3] |
Химические свойства
[править | править код]Гексафторид серы — достаточно инертное соединение, наименее активное химически среди всех фторидов серы, не реагирует с чистой водой из-за кинетических факторов. Не реагирует также с растворами HCl, NaOH и NH3, однако при действии восстановителей могут протекать некоторые реакции. Не взаимодействует с галогенами, фосфором, мышьяком, углеродом, кремнием, бором, медью и серебром при температуре красного каления. Не подвергается воздействию нагретых CuO, PbCrO4 и расплавленного KOH[3], но при температуре выше +300°C реагирует с водой под избыточным давлением. Реакцию следует проводить при температуре не выше +370°C:
Взаимодействие с металлическим натрием проходит только при нагревании последнего до температуры кипения, однако уже при 64 °C взаимодействует с раствором натрия в аммиаке: :
Гексафторид серы реагирует с литием с выделением большого количества тепла:
При этом продукты реакции — элементарная сера и фторид лития — имеют меньший объём, чем исходные вещества, что нашло применение в некоторых экзотических тепловых двигателях (см. ниже).
С водородом и кислородом гексафторид не реагирует. Однако при сильном нагревании (до 400 °C) SF6 взаимодействует с сероводородом, а при 30 °C — с иодоводородом:
При повышенном давлении и температуре около 500 °C SF6 окисляет PF3 до PF5:
Применение
[править | править код]- как изолятор и теплоноситель в высоковольтной электротехнике;
- как технологическая среда в электронной и металлургической промышленности;
- в системах газового пожаротушения в качестве пожаротушащего вещества;
- как хладагент благодаря высокой теплоёмкости, низкой теплопроводности и низкой вязкости[7];
- для улучшения звукоизоляции в стеклопакетах;
- в полупроводниковой промышленности для плазмохимического травления кремния;
- как окислитель в некоторых экзотических тепловых двигателях — например, в паротурбинной установке американской малогабаритной 324-мм противолодочной торпеды Mark 50, где он используется для окисления металлического лития.
Применение в электротехнике
[править | править код]Название «элегаз» шестифтористая сера получила от сокращения «электрический газ». Уникальные свойства элегаза были открыты в СССР, его применение также началось в Советском Союзе. В 30-х годах известный учёный Б. М. Гохберг в ЛФТИ исследовал электрические свойства ряда газов и обратил внимание на некоторые свойства шестифтористой серы SF6 (элегаза)[8]. Потребность в элегазе появилась в стране в начале 1980-х годов и была связана с разработкой и освоением электрооборудования для передач постоянного тока сверхвысокого напряжения. Его промышленное производство в РФ было освоено в 1998 году на Кирово-Чепецком химическом комбинате[9].
Электрическая прочность при атмосферном давлении и зазоре 1 см составляет 89 кВ/см. Характерным является очень большой коэффициент теплового расширения и высокая плотность. Это важно для энергетических установок, в которых проводится охлаждение каких-либо частей устройства, так как при большом коэффициенте теплового расширения легко образуется конвективный поток, уносящий тепло[10].
В центре молекулы элегаза расположен атом серы, а на равном расстоянии от него в вершинах правильного октаэдра располагаются шесть атомов фтора. Это определяет высокую эффективность захвата электронов молекулами, их относительно небольшую длину свободного пробега и слабую реакционную способность. Поэтому элегаз обладает высокой электрической прочностью.
Элегаз безвреден в смеси с воздухом. Однако вследствие нарушения технологии производства элегаза или его разложения в аппарате под действием электрических разрядов (дугового, коронного, частичных), в элегазе могут возникать чрезвычайно активные в химическом отношении и вредные для человека примеси, а также различные твёрдые соединения, оседающие на стенах конструкции. Интенсивность образования таких примесей зависит от наличия в элегазе примесей кислорода и особенно паров воды.
Некоторое количество элегаза в электротехнической аппаратуре также разлагается в процессе нормальной работы. Например, коммутация тока 31,5 кА в выключателе 110 кВ приводит к разложению 5—7 см³ элегаза на 1 кДж выделяемой в дуге энергии.
Стоимость элегаза довольно высока, однако он нашёл достаточно широкое применение в технике, особенно в высоковольтной электротехнике. Он прежде всего используется как диэлектрик, то есть в качестве основной изоляции для комплектных распределительных устройств, высоковольтных измерительных трансформаторов тока и напряжения и др[11]. Также элегаз используется как среда дугогашения в высоковольтных выключателях[12].
Основные преимущества элегаза перед его основным «конкурентом», трансформаторным маслом, это:
- взрыво- и пожаробезопасность;
- снижения массо-габаритных показателей конструкции за счёт уменьшения изоляционных промежутков и улучшенных условий охлаждения токоведущих частей[источник не указан 4144 дня].
Регламентирующие стандарты
[править | править код]- IEC 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- IEC 60480:2004 — Руководство по проверке и обработке серы шестифтористой (SF6), взятой из электротехнического оборудования, и технические условия на её повторное использование.
- EN 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- EN 60480:2004 — Руководство по проверке и обработке элегаза (SF6), взятого из электротехнического оборудования, и технические условия на его повторное использование.
Вредное воздействие
[править | править код]По степени воздействия на организм человека относится к малоопасным химическим веществам (класс опасности IV согласно ГОСТ 12.1.007-76).
Имеется возможность отравления продуктами распада элегаза (низшими фторидами), образующимися, например, при работе дугогасительных камер в высоковольтных выключателях.
Потенциал разрушения озонового слоя ODP = 0.
Сильнейший известный парниковый газ, потенциал глобального потепления GWP = 24 900. Из-за небольших объёмов изготовления вклад в глобальное потепление не превышает 0,2 %. Регламентируется Киотским протоколом.
Дополнительная информация
[править | править код]Если наполнить гексафторидом серы открытый сверху сосуд (так как газ тяжелее воздуха, то он не будет «выливаться» из сосуда) и поместить туда лёгкую лодочку, сделанную, например, из фольги, то лодочка будет держаться на поверхности и не «утонет». Этот опыт был показан в передаче «Разрушители легенд» как фокус с «прозрачной водой»[14].
Также высокая плотность газа приводит к комичному эффекту при его вдыхании — голос становится очень низким и грубым, подобно голосу Дарта Вейдера. Опыт также демонстрировался в «Разрушителях легенд»[15]. Аналогичный эффект создаёт и ксенон. А гелий, который в 6 раз легче воздуха, при вдыхании, наоборот, создаёт тонкий и писклявый голос.
Примечания
[править | править код]- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0576.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Опаловский А. А., Лобков Е. У. Гексафторид серы // Успехи химии. — 1975. — Т. 44, вып. 2. — С. 193—213. — doi:10.1070/RC1975v044n02ABEH002249. Архивировано 1 апреля 2022 года.
- ↑ [www.xumuk.ru/encyklopedia/2/4038.html Свойства гексафторида серы на сайте «Химик.ру»]
- ↑ Kestin J., Imaishi N. Thermal conductivity of sulfur hexafluoride (англ.) // International Journal of Thermophysics. — 1985. — Vol. 6, no. 2. — P. 107—118. — ISSN 0195-928X. — doi:10.1007/BF00500026.
- ↑ 1 2 Sulfur hexafluoride. Air Liquide Gas Encyclopedia. Дата обращения: 22 февраля 2013. Архивировано 31 марта 2012 года.
- ↑ Применение шестифтористой серы. Дата обращения: 20 апреля 2007. Архивировано 17 декабря 2007 года.
- ↑ Гохберг Б. М. Ленинградский физико-технический институт Академии наук СССР // Успехи физических наук. — 1940. — Т. XXIV, вып. 1. — С. 11-20. Архивировано 4 марта 2016 года. См. стр. 16-17, раздел «Электрическая прочность газов»
- ↑ Уткин В. В. Завод у двуречья. Кирово-Чепецкий химический комбинат имени Б. П. Константинова: строительство, развитие, люди. — Киров: ОАО «Дом печати — Вятка», 2007. — Т. 4 (1973—1992), часть 1. — С. 66—67. — 144 с. — 1000 экз. — ISBN 978-5-85271-293-6.
- ↑ Коробейников С.М., д.ф.м.н., профессор. Диэлектрические материалы. 4.1.2. Электроотрицательные газы, применение газообразных диэлектриков. Дата обращения: 2 июня 2011. Архивировано 6 октября 2014 года.
- ↑ ЗВА :: Измерительные трансформаторы с газовой изоляцией. Дата обращения: 16 декабря 2009. Архивировано из оригинала 27 мая 2011 года.
- ↑ Применение SF6 в высоковольтной электронике. Дата обращения: 9 июля 2009. Архивировано 15 июля 2009 года.
- ↑ Элегаз. Свойства. Дата обращения: 17 июля 2012. Архивировано 6 января 2012 года.
- ↑ Фрагмент передачи «Разрушители мифов». Дата обращения: 20 декабря 2022. Архивировано 20 декабря 2022 года.
- ↑ Фрагмент передачи «Разрушители мифов». Дата обращения: 20 декабря 2022. Архивировано 6 июня 2017 года.
Литература
[править | править код]- Гохберг Б. М. Элегаз — электрическая газовая изоляция // «Электричество». — 1947. — № 3. — С. 15.
См. также
[править | править код]- Тетрафторид серы — SF4
- Декафторид дисеры — S2F10
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |