Диены: различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
Wikifido (обсуждение | вклад) отклонено последнее 1 изменение (176.195.210.91): было верно Метка: ручная отмена |
м →Классификация: оформление |
||
| (не показаны 24 промежуточные версии 16 участников) | |||
| Строка 1: | Строка 1: | ||
[[Файл:1,3-butadiene.svg|thumb|200px|right|[[Бутадиен|Бутадиен-1,3]]]] |
[[Файл:1,3-butadiene.svg|thumb|200px|right|[[Бутадиен|Бутадиен-1,3]]]] |
||
'''Алкадие́ны''' (''дие́ны'', ''дие́новые углеводоро́ды'', ''диолефи́ны'') — [[Алифатические соединения#Ациклические соединения|ациклические]] [[Непредельные углеводороды|непредельные]] [[углеводороды]], содержащие две [[Двойная связь (химия)|двойных связи]] [[углерод]]-[[углерод]], образующие гомологический ряд с общей формулой '''C<sub>n</sub>H<sub>2n-2</sub>'''.<ref name=":0">{{Cite web|url=https://goldbook.iupac.org/terms/view/D01699|title=Определение диенов по номенклатуре ИЮПАК|author=The International Union of Pure and Applied Chemistry (IUPAC)|website=goldbook.iupac.org|access-date=2023-03-26|archive-date=2023-03-29|archive-url=https://web.archive.org/web/20230329172700/https://goldbook.iupac.org/terms/view/D01699|deadlink=no}}</ref><ref>{{Книга|автор={{nobr|Степаненко Б. Н.}}|заглавие=Органическая химия|год=1970|издание=4-е изд., перераб|место=М.|издательство=Медицина|страницы=44, 50—51|страниц=336}}</ref> |
|||
'''Алкадиены,''' или просто '''диены''' — класс [[углеводороды|углеводородов]], содержащих две [[Двойная связь (химия)|двойных связи]] углерод-углерод. |
|||
Атомы углерода при двойных связях находятся в состоянии [[Гибридизация орбиталей#sp-гибридизация|sp-гибридизации]]. |
|||
Простейшим алкадиеном является [[пропадиен]] (C<sub>3</sub>H<sub>4</sub>), относящийся к кумулированным диенам. |
|||
По номенклатуре «[[IUPAC]]», названия алкадиенов образуются от названий соответствующих [[Алканы|алканов]] заменой суффикса «''-ан''» на «''-дие́н''». Положение двойных связей указывается арабской цифрой. |
|||
== Классификация == |
== Классификация == |
||
В зависимости от взаимного расположения кратных связей, диены подразделяются на три группы |
В зависимости от взаимного расположения кратных связей, диены подразделяются на три группы<ref name=":0" />: |
||
* диены с [[Аллены|алленовыми]], или кумулированными связями (1,2-диены); |
|||
1) Диены с '''[[Аллены|алле́новыми]]''' ('''кумули́рованными''') связями (1,2-диены): CH<sub>2</sub>=С=CH<sub>2</sub>; |
|||
| ⚫ | |||
* диены с изолированными связями, у которых двойные связи разделены более чем одной одинарной. |
|||
| ⚫ | |||
3) Диены с '''изоли́рованными связями''': двойные связи разделены более, чем одной одинарной: CH<sub>2</sub>=CH−(CH<sub>2</sub>)<sub>''n''</sub>−CH=CH<sub>2</sub>, где ''n'' ≥ 1; |
|||
Гетероаналоги диенов, в которых один из ненасыщенных углеродных атомов замещён [[гетероатом]]ом, называются ''гетеродиенами''<ref |
Гетероаналоги диенов, в которых один из ненасыщенных углеродных атомов замещён [[гетероатом]]ом, называются ''гетеродиенами''.<ref name=":0" /> |
||
Обычно к диенам относят ациклические и циклические 1,3-диены, образующие [[гомологический ряд|гомологические ряды]] общих формул <math>C_nH_{2n-2}</math> и <math>C_nH_{2n-4}</math> соответственно, ациклические диены являются структурными [[изомер]]ами [[алкины|алкинов]]. |
Обычно к диенам относят ациклические и циклические 1,3-диены, образующие [[гомологический ряд|гомологические ряды]] общих формул <math>C_nH_{2n-2}</math> и <math>C_nH_{2n-4}</math> соответственно, ациклические диены являются структурными [[изомер]]ами [[алкины|алкинов]]. |
||
== Гомологический ряд == |
|||
Гомологический ряд алкадиенов: |
|||
{| class=standard cellpadding=2 |
|||
| '''Название диена''' || '''Химическая формула''' |
|||
|- |
|||
| [[Пропадиен]] || C<sub>3</sub>H<sub>4</sub> |
|||
|- |
|||
| [[Бутадиен]] (дивинил) || C<sub>4</sub>H<sub>6</sub> |
|||
|- |
|||
| [[Пентадиен-1,3]] ([[пиперилен]]) || C<sub>5</sub>H<sub>8</sub> |
|||
|- |
|||
| Гексадиен || C<sub>6</sub>H<sub>10</sub> |
|||
|- |
|||
| Гептадиен || C<sub>7</sub>H<sub>12</sub> |
|||
|- |
|||
| Октадиен || C<sub>8</sub>H<sub>14</sub> |
|||
|- |
|||
| Нонадиен || C<sub>9</sub>H<sub>16</sub> |
|||
|- |
|||
| Декадиен || C<sub>10</sub>H<sub>18</sub> |
|||
|} |
|||
== Физические свойства == |
== Физические свойства == |
||
Низшие диены — бесцветные легкокипящие жидкости (температура кипения [[изопрен]]а |
Низшие диены — бесцветные легкокипящие жидкости (температура кипения [[изопрен]]а 34 °C; температура кипения 2,3-диметил-1,3-бутадиена 68,78 °C; температура кипения 1,3-[[циклопентадиен]]а 41,5 °C). 1,3-Бутадиен и [[Аллены|аллен]] (1,2-пропадиен) — газы (T<sub>кип</sub> −4,5 °C и −34 °C соответственно). |
||
Сопряжённые диены существуют в виде двух конформаций — цисоидной (s-''цис''-форма) и трансоидной (s-''транс''-форма), способных переходить друг в друга, более устойчивой является s-''транс''-форма: |
|||
: [[Файл:Cisoid-transoid2.png|249x249px]] |
: [[Файл:Cisoid-transoid2.png|249x249px]] |
||
| Строка 23: | Строка 54: | ||
=== Реакции алленов === |
=== Реакции алленов === |
||
Центральный sp-гибридизованный атом углерода в алленах является электрофильным центром, поэтому, в отличие от не активированных электронакцепторными заместителями алкенов, аллены реагируют с мягкими нуклеофилами, образуя винильные и аллильные производные: |
Центральный sp-гибридизованный атом углерода в алленах является электрофильным центром, поэтому, в отличие от не активированных электронакцепторными заместителями алкенов, аллены реагируют с мягкими нуклеофилами, образуя винильные и аллильные производные: |
||
: <math>\mathsf{CH_2\!\!=\!\!C\!\!=\!\! CH_2+PhSH}\rightarrow\mathsf{CH_2\!\!=\!\!C(SPh)\!\!-\!\!CH_3+CH_2\!\!=\!\!CH\!\!-\!\!CH_2SPh}</math> |
|||
: CH<sub>2</sub>=C=CH<sub>2</sub> + PhSH <math>\to</math> CH<sub>2</sub>=C(SPh)-CH<sub>3</sub> + CH<sub>2</sub>=CH-CH<sub>2</sub>SPh |
|||
Электрофильность sp-гибридизованного атома алленов повышается электроноакцепторными группами, в этом случае присоединение нуклеофила идёт исключительно по этому атому: |
Электрофильность sp-гибридизованного атома алленов повышается электроноакцепторными группами, в этом случае присоединение нуклеофила идёт исключительно по этому атому: |
||
: <math>\mathsf{CH_2\!\!=\!\!C\!\!=\!\! CHCOOR+NuH}\rightarrow\mathsf{CH_2\!\!=\!\!CNuCH_2COOR+CH_3C(Nu)\!\!=\!\!CHCOOR}</math> |
|||
: CH<sub>2</sub>=C=CHCOOR + NuH <math>\to</math> CH<sub>2</sub>=CNuCH<sub>2</sub>COOR + CH<sub>3</sub>C(Nu)=CHCOOR |
|||
Гидратации аллена в условиях кислотного катализа присоединение протона идёт по терминальному углероду, образующийся при этом [[Енолы|енол]] далее [[Таутомерия|таутомеризуется]] в [[ацетон]]: |
Гидратации аллена в условиях кислотного катализа присоединение протона идёт по терминальному углероду, образующийся при этом [[Енолы|енол]] далее [[Таутомерия|таутомеризуется]] в [[ацетон]]: |
||
: <math>\mathsf{CH_2\!\!=\!\!C\!\!=\!\! CH_2+H_2O}\rightarrow\mathsf{[CH_2\!\!=\!\!C(OH)CH_3]}\rightarrow\mathsf{CH_3COCH_3}</math> |
|||
: CH<sub>2</sub>=С=CH<sub>2</sub> + H<sub>2</sub>O <math>\to</math> [CH<sub>2</sub>=С(OH)CH<sub>3</sub>] <math>\to</math> CH<sub>3</sub>COCH<sub>3</sub> |
|||
Под действием щелочей или кислот аллены могут претерпевать прототропные перегруппировки в 1,3-диены: |
Под действием щелочей или кислот аллены могут претерпевать прототропные перегруппировки в 1,3-диены: |
||
: <math>\mathsf{RCH_2CH\!\!=\!\!C\!\!=\!\! CH_2}\rightarrow\mathsf{RCH\!\!=\!\!CHCH\!\!=\!\!CH_2}</math> |
|||
: RCH<sub>2</sub>CH=C=CH<sub>2</sub> <math>\to</math> RCH=CHCH=CH<sub>2</sub> |
|||
: |
|||
=== Реакции 1,3-диенов === |
=== Реакции 1,3-диенов === |
||
Специфика реакционной способности 1,3-диенов обусловлена [[Мезомерный эффект|мезомерией]] вследствие сопряжения двойных связей: |
Специфика реакционной способности 1,3-диенов обусловлена [[Мезомерный эффект|мезомерией]] вследствие сопряжения двойных связей: |
||
: [[Файл: |
: [[Файл:1,3-butadiene resonance.svg|300 px]] |
||
Результатом является то, что в случае электрофильного присоединения к сопряжённым диенам типичны реакции 1,4-присоединения, идущие через промежуточное образование резонансно стабилизированных аллильных карбокатионов: |
Результатом является то, что в случае электрофильного присоединения к сопряжённым диенам типичны реакции 1,4-присоединения, идущие через промежуточное образование резонансно стабилизированных аллильных карбокатионов: |
||
: <math>\mathsf{CH_2\!\!=\!\!CH\!\!-\!\!CH\!\!=\!\!CH_2+X^+}\rightarrow\mathsf{XCH_2\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!CH_2^+}</math> |
|||
: CH<sub>2</sub>=CH-CH=CH<sub>2</sub> + X<sup>+</sup> <math>\to</math> XCH<sub>2</sub>-CH=CH-CH<sub>2</sub><sup>+</sup> |
|||
: <math>\mathsf{XCH_2\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!CH_2^++Y^-}\rightarrow\mathsf{XCH_2\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!CH_2Y}</math>, |
|||
: XCH<sub>2</sub>-CH=CH-CH<sub>2</sub><sup>+</sup> + Y<sup>-</sup> <math>\to</math> XCH<sub>2</sub>-CH=CH-CH<sub>2</sub>Y |
|||
Х = Hal, H, Y = Hal, OH |
|||
где '''Х''' — это [[Галогены|Hal]], [[Водород|H]], а '''Y''' — это [[Галогены|Hal]], [[Гидроксильная группа|OH]] |
|||
| ⚫ | |||
| ⚫ | |||
Диены также реагируют с алкенами и другими соединениями — диенофилами с активированной электронакцепторными заместителями кратной связью, образуя продукты [4+2]-присоединения ([[реакция Дильса — Альдера]]) |
Диены также реагируют с алкенами и другими соединениями — диенофилами с активированной электронакцепторными заместителями кратной связью, образуя продукты [4+2]-присоединения ([[реакция Дильса — Альдера]]) |
||
| Строка 47: | Строка 81: | ||
== Получение == |
== Получение == |
||
* Синтез Лебедева: |
* [[Синтез]] [[Лебедев, Сергей Васильевич (1874—1934)|С.В. Лебедева]]: |
||
: <math>\mathsf{CH_3\!\!-\!\!CH_2\!\!-\!\!OH+CH_3\!\!-\!\!CH_2\!\!-\!\!OH}\stackrel{Al_2O_3, ZnO, t}{\longrightarrow}\mathsf{CH_2\!\!=\!\!CH\!\!-\!\!CH\!\!=\!\!CH_2+2H_2O+H_2\uparrow}</math> |
|||
: CH<sub>3</sub>-CH<sub>2</sub>-OH+CH<sub>3</sub>-CH<sub>2</sub>-OH --Al<sub>2</sub>O<sub>3</sub>, ZnO, t--> CH<sub>2</sub>=CH-CH=CH<sub>2</sub> + 2H<sub>2</sub>O + H<sub>2</sub> |
|||
Формально эту реакцию можно представить как дегидратацию двух молекул этилового спирта с одновременным межмолекулярным |
Формально эту реакцию можно представить как [[Реакция дегидратации|дегидратацию]] двух молекул [[Этиловый спирт|этилового спирта]] с одновременным межмолекулярным [[дегидрирование]]м. |
||
| ⚫ | |||
CH<sub>2</sub>Br-CH<sub>2</sub>-CH<sub>2</sub>-CH<sub>2</sub>Br + 2KOH → CH<sub>2</sub>=CH-CH=CH<sub>2</sub> + 2KBr + 2H<sub>2</sub>O |
|||
| ⚫ | |||
: <math>\mathsf{CH_2Br\!\!-\!\!CH_2\!\!-\!\!CH_2\!\!-\!\!CH_2Br+2KOH}\rightarrow\mathsf{CH_2\!\!=\!\!CH\!\!-\!\!CH\!\!=\!\!CH_2+2KBr+2H_2O}</math> |
|||
== См. также == |
|||
* [[1-Ацетоксибутадиен-1,3]] |
|||
== Примечания == |
== Примечания == |
||
Текущая версия от 22:18, 3 июня 2024
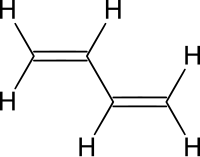
Алкадие́ны (дие́ны, дие́новые углеводоро́ды, диолефи́ны) — ациклические непредельные углеводороды, содержащие две двойных связи углерод-углерод, образующие гомологический ряд с общей формулой CnH2n-2.[1][2]
Атомы углерода при двойных связях находятся в состоянии sp-гибридизации. Простейшим алкадиеном является пропадиен (C3H4), относящийся к кумулированным диенам.
По номенклатуре «IUPAC», названия алкадиенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-дие́н». Положение двойных связей указывается арабской цифрой.
Классификация
[править | править код]В зависимости от взаимного расположения кратных связей, диены подразделяются на три группы[1]:
1) Диены с алле́новыми (кумули́рованными) связями (1,2-диены): CH2=С=CH2;
2) Диены с сопряжёнными связями: двойные связи разделены одной одинарной связью (1,3-диены): СH2=CH−CH=CH2;
3) Диены с изоли́рованными связями: двойные связи разделены более, чем одной одинарной: CH2=CH−(CH2)n−CH=CH2, где n ≥ 1;
Гетероаналоги диенов, в которых один из ненасыщенных углеродных атомов замещён гетероатомом, называются гетеродиенами.[1]
Обычно к диенам относят ациклические и циклические 1,3-диены, образующие гомологические ряды общих формул и соответственно, ациклические диены являются структурными изомерами алкинов.
Гомологический ряд
[править | править код]Гомологический ряд алкадиенов:
| Название диена | Химическая формула |
| Пропадиен | C3H4 |
| Бутадиен (дивинил) | C4H6 |
| Пентадиен-1,3 (пиперилен) | C5H8 |
| Гексадиен | C6H10 |
| Гептадиен | C7H12 |
| Октадиен | C8H14 |
| Нонадиен | C9H16 |
| Декадиен | C10H18 |
Физические свойства
[править | править код]Низшие диены — бесцветные легкокипящие жидкости (температура кипения изопрена 34 °C; температура кипения 2,3-диметил-1,3-бутадиена 68,78 °C; температура кипения 1,3-циклопентадиена 41,5 °C). 1,3-Бутадиен и аллен (1,2-пропадиен) — газы (Tкип −4,5 °C и −34 °C соответственно).
Сопряжённые диены существуют в виде двух конформаций — цисоидной (s-цис-форма) и трансоидной (s-транс-форма), способных переходить друг в друга, более устойчивой является s-транс-форма:
Химические свойства
[править | править код]Реакционная способность диенов определяется спецификой сопряжения двойных связей — если для диенов с изолированными двойными связями реакционная способность аналогична реакционной способности алкенов, то в случае алленов и 1,3-диенов эффекты сопряжения ведут к специфике реакционной способности этих классов соединений.
Реакции алленов
[править | править код]Центральный sp-гибридизованный атом углерода в алленах является электрофильным центром, поэтому, в отличие от не активированных электронакцепторными заместителями алкенов, аллены реагируют с мягкими нуклеофилами, образуя винильные и аллильные производные:
Электрофильность sp-гибридизованного атома алленов повышается электроноакцепторными группами, в этом случае присоединение нуклеофила идёт исключительно по этому атому:
Гидратации аллена в условиях кислотного катализа присоединение протона идёт по терминальному углероду, образующийся при этом енол далее таутомеризуется в ацетон:
Под действием щелочей или кислот аллены могут претерпевать прототропные перегруппировки в 1,3-диены:
Реакции 1,3-диенов
[править | править код]Специфика реакционной способности 1,3-диенов обусловлена мезомерией вследствие сопряжения двойных связей:
Результатом является то, что в случае электрофильного присоединения к сопряжённым диенам типичны реакции 1,4-присоединения, идущие через промежуточное образование резонансно стабилизированных аллильных карбокатионов:
- ,
где Х — это Hal, H, а Y — это Hal, OH
Сопряжённые диены легко полимеризуются по механизму 1,4-присоединения, реакция полимеризации 1,3-диенов лежат в основе синтеза диеновых каучуков.
Диены также реагируют с алкенами и другими соединениями — диенофилами с активированной электронакцепторными заместителями кратной связью, образуя продукты [4+2]-присоединения (реакция Дильса — Альдера)
Получение
[править | править код]Формально эту реакцию можно представить как дегидратацию двух молекул этилового спирта с одновременным межмолекулярным дегидрированием.
См. также
[править | править код]Примечания
[править | править код]- ↑ 1 2 3 The International Union of Pure and Applied Chemistry (IUPAC). Определение диенов по номенклатуре ИЮПАК. goldbook.iupac.org. Дата обращения: 26 марта 2023. Архивировано 29 марта 2023 года.
- ↑ Степаненко Б. Н. Органическая химия. — 4-е изд., перераб. — М.: Медицина, 1970. — С. 44, 50—51. — 336 с.
Литература
[править | править код]- Грандберг И.И., Нам Н.Л. Органическая химия. Учебник для СПО. — 8-е изд. — Москва: Юрайт, 2016. — 608 с. — ISBN 978-5-9916-6328-1.
- Каминский В.А. Органическая химия. В 2 ч. Часть 1. — 2-е изд. — Москва: Юрайт, 2019. — 287 с. — ISBN 978-5-534-02906-2.
В статье не хватает ссылок на источники (см. рекомендации по поиску). |





![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!C\!\!=\!\!CH_{2}+H_{2}O}}\rightarrow {\mathsf {[CH_{2}\!\!=\!\!C(OH)CH_{3}]}}\rightarrow {\mathsf {CH_{3}COCH_{3}}}}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/e52f821e650c4a6ac6bfd9ab7dbdce3f56191aa8)






