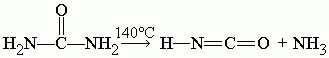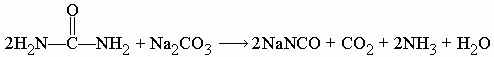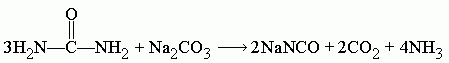Цианат натрия: различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
Maqivi (обсуждение | вклад) Нет описания правки |
Urbic (обсуждение | вклад) м оформление |
||
| Строка 52: | Строка 52: | ||
}} |
}} |
||
'''Цианат натрия''' (''натрий циановоки́слый'') |
'''Цианат натрия''' (''натрий циановоки́слый'') — [[неорганическое соединение|неорганическое]] [[бинарное соединение]], [[Натрий|натриевая]] [[Соли|соль]] [[Циановая кислота|циановой кислоты]] с формулой {{Химическая формула|Na|1|N|1|C|1|O|1|sort=ne}}. Нелетуч, не имеет запаха. Представляет собой бесцветные [[кристалл]]ы [[Тригональная сингония|тригональной сингонии]] [[плотность]]ю 1,893 г/см{{sup|3}}. Температура плавления цианата натрия 550 °C, выше 700 °C разлагается. Хорошо растворим в воде — 11,6 г/100г при 25 °C. |
||
Цианат натрия часто применяется в [[Органический синтез|органическом синтезе]]. |
Цианат натрия часто применяется в [[Органический синтез|органическом синтезе]]. |
||
| Строка 59: | Строка 59: | ||
Цианат натрия можно синтезировать несколькими способами, один из них заключается в сплавлении [[Мочевина|карбамида]] с [[Карбонат натрия|карбонатом натрия]]. Этот метод наиболее простой и дешёвый. |
Цианат натрия можно синтезировать несколькими способами, один из них заключается в сплавлении [[Мочевина|карбамида]] с [[Карбонат натрия|карбонатом натрия]]. Этот метод наиболее простой и дешёвый. |
||
При 140 |
При 140 °C мочевина разлагается на циановую кислоту и аммиак: |
||
[[Файл:Formula1.gif]] |
[[Файл:Formula1.gif]] |
||
| Строка 71: | Строка 71: | ||
[[Файл:Formula3.gif]] |
[[Файл:Formula3.gif]] |
||
Поскольку цианат натрия [[ |
Поскольку цианат натрия [[гидролиз]]уется в присутствии H<sub>2</sub>O, которая образуется в ходе реакции, то следует добавить избыточное количество мочевины, при этом циановая кислота, которая образуется в ходе разложения мочевины, реагирует с водой, образуя CO<sub>2</sub> и NH<sub>3</sub>. |
||
[[Файл:Formula4.gif]] |
[[Файл:Formula4.gif]] |
||
| Строка 81: | Строка 81: | ||
На этом и основан один из методов синтеза цианата натрия. |
На этом и основан один из методов синтеза цианата натрия. |
||
Возможен другой механизм синтеза, но приводящий к тому же конечному уравнению: [[пиролиз]] мочевины с образованием [[Циануровая кислота|циануровой кислоты]] и аммиака, инверсия циануровой кислоты в её [[Изомерия|изомер]] |
Возможен другой механизм синтеза, но приводящий к тому же конечному уравнению: [[пиролиз]] мочевины с образованием [[Циануровая кислота|циануровой кислоты]] и аммиака, инверсия циануровой кислоты в её [[Изомерия|изомер]] — [[Тримеризация|тример]] циановой кислоты с последующей [[Деполимеризация|деполимеризацией]], и затем взаимодействие циановой кислоты с карбонатом натрия. |
||
<!-- разобрать === Этапы синтеза === |
<!-- разобрать === Этапы синтеза === |
||
'''Реактивы:''' мочевина 53г |
'''Реактивы:''' мочевина 53г |
||
сода кальцинированная (Na<sub>2</sub>CO<sub>3</sub> техн.) 30г. |
|||
'''Посуда:''' колба ТС или кварцевая (V = 100—150см³) |
'''Посуда:''' колба ТС или кварцевая (V = 100—150см³) |
||
| Строка 98: | Строка 97: | ||
Вначале нужно приготовить смесь мочевины с карбонатом натрия, путём измельчения обоих компонентов в ступке или в электрокофемолке. По возможности исходная мочевина должна быть максимально сухой, а сода полностью освобождена от воды. Чем однороднее будет смесь и чем тоньше будут измельчены ингредиенты, тем полнее будет протекать реакция, соответственно и выход продукта увеличится. |
Вначале нужно приготовить смесь мочевины с карбонатом натрия, путём измельчения обоих компонентов в ступке или в электрокофемолке. По возможности исходная мочевина должна быть максимально сухой, а сода полностью освобождена от воды. Чем однороднее будет смесь и чем тоньше будут измельчены ингредиенты, тем полнее будет протекать реакция, соответственно и выход продукта увеличится. |
||
Данную реакцию следует проводить в вытяжном шкафу, вследствие выделения паров NH<sub>3</sub>. Температура не должна превышать 500 |
Данную реакцию следует проводить в вытяжном шкафу, вследствие выделения паров NH<sub>3</sub>. Температура не должна превышать 500 °C. 53г просушенной мочевины измельчают до размера частиц 0,2-0,5 мм. Далее, измельчённую мочевину смешивают с 30г кальцинированной соды, доводят смесь до однородного состояния и подвергают дальнейшему измельчению. После этого смесь переносят в колбу. Для того, чтобы предотвратить попадание частичек реакционной смеси, на стенки печки, необходимо накрыть колбу термостойким проницаемым материалом, например стеклотканью или углеволокном. Чтобы не поцарапать дно колбы лучше под неё подложить кусочек, заранее прокалённого асбеста. |
||
Смесь как можно сильнее утрамбовывают в дно колбы и ставят в печку. Колбу со смесью необходимо разогревать плавно, чтобы она не треснула. По мере начала плавления мочевины, колбу достают из печки и ещё раз как можно сильнее утрамбовывают эту смесь и проводят дальнейшее нагревание. Как показал дальнейший анализ, чем чаще и интенсивнее перемешивать смесь, тем выше будет выход цианата. Нагревание проводят в течение 1-2 часов, пока оставшаяся часть карбоната натрия не перейдёт в цианат, а оставшаяся часть биурета полностью не разложится. По истечении заданного времени, реакция практически полностью прекратится. Колбу достают из печки и дают ей немного остыть. Когда температура упадёт до комнатной, полученную массу переносят в ступку и измельчают. |
Смесь как можно сильнее утрамбовывают в дно колбы и ставят в печку. Колбу со смесью необходимо разогревать плавно, чтобы она не треснула. По мере начала плавления мочевины, колбу достают из печки и ещё раз как можно сильнее утрамбовывают эту смесь и проводят дальнейшее нагревание. Как показал дальнейший анализ, чем чаще и интенсивнее перемешивать смесь, тем выше будет выход цианата. Нагревание проводят в течение 1-2 часов, пока оставшаяся часть карбоната натрия не перейдёт в цианат, а оставшаяся часть биурета полностью не разложится. По истечении заданного времени, реакция практически полностью прекратится. Колбу достают из печки и дают ей немного остыть. Когда температура упадёт до комнатной, полученную массу переносят в ступку и измельчают. |
||
| Строка 104: | Строка 103: | ||
=== Анализ полученного продукта === |
=== Анализ полученного продукта === |
||
Существует несколько способов количественного и качественного анализа продукта. |
Существует несколько способов количественного и качественного анализа продукта. |
||
==== Качественный анализ ==== |
==== Качественный анализ ==== |
||
[[Файл:D NCO.JPG|thumb|right|Раствор интенсивно тёмно-синего цвета]] |
[[Файл:D NCO.JPG|thumb|right|Раствор интенсивно тёмно-синего цвета]] |
||
Здесь можно использовать 2 простых метода. Один из них, заключается в способности ионов кобальта образовывать комплексные соединения, окрашенные в интенсивный тёмно-синий цвет. Так при добавлении раствора цианата натрия к раствору нитрата или ацетата кобальта, наблюдается интенсивное тёмно синее окрашивание. |
Здесь можно использовать 2 простых метода. Один из них, заключается в способности ионов кобальта образовывать комплексные соединения, окрашенные в интенсивный тёмно-синий цвет. Так при добавлении раствора цианата натрия к раствору нитрата или ацетата кобальта, наблюдается интенсивное тёмно синее окрашивание. |
||
| Строка 118: | Строка 115: | ||
==== Количественный анализ ==== |
==== Количественный анализ ==== |
||
Как раз этот метод нас будет больше всего интересовать, так как основной целью этого эксперимента является достичь максимального выхода цианата натрия, поэтому остановимся на нём подробнее. |
Как раз этот метод нас будет больше всего интересовать, так как основной целью этого эксперимента является достичь максимального выхода цианата натрия, поэтому остановимся на нём подробнее. |
||
| Строка 129: | Строка 125: | ||
'''Реактивы:''' анализируемый цианат 1г |
'''Реактивы:''' анализируемый цианат 1г |
||
:* раствор серной кислоты (w= 10%) |
:* раствор серной кислоты (w= 10 %) — 50см³ |
||
'''Посуда:''' колба ТС (V = 500см³) со шлифами, 2 штуки |
'''Посуда:''' колба ТС (V = 500см³) со шлифами, 2 штуки |
||
:* обратный холодильник со шлифами 14/16 |
:* обратный холодильник со шлифами 14/16 |
||
| Строка 155: | Строка 151: | ||
'''Ход анализа:''' |
'''Ход анализа:''' |
||
1г анализируемого вещества помещают в колбу из термостойкого стекла и растворяют в 200 см³ воды. Прибавляется 50 см³ 10 |
1г анализируемого вещества помещают в колбу из термостойкого стекла и растворяют в 200 см³ воды. Прибавляется 50 см³ 10 % раствора H2SO4. Смесь осторожно кипятят, пока её объём не уменьшится на половину. Затем смесь охлаждается до 0 °C и в неё добавляют избыток едкого натра до сильно щелочной реакции. Колбу со смесью подсоединяют к дистилляционному прибору, образовавшийся аммиак отгоняется к титрованной кислоте. |
||
Далее кислоту титруют щелочью и по количеству затраченной щёлочи устанавливают содержание цианата в исходном веществе. |
Далее кислоту титруют щелочью и по количеству затраченной щёлочи устанавливают содержание цианата в исходном веществе. |
||
--> |
--> |
||
== Физические свойства == |
== Физические свойства == |
||
Цианат натрия умеренно растворим в воде (10,4 |
Цианат натрия умеренно растворим в воде (10,4 % по массе при 25 °C), плохо растворим в [[этанол]]е (0,5 % при 78,4 °C), [[бензол]]е и жидком [[аммиак]]е, не растворим в [[Диэтиловый эфир|диэтиловом эфире]]. |
||
== Химические свойства == |
== Химические свойства == |
||
В присутствии [[Железо|железа]] или [[Никель|никеля]] при |
В присутствии [[Железо|железа]] или [[Никель|никеля]] при 500—600 °C частично разлагается до [[Цианид натрия|цианида натрия]], [[Карбонат натрия|карбоната натрия]], [[Монооксид углерода|монооксида углерода]] и молекулярного [[азот]]а<ref>[www.xumuk.ru/encyklopedia/2/5150.html Цианаты неорганические — ХиМик. Ру]</ref>: |
||
:: <math>\mathsf{4NaNCO \rightarrow 2NaCN + Na_2CO_3 + CO + N_2}</math>. |
:: <math>\mathsf{4NaNCO \rightarrow 2NaCN + Na_2CO_3 + CO + N_2}</math>. |
||
| Строка 183: | Строка 179: | ||
:: <math>\mathsf{3NaNCO + 2C \rightarrow 3NaCN + CO + CO_2}</math>. |
:: <math>\mathsf{3NaNCO + 2C \rightarrow 3NaCN + CO + CO_2}</math>. |
||
С минеральными кислотами образует [[Циановая кислота|циановую кислоту]] HNCO и её тример |
С минеральными кислотами образует [[Циановая кислота|циановую кислоту]] HNCO и её тример — [[Циануровая кислота|циануровую кислоту]] (HNCO){{sub|3}}. |
||
== Применение == |
== Применение == |
||
Текущая версия от 10:49, 17 апреля 2024
| Цианат натрия | |
|---|---|
| | |
| Общие | |
| Хим. формула | NaOCN |
| Физические свойства | |
| Состояние | кристаллический |
| Молярная масса | 65,01[1] г/моль |
| Плотность | 1,893 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 550 °C |
| • разложения | 600 °C |
| Энтальпия | |
| • образования | -400 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 11,6 г/100 мл |
| Классификация | |
| Рег. номер CAS | 917-61-3 |
| PubChem | 517096 |
| Рег. номер EINECS | 213-030-6 |
| SMILES | |
| InChI | |
| ChEBI | 38906 |
| ChemSpider | 12922 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Цианат натрия (натрий циановоки́слый) — неорганическое бинарное соединение, натриевая соль циановой кислоты с формулой NaNCO. Нелетуч, не имеет запаха. Представляет собой бесцветные кристаллы тригональной сингонии плотностью 1,893 г/см3. Температура плавления цианата натрия 550 °C, выше 700 °C разлагается. Хорошо растворим в воде — 11,6 г/100г при 25 °C.
Цианат натрия часто применяется в органическом синтезе.
Получение
[править | править код]Цианат натрия можно синтезировать несколькими способами, один из них заключается в сплавлении карбамида с карбонатом натрия. Этот метод наиболее простой и дешёвый.
При 140 °C мочевина разлагается на циановую кислоту и аммиак:
Далее циановая кислота реагирует с оставшейся частью мочевины, образуя биурет:
При сплавлении мочевины с карбонатом натрия Na2CO3 образуется цианат натрия NaNCO, углекислый газ CO2, аммиак NH3 и вода H2O:
Поскольку цианат натрия гидролизуется в присутствии H2O, которая образуется в ходе реакции, то следует добавить избыточное количество мочевины, при этом циановая кислота, которая образуется в ходе разложения мочевины, реагирует с водой, образуя CO2 и NH3.
Поэтому, если необходимо исключить воду из продуктов реакции и тем самым повысить выход конечного цианата, то расчёт пропорции следует проводить по следующему уравнению:
На этом и основан один из методов синтеза цианата натрия.
Возможен другой механизм синтеза, но приводящий к тому же конечному уравнению: пиролиз мочевины с образованием циануровой кислоты и аммиака, инверсия циануровой кислоты в её изомер — тример циановой кислоты с последующей деполимеризацией, и затем взаимодействие циановой кислоты с карбонатом натрия.
Физические свойства
[править | править код]Цианат натрия умеренно растворим в воде (10,4 % по массе при 25 °C), плохо растворим в этаноле (0,5 % при 78,4 °C), бензоле и жидком аммиаке, не растворим в диэтиловом эфире.
Химические свойства
[править | править код]В присутствии железа или никеля при 500—600 °C частично разлагается до цианида натрия, карбоната натрия, монооксида углерода и молекулярного азота[2]:
- .
Как и все цианаты щелочных металлов (и аммония), цианат натрия во влажном воздухе и в водных растворах постепенно гидролизуется до карбоната натрия, диоксида углерода и аммиака:
- .
При действии на цианат натрия растворов сильных кислот, он разлагается, например:
- .
Восстанавливается монооксидом углерода до цианида натрия:
- ,
и углеродом:
- .
С минеральными кислотами образует циановую кислоту HNCO и её тример — циануровую кислоту (HNCO)3.
Применение
[править | править код]В основном цианат натрия используется в органическом синтезе. Из него синтезируют органические изоцианаты.
Токсикология
[править | править код]Цианаты гораздо менее токсичны цианидов, что используется для дегазации последних. Так, например, для человека смертельная доза NaNCO составляет около 13 граммов.
В России класс опасности III, ПДК в воздухе рабочей зоны 1 мг/м³ (по цианат-анионам), ирритант (1998).
Примечания
[править | править код]- ↑ Sicherheitsdatenblatt Merck
- ↑ [www.xumuk.ru/encyklopedia/2/5150.html Цианаты неорганические — ХиМик. Ру]
Литература
[править | править код]- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
Этот раздел содержит материал неэнциклопедичного характера. |
В статье не хватает ссылок на источники (см. рекомендации по поиску). |
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |