Потенциал Сазерленда: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
→Вириальные коэффициенты: Исправление фактической ошибки, добавление информации |
РобоСтася (обсуждение | вклад) м косметические изменения |
||
| (не показано 18 промежуточных версий 2 участников) | |||
| Строка 1: | Строка 1: | ||
'''Потенциал Сазерленда'''<ref group="ссылка">{{Статья|заглавие=The viscosity of gases and molecular force|издание=Philosophical Magazine|автор=William Sutherland|ссылка=https://www.tandfonline.com/doi/abs/10.1080/14786449308620508|год=1893|том=36|страницы=507—531|archivedate=2023-12-23|archiveurl=https://web.archive.org/web/20231223124130/https://www.tandfonline.com/doi/abs/10.1080/14786449308620508}}</ref><ref group="ссылка">{{Статья|заглавие=Third Virial Coefficient for the Sutherland (∞, ν) Potential|издание=Reviews of Modern Physics|автор=H. W. Graben and R. D. Present|ссылка=https://journals.aps.org/rmp/abstract/10.1103/RevModPhys.36.1025|год=1964|том=36|страницы=1025—1033|archivedate=2023-12-23|archiveurl=https://web.archive.org/web/20231223124130/https://journals.aps.org/rmp/abstract/10.1103/RevModPhys.36.1025}}</ref> (Sutherland potential) — простая модель парного взаимодействия неполярных молекул, описывающая зависимость энергии взаимодействия двух частиц от расстояния <math>r</math> между ними. Впервые этот вид потенциала был предложен {{Iw|Сазерленд, Уильям (физик)|Уильямом Сазерлендом|4=William Sutherland (physicist)}} в 1893 году. Потенциал сочетает в себе твердую сердцевину (бесконечно |
'''Потенциал Сазерленда'''<ref group="ссылка">{{Статья|заглавие=The viscosity of gases and molecular force|издание=Philosophical Magazine|автор=William Sutherland|ссылка=https://www.tandfonline.com/doi/abs/10.1080/14786449308620508|год=1893|том=36|страницы=507—531|archivedate=2023-12-23|archiveurl=https://web.archive.org/web/20231223124130/https://www.tandfonline.com/doi/abs/10.1080/14786449308620508}}</ref><ref group="ссылка">{{Статья|заглавие=Third Virial Coefficient for the Sutherland (∞, ν) Potential|издание=Reviews of Modern Physics|автор=H. W. Graben and R. D. Present|ссылка=https://journals.aps.org/rmp/abstract/10.1103/RevModPhys.36.1025|год=1964|том=36|страницы=1025—1033|archivedate=2023-12-23|archiveurl=https://web.archive.org/web/20231223124130/https://journals.aps.org/rmp/abstract/10.1103/RevModPhys.36.1025}}</ref> (Sutherland potential) — простая модель парного взаимодействия неполярных молекул, описывающая зависимость энергии взаимодействия двух частиц от расстояния <math>r</math> между ними. Впервые этот вид потенциала был предложен {{Iw|Сазерленд, Уильям (физик)|Уильямом Сазерлендом|4=William Sutherland (physicist)}} в 1893 году. Потенциал сочетает в себе твердую сердцевину (бесконечно сильное отталкивание на близких расстояниях) с притягивающим хвостом, описываемым степенным законом. Эта модель относительно реалистично передаёт свойства реального взаимодействия сферических неполярных молекул и поэтому широко используется в расчётах и при компьютерном моделировании. |
||
== Вид потенциала взаимодействия == |
== Вид потенциала взаимодействия == |
||
[[Файл:Sutherland potantial.png|мини|альт=Характерный вид потенциала Сазерленда|Характерный вид потенциала Сазерленда]] |
[[Файл:Sutherland potantial.png|мини|альт=Характерный вид потенциала Сазерленда|Характерный вид потенциала Сазерленда]] |
||
Обобщённая форма потенциала Сазерленда описывается следующим образом: |
|||
Уильям Сазерленд получил более реалистичное выражение для потенциала взаимодействия, чем полученное из потенциала бесконечно жестких упругих сфер. Данный потенциал описывается следующим выражением: |
|||
: <math> |
: <math> |
||
\Phi_2(r) = \begin{cases} |
\Phi_2(r) = \begin{cases} |
||
| Строка 10: | Строка 10: | ||
\end{cases}, |
\end{cases}, |
||
</math> |
</math> |
||
где <math>\Phi_2(r)</math> — |
где <math>\Phi_2(r)</math> — {{iw|Потенциал парного взаимодействия|потенциал парного взаимодействия|en|Pair_potential}}<ref group="комментарий">[http://www.sklogwiki.org/SklogWiki/index.php/Intermolecular_pair_potential Intermolecular pair potential] {{Wayback|url=http://www.sklogwiki.org/SklogWiki/index.php/Intermolecular_pair_potential |date=20231223124134 }} on [http://www.sklogwiki.org SklogWiki] {{Wayback|url=http://www.sklogwiki.org/ |date=20200108065124 }}.</ref>, <math>r=|\boldsymbol{r_1}-\boldsymbol{r_2}|</math> — расстояние между частицами 1 и 2, положение которых описывается радиусом-вектором <math>\boldsymbol{r}</math>. <math>\varepsilon</math> — глубина [[Потенциальная яма|потенциальной ямы]], <math>\sigma</math> — радиус соответствующей твёрдой сферы, <math>\gamma</math> — параметр, контроллирующий скорость убывания потенциала до нуля. |
||
На больших расстояниях данный потенциал является притягивательным |
|||
Данный потенциал, в отличие от [[Потенциал Леннарда-Джонса|потенциала Леннарда-Джонса]], является «притягивательным», то есть описывающим лишь притяжение частиц в силу того, что на больших расстояниях <math>F_2=-\frac{\text{d}\Phi_2(r)}{\text{d}r}\le0</math>. Отталкивание частиц происходит лишь на расстояниях, <math>r\le\sigma</math> с бесконечной силой. |
|||
: <math> |
|||
F_2=-\frac{\text{d}\Phi_2(r)}{\text{d}r}\le0 |
|||
</math> |
|||
Отталкивание частиц происходит лишь на расстояниях, <math>r\le\sigma</math> с бесконечной силой. |
|||
Общая форма взаимодействия между атомами или молекулами включает в себя отталкивающую часть на малых расстояниях и притягивающую часть на больших расстояниях. В качестве аналитического представления взаимодействия часто используется потенциал [[Потенциал Леннарда-Джонса|потенциала Леннарда-Джонса]] 6-12. Притягательный хвост, являющийся следствием флуктуаций электрических дипольных моментов, хорошо описывается законом <math>r^{-6}</math>. Однако <math>r^{-12}</math> описание отталкивающего центра является простым приближением степенного закона к реальному взаимодействию на близких расстояниях. Популярность потенциала 6-12 заключается, главным образом, в его математической элегантности. |
|||
Потенциал Сазерленда рассматривает отталкивание на коротких расстояниях по-другому; он аппроксимирует взаимодействие в виде жесткого ядра. Притягивающий хвост описывается обычным дипольным законом <math>r^{-6}</math>. |
|||
{| class="wikitable" style="text-align:center;" |
|||
|+ Параметры потенциала Сазерленда (<math>\gamma=6</math>)<ref group="ссылка">{{Книга|заглавие=Молекулярная теория газов и жидкостей|автор=Дж. Гиршфельдер, Ч. Кертисс и Р. Берд|ответственный=перевод с английского под редакцией Е.В. Ступоченко|год=1961|язык=ru|место=М.|издательство=Издательство иностранной литературы|страниц=931}}</ref> |
|||
|- |
|||
! rowspan="2" | Газ |
|||
! colspan="2" | Из измеренной вязкости |
|||
! colspan="2" | Из измеренной самодиффузии |
|||
|- |
|||
| <math>\sigma, {\AA}</math> || <math>\varepsilon/k_B, K</math> || <math>\sigma, {\AA}</math> || <math>\varepsilon/k_B, K</math> |
|||
|- |
|||
| <math>Ne</math> || 2.33 || 192 || 2.20 || 196 |
|||
|- |
|||
| <math>N_2</math> || 3.07 || 416 || 3.17 || 202 |
|||
|- |
|||
| <math>CO_2</math> || 3.43 || 638 || — || — |
|||
|} |
|||
== Вириальные коэффициенты == |
== Вириальные коэффициенты == |
||
[[ |
[[Файл:AX22245465fff.svg|thumb|Вид второго вириального коэффициента при <math>\gamma=6</math>. Пунктирная линия — касательная к графику.]] |
||
{| class="wikitable" style="float:right; clear:right;" |
|||
Второй [[Вириальное разложение|вириальный коэффициент]] данного потенциала можно выразить в следующем виде |
|||
|+ Коэффициенты разложения третьего вириального коэффициента<ref group="ссылка">{{Статья|заглавие=Third Virial Coefficient for the Sutherland (∞, ν) Potential|издание=Reviews of Modern Physics|автор=H. W. Graben and R. D. Present|ссылка=https://journals.aps.org/rmp/abstract/10.1103/RevModPhys.36.1025|год=1964|том=36|страницы=1025—1033|archivedate=2023-12-23|archiveurl=https://web.archive.org/web/20231223124130/https://journals.aps.org/rmp/abstract/10.1103/RevModPhys.36.1025}}</ref> |
|||
|- |
|||
! Коэффициент !! Значение коэффициента |
|||
|- |
|||
| <math>c_0</math> || 0.625 |
|||
|- |
|||
| <math>c_1</math> || -0.6448603 |
|||
|- |
|||
| <math>c_2</math> || 0.2861417 |
|||
|- |
|||
| <math>c_3</math> || 0.0709195 |
|||
|- |
|||
| <math>c_4</math> || 0.0027382 |
|||
|- |
|||
| <math>c_5</math> || -0.0062834 |
|||
|- |
|||
| <math>c_6</math> || -0.0035694 |
|||
|- |
|||
| <math>c_7</math> || -0.0013018 |
|||
|- |
|||
| <math>c_8</math> || -0.0003808 |
|||
|- |
|||
| <math>c_9</math> || -0.0000961 |
|||
|- |
|||
| <math>c_{10}</math> || -0.0000217 |
|||
|} |
|||
=== Второй вириальный коэффициент === |
|||
Второй [[Вириальное разложение|вириальный коэффициент]] данного потенциала можно выразить в следующем виде<ref group="ссылка">{{Статья|заглавие=Closed form of second virial coefficient for Sutherland potential|издание=J. Chem. Phys|ссылка=https://doi.org/10.1063/1.431141|автор=D. Levi and M. de Llano|год=1975|том=63|страницы=4561—4562}}</ref> |
|||
: <math> |
: <math> |
||
B_2(\tau)=-2\pi\sigma^3\sum_{n=0}^{\infty}\frac{\tau^{-n}}{n!(n\gamma-3)}=-\frac{2\pi\sigma^3}{\gamma}\left(-\frac{1}{\tau}\right)^{3/\gamma}\Gamma\left(-\frac{3}{\gamma},0,-\frac{1}{\tau}\right) |
B_2(\tau)=-2\pi\sigma^3\sum_{n=0}^{\infty}\frac{\tau^{-n}}{n!(n\gamma-3)}=-\frac{2\pi\sigma^3}{\gamma}\left(-\frac{1}{\tau}\right)^{3/\gamma}\Gamma\left(-\frac{3}{\gamma},0,-\frac{1}{\tau}\right) |
||
</math> |
</math> |
||
где <math>\tau=kT/\ |
где <math>\tau=kT/\varepsilon</math> — приведённая температура, а <math>\Gamma(a,z_0,z_1)</math> — обобщённая [[неполная гамма-функция]]: <math>\Gamma(a,z_0,z_1)=\Gamma(a,z_0)-\Gamma(a,z_1)</math> |
||
{{collapse top|Вывод выражения второго вириального коэффициента}} |
|||
=== Случай <math>\gamma=6</math> === |
|||
Как известно, в общем виде второй вириальный коэффициент можно записать как |
|||
: <math> |
|||
B_2(T)=-2\pi\int_0^{\infty}r^2\left(\exp\left[-\frac{\Phi_{ij}(r)}{kT}\right]-1\right)dr |
|||
</math> |
|||
Подставим выражение потенциала Сазерленда |
|||
: <math> |
|||
B_2(T)=-2\pi\int_0^{\infty}r^2\left(\exp\left[-\frac{\Phi_{ij}(r)}{kT}\right]-1\right)dr=2\pi\int_{0}^{\sigma}r^2dr-2\pi\int_{\sigma}^{\infty}r^2\left(\exp\left[\frac{\varepsilon}{kT}\left(\frac{\sigma}{r}\right)^{\gamma}\right]-1\right)dr=\frac{2}{3}\pi\sigma^3-2\pi\int_{\sigma}^{\infty}r^2\left(\exp\left[\frac{\varepsilon}{kT}\left(\frac{\sigma}{r}\right)^{\gamma}\right]-1\right)dr |
|||
</math> |
|||
Сделаем подстановку <math>x=r/\sigma</math> и <math>\tau=kT/\varepsilon</math> |
|||
: <math> |
|||
B_2(\tau)/\frac{2}{3}\pi\sigma^3=1-3\int_1^{\infty}x^2\left(\exp\left[\frac{1}{\tau x^{\gamma}}\right]-1\right)dx |
|||
</math> |
|||
Разложим экспоненту в ряд по степеням <math>1/\tau</math> и почленно проинтегрируем |
|||
: <math> |
|||
B_2(\tau)/\frac{2}{3}\pi\sigma^3=1-3\sum\limits_{n=1}^{\infty}\frac{\tau^{-n}}{n!(\gamma n-3)}=-3\sum\limits_{n=0}^{\infty}\frac{\tau^{-n}}{n!(\gamma n-3)} |
|||
</math> |
|||
В результате получим, что второй вириальный коэффициент данного потенциала можно выразить в следующем виде |
|||
: <math> |
|||
B_2(\tau)=-2\pi\sigma^3\sum_{n=0}^{\infty}\frac{\tau^{-n}}{n!(n\gamma-3)}=-\frac{2\pi\sigma^3}{\gamma}\left(-\frac{1}{\tau}\right)^{3/\gamma}\Gamma\left(-\frac{3}{\gamma},0,-\frac{1}{\tau}\right) |
|||
</math> |
|||
{{collapse bottom}} |
|||
В высокотемпературном пределе второй вириальный коэффициент потенциала Сазерленда стремится к значению для потенциала {{Iw|Твёрдые сферы|твёрдых сфер|4=Hard spheres}}: <math>B_2^{\text{т.с.}}=\frac{2}{3}\pi\sigma^3</math> |
|||
: <math> |
|||
B_2(T)\sim \frac{2}{3}\pi\sigma^3\left(1-\frac{\varepsilon}{kT}-...\right) |
|||
</math> |
|||
при этом основное его изменение линейно, в отличие от, например, потенциала Леннарда-Джонса, который не имеет столь простого поведения при <math>T\to\infty</math>, что является следствием «размягчения» твёрдого ядра. Отметим, что при <math>T\to\infty: B_2^{LJ}(T)\to0</math>. |
|||
'''Связь параметров уравнения Ван-дер-Ваальса с параметрами потенциала''' |
|||
Параметры [[Уравнение Ван-дер-Ваальса|уравнения Ван-дер-Ваальса]] можно связать с параметрами потенциала Сазерленда следующим образом<ref group="ссылка">{{Статья|заглавие=Modification to the Van der Waals Equation of State|издание=J. phase equilib|ссылка=https://doi.org/10.1361/105497103772084570|автор=J. Tian and Y. Gui|год=2003|том=24|страницы=533—541}}</ref>: |
|||
: <math> |
|||
b=\frac{2}{3}\pi\sigma^3 |
|||
</math> |
|||
: <math> |
|||
a=b\frac{3\varepsilon}{\gamma-3}=\frac{2\pi\sigma^3\varepsilon}{\gamma-3} |
|||
</math> |
|||
{{collapse top|Вывод}} |
|||
В выражении для второго вириального коэффициента разложим экспоненту в ряд, ограничившись только первыми двумя слагаемыми <math>\exp\left[\frac{1}{\tau x^{\gamma}}\right]=1+\frac{1}{\tau x^{\gamma}}+...</math> |
|||
: <math> |
|||
B_2(\tau)\bigg/\frac{2}{3}\pi\sigma^3=1-3\int_1^{\infty}x^2\left(\frac{1}{\tau x^{\gamma}}\right)\text{d}x=1-\frac{3}{\tau(\gamma-3)}=1-\frac{3\varepsilon}{kT(\gamma-3)} |
|||
</math> |
|||
Обратим внимание, что получившийся интеграл сходится только при <math>\gamma>3</math> |
|||
Учитывая, что для уравнения Ван-дер-Ваальса |
|||
: <math> |
|||
B_2(T)=b-\frac{a}{kT} |
|||
</math> |
|||
Получим выражения для параметров уравнения: |
|||
: <math> |
|||
b=\frac{2}{3}\pi\sigma^3 |
|||
</math> |
|||
: <math> |
|||
a=b\frac{3\varepsilon}{\gamma-3}=\frac{2\pi\sigma^3\varepsilon}{\gamma-3} |
|||
</math> |
|||
{{collapse bottom}} |
|||
'''Случай <math>\gamma=6</math>''' |
|||
При <math>\gamma=6</math> второй вириальный коэффициент возможно выразить как |
При <math>\gamma=6</math> второй вириальный коэффициент возможно выразить как |
||
| Строка 28: | Строка 139: | ||
B_2(\tau)=\frac{2}{3}\pi\sigma^3\left(e^{1/\tau}-\sqrt{\frac{\pi}{\tau}}\text{Erfi}\frac{1}{\sqrt{\tau}}\right) |
B_2(\tau)=\frac{2}{3}\pi\sigma^3\left(e^{1/\tau}-\sqrt{\frac{\pi}{\tau}}\text{Erfi}\frac{1}{\sqrt{\tau}}\right) |
||
</math> |
</math> |
||
где <math>\text{Erfi}(z)</math> |
где <math>\text{Erfi}(z)</math> — {{Iw|Комплексная функция ошибок|комплексная функция ошибок|4=Error function#Imaginary error function}}. |
||
Температура Бойля и температура инверсии могу быть найдены из своих определений: |
[[Реальный газ#Точки Бойля, кривая Бойля, температура Бойля|Температура Бойля]] и [[Эффект Джоуля — Томсона|температура инверсии]] могу быть найдены из своих определений: |
||
: <math> |
: <math> |
||
\begin{array}{ll} |
\begin{array}{ll} |
||
| Строка 37: | Строка 148: | ||
\end{array} |
\end{array} |
||
</math> |
</math> |
||
=== Третий вириальный коэффициент === |
|||
Третий вириальный коэффициент данного потенциала может быть получен в виде разложения<ref group="ссылка">{{Статья|заглавие=Third Virial Coefficient for the Sutherland (∞, ν) Potential|издание=Reviews of Modern Physics|автор=H. W. Graben and R. D. Present|ссылка=https://journals.aps.org/rmp/abstract/10.1103/RevModPhys.36.1025|год=1964|том=36|страницы=1025—1033|archivedate=2023-12-23|archiveurl=https://web.archive.org/web/20231223124130/https://journals.aps.org/rmp/abstract/10.1103/RevModPhys.36.1025}}</ref> по степеням <math>\tau</math>: |
|||
: <math> |
|||
B_3(\tau)=\sum_{n=0}^{\infty}\frac{c_n}{\tau^n} |
|||
</math> |
|||
где <math>c_n</math> — коэффициенты, первые 11 из которых приведены в таблице. |
|||
== Закон Сазерленда == |
|||
{| class="wikitable" style="float:right; clear:right;" |
|||
|+ Постоянные пропорциональности для постоянных Сазерленда<ref group="ссылка">{{Книга|заглавие=Молекулярная теория газов и жидкостей|автор=Дж. Гиршфельдер, Ч. Кертисс и Р. Берд|ответственный=перевод с английского под редакцией Е.В. Ступоченко|год=1961|язык=ru|место=М.|издательство=Издательство иностранной литературы|страниц=931}}</ref> |
|||
|- |
|||
! <math>\gamma</math> !! <math>f_{D}(\gamma)</math> !! <math>f_{\eta}(\gamma)</math> |
|||
|- |
|||
| 2 || 0.2662 || 0.2336 |
|||
|- |
|||
| 3 || 0.2276 || 0.2118 |
|||
|- |
|||
| 4 || 0.2010 || 0.1956 |
|||
|- |
|||
| 6 || 0.1667 || 0.1736 |
|||
|- |
|||
| 8 || 0.1444 || 0.1556 |
|||
|} |
|||
{| class="wikitable" style="float:right; clear:right;" |
|||
|+ Постоянные Сазерленда и вязкость некоторых газов<ref group="комментарий">[https://profbeckman.narod.ru/MedMemb.htm {{Книга|заглавие=Курс лекций Мембраны в медицине|автор=Бекман И. Н.|место=М.|год=2010}}]</ref> |
|||
|- |
|||
! Газ !! <math>\eta</math>, мкпз <math>(0^{\circ}C)</math> !! <math>S_{\eta}, ^{\circ}C</math>, 1 атм. |
|||
|- |
|||
| <math>CO_2</math> || 137 || 254 |
|||
|- |
|||
| <math>CO</math> || 166 || 101 |
|||
|- |
|||
| <math>NH_3</math> || 93 || 503 |
|||
|- |
|||
| <math>SO_2</math> || 116 || 306 |
|||
|- |
|||
| <math>H_2S</math> || 116 || 331 |
|||
|- |
|||
| <math>HBr</math> || 171 || 375 |
|||
|- |
|||
| <math>HCl</math> || 133 || 360 |
|||
|- |
|||
| <math>HI</math> || 173 || 390 |
|||
|- |
|||
| <math>NO</math> || 179 || 128 |
|||
|- |
|||
| <math>PH_3</math> || 107 || 290 |
|||
|- |
|||
| <math>He</math> || 188 || 83 |
|||
|- |
|||
| <math>Ne</math> || 298 || 61 |
|||
|- |
|||
| <math>Ar</math> || 210 || 142 |
|||
|- |
|||
| <math>Kr</math> || 233 || 210 |
|||
|- |
|||
| <math>Xe</math> || 211 || 290 |
|||
|- |
|||
| <math>Cl_2</math> || 123 || 351 |
|||
|- |
|||
| <math>Br_2</math> || 146 || 533 |
|||
|- |
|||
| <math>H_2</math> || 85 || 73 |
|||
|- |
|||
| <math>N_2O</math> || 137 || 260 |
|||
|- |
|||
| <math>N_2</math> || 165 || 104 |
|||
|- |
|||
| <math>O_2</math> || 192 || 125 |
|||
|} |
|||
Используя [[Метод Чепмена — Энскога|метод Чепмена—Энскога]] можно получить следующее выражение для [[Вязкость#Динамическая вязкость|динамической вязкости]] газа <math>\eta</math> и коэффициента [[Диффузия|самодиффузии]] <math>D</math>: |
|||
: <math> |
|||
\eta=\frac{5}{16}\frac{\sqrt{\pi mkT}}{\bar{Q}_{(2,2)}} \quad D=\frac{3}{8}\frac{\sqrt{\pi k_BT/m}}{n\bar{Q}_{(1,1)}} |
|||
</math> |
|||
где <math>\bar{Q}_{(2,2)}</math> — осреднённое сечение потери энергии, <math>\bar{Q}_{(1,1)}</math> — усреднённое диффузионное сечение потери импульса. |
|||
Точный расчет углов отклонения и эффективных сечений столкновения требует трудоемкой вычислительной работы. Однако если предположить, что притяжение относительно слабо, то высшими степенями <math>\varepsilon</math>, которые появляются при точном подходе к проблеме, можно пренебречь. В результате получим формулы Сюзерленда для вязкости и диффузии, широко используемые для получения кривых, соответствующих экспериментальным данным |
|||
: <math> |
|||
\eta=\frac{\eta_{\text{т.с.}}}{1+\frac{S_{\eta}}{T}} \quad D=\frac{D_{\text{т.с.}}}{1+\frac{S_D}{T}} |
|||
</math> |
|||
где <math>\eta_{\text{т.с.}}, D_{\text{т.с.}}</math> — динамическая вязкость и коэффициент диффузии модели твёрдых сфер. |
|||
: <math> |
|||
\eta_{\text{т.с.}}=\frac{5}{16\sigma^2}\sqrt{\frac{mk_BT}{\pi}} \quad D_{\text{т.с.}}=\frac{3}{16n\sigma^2}\sqrt{\frac{k_BT}{\pi m}} |
|||
</math> |
|||
а <math>S_{\eta}</math> — постоянная Сазерленда, пропорциональная энергии взаимодействия двух молекул при их соприкосновении: |
|||
: <math> |
|||
S_{\eta}=f_{\eta}(\gamma)\frac{\varepsilon}{k_B} \quad S_{D}=f_{D}(\gamma)\frac{\varepsilon}{k_B} |
|||
</math> |
|||
Данные соотношения лежат в основе полу-эмпирической формулы, носящей название закона Сазерленда, позволяющей рассчитать вязкость при температуре <math>T</math> по известной вязкости при опорной температуре <math>T_{ref}</math>: |
|||
: <math> |
|||
\eta\approx\eta_{ref}\left(\frac{T}{T_{ref}}\right)^{3/2}\frac{T_{ref}+S_{\eta}}{T+S_{\eta}} |
|||
</math> |
|||
За опорную температуру обычно принимают 273.15K. Так, данные для воздуха <math>S_{\eta}=110.4K</math>, <math>\eta(T_{ref})=1.715\cdot10^5\text{Па}\cdot\text{с}</math> дают хорошую аппроксимацию в диапазоне температур <math>T=170..1500 K</math>. При этом подразумевается, что постоянная Сазерленда практически не зависит от температуры: для воздуха <math>S_{\eta}(273.15K)=113K</math>, <math>S_{\eta}(1873.15K)=124K</math>. |
|||
При отсутствии данных по <math>S_{\eta}</math> можно использовать следующую аппроксимацию: |
|||
: <math> |
|||
S_{\eta}\approx1.47T_s |
|||
</math> |
|||
где <math>T_s</math> — температура кипения. |
|||
Сазерленд пришёл к этой зависимости при анализе экспериментально измеренной вязкости газа от температуры, впервые обратив внимание на зависимость газокинетического диаметра молекулы от температуры: |
|||
: <math> |
|||
\sigma^2=\sigma_{\infty}^2\left(1+\frac{S_{\eta}}{T}\right) |
|||
</math> |
|||
где <math>\sigma_{\infty}</math> — диаметр Стюарта, соответствующий размеру молекул при <math>T\to\infty</math> |
|||
== Примечания == |
== Примечания == |
||
| Строка 48: | Строка 271: | ||
== Литература == |
== Литература == |
||
* {{Статья|заглавие=The viscosity of gases and molecular force|издание=Philosophical Magazine Series 5|ссылка=http://dx.doi.org/10.1080/14786449308620508|автор=William Sutherland|год=1893|месяц=Декабрь|том=36|номер=223|страницы=507—531}} |
|||
* {{Книга|заглавие=Молекулярная теория газов и жидкостей|автор=Дж. Гиршфельдер, Ч. Кертисс и Р. Берд|ответственный=перевод с английского под редакцией Е.В. Ступоченко|год=1961|язык=ru|место=М.|издательство=Издательство иностранной литературы|страниц=931}} |
|||
* {{Книга|заглавие=Введение в теорию межмолекулярных взаимодействий.|автор=Каплан И. Г.|место=М.|издательство=Наука. Главная редакция физико-математической литературы|год=1982|страницы=312}} |
* {{Книга|заглавие=Введение в теорию межмолекулярных взаимодействий.|автор=Каплан И. Г.|место=М.|издательство=Наука. Главная редакция физико-математической литературы|год=1982|страницы=312}} |
||
* {{Книга|заглавие=Computer Simulation of Liquids|автор=M. P. Allen, D. J. Tildesley|издательство=Oxford University Press|год=1990|isbn=0198556454|isbn2=9780198556459}} |
* {{Книга|заглавие=Computer Simulation of Liquids|автор=M. P. Allen, D. J. Tildesley|издательство=Oxford University Press|год=1990|isbn=0198556454|isbn2=9780198556459}} |
||
| Строка 57: | Строка 282: | ||
* {{Статья|заглавие=Liquid/vapor coexistence and surface tension of the Sutherland fluid with a variable range of interaction: Computer simulation and perturbation theory studies|издание=Journal of Chemical Physics|автор=Roman Melnyk, Pedro Orea, Ivo Nezbeda, and Andrij Trokhymchuk|ссылка=http://dx.doi.org/10.1063/1.3371710|год=2010|номер=132|страницы=134504}} |
* {{Статья|заглавие=Liquid/vapor coexistence and surface tension of the Sutherland fluid with a variable range of interaction: Computer simulation and perturbation theory studies|издание=Journal of Chemical Physics|автор=Roman Melnyk, Pedro Orea, Ivo Nezbeda, and Andrij Trokhymchuk|ссылка=http://dx.doi.org/10.1063/1.3371710|год=2010|номер=132|страницы=134504}} |
||
* {{Статья|заглавие=Application of the SAFT-VR equation of state to vapor–liquid equilibrium calculations for pure components and binary mixtures using the Sutherland potential|издание=Fluid Phase Equilibria|автор=F. Paragand, F. Feyzi and B. Behzadi|ссылка=http://dx.doi.org/10.1016/j.fluid.2009.10.027|год=2010|том=290|страницы=181—194}} |
* {{Статья|заглавие=Application of the SAFT-VR equation of state to vapor–liquid equilibrium calculations for pure components and binary mixtures using the Sutherland potential|издание=Fluid Phase Equilibria|автор=F. Paragand, F. Feyzi and B. Behzadi|ссылка=http://dx.doi.org/10.1016/j.fluid.2009.10.027|год=2010|том=290|страницы=181—194}} |
||
* {{Статья|заглавие=Modification to the Van der Waals Equation of State|издание=J. phase equilib|ссылка=https://doi.org/10.1361/105497103772084570|автор=J. Tian and Y. Gui|год=2003|том=24|страницы=533—541}} |
|||
== См. также == |
== См. также == |
||
Текущая версия от 22:25, 3 декабря 2024
Потенциал Сазерленда[ссылка 1][ссылка 2] (Sutherland potential) — простая модель парного взаимодействия неполярных молекул, описывающая зависимость энергии взаимодействия двух частиц от расстояния между ними. Впервые этот вид потенциала был предложен Уильямом Сазерлендом[англ.] в 1893 году. Потенциал сочетает в себе твердую сердцевину (бесконечно сильное отталкивание на близких расстояниях) с притягивающим хвостом, описываемым степенным законом. Эта модель относительно реалистично передаёт свойства реального взаимодействия сферических неполярных молекул и поэтому широко используется в расчётах и при компьютерном моделировании.
Вид потенциала взаимодействия
[править | править код]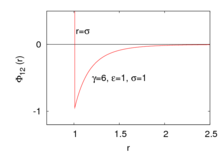
Обобщённая форма потенциала Сазерленда описывается следующим образом:
где — потенциал парного взаимодействия[англ.][комментарий 1], — расстояние между частицами 1 и 2, положение которых описывается радиусом-вектором . — глубина потенциальной ямы, — радиус соответствующей твёрдой сферы, — параметр, контроллирующий скорость убывания потенциала до нуля.
На больших расстояниях данный потенциал является притягивательным
Отталкивание частиц происходит лишь на расстояниях, с бесконечной силой.
Общая форма взаимодействия между атомами или молекулами включает в себя отталкивающую часть на малых расстояниях и притягивающую часть на больших расстояниях. В качестве аналитического представления взаимодействия часто используется потенциал потенциала Леннарда-Джонса 6-12. Притягательный хвост, являющийся следствием флуктуаций электрических дипольных моментов, хорошо описывается законом . Однако описание отталкивающего центра является простым приближением степенного закона к реальному взаимодействию на близких расстояниях. Популярность потенциала 6-12 заключается, главным образом, в его математической элегантности. Потенциал Сазерленда рассматривает отталкивание на коротких расстояниях по-другому; он аппроксимирует взаимодействие в виде жесткого ядра. Притягивающий хвост описывается обычным дипольным законом .
| Газ | Из измеренной вязкости | Из измеренной самодиффузии | ||
|---|---|---|---|---|
| 2.33 | 192 | 2.20 | 196 | |
| 3.07 | 416 | 3.17 | 202 | |
| 3.43 | 638 | — | — | |
Вириальные коэффициенты
[править | править код]
| Коэффициент | Значение коэффициента |
|---|---|
| 0.625 | |
| -0.6448603 | |
| 0.2861417 | |
| 0.0709195 | |
| 0.0027382 | |
| -0.0062834 | |
| -0.0035694 | |
| -0.0013018 | |
| -0.0003808 | |
| -0.0000961 | |
| -0.0000217 |
Второй вириальный коэффициент
[править | править код]Второй вириальный коэффициент данного потенциала можно выразить в следующем виде[ссылка 5]
где — приведённая температура, а — обобщённая неполная гамма-функция:
Как известно, в общем виде второй вириальный коэффициент можно записать как
Подставим выражение потенциала Сазерленда
Сделаем подстановку и
Разложим экспоненту в ряд по степеням и почленно проинтегрируем
В результате получим, что второй вириальный коэффициент данного потенциала можно выразить в следующем виде
В высокотемпературном пределе второй вириальный коэффициент потенциала Сазерленда стремится к значению для потенциала твёрдых сфер[англ.]:
при этом основное его изменение линейно, в отличие от, например, потенциала Леннарда-Джонса, который не имеет столь простого поведения при , что является следствием «размягчения» твёрдого ядра. Отметим, что при .
Связь параметров уравнения Ван-дер-Ваальса с параметрами потенциала
Параметры уравнения Ван-дер-Ваальса можно связать с параметрами потенциала Сазерленда следующим образом[ссылка 6]:
В выражении для второго вириального коэффициента разложим экспоненту в ряд, ограничившись только первыми двумя слагаемыми
Обратим внимание, что получившийся интеграл сходится только при
Учитывая, что для уравнения Ван-дер-Ваальса
Получим выражения для параметров уравнения:
Случай
При второй вириальный коэффициент возможно выразить как
где — комплексная функция ошибок[англ.].
Температура Бойля и температура инверсии могу быть найдены из своих определений:
Третий вириальный коэффициент
[править | править код]Третий вириальный коэффициент данного потенциала может быть получен в виде разложения[ссылка 7] по степеням :
где — коэффициенты, первые 11 из которых приведены в таблице.
Закон Сазерленда
[править | править код]| 2 | 0.2662 | 0.2336 |
| 3 | 0.2276 | 0.2118 |
| 4 | 0.2010 | 0.1956 |
| 6 | 0.1667 | 0.1736 |
| 8 | 0.1444 | 0.1556 |
| Газ | , мкпз | , 1 атм. |
|---|---|---|
| 137 | 254 | |
| 166 | 101 | |
| 93 | 503 | |
| 116 | 306 | |
| 116 | 331 | |
| 171 | 375 | |
| 133 | 360 | |
| 173 | 390 | |
| 179 | 128 | |
| 107 | 290 | |
| 188 | 83 | |
| 298 | 61 | |
| 210 | 142 | |
| 233 | 210 | |
| 211 | 290 | |
| 123 | 351 | |
| 146 | 533 | |
| 85 | 73 | |
| 137 | 260 | |
| 165 | 104 | |
| 192 | 125 |
Используя метод Чепмена—Энскога можно получить следующее выражение для динамической вязкости газа и коэффициента самодиффузии :
где — осреднённое сечение потери энергии, — усреднённое диффузионное сечение потери импульса.
Точный расчет углов отклонения и эффективных сечений столкновения требует трудоемкой вычислительной работы. Однако если предположить, что притяжение относительно слабо, то высшими степенями , которые появляются при точном подходе к проблеме, можно пренебречь. В результате получим формулы Сюзерленда для вязкости и диффузии, широко используемые для получения кривых, соответствующих экспериментальным данным
где — динамическая вязкость и коэффициент диффузии модели твёрдых сфер.
а — постоянная Сазерленда, пропорциональная энергии взаимодействия двух молекул при их соприкосновении:
Данные соотношения лежат в основе полу-эмпирической формулы, носящей название закона Сазерленда, позволяющей рассчитать вязкость при температуре по известной вязкости при опорной температуре :
За опорную температуру обычно принимают 273.15K. Так, данные для воздуха , дают хорошую аппроксимацию в диапазоне температур . При этом подразумевается, что постоянная Сазерленда практически не зависит от температуры: для воздуха , .
При отсутствии данных по можно использовать следующую аппроксимацию:
где — температура кипения.
Сазерленд пришёл к этой зависимости при анализе экспериментально измеренной вязкости газа от температуры, впервые обратив внимание на зависимость газокинетического диаметра молекулы от температуры:
где — диаметр Стюарта, соответствующий размеру молекул при
Примечания
[править | править код]Комментарии
- ↑ Intermolecular pair potential Архивная копия от 23 декабря 2023 на Wayback Machine on SklogWiki Архивная копия от 8 января 2020 на Wayback Machine.
- ↑ Бекман И. Н. Курс лекций Мембраны в медицине. — М., 2010.
Источники
- ↑ William Sutherland. The viscosity of gases and molecular force // Philosophical Magazine. — 1893. — Т. 36. — С. 507—531. Архивировано 23 декабря 2023 года.
- ↑ H. W. Graben and R. D. Present. Third Virial Coefficient for the Sutherland (∞, ν) Potential // Reviews of Modern Physics. — 1964. — Т. 36. — С. 1025—1033. Архивировано 23 декабря 2023 года.
- ↑ Дж. Гиршфельдер, Ч. Кертисс и Р. Берд. Молекулярная теория газов и жидкостей / перевод с английского под редакцией Е.В. Ступоченко. — М.: Издательство иностранной литературы, 1961. — 931 с.
- ↑ H. W. Graben and R. D. Present. Third Virial Coefficient for the Sutherland (∞, ν) Potential // Reviews of Modern Physics. — 1964. — Т. 36. — С. 1025—1033. Архивировано 23 декабря 2023 года.
- ↑ D. Levi and M. de Llano. Closed form of second virial coefficient for Sutherland potential // J. Chem. Phys. — 1975. — Т. 63. — С. 4561—4562.
- ↑ J. Tian and Y. Gui. Modification to the Van der Waals Equation of State // J. phase equilib. — 2003. — Т. 24. — С. 533—541.
- ↑ H. W. Graben and R. D. Present. Third Virial Coefficient for the Sutherland (∞, ν) Potential // Reviews of Modern Physics. — 1964. — Т. 36. — С. 1025—1033. Архивировано 23 декабря 2023 года.
- ↑ Дж. Гиршфельдер, Ч. Кертисс и Р. Берд. Молекулярная теория газов и жидкостей / перевод с английского под редакцией Е.В. Ступоченко. — М.: Издательство иностранной литературы, 1961. — 931 с.
Литература
[править | править код]- William Sutherland. The viscosity of gases and molecular force // Philosophical Magazine Series 5. — 1893. — Декабрь (т. 36, № 223). — С. 507—531.
- Дж. Гиршфельдер, Ч. Кертисс и Р. Берд. Молекулярная теория газов и жидкостей / перевод с английского под редакцией Е.В. Ступоченко. — М.: Издательство иностранной литературы, 1961. — 931 с.
- Каплан И. Г. Введение в теорию межмолекулярных взаимодействий.. — М.: Наука. Главная редакция физико-математической литературы, 1982. — С. 312.
- M. P. Allen, D. J. Tildesley. Computer Simulation of Liquids. — Oxford University Press, 1990. — ISBN 0198556454. — ISBN 9780198556459.
- Цянь Сюэ-Сень. Физическая механика. — М.: Мир, 1965. — 544 с.
- D. Levi and M. de Llano. Closed form of second virial coefficient for Sutherland potential // Journal of Chemical Physics. — 1975. — Т. 63. — С. 4561—4562.
- Jianxiang Tian and Yuanxing Gui. Liquid-gas phase transition to first order of an argon-like fluid modeled by the hard-core similar Sutherland potential // International Journal of Modern Physics B. — 2004. — Т. 18. — С. 2057—2069.
- A. Díez, J. Largo and J. R. Solana. Structure and thermodynamic properties of Sutherland fluids from computer simulation and the Tang–Lu integral equation theory // Fluid Phase Equilibria. — 2007. — № 253. — С. 67—73.
- Jianguo Mi, Yiping Tang, and Chongli Zhong. Theoretical study of Sutherland fluids with long-range, short-range, and highly short-range potential parameters // Journal of Chemical Physics. — 2008. — Т. 128. — С. 054503.
- Roman Melnyk, Pedro Orea, Ivo Nezbeda, and Andrij Trokhymchuk. Liquid/vapor coexistence and surface tension of the Sutherland fluid with a variable range of interaction: Computer simulation and perturbation theory studies // Journal of Chemical Physics. — 2010. — № 132. — С. 134504.
- F. Paragand, F. Feyzi and B. Behzadi. Application of the SAFT-VR equation of state to vapor–liquid equilibrium calculations for pure components and binary mixtures using the Sutherland potential // Fluid Phase Equilibria. — 2010. — Т. 290. — С. 181—194.
- J. Tian and Y. Gui. Modification to the Van der Waals Equation of State // J. phase equilib. — 2003. — Т. 24. — С. 533—541.

































![{\displaystyle B_{2}(T)=-2\pi \int _{0}^{\infty }r^{2}\left(\exp \left[-{\frac {\Phi _{ij}(r)}{kT}}\right]-1\right)dr}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/ca020a2ae976534f3cf0dcedd4d744185eda2223)
![{\displaystyle B_{2}(T)=-2\pi \int _{0}^{\infty }r^{2}\left(\exp \left[-{\frac {\Phi _{ij}(r)}{kT}}\right]-1\right)dr=2\pi \int _{0}^{\sigma }r^{2}dr-2\pi \int _{\sigma }^{\infty }r^{2}\left(\exp \left[{\frac {\varepsilon }{kT}}\left({\frac {\sigma }{r}}\right)^{\gamma }\right]-1\right)dr={\frac {2}{3}}\pi \sigma ^{3}-2\pi \int _{\sigma }^{\infty }r^{2}\left(\exp \left[{\frac {\varepsilon }{kT}}\left({\frac {\sigma }{r}}\right)^{\gamma }\right]-1\right)dr}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/a27f1f088af9b93a0472148cba0f0ed3df9a6064)

![{\displaystyle B_{2}(\tau )/{\frac {2}{3}}\pi \sigma ^{3}=1-3\int _{1}^{\infty }x^{2}\left(\exp \left[{\frac {1}{\tau x^{\gamma }}}\right]-1\right)dx}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/e47ab79218ed36764443d4392c0335fb3871ea47)








![{\displaystyle \exp \left[{\frac {1}{\tau x^{\gamma }}}\right]=1+{\frac {1}{\tau x^{\gamma }}}+...}](https://wikimedia.org/ruwiki/api/rest_v1/media/math/render/svg/b0cc594e8746b34966607da6407ce44cf028ef83)




















































