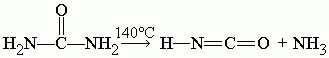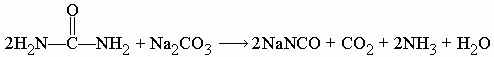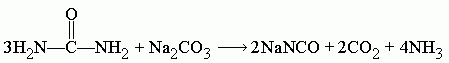Цианат натрия: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
Alexbot (обсуждение | вклад) м робот добавил: pt:Cianato de sódio |
Urbic (обсуждение | вклад) м оформление |
||
| (не показаны 33 промежуточные версии 26 участников) | |||
| Строка 4: | Строка 4: | ||
| картинка малая = |
| картинка малая = |
||
| наименование = |
| наименование = |
||
| сокращения = |
| сокращения = |
||
| традиционные названия = |
| традиционные названия = |
||
| хим. формула = NaOCN |
| хим. формула = NaOCN |
||
| эмпирическая формула = |
|||
| молярная масса = 65,01<ref name=merck>[http://assets.chemportals.merck.de/documents/sds/emd/deu/de/8221/822104.pdf Sicherheitsdatenblatt Merck]</ref> |
| молярная масса = 65,01<ref name=merck>[http://assets.chemportals.merck.de/documents/sds/emd/deu/de/8221/822104.pdf Sicherheitsdatenblatt Merck]</ref> |
||
| темп. плавления = 550 |
| темп. плавления = 550 |
||
| темп. кипения = |
| темп. кипения = |
||
| темп. разложения = |
| темп. разложения = 600 |
||
| темп. вспышки = |
| темп. вспышки = |
||
| тройная точка = |
| тройная точка = |
||
| критическая точка = |
| критическая точка = |
||
| плотность = 1,893 |
| плотность = 1,893 |
||
| состояние = кристаллический |
| состояние = кристаллический |
||
| динамическая вязкость = |
| динамическая вязкость = |
||
| кинематическая вязкость = |
| кинематическая вязкость = |
||
| теплоёмкость = |
| теплоёмкость = |
||
| энтальпия образования = |
| энтальпия образования = -400 |
||
| удельная теплота парообразования = |
| удельная теплота парообразования = |
||
| удельная теплота плавления = |
| удельная теплота плавления = |
||
| конст. диссоц. кислоты = |
| конст. диссоц. кислоты = |
||
| растворимость = |
| растворимость = 11,6 |
||
| вещество1 = <!--(в) спирте--> |
| вещество1 = <!--(в) спирте--> |
||
| растворимость1 = |
| растворимость1 = |
||
| вращение = |
| вращение = |
||
| изоэлектрическая точка = |
| изоэлектрическая точка = |
||
| гибридизация = |
| гибридизация = |
||
| координационная геометрия = |
| координационная геометрия = |
||
| кристаллическая структура = |
| кристаллическая структура = |
||
| дипольный момент = |
| дипольный момент = |
||
| CAS = 917-61-3 |
| CAS = 917-61-3 |
||
| EINECS = |
| EINECS = |
||
| SMILES = |
| SMILES = |
||
| |
| RTECS = |
||
| RTECS = |
|||
| ЕС = |
| ЕС = |
||
| ЛД50 = (крысы, перорально) 1500 |
| ЛД50 = <!-- (крысы, перорально) 1500{{Нет АИ|10|5|2013}}--> |
||
| токсичность = |
| токсичность = |
||
| угол Брюстера = |
| угол Брюстера = |
||
| показатель преломления = |
| показатель преломления = |
||
| диапазон прозрачности = |
| диапазон прозрачности = |
||
| примеси = |
| примеси = |
||
| предел прочности = |
| предел прочности = |
||
| тепловое расширение = |
| тепловое расширение = |
||
| теплоёмкость2 = |
| теплоёмкость2 = |
||
| теплопроводность = |
| теплопроводность = |
||
| интервал трансформации = |
| интервал трансформации = |
||
| температура размягчения = |
| температура размягчения = |
||
| твёрдость = |
| твёрдость = |
||
}} |
}} |
||
'''Цианат натрия''' (''натрий циановоки́слый'') — [[неорганическое соединение|неорганическое]] [[бинарное соединение]], [[Натрий|натриевая]] [[Соли|соль]] [[Циановая кислота|циановой кислоты]] с формулой {{Химическая формула|Na|1|N|1|C|1|O|1|sort=ne}}. Нелетуч, не имеет запаха. Представляет собой бесцветные [[кристалл]]ы [[Тригональная сингония|тригональной сингонии]] [[плотность]]ю 1,893 г/см{{sup|3}}. Температура плавления цианата натрия 550 °C, выше 700 °C разлагается. Хорошо растворим в воде — 11,6 г/100г при 25 °C. |
|||
'''Цианат натрия''' (NaNCO) представляет собой бесцветные [[кристалл]]ы, [[плотность]]ю 1,893г/см³, с температурой плавления 550 °C. В присутствии [[Железо|Fe]] и [[Никель|Ni]] при 500°С-700°С разлагается по реакции: |
|||
Цианат натрия часто применяется в [[Органический синтез|органическом синтезе]]. |
|||
:'''''5NaNCO → 3NaCN + Na<sub>2</sub>CO<sub>3</sub> + CO<sub>2</sub> + N<sub>2</sub>''''' |
|||
== Получение == |
|||
Выше 700°С: |
|||
| ⚫ | |||
| ⚫ | |||
:'''''4NaNCO → 2NaCN + Na<sub>2</sub>CO<sub>3</sub> + CO + N<sub>2</sub>''''' |
|||
| ⚫ | |||
Во влажном воздухе и в водном растворе постепенно [[гидролиз]]уется до Na<sub>2</sub>CO<sub>3</sub>, CO<sub>2</sub> и NH<sub>3</sub>: |
|||
:'''''2NaNCO + 3H<sub>2</sub>O → Na<sub>2</sub>CO<sub>3</sub> + CO<sub>2</sub> + 2NH<sub>3</sub>''''' |
|||
С увеличением температуры раствора, гидролиз усиливается. |
|||
| ⚫ | |||
:'''''NaNCO+ 2HCl + H<sub>2</sub>O → NaCl + NH<sub>4</sub>Cl + CO<sub>2</sub>''''' |
|||
По химическим свойствам подобен другим неорганическим цианатам, например, восстанавливается [[Угарный газ|СО]] или [[Углерод|C]] до [[NaCN]]: |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
== Метод синтеза цианата натрия из карбамида и карбоната натрия == |
|||
| ⚫ | |||
=== Механизм реакций === |
|||
| ⚫ | |||
[[Файл:Formula1.gif]] |
[[Файл:Formula1.gif]] |
||
Далее |
Далее [[циановая кислота]] реагирует с оставшейся частью мочевины, образуя [[биурет]]: |
||
[[Файл:Formula2.gif]] |
[[Файл:Formula2.gif]] |
||
При сплавлении мочевины с Na<sub>2</sub>CO<sub>3</sub> |
При сплавлении мочевины с карбонатом натрия Na<sub>2</sub>CO<sub>3</sub> образуется цианат натрия NaNCO, [[Диоксид углерода|углекислый газ]] CO<sub>2</sub>, [[аммиак]] NH<sub>3</sub> и [[вода]] H<sub>2</sub>O: |
||
[[Файл:Formula3.gif]] |
[[Файл:Formula3.gif]] |
||
Поскольку цианат натрия |
Поскольку цианат натрия [[гидролиз]]уется в присутствии H<sub>2</sub>O, которая образуется в ходе реакции, то следует добавить избыточное количество мочевины, при этом циановая кислота, которая образуется в ходе разложения мочевины, реагирует с водой, образуя CO<sub>2</sub> и NH<sub>3</sub>. |
||
[[Файл:Formula4.gif]] |
[[Файл:Formula4.gif]] |
||
Поэтому, если |
Поэтому, если необходимо исключить воду из продуктов реакции и тем самым повысить выход конечного цианата, то расчёт пропорции следует проводить по следующему уравнению: |
||
[[Файл:Formula5.gif]] |
[[Файл:Formula5.gif]] |
||
На этом и основан один из методов синтеза цианата |
На этом и основан один из методов синтеза цианата натрия. |
||
| ⚫ | |||
Возможен другой механизм синтеза, но приводящий к тому же конечному уравнению: [[пиролиз]] мочевины с образованием [[Циануровая кислота|циануровой кислоты]] и аммиака, инверсия циануровой кислоты в её [[Изомерия|изомер]] — [[Тримеризация|тример]] циановой кислоты с последующей [[Деполимеризация|деполимеризацией]], и затем взаимодействие циановой кислоты с карбонатом натрия. |
|||
| ⚫ | |||
'''Реактивы:''' мочевина 53г |
'''Реактивы:''' мочевина 53г |
||
сода кальцинированная (Na<sub>2</sub>CO<sub>3</sub> техн.) 30г. |
|||
'''Посуда:''' колба ТС или кварцевая (V = |
'''Посуда:''' колба ТС или кварцевая (V = 100—150см³) |
||
:* ступка с пестиком |
:* ступка с пестиком |
||
:* бюкс (V = 50см |
:* бюкс (V = 50см³) |
||
:* асбест |
:* асбест |
||
:* стеклоткань |
:* стеклоткань |
||
| Строка 124: | Строка 97: | ||
Вначале нужно приготовить смесь мочевины с карбонатом натрия, путём измельчения обоих компонентов в ступке или в электрокофемолке. По возможности исходная мочевина должна быть максимально сухой, а сода полностью освобождена от воды. Чем однороднее будет смесь и чем тоньше будут измельчены ингредиенты, тем полнее будет протекать реакция, соответственно и выход продукта увеличится. |
Вначале нужно приготовить смесь мочевины с карбонатом натрия, путём измельчения обоих компонентов в ступке или в электрокофемолке. По возможности исходная мочевина должна быть максимально сухой, а сода полностью освобождена от воды. Чем однороднее будет смесь и чем тоньше будут измельчены ингредиенты, тем полнее будет протекать реакция, соответственно и выход продукта увеличится. |
||
Данную реакцию следует проводить в вытяжном шкафу, вследствие выделения паров NH<sub>3</sub>. Температура не должна превышать 500° |
Данную реакцию следует проводить в вытяжном шкафу, вследствие выделения паров NH<sub>3</sub>. Температура не должна превышать 500 °C. 53г просушенной мочевины измельчают до размера частиц 0,2-0,5 мм. Далее, измельчённую мочевину смешивают с 30г кальцинированной соды, доводят смесь до однородного состояния и подвергают дальнейшему измельчению. После этого смесь переносят в колбу. Для того, чтобы предотвратить попадание частичек реакционной смеси, на стенки печки, необходимо накрыть колбу термостойким проницаемым материалом, например стеклотканью или углеволокном. Чтобы не поцарапать дно колбы лучше под неё подложить кусочек, заранее прокалённого асбеста. |
||
Смесь как можно сильнее утрамбовывают в дно колбы и ставят в печку. Колбу со смесью необходимо разогревать плавно, чтобы она не треснула. По мере начала плавления мочевины, колбу достают из печки и ещё раз как можно сильнее утрамбовывают эту смесь и проводят дальнейшее нагревание. Как показал дальнейший анализ, чем чаще и интенсивнее перемешивать смесь, тем выше будет выход цианата. Нагревание проводят в течение 1-2 часов, пока оставшаяся часть карбоната натрия не перейдёт в цианат, а оставшаяся часть биурета полностью не разложится. По |
Смесь как можно сильнее утрамбовывают в дно колбы и ставят в печку. Колбу со смесью необходимо разогревать плавно, чтобы она не треснула. По мере начала плавления мочевины, колбу достают из печки и ещё раз как можно сильнее утрамбовывают эту смесь и проводят дальнейшее нагревание. Как показал дальнейший анализ, чем чаще и интенсивнее перемешивать смесь, тем выше будет выход цианата. Нагревание проводят в течение 1-2 часов, пока оставшаяся часть карбоната натрия не перейдёт в цианат, а оставшаяся часть биурета полностью не разложится. По истечении заданного времени, реакция практически полностью прекратится. Колбу достают из печки и дают ей немного остыть. Когда температура упадёт до комнатной, полученную массу переносят в ступку и измельчают. |
||
Цианат натрия следует хранить в сухой, плотно закупоренной таре, со вложенным пакетиком силикагеля или других поглощающих воду веществ. |
Цианат натрия следует хранить в сухой, плотно закупоренной таре, со вложенным пакетиком силикагеля или других поглощающих воду веществ. |
||
=== Анализ полученного продукта === |
=== Анализ полученного продукта === |
||
| ⚫ | |||
| ⚫ | |||
==== Качественный анализ ==== |
==== Качественный анализ ==== |
||
[[Файл:D NCO.JPG|thumb|right|Раствор интенсивно тёмно-синего цвета]] |
[[Файл:D NCO.JPG|thumb|right|Раствор интенсивно тёмно-синего цвета]] |
||
Здесь можно использовать 2 простых метода. Один из них, заключается |
Здесь можно использовать 2 простых метода. Один из них, заключается в способности ионов кобальта образовывать комплексные соединения, окрашенные в интенсивный тёмно-синий цвет. Так при добавлении раствора цианата натрия к раствору нитрата или ацетата кобальта, наблюдается интенсивное тёмно синее окрашивание. |
||
[[Файл:P NCO.JPG|thumb|right|Раствор розового цвета.]] |
[[Файл:P NCO.JPG|thumb|right|Раствор розового цвета.]] |
||
Синее соединение гидролизуется, если раствор разбавить и окрашивание исчезает, однако оно устойчиво в спирте. Ограничение этого метода обуславливается наличием в анализируемом веществе, соединений, способных давать, так же как и цианаты, синие комплексы с кобальтом, но в данном случае этот метод нам подходит. |
Синее соединение гидролизуется, если раствор разбавить и окрашивание исчезает, однако оно устойчиво в спирте. Ограничение этого метода обуславливается наличием в анализируемом веществе, соединений, способных давать, так же как и цианаты, синие комплексы с кобальтом, но в данном случае этот метод нам подходит. Вследствие гидролиза, со временем раствор теряет свою первоначальную окраску и приобретает розовую, а на стенках стекла откладывается розовый налёт карбоната кобальта. |
||
Второй метод, который так же является и количественным, основан на способности цианата серебра, в отличие от цианидов и других соединений, растворятся в разбавленной азотной кислоте. Например, если к свежеприготовленному раствору цианата добавит кислый раствор нитрата серебра, то наблюдается выпадение осадка, который тут же исчезает, в итоге раствор приобретает немного мутный прозрачный цвет. |
Второй метод, который так же является и количественным, основан на способности цианата серебра, в отличие от цианидов и других соединений, растворятся в разбавленной азотной кислоте. Например, если к свежеприготовленному раствору цианата добавит кислый раствор нитрата серебра, то наблюдается выпадение осадка, который тут же исчезает, в итоге раствор приобретает немного мутный прозрачный цвет. |
||
==== Количественный |
==== Количественный анализ ==== |
||
| ⚫ | |||
| ⚫ | |||
Здесь тоже можно выделить несколько основных методов. |
Здесь тоже можно выделить несколько основных методов. |
||
Первый, как уже отмечалось, основан на свойстве цината серебра растворятся в разбавленной азотной кислоте. |
Первый, как уже отмечалось, основан на свойстве цината серебра растворятся в разбавленной азотной кислоте. Избыток кислого раствора нитрата серебра прибавляют к раствору анализируемого цианата. После полного растворения осадка, раствор фильтруют и добавляют туда серной кислоты. Смесь кипятят на водяной бане в течение 30 мин. Затем добавляют большой избыток щёлочи, а образовавшийся аммиак отгоняют к титрованной кислоте. Кислоту титруют и по количеству щёлочи устанавливают содержание цианата. |
||
Второй более простой, дешёвый и одинаково точный метод, основан на свойстве цианатов в присутствии сильных кислот, быстро гидролизоваться |
Второй более простой, дешёвый и одинаково точный метод, основан на свойстве цианатов в присутствии сильных кислот, быстро гидролизоваться до аммонийной соли данной кислоты, если она содержится в избытке. К образовавшейся аммонийной соли добавляют большой избыток щёлочи и образовавшийся аммиак отгоняется к титрованной кислоте. Далее кислоту титруют щёлочью и, соответственно, устанавливают количество цианата. |
||
Как раз этим методом мы воспользуемся, из за его простоты, дешевизны и точности. |
Как раз этим методом мы воспользуемся, из за его простоты, дешевизны и точности. |
||
'''Реактивы:''' анализируемый цианат 1г |
'''Реактивы:''' анализируемый цианат 1г |
||
:* раствор серной кислоты (w= 10%) |
:* раствор серной кислоты (w= 10 %) — 50см³ |
||
'''Посуда:''' колба ТС (V = 500см |
'''Посуда:''' колба ТС (V = 500см³) со шлифами, 2 штуки |
||
:* обратный холодильник со шлифами 14/16 |
:* обратный холодильник со шлифами 14/16 |
||
:* переходник со шлифами 23/14 |
:* переходник со шлифами 23/14 |
||
| Строка 171: | Строка 141: | ||
Основными элементами, входящими в состав этого аппарата, являются: колба, переходник, дефлегматор, насадка Вюрца, холодильник, аллонж, приёмная колба. |
Основными элементами, входящими в состав этого аппарата, являются: колба, переходник, дефлегматор, насадка Вюрца, холодильник, аллонж, приёмная колба. |
||
Переходник предназначен для соединения колбы с дефлегматором. Он имеет два шлифа, один предназначен для соединения с колбой (23), а другой (14) для соединения с |
Переходник предназначен для соединения колбы с дефлегматором. Он имеет два шлифа, один предназначен для соединения с колбой (23), а другой (14) для соединения с различными переходниками. |
||
Дефлегматор соединяется с насадкой Вюрца. Он здесь играет роль разделителя фракции, и, в целом, повышающим чистоту отогнанной массы. |
Дефлегматор соединяется с насадкой Вюрца. Он здесь играет роль разделителя фракции, и, в целом, повышающим чистоту отогнанной массы. |
||
Насадка Вюрца нужна для соединения холодильника с другими переходниками. Она имеет три отверстия, одно входное и два выходных. В данном случае нам нужны только два выходных отверстия, а третье можно закрыть, например лабораторным |
Насадка Вюрца нужна для соединения холодильника с другими переходниками. Она имеет три отверстия, одно входное и два выходных. В данном случае нам нужны только два выходных отверстия, а третье можно закрыть, например лабораторным термометром со шлифом. |
||
Отогнанные пары воды конденсируются в холодильнике, и чем ниже будет температура отогнанной воды, тем лучше в ней будет растворятся аммиак. |
Отогнанные пары воды конденсируются в холодильнике, и чем ниже будет температура отогнанной воды, тем лучше в ней будет растворятся аммиак. |
||
Аллонж предназначен для соединения холодильника с колбой, а отвод нужен для того, чтобы внутри не повышалось давление. |
Аллонж предназначен для соединения холодильника с колбой, а отвод нужен для того, чтобы внутри не повышалось давление. |
||
Отогнанный аммиак позлащается кислотой в приёмной колбе. |
Отогнанный аммиак позлащается кислотой в приёмной колбе. Чтобы обеспечить максимальное поглощение аммиака, необходимо чтобы он подавался не над кислотой, а через неё, то есть трубочка, через которую выходит аммиак, должна упираться в самое дно колбы. |
||
Данному аппарату необходима большая герметичность, для этого все соединения шлифов должны быть герметизированы тонкой тефлоновой лентой. |
Данному аппарату необходима большая герметичность, для этого все соединения шлифов должны быть герметизированы тонкой тефлоновой лентой. |
||
'''Ход анализа:''' |
'''Ход анализа:''' |
||
1г анализируемого вещества помещают в колбу из термостойкого стекла и растворяют в 200 |
1г анализируемого вещества помещают в колбу из термостойкого стекла и растворяют в 200 см³ воды. Прибавляется 50 см³ 10 % раствора H2SO4. Смесь осторожно кипятят, пока её объём не уменьшится на половину. Затем смесь охлаждается до 0 °C и в неё добавляют избыток едкого натра до сильно щелочной реакции. Колбу со смесью подсоединяют к дистилляционному прибору, образовавшийся аммиак отгоняется к титрованной кислоте. |
||
Далее кислоту титруют щелочью и по количеству затраченной щёлочи устанавливают содержание цианата в исходном веществе. |
Далее кислоту титруют щелочью и по количеству затраченной щёлочи устанавливают содержание цианата в исходном веществе. |
||
--> |
|||
== Физические свойства == |
|||
| ⚫ | |||
== Химические свойства == |
|||
В присутствии [[Железо|железа]] или [[Никель|никеля]] при 500—600 °C частично разлагается до [[Цианид натрия|цианида натрия]], [[Карбонат натрия|карбоната натрия]], [[Монооксид углерода|монооксида углерода]] и молекулярного [[азот]]а<ref>[www.xumuk.ru/encyklopedia/2/5150.html Цианаты неорганические — ХиМик. Ру]</ref>: |
|||
:: <math>\mathsf{4NaNCO \rightarrow 2NaCN + Na_2CO_3 + CO + N_2}</math>. |
|||
Как и все [[цианаты]] [[Щелочные металлы|щелочных металлов]] (и [[Аммоний|аммония]]), цианат натрия во влажном воздухе и в водных растворах постепенно [[гидролиз]]уется до [[Карбонат натрия|карбоната натрия]], [[Диоксид углерода|диоксида углерода]] и [[аммиак]]а: |
|||
:: <math>\mathsf{2NaNCO + 3H_2O \rightarrow Na_2CO_3 + CO_2 + 2NH_3}</math>. |
|||
| ⚫ | |||
:: <math>\mathsf{NaNCO + 2HCl + H_2O \rightarrow NaCl + NH_4Cl + CO_2}</math>. |
|||
Восстанавливается [[Монооксид углерода|монооксидом углерода]] до [[Цианид натрия|цианида натрия]]: |
|||
:: <math>\mathsf{NaNCO + CO \rightarrow NaCN + CO_2}</math>, |
|||
и углеродом: |
|||
| ⚫ | |||
| ⚫ | |||
== Применение == |
== Применение == |
||
| ⚫ | |||
== Токсикология == |
|||
| ⚫ | |||
| ⚫ | |||
В [[Россия|России]] [[класс опасности]] III, [[ПДК]] в воздухе рабочей зоны 1 мг/м³ (по цианат-анионам), ирритант (1998). |
|||
== Примечания == |
== Примечания == |
||
{{примечания}} |
{{примечания}} |
||
== Литература == |
|||
* {{книга |
|||
|заглавие = Химический энциклопедический словарь |ответственный = Редкол.: Кнунянц И.Л. и др. |место = М. |
|||
|издательство = Советская энциклопедия |год = 1983 |том = |страниц = 792 |isbn = |
|||
}} |
|||
{{неэнциклопедично|не совсем энциклопедический, похож на статью в учебнике.}} |
{{неэнциклопедично|не совсем энциклопедический, похож на статью в учебнике.}} |
||
{{Нет ссылок|дата=15 мая 2011}} |
|||
{{нет источников}} |
|||
{{Соединения натрия}} |
|||
{{изолированная статья}} |
|||
[[Категория:Цианаты]] |
|||
[[Категория:Соединения натрия]] |
[[Категория:Соединения натрия]] |
||
[[Категория:Производные циановой кислоты]] |
|||
{{спам-ссылки|1= |
|||
[[de:Natriumcyanat]] |
|||
* www.xumuk.ru/encyklopedia/2/5150.html |
|||
[[pt:Cianato de sódio]] |
|||
}} |
|||
Текущая версия от 10:49, 17 апреля 2024
| Цианат натрия | |
|---|---|
| | |
| Общие | |
| Хим. формула | NaOCN |
| Физические свойства | |
| Состояние | кристаллический |
| Молярная масса | 65,01[1] г/моль |
| Плотность | 1,893 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 550 °C |
| • разложения | 600 °C |
| Энтальпия | |
| • образования | -400 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 11,6 г/100 мл |
| Классификация | |
| Рег. номер CAS | 917-61-3 |
| PubChem | 517096 |
| Рег. номер EINECS | 213-030-6 |
| SMILES | |
| InChI | |
| ChEBI | 38906 |
| ChemSpider | 12922 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Цианат натрия (натрий циановоки́слый) — неорганическое бинарное соединение, натриевая соль циановой кислоты с формулой NaNCO. Нелетуч, не имеет запаха. Представляет собой бесцветные кристаллы тригональной сингонии плотностью 1,893 г/см3. Температура плавления цианата натрия 550 °C, выше 700 °C разлагается. Хорошо растворим в воде — 11,6 г/100г при 25 °C.
Цианат натрия часто применяется в органическом синтезе.
Получение
[править | править код]Цианат натрия можно синтезировать несколькими способами, один из них заключается в сплавлении карбамида с карбонатом натрия. Этот метод наиболее простой и дешёвый.
При 140 °C мочевина разлагается на циановую кислоту и аммиак:
Далее циановая кислота реагирует с оставшейся частью мочевины, образуя биурет:
При сплавлении мочевины с карбонатом натрия Na2CO3 образуется цианат натрия NaNCO, углекислый газ CO2, аммиак NH3 и вода H2O:
Поскольку цианат натрия гидролизуется в присутствии H2O, которая образуется в ходе реакции, то следует добавить избыточное количество мочевины, при этом циановая кислота, которая образуется в ходе разложения мочевины, реагирует с водой, образуя CO2 и NH3.
Поэтому, если необходимо исключить воду из продуктов реакции и тем самым повысить выход конечного цианата, то расчёт пропорции следует проводить по следующему уравнению:
На этом и основан один из методов синтеза цианата натрия.
Возможен другой механизм синтеза, но приводящий к тому же конечному уравнению: пиролиз мочевины с образованием циануровой кислоты и аммиака, инверсия циануровой кислоты в её изомер — тример циановой кислоты с последующей деполимеризацией, и затем взаимодействие циановой кислоты с карбонатом натрия.
Физические свойства
[править | править код]Цианат натрия умеренно растворим в воде (10,4 % по массе при 25 °C), плохо растворим в этаноле (0,5 % при 78,4 °C), бензоле и жидком аммиаке, не растворим в диэтиловом эфире.
Химические свойства
[править | править код]В присутствии железа или никеля при 500—600 °C частично разлагается до цианида натрия, карбоната натрия, монооксида углерода и молекулярного азота[2]:
- .
Как и все цианаты щелочных металлов (и аммония), цианат натрия во влажном воздухе и в водных растворах постепенно гидролизуется до карбоната натрия, диоксида углерода и аммиака:
- .
При действии на цианат натрия растворов сильных кислот, он разлагается, например:
- .
Восстанавливается монооксидом углерода до цианида натрия:
- ,
и углеродом:
- .
С минеральными кислотами образует циановую кислоту HNCO и её тример — циануровую кислоту (HNCO)3.
Применение
[править | править код]В основном цианат натрия используется в органическом синтезе. Из него синтезируют органические изоцианаты.
Токсикология
[править | править код]Цианаты гораздо менее токсичны цианидов, что используется для дегазации последних. Так, например, для человека смертельная доза NaNCO составляет около 13 граммов.
В России класс опасности III, ПДК в воздухе рабочей зоны 1 мг/м³ (по цианат-анионам), ирритант (1998).
Примечания
[править | править код]- ↑ Sicherheitsdatenblatt Merck
- ↑ [www.xumuk.ru/encyklopedia/2/5150.html Цианаты неорганические — ХиМик. Ру]
Литература
[править | править код]- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
Этот раздел содержит материал неэнциклопедичного характера. |
В статье не хватает ссылок на источники (см. рекомендации по поиску). |
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |