Эпителиальный натриевый канал: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
Нет описания правки |
Artikin (обсуждение | вклад) Функция «Добавить ссылку»: добавлено 3 ссылки. Метки: через визуальный редактор с мобильного устройства из мобильной версии Задача для новичков предложение: добавить ссылки |
||
| (не показано 28 промежуточных версий 8 участников) | |||
| Строка 1: | Строка 1: | ||
[[Файл:ENaC membrane side eng.svg|thumb]] |
|||
'''Эпителиальный натриевый канал''' — мембранный белок, проводящий [[ионы]] [[Li]], [[Na]] и |
'''Эпителиальный натриевый канал''' — [[мембранный белок]], проводящий [[ионы]] [[Литий|Li]], [[Натрий|Na]] и [[протон]]ы. Он постоянно активен и, вероятно, является одним из самых избирательных [[Ионные каналы|ионных каналов]]. |
||
Натриевые каналы находятся на апикальных участках мембран клеток эпителия. Они играют важную роль в поддержании водно-солевого баланса в организме, у [[позвоночные|позвоночных]] контролируют обратное всасывание натрия в почках, прямой кишке, лёгких, потовых железах и пр., также участвуют во вкусовых ощущениях. |
Натриевые каналы находятся на апикальных участках [[клеточная мембрана|мембран клеток]] [[эпителий|эпителия]]. Они играют важную роль в поддержании водно-солевого баланса в организме, у [[позвоночные|позвоночных]] контролируют обратное всасывание натрия в почках, прямой кишке, лёгких, потовых железах и пр., также участвуют во вкусовых ощущениях. |
||
==Структура== |
== Структура == |
||
Белок состоит из трёх разных субъединиц. Судя по всему, он является гетеротримерным белком, похожим на недавно исследованный кислотный ионный канал, и принадлежит к тому же типу. Каждая из субъединиц состоит из двух проходящих сквозь мембрану спиралей и внеклеточной петли. N- и C-концы всех полипептидных цепей находятся в |
Белок состоит из трёх разных субъединиц. Судя по всему, он является гетеротримерным белком, похожим на недавно исследованный [[Кислото-чувствительные ионные каналы|кислотный ионный канал]], и принадлежит к тому же типу. Каждая из субъединиц состоит из двух проходящих сквозь мембрану спиралей и внеклеточной петли. N- и C-концы всех полипептидных цепей находятся в [[Цитоплазма|цитоплазме]]. |
||
Обычно белки, принадлежащие к этому типу, состоят из 510—920 аминокислотных остатков |
Обычно белки, принадлежащие к этому типу, состоят из 510—920 [[аминокислота|аминокислотных остатков]] и сделаны из трансмембранных сегментов, внутриклеточных участков, больших внеклеточных петель и внутриклеточного «хвоста» |
||
==Свойства типа== |
== Свойства типа == |
||
Все эпителиальные натриевые каналы состоят из пар трансмембранных сегментов, разделённых внеклеточной петлёй. В большинстве изученных на сегодняшний момент подобных белков внеклеточные участки содержат множество цистеиновых остатков. Считается, что они помогают регулировать активность канала. |
Все эпителиальные натриевые каналы состоят из пар трансмембранных сегментов, разделённых внеклеточной петлёй. В большинстве изученных на сегодняшний момент подобных белков внеклеточные участки содержат множество [[цистеин|цистеиновых остатков]]. Считается, что они помогают регулировать активность канала. |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
Также эти каналы присутствуют в клетках вкусовых рецепторов, где помогают чувствовать солёный вкус. Однако у человека он отвечает за восприятие вкуса менее, чем у некоторых других млекопитающих (например, грызунов) |
Также эти каналы присутствуют в клетках вкусовых рецепторов, где помогают чувствовать солёный вкус. Однако у человека он отвечает за восприятие вкуса менее, чем у некоторых других млекопитающих (например, грызунов) |
||
==Медицинское использование== |
== Медицинское использование == |
||
Взаимодействие натриевого канала с CFTR — одна из причин |
Взаимодействие натриевого канала с [[Cystic fibrosis transmembrane conductance regulator|CFTR]] — одна из причин [[муковисцидоз]]а. CFTR — мембранный белок, ответственный за транспорт [[Хлориды|хлоридов]], и неполадки в его работе вызывают муковисцидоз. В потовых железах натриевый канал и CFTR отвечают за всасывание солей, и CFTR стимулирует работу натриевого канала. Во время муковисцидоза CFTR-канал не работает, поэтому натриевый канал тоже выключается. Из-за этого [[пот]] пациента становится солонее. Подобное свойство помогает диагностировать заболевание. |
||
Везде, кроме потовых желез, CFTR ингибирует натриевый канал. Обычно хлорид-ион выделяется на слизистую, а натрий всасывается. Однако во время |
Везде, кроме потовых желез, CFTR ингибирует натриевый канал. Обычно хлорид-ион выделяется на слизистую, а натрий всасывается. Однако во время муковисцидоза хлорид не выделяется и не ингибируется. Поэтому всасывание натрия увеличивается. В результате низкого содержания солей в слизи она становится густой и липкой, с недостаточным содержанием воды. Это вызывает проблемы от затрудненного дыхания до предрасположенности к респираторным болезням. |
||
Амилорид и |
Амилорид и триамтерен блокируют работу натриевого канала. |
||
== Литература == |
|||
# ^ Palmer LG (1987). «Ion selectivity of epithelial Na channels». J Membr Biol 96: 97-106. doi:10.1007/BF01869236. PMID 2439691. |
|||
# ^ a b Garty H (1994). «Molecular properties of epithelial, amiloride-blockab le Na+ channels». FASEB J. 8 (8): 522—528. PMID 8181670. |
|||
# ^ a b c Le T, Saier Jr MH (1996). «Phylogenetic characterization of the epithelial Na+ channel (ENaC) family». Mol. Membr. Biol. 13 (3): 149—157. PMID 8905643. |
|||
# ^ Lazdunski M, Waldmann R, Champigny G, Bassilana F, Voilley N (1995). «Molecular cloning and functional expression of a novel amiloride-sensitive Na+ channel». J. Biol. Chem. 270 (46): 27411-27414. doi:10.1074/jbc.270.46.27411. PMID 7499195. |
|||
# ^ Loffing J, Schild L (November 2005). «Functional domains of the epithelial sodium channel». J. Am. Soc. Nephrol. 16 (11): 3175-81. doi:10.1681/ASN.2005050456. PMID 16192417. http://jasn.asnjournals.org/cgi/pmidlookup?view=long&pmid=16192417. |
|||
# ^ Jasti J, Furukawa H, Gonzales EB, Gouaux E (2007). «Structure of acid-sensing ion channel 1 at 1.9 Å resolution and low pH». Nature 449: 316—322. doi:10.1038/nature06163. |
|||
# ^ a b Snyder PM, McDonald FJ, Stokes JB, Welsh MJ (1994). «Membrane topology of the amiloride-sensitive epithelial sodium channel». J. Biol. Chem. 269 (39): 24379-24383. PMID 7929098. |
|||
# ^ Horisberger JD, Chraïbi A (2004). «Epithelial sodium channel: a ligand-gated channel?». Nephron Physiol 96 (2): p37-41. doi:10.1159/000076406. PMID 14988660. http://content.karger.com/produktedb/produkte.asp?typ=pdf&file=NEP2004096002037. |
|||
# ^ Ion Channel Diseases |
|||
# ^ Saxena A, Hanukoglu I, Strautnieks SS, Thompson RJ, Gardiner RM, Hanukoglu A. (1998). «Gene structure of the human amiloride-sensitive epithelial sodium channel beta subunit.». Biochem. Biophys. Res. Commun. 252: 208—213. doi:10.1006/bbrc.1998.9625. |
|||
[[Категория:Ионные каналы]] |
|||
Текущая версия от 16:59, 11 марта 2022
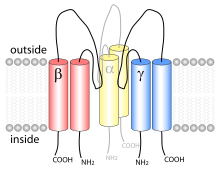
Эпителиальный натриевый канал — мембранный белок, проводящий ионы Li, Na и протоны. Он постоянно активен и, вероятно, является одним из самых избирательных ионных каналов. Натриевые каналы находятся на апикальных участках мембран клеток эпителия. Они играют важную роль в поддержании водно-солевого баланса в организме, у позвоночных контролируют обратное всасывание натрия в почках, прямой кишке, лёгких, потовых железах и пр., также участвуют во вкусовых ощущениях.
Структура
[править | править код]Белок состоит из трёх разных субъединиц. Судя по всему, он является гетеротримерным белком, похожим на недавно исследованный кислотный ионный канал, и принадлежит к тому же типу. Каждая из субъединиц состоит из двух проходящих сквозь мембрану спиралей и внеклеточной петли. N- и C-концы всех полипептидных цепей находятся в цитоплазме. Обычно белки, принадлежащие к этому типу, состоят из 510—920 аминокислотных остатков и сделаны из трансмембранных сегментов, внутриклеточных участков, больших внеклеточных петель и внутриклеточного «хвоста»
Свойства типа
[править | править код]Все эпителиальные натриевые каналы состоят из пар трансмембранных сегментов, разделённых внеклеточной петлёй. В большинстве изученных на сегодняшний момент подобных белков внеклеточные участки содержат множество цистеиновых остатков. Считается, что они помогают регулировать активность канала.
Местонахождение и функции
[править | править код]Натриевый канал находится в апикальной мембране поляризованных эпителиальных клеток почек (особенно в извитых канальцах), лёгких и кишечника. Он необходим для транспорта ионов Na+ сквозь мембрану, эту задачу он выполняет совместно с натрий-калиевой АТФ-азой. Натриевый канал чрезвычайно важен для поддержания концентрации ионов Na+ и K+ . Его активность в кишечнике и почках можно регулировать при помощи триамтерена и амилорида, которые используются в медицине как диуретики. Также эти каналы присутствуют в клетках вкусовых рецепторов, где помогают чувствовать солёный вкус. Однако у человека он отвечает за восприятие вкуса менее, чем у некоторых других млекопитающих (например, грызунов)
Медицинское использование
[править | править код]Взаимодействие натриевого канала с CFTR — одна из причин муковисцидоза. CFTR — мембранный белок, ответственный за транспорт хлоридов, и неполадки в его работе вызывают муковисцидоз. В потовых железах натриевый канал и CFTR отвечают за всасывание солей, и CFTR стимулирует работу натриевого канала. Во время муковисцидоза CFTR-канал не работает, поэтому натриевый канал тоже выключается. Из-за этого пот пациента становится солонее. Подобное свойство помогает диагностировать заболевание. Везде, кроме потовых желез, CFTR ингибирует натриевый канал. Обычно хлорид-ион выделяется на слизистую, а натрий всасывается. Однако во время муковисцидоза хлорид не выделяется и не ингибируется. Поэтому всасывание натрия увеличивается. В результате низкого содержания солей в слизи она становится густой и липкой, с недостаточным содержанием воды. Это вызывает проблемы от затрудненного дыхания до предрасположенности к респираторным болезням. Амилорид и триамтерен блокируют работу натриевого канала.
Литература
[править | править код]- ^ Palmer LG (1987). «Ion selectivity of epithelial Na channels». J Membr Biol 96: 97-106. doi:10.1007/BF01869236. PMID 2439691.
- ^ a b Garty H (1994). «Molecular properties of epithelial, amiloride-blockab le Na+ channels». FASEB J. 8 (8): 522—528. PMID 8181670.
- ^ a b c Le T, Saier Jr MH (1996). «Phylogenetic characterization of the epithelial Na+ channel (ENaC) family». Mol. Membr. Biol. 13 (3): 149—157. PMID 8905643.
- ^ Lazdunski M, Waldmann R, Champigny G, Bassilana F, Voilley N (1995). «Molecular cloning and functional expression of a novel amiloride-sensitive Na+ channel». J. Biol. Chem. 270 (46): 27411-27414. doi:10.1074/jbc.270.46.27411. PMID 7499195.
- ^ Loffing J, Schild L (November 2005). «Functional domains of the epithelial sodium channel». J. Am. Soc. Nephrol. 16 (11): 3175-81. doi:10.1681/ASN.2005050456. PMID 16192417. http://jasn.asnjournals.org/cgi/pmidlookup?view=long&pmid=16192417.
- ^ Jasti J, Furukawa H, Gonzales EB, Gouaux E (2007). «Structure of acid-sensing ion channel 1 at 1.9 Å resolution and low pH». Nature 449: 316—322. doi:10.1038/nature06163.
- ^ a b Snyder PM, McDonald FJ, Stokes JB, Welsh MJ (1994). «Membrane topology of the amiloride-sensitive epithelial sodium channel». J. Biol. Chem. 269 (39): 24379-24383. PMID 7929098.
- ^ Horisberger JD, Chraïbi A (2004). «Epithelial sodium channel: a ligand-gated channel?». Nephron Physiol 96 (2): p37-41. doi:10.1159/000076406. PMID 14988660. http://content.karger.com/produktedb/produkte.asp?typ=pdf&file=NEP2004096002037.
- ^ Ion Channel Diseases
- ^ Saxena A, Hanukoglu I, Strautnieks SS, Thompson RJ, Gardiner RM, Hanukoglu A. (1998). «Gene structure of the human amiloride-sensitive epithelial sodium channel beta subunit.». Biochem. Biophys. Res. Commun. 252: 208—213. doi:10.1006/bbrc.1998.9625.