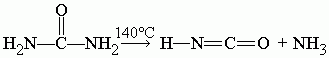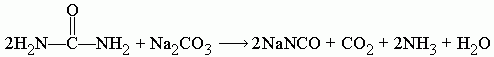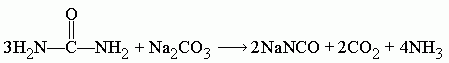Цианат натрия: различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
Addbot (обсуждение | вклад) м Перемещение 4 интервики на Викиданные, d:q412708 |
Urbic (обсуждение | вклад) м оформление |
||
| (не показано 19 промежуточных версий 14 участников) | |||
| Строка 4: | Строка 4: | ||
| картинка малая = |
| картинка малая = |
||
| наименование = |
| наименование = |
||
| сокращения = |
| сокращения = |
||
| традиционные названия = |
| традиционные названия = |
||
| хим. формула = NaOCN |
| хим. формула = NaOCN |
||
| эмпирическая формула = |
|||
| молярная масса = 65,01<ref name=merck>[http://assets.chemportals.merck.de/documents/sds/emd/deu/de/8221/822104.pdf Sicherheitsdatenblatt Merck]</ref> |
| молярная масса = 65,01<ref name=merck>[http://assets.chemportals.merck.de/documents/sds/emd/deu/de/8221/822104.pdf Sicherheitsdatenblatt Merck]</ref> |
||
| темп. плавления = 550 |
| темп. плавления = 550 |
||
| темп. кипения = |
| темп. кипения = |
||
| темп. разложения = |
| темп. разложения = 600 |
||
| темп. вспышки = |
| темп. вспышки = |
||
| тройная точка = |
| тройная точка = |
||
| критическая точка = |
| критическая точка = |
||
| плотность = 1,893 |
| плотность = 1,893 |
||
| состояние = кристаллический |
| состояние = кристаллический |
||
| динамическая вязкость = |
| динамическая вязкость = |
||
| кинематическая вязкость = |
| кинематическая вязкость = |
||
| теплоёмкость = |
| теплоёмкость = |
||
| энтальпия образования = |
| энтальпия образования = -400 |
||
| удельная теплота парообразования = |
| удельная теплота парообразования = |
||
| удельная теплота плавления = |
| удельная теплота плавления = |
||
| конст. диссоц. кислоты = |
| конст. диссоц. кислоты = |
||
| растворимость = |
| растворимость = 11,6 |
||
| вещество1 = <!--(в) спирте--> |
| вещество1 = <!--(в) спирте--> |
||
| растворимость1 = |
| растворимость1 = |
||
| вращение = |
| вращение = |
||
| изоэлектрическая точка = |
| изоэлектрическая точка = |
||
| гибридизация = |
| гибридизация = |
||
| координационная геометрия = |
| координационная геометрия = |
||
| кристаллическая структура = |
| кристаллическая структура = |
||
| дипольный момент = |
| дипольный момент = |
||
| CAS = 917-61-3 |
| CAS = 917-61-3 |
||
| EINECS = |
| EINECS = |
||
| SMILES = |
| SMILES = |
||
| |
| RTECS = |
||
| RTECS = |
|||
| ЕС = |
| ЕС = |
||
| ЛД50 = (крысы, перорально) 1500 |
| ЛД50 = <!-- (крысы, перорально) 1500{{Нет АИ|10|5|2013}}--> |
||
| токсичность = |
| токсичность = |
||
| угол Брюстера = |
| угол Брюстера = |
||
| показатель преломления = |
| показатель преломления = |
||
| диапазон прозрачности = |
| диапазон прозрачности = |
||
| примеси = |
| примеси = |
||
| предел прочности = |
| предел прочности = |
||
| тепловое расширение = |
| тепловое расширение = |
||
| теплоёмкость2 = |
| теплоёмкость2 = |
||
| теплопроводность = |
| теплопроводность = |
||
| интервал трансформации = |
| интервал трансформации = |
||
| температура размягчения = |
| температура размягчения = |
||
| твёрдость = |
| твёрдость = |
||
}} |
}} |
||
'''Цианат натрия''' (''натрий циановоки́слый'') — [[неорганическое соединение|неорганическое]] [[бинарное соединение]], [[Натрий|натриевая]] [[Соли|соль]] [[Циановая кислота|циановой кислоты]] с формулой {{Химическая формула|Na|1|N|1|C|1|O|1|sort=ne}}. Нелетуч, не имеет запаха. Представляет собой бесцветные [[кристалл]]ы [[Тригональная сингония|тригональной сингонии]] [[плотность]]ю 1,893 г/см{{sup|3}}. Температура плавления цианата натрия 550 °C, выше 700 °C разлагается. Хорошо растворим в воде — 11,6 г/100г при 25 °C. |
|||
'''Цианат натрия''' (NaNCO) представляет собой бесцветные [[кристалл]]ы, [[плотность]]ю 1,893г/см³, с температурой плавления 550 °C. В присутствии [[Железо|Fe]] и [[Никель|Ni]] при 500°С-700 °C разлагается по реакции: |
|||
Цианат натрия часто применяется в [[Органический синтез|органическом синтезе]]. |
|||
: '''''5NaNCO → 3NaCN + Na<sub>2</sub>CO<sub>3</sub> + CO<sub>2</sub> + N<sub>2</sub>''''' |
|||
== Получение == |
|||
Выше 700°С: |
|||
| ⚫ | |||
| ⚫ | |||
: '''''4NaNCO → 2NaCN + Na<sub>2</sub>CO<sub>3</sub> + CO + N<sub>2</sub>''''' |
|||
| ⚫ | |||
Во влажном воздухе и в водном растворе постепенно [[гидролиз]]уется до Na<sub>2</sub>CO<sub>3</sub>, CO<sub>2</sub> и NH<sub>3</sub>: |
|||
: '''''2NaNCO + 3H<sub>2</sub>O → Na<sub>2</sub>CO<sub>3</sub> + CO<sub>2</sub> + 2NH<sub>3</sub>''''' |
|||
С увеличением температуры раствора, гидролиз усиливается. |
|||
| ⚫ | |||
: '''''NaNCO+ 2HCl + H<sub>2</sub>O → NaCl + NH<sub>4</sub>Cl + CO<sub>2</sub>''''' |
|||
По химическим свойствам подобен другим неорганическим цианатам, например, восстанавливается [[Угарный газ|СО]] или [[Углерод|C]] до [[NaCN]]: |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
== Метод синтеза цианата натрия из карбамида и карбоната натрия == |
|||
| ⚫ | |||
=== Механизм реакций === |
|||
| ⚫ | |||
[[Файл:Formula1.gif]] |
[[Файл:Formula1.gif]] |
||
Далее |
Далее [[циановая кислота]] реагирует с оставшейся частью мочевины, образуя [[биурет]]: |
||
[[Файл:Formula2.gif]] |
[[Файл:Formula2.gif]] |
||
При сплавлении мочевины с Na<sub>2</sub>CO<sub>3</sub> |
При сплавлении мочевины с карбонатом натрия Na<sub>2</sub>CO<sub>3</sub> образуется цианат натрия NaNCO, [[Диоксид углерода|углекислый газ]] CO<sub>2</sub>, [[аммиак]] NH<sub>3</sub> и [[вода]] H<sub>2</sub>O: |
||
[[Файл:Formula3.gif]] |
[[Файл:Formula3.gif]] |
||
Поскольку цианат натрия |
Поскольку цианат натрия [[гидролиз]]уется в присутствии H<sub>2</sub>O, которая образуется в ходе реакции, то следует добавить избыточное количество мочевины, при этом циановая кислота, которая образуется в ходе разложения мочевины, реагирует с водой, образуя CO<sub>2</sub> и NH<sub>3</sub>. |
||
[[Файл:Formula4.gif]] |
[[Файл:Formula4.gif]] |
||
Поэтому, если |
Поэтому, если необходимо исключить воду из продуктов реакции и тем самым повысить выход конечного цианата, то расчёт пропорции следует проводить по следующему уравнению: |
||
[[Файл:Formula5.gif]] |
[[Файл:Formula5.gif]] |
||
На этом и основан один из методов синтеза цианата |
На этом и основан один из методов синтеза цианата натрия. |
||
| ⚫ | |||
Возможен другой механизм синтеза, но приводящий к тому же конечному уравнению: [[пиролиз]] мочевины с образованием [[Циануровая кислота|циануровой кислоты]] и аммиака, инверсия циануровой кислоты в её [[Изомерия|изомер]] — [[Тримеризация|тример]] циановой кислоты с последующей [[Деполимеризация|деполимеризацией]], и затем взаимодействие циановой кислоты с карбонатом натрия. |
|||
| ⚫ | |||
'''Реактивы:''' мочевина 53г |
'''Реактивы:''' мочевина 53г |
||
сода кальцинированная (Na<sub>2</sub>CO<sub>3</sub> техн.) 30г. |
|||
'''Посуда:''' колба ТС или кварцевая (V = 100—150см³) |
'''Посуда:''' колба ТС или кварцевая (V = 100—150см³) |
||
| Строка 130: | Строка 103: | ||
=== Анализ полученного продукта === |
=== Анализ полученного продукта === |
||
Существует несколько способов количественного и качественного анализа продукта. |
Существует несколько способов количественного и качественного анализа продукта. |
||
==== Качественный анализ ==== |
==== Качественный анализ ==== |
||
[[Файл:D NCO.JPG|thumb|right|Раствор интенсивно тёмно-синего цвета]] |
[[Файл:D NCO.JPG|thumb|right|Раствор интенсивно тёмно-синего цвета]] |
||
Здесь можно использовать 2 простых метода. Один из них, заключается в способности ионов кобальта образовывать комплексные соединения, окрашенные в интенсивный тёмно-синий цвет. Так при добавлении раствора цианата натрия к раствору нитрата или ацетата кобальта, наблюдается интенсивное тёмно синее окрашивание. |
Здесь можно использовать 2 простых метода. Один из них, заключается в способности ионов кобальта образовывать комплексные соединения, окрашенные в интенсивный тёмно-синий цвет. Так при добавлении раствора цианата натрия к раствору нитрата или ацетата кобальта, наблюдается интенсивное тёмно синее окрашивание. |
||
| Строка 144: | Строка 115: | ||
==== Количественный анализ ==== |
==== Количественный анализ ==== |
||
Как раз этот метод нас будет больше всего интересовать, так как основной целью этого эксперимента является достичь максимального выхода цианата натрия, поэтому остановимся на нём подробнее. |
Как раз этот метод нас будет больше всего интересовать, так как основной целью этого эксперимента является достичь максимального выхода цианата натрия, поэтому остановимся на нём подробнее. |
||
| Строка 183: | Строка 153: | ||
1г анализируемого вещества помещают в колбу из термостойкого стекла и растворяют в 200 см³ воды. Прибавляется 50 см³ 10 % раствора H2SO4. Смесь осторожно кипятят, пока её объём не уменьшится на половину. Затем смесь охлаждается до 0 °C и в неё добавляют избыток едкого натра до сильно щелочной реакции. Колбу со смесью подсоединяют к дистилляционному прибору, образовавшийся аммиак отгоняется к титрованной кислоте. |
1г анализируемого вещества помещают в колбу из термостойкого стекла и растворяют в 200 см³ воды. Прибавляется 50 см³ 10 % раствора H2SO4. Смесь осторожно кипятят, пока её объём не уменьшится на половину. Затем смесь охлаждается до 0 °C и в неё добавляют избыток едкого натра до сильно щелочной реакции. Колбу со смесью подсоединяют к дистилляционному прибору, образовавшийся аммиак отгоняется к титрованной кислоте. |
||
Далее кислоту титруют щелочью и по количеству затраченной щёлочи устанавливают содержание цианата в исходном веществе. |
Далее кислоту титруют щелочью и по количеству затраченной щёлочи устанавливают содержание цианата в исходном веществе. |
||
--> |
|||
== Физические свойства == |
|||
| ⚫ | |||
== Химические свойства == |
|||
В присутствии [[Железо|железа]] или [[Никель|никеля]] при 500—600 °C частично разлагается до [[Цианид натрия|цианида натрия]], [[Карбонат натрия|карбоната натрия]], [[Монооксид углерода|монооксида углерода]] и молекулярного [[азот]]а<ref>[www.xumuk.ru/encyklopedia/2/5150.html Цианаты неорганические — ХиМик. Ру]</ref>: |
|||
:: <math>\mathsf{4NaNCO \rightarrow 2NaCN + Na_2CO_3 + CO + N_2}</math>. |
|||
Как и все [[цианаты]] [[Щелочные металлы|щелочных металлов]] (и [[Аммоний|аммония]]), цианат натрия во влажном воздухе и в водных растворах постепенно [[гидролиз]]уется до [[Карбонат натрия|карбоната натрия]], [[Диоксид углерода|диоксида углерода]] и [[аммиак]]а: |
|||
:: <math>\mathsf{2NaNCO + 3H_2O \rightarrow Na_2CO_3 + CO_2 + 2NH_3}</math>. |
|||
| ⚫ | |||
:: <math>\mathsf{NaNCO + 2HCl + H_2O \rightarrow NaCl + NH_4Cl + CO_2}</math>. |
|||
Восстанавливается [[Монооксид углерода|монооксидом углерода]] до [[Цианид натрия|цианида натрия]]: |
|||
:: <math>\mathsf{NaNCO + CO \rightarrow NaCN + CO_2}</math>, |
|||
и углеродом: |
|||
| ⚫ | |||
| ⚫ | |||
== Применение == |
== Применение == |
||
| ⚫ | |||
== Токсикология == |
|||
| ⚫ | |||
| ⚫ | |||
В [[Россия|России]] [[класс опасности]] III, [[ПДК]] в воздухе рабочей зоны 1 мг/м³ (по цианат-анионам), ирритант (1998). |
|||
== Примечания == |
== Примечания == |
||
{{примечания}} |
{{примечания}} |
||
== Литература == |
|||
* {{книга |
|||
|заглавие = Химический энциклопедический словарь |ответственный = Редкол.: Кнунянц И.Л. и др. |место = М. |
|||
|издательство = Советская энциклопедия |год = 1983 |том = |страниц = 792 |isbn = |
|||
}} |
|||
{{неэнциклопедично|не совсем энциклопедический, похож на статью в учебнике.}} |
{{неэнциклопедично|не совсем энциклопедический, похож на статью в учебнике.}} |
||
| Строка 197: | Строка 204: | ||
[[Категория:Цианаты]] |
[[Категория:Цианаты]] |
||
[[Категория:Соединения натрия]] |
|||
{{спам-ссылки|1= |
|||
* www.xumuk.ru/encyklopedia/2/5150.html |
|||
}} |
|||
Текущая версия от 10:49, 17 апреля 2024
| Цианат натрия | |
|---|---|
| | |
| Общие | |
| Хим. формула | NaOCN |
| Физические свойства | |
| Состояние | кристаллический |
| Молярная масса | 65,01[1] г/моль |
| Плотность | 1,893 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 550 °C |
| • разложения | 600 °C |
| Энтальпия | |
| • образования | -400 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 11,6 г/100 мл |
| Классификация | |
| Рег. номер CAS | 917-61-3 |
| PubChem | 517096 |
| Рег. номер EINECS | 213-030-6 |
| SMILES | |
| InChI | |
| ChEBI | 38906 |
| ChemSpider | 12922 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Цианат натрия (натрий циановоки́слый) — неорганическое бинарное соединение, натриевая соль циановой кислоты с формулой NaNCO. Нелетуч, не имеет запаха. Представляет собой бесцветные кристаллы тригональной сингонии плотностью 1,893 г/см3. Температура плавления цианата натрия 550 °C, выше 700 °C разлагается. Хорошо растворим в воде — 11,6 г/100г при 25 °C.
Цианат натрия часто применяется в органическом синтезе.
Получение
[править | править код]Цианат натрия можно синтезировать несколькими способами, один из них заключается в сплавлении карбамида с карбонатом натрия. Этот метод наиболее простой и дешёвый.
При 140 °C мочевина разлагается на циановую кислоту и аммиак:
Далее циановая кислота реагирует с оставшейся частью мочевины, образуя биурет:
При сплавлении мочевины с карбонатом натрия Na2CO3 образуется цианат натрия NaNCO, углекислый газ CO2, аммиак NH3 и вода H2O:
Поскольку цианат натрия гидролизуется в присутствии H2O, которая образуется в ходе реакции, то следует добавить избыточное количество мочевины, при этом циановая кислота, которая образуется в ходе разложения мочевины, реагирует с водой, образуя CO2 и NH3.
Поэтому, если необходимо исключить воду из продуктов реакции и тем самым повысить выход конечного цианата, то расчёт пропорции следует проводить по следующему уравнению:
На этом и основан один из методов синтеза цианата натрия.
Возможен другой механизм синтеза, но приводящий к тому же конечному уравнению: пиролиз мочевины с образованием циануровой кислоты и аммиака, инверсия циануровой кислоты в её изомер — тример циановой кислоты с последующей деполимеризацией, и затем взаимодействие циановой кислоты с карбонатом натрия.
Физические свойства
[править | править код]Цианат натрия умеренно растворим в воде (10,4 % по массе при 25 °C), плохо растворим в этаноле (0,5 % при 78,4 °C), бензоле и жидком аммиаке, не растворим в диэтиловом эфире.
Химические свойства
[править | править код]В присутствии железа или никеля при 500—600 °C частично разлагается до цианида натрия, карбоната натрия, монооксида углерода и молекулярного азота[2]:
- .
Как и все цианаты щелочных металлов (и аммония), цианат натрия во влажном воздухе и в водных растворах постепенно гидролизуется до карбоната натрия, диоксида углерода и аммиака:
- .
При действии на цианат натрия растворов сильных кислот, он разлагается, например:
- .
Восстанавливается монооксидом углерода до цианида натрия:
- ,
и углеродом:
- .
С минеральными кислотами образует циановую кислоту HNCO и её тример — циануровую кислоту (HNCO)3.
Применение
[править | править код]В основном цианат натрия используется в органическом синтезе. Из него синтезируют органические изоцианаты.
Токсикология
[править | править код]Цианаты гораздо менее токсичны цианидов, что используется для дегазации последних. Так, например, для человека смертельная доза NaNCO составляет около 13 граммов.
В России класс опасности III, ПДК в воздухе рабочей зоны 1 мг/м³ (по цианат-анионам), ирритант (1998).
Примечания
[править | править код]- ↑ Sicherheitsdatenblatt Merck
- ↑ [www.xumuk.ru/encyklopedia/2/5150.html Цианаты неорганические — ХиМик. Ру]
Литература
[править | править код]- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
Этот раздел содержит материал неэнциклопедичного характера. |
В статье не хватает ссылок на источники (см. рекомендации по поиску). |
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |