Метантиол: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
Нет описания правки |
Исправлена опечатка #article-section-source-editor Метки: с мобильного устройства через мобильное приложение через приложение для iOS |
||
| (не показано 30 промежуточных версий 21 участника) | |||
| Строка 1: | Строка 1: | ||
{{Вещество |
{{Вещество |
||
| заголовок = |
| заголовок = |
||
| картинка = Methanethiol |
| картинка = Methanethiol.svg |
||
| картинка3D = Methanethiol-3D-balls.png |
| картинка3D = Methanethiol-3D-balls.png |
||
| картинка малая = |
| картинка малая = |
||
| Строка 14: | Строка 14: | ||
| примеси = <!-- типичное кол-во, указать единицы --> |
| примеси = <!-- типичное кол-во, указать единицы --> |
||
| молярная концентрация = <!-- число, в моль/л --> |
| молярная концентрация = <!-- число, в моль/л --> |
||
| молярная масса = 48 |
| молярная масса = 48,11 |
||
| плотность = 1.7<ref name="fireman">Источник: https://fireman.club/inseklodepia/metilmerkaptan-metantiol/ {{Wayback|url=https://fireman.club/inseklodepia/metilmerkaptan-metantiol/ |date=20190927073154 }} Метилмеркаптан (метантиол). Аварийная карточка</ref>-2<ref name="gost_gaz">{{Cite web |url=http://docs.cntd.ru/document/1200002061 |title=ГОСТ 30319.1-96 Газ природный. Методы расчета физических свойств. |access-date=2019-10-02 |archive-date=2019-09-27 |archive-url=https://web.archive.org/web/20190927214559/http://docs.cntd.ru/document/1200002061 |deadlink=no }}</ref> (к воздуху) |
|||
| плотность = <!-- число, по умолчанию в г/см³ --> |
|||
| предел прочности = <!-- число, в Н/мм² --> |
| предел прочности = <!-- число, в Н/мм² --> |
||
| твёрдость = <!-- число (безразм.) --> |
| твёрдость = <!-- число (безразм.) --> |
||
| Строка 29: | Строка 29: | ||
| темп. плавления = -123 |
| темп. плавления = -123 |
||
| температура размягчения = <!-- число, в °C для аморфных веществ --> |
| температура размягчения = <!-- число, в °C для аморфных веществ --> |
||
| темп. кипения = 5 |
| темп. кипения = 5,9 |
||
| темп. сублимации = <!-- число, в °C — для сублимирующихся веществ --> |
| темп. сублимации = <!-- число, в °C — для сублимирующихся веществ --> |
||
| темп. разложения = <!-- число, в °C --> |
| темп. разложения = <!-- число, в °C --> |
||
| Строка 60: | Строка 60: | ||
| константа В. дер В. = <!-- число --> |
| константа В. дер В. = <!-- число --> |
||
| конст. диссоц. кислоты = ~ |
| конст. диссоц. кислоты = ~10,4 |
||
| растворимость = <!-- число, по умолчанию в г/100 мл --> |
| растворимость = <!-- число, по умолчанию в г/100 мл --> |
||
| растворимость1 = 2% |
| растворимость1 = 2% |
||
| вещество1 = [[вода]] |
| вещество1 = [[вода|воде]] |
||
| растворимость2 = [[этанол]], [[диэтиловый эфир]] |
| растворимость2 = [[этанол]], [[диэтиловый эфир]] |
||
| вещество2 = <!-- веществе 2 --> |
| вещество2 = <!-- веществе 2 --> |
||
| Строка 93: | Строка 93: | ||
| ПДК = 0,006<ref>ГН 2.1.6.2326-08 Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест. Дополнение N 4 к ГН 2.1.6.1338-03</ref> |
| ПДК = 0,006<ref>ГН 2.1.6.2326-08 Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест. Дополнение N 4 к ГН 2.1.6.1338-03</ref> |
||
| ЛД50 = |
| ЛД50 = ЛД50: 60; 67 мг/кг <br>LC50: 3,3 мг/м<sup>3</sup> (мыши, экспозиция 2 часа) |
||
675 мг/м3 (крыса, 4 часа) |
|||
| токсичность = |
| токсичность = Весьма ядовит |
||
| R-фразы = {{R12}}, {{R23}}, {{R50/53}} |
| R-фразы = {{R12}}, {{R23}}, {{R50/53}} |
||
| S-фразы = {{S16}}, {{S25}}, {{S33}}{{S60}}, {{S61}} |
| S-фразы = {{S16}}, {{S25}}, {{S33}},{{S60}}, {{S61}} |
||
| H-фразы = <!-- {{H-фразы|201|202|235+410}} --> |
| H-фразы = <!-- {{H-фразы|201|202|235+410}} --> |
||
| P-фразы = <!-- {{P-фразы|201}} --> |
| P-фразы = <!-- {{P-фразы|201}} --> |
||
| сигнальное слово = <!-- слово Опасно или Осторожно (если есть) --> |
| сигнальное слово = <!-- слово Опасно или Осторожно (если есть) --> |
||
| СГС = |
| СГС = {{СГС|Череп|Опасность|Пламя|Окружающая среда}} |
||
| NFPA 704 = |
| NFPA 704 = |
||
{{NFPA 704 |
{{NFPA 704 |
||
| опасность для здоровья = 4 |
| опасность для здоровья = 4 |
||
| огнеопасность = 4 |
| огнеопасность = 4 |
||
| |
| реакционноспособность = 1 |
||
| прочее = }} |
| прочее = }} |
||
}} |
}} |
||
''' |
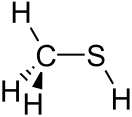
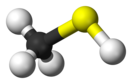
'''Метантио́л''' ('''метилмеркапта́н''') CH<sub>3</sub>SH — простейший представитель [[Гомологический ряд|гомологического ряда]] [[Тиолы|тиолов]], бесцветный токсичный газ с сильным неприятным [[запах]]ом, при малых концентрациях напоминающим запах гнилой капусты. |
||
== Свойства == |
== Свойства == |
||
Труднорастворим в воде, растворим в |
Труднорастворим в воде, растворим в [[этанол]]е и [[Диэтиловый эфир|диэтиловом эфире]]. Весьма огнеопасен. При высоких концентрациях негативно воздействует на центральную нервную систему. Порог ощущения запаха метантиола человеком при объемной концентрации 1 часть на миллион<ref><span class="reference-text"><span class="citation book">''Devos, M; F. Patte, J. Rouault, P. Lafort, L. J. Van Gemert'' (1990). Standardized Human Olfactory Thresholds. Oxford: IRL Press. p. 101. ISBN 0-19-963146-8</ref>. |
||
В газообразном виде тяжелее воздуха.<ref name="fireman"/><ref name="gost_gaz"/> |
|||
== Нахождение в природе == |
== Нахождение в природе == |
||
Метантиол образуется при различных процессах [[Биодеградация| |
Метантиол образуется при различных процессах [[Биодеградация|разложения]] [[Сераорганические соединения|сераорганических соединений]], в первую очередь — при [[гниение|гниении]] [[белок|белков]], в состав которых входят серосодержащие [[аминокислоты]] — [[цистеин]] и [[метионин]]. Он находится также в испражнениях и кишечных газах человека и животных, придавая им вместе со [[скатол]]ом и другими тиолами неприятный [[запах]]. |
||
== Синтез == |
== Синтез == |
||
В промышленности метантиол синтезируют из [[ |
В промышленности метантиол синтезируют из [[метанол]]а и сероводорода, используя в качестве [[катализатор]]а [[Оксид тория(IV)|диоксид тория]], нанесенный на [[оксид алюминия]] в количестве 5—12 %, или [[кобальт]] — диоксид тория, при температуре 316—468 °С. |
||
== Применение == |
== Применение == |
||
Метантиол используется в производстве аминокислоты [[метионин]]а, использующейся в качестве кормовой добавки, из [[акролеин]]а |
Метантиол используется в производстве [[аминокислоты]] [[метионин]]а, использующейся в качестве кормовой добавки, из [[акролеин]]а <chem>H2C=CH-CHO</chem>. |
||
На первой стадии присоединением метантиола к [[акролеин]]у синтезируют 3-метилтиопропионовый альдегид: |
|||
: CH<sub>3</sub>SH + H<sub>2</sub>C=CH-CHO <math>\to</math> CH<sub>3</sub>SCH<sub>2</sub>CH<sub>2</sub>CHO |
|||
: <chem>CH3SH + H2C=CH-CHO -> CH3SCH2CH2CHO,</chem> |
|||
| ⚫ | |||
: CH<sub>3</sub>SCH<sub>2</sub>CH<sub>2</sub>CHO + HCN + NH<sub>3</sub> <math>\to</math> CH<sub>3</sub>SCH<sub>2</sub>CH<sub>2</sub>CH(NH<sub>2</sub>)CN |
|||
| ⚫ | |||
: CH<sub>3</sub>SCH<sub>2</sub>CH<sub>2</sub>CH(NH<sub>2</sub>)CN + H<sub>2</sub>O <math>\to</math> CH<sub>3</sub>SCH<sub>2</sub>CH<sub>2</sub>CH(NH<sub>2</sub>)COOH |
|||
: <chem>CH3SCH2CH2CHO + HCN + NH3 -> CH3SCH2CH2CH(NH2)CN;</chem> |
|||
: <chem>CH3SCH2CH2CH(NH2)CN + H2O -> CH3SCH2CH2CH(NH2)COOH.</chem> |
|||
Метантиол применяется при синтезе [[Пестициды|пестицидов]] и [[Фунгициды|фунгицидов]]. |
Метантиол применяется при синтезе [[Пестициды|пестицидов]] и [[Фунгициды|фунгицидов]]. |
||
Метантиол также применяется в качестве [[Одорант|одорирующей]] добавки к природному газу |
Метантиол также применяется в качестве [[Одорант|одорирующей]] добавки к природному газу, используемому в быту для обнаружения людьми аварийных утечек природного бытового газа по запаху<ref>''Schlager N., Weisblatt J., Newton D. E.'' Methyl Mercaptan — Chemical Compounds. — Thomson Gale. — 2006. — vol.2 — p. p. 455—457.</ref>. |
||
== Опасность == |
|||
| ⚫ | |||
Метантиол ядовит, относится ко 2-му классу опасности. Максимальная разовая ПДК для атмосферного воздуха населенных мест составляет 0,006 мг/м<sup>3</sup><ref>{{Cite web |url=https://ohranatruda.ru/ot_biblio/normativ/data_normativ/53/53008/index.php |title=Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест. Дополнение 4 к ГН 2.1.6.1338-03. |accessdate=2017-07-24 |archiveurl=https://web.archive.org/web/20150521024718/http://ohranatruda.ru/ot_biblio/normativ/data_normativ/53/53008/index.php |archivedate=2015-05-21 |deadlink=yes }}</ref>. |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
== Примечания == |
== Примечания == |
||
{{примечания}} |
{{примечания}} |
||
{{rq|sources|infobox|img}} |
|||
{{orgchem-stub}} |
|||
[[Категория:Тиолы]] |
[[Категория:Тиолы]] |
||
[[Категория:Метеоризм]] |
[[Категория:Метеоризм]] |
||
[[Категория:Сераорганические соединения]] |
|||
[[Категория:Биогазы]] |
|||
Текущая версия от 05:32, 7 июня 2024
| Метантиол | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
метантиол | ||
| Традиционные названия | метилмеркаптан | ||
| Хим. формула | CH4S | ||
| Рац. формула | CH3SH | ||
| Физические свойства | |||
| Состояние | Газ | ||
| Молярная масса | 48,11 г/моль | ||
| Плотность | 1.7[1]-2[2] (к воздуху) | ||
| Энергия ионизации | 9,44 ± 0,01 эВ[3][5] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -123 °C | ||
| • кипения | 5,9 °C | ||
| • вспышки | 0 ± 1 ℉[3] | ||
| Пределы взрываемости | 3,9 ± 0,1 об.%[3] | ||
| Давление пара | 1,7 ± 0,1 атм[3] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | ~10,4 | ||
| Растворимость | |||
| • в воде | 2% | ||
| • в | этанол, диэтиловый эфир | ||
| Структура | |||
| Дипольный момент | 5,1E−30 Кл·м[5] | ||
| Классификация | |||
| Рег. номер CAS | 74-93-1 | ||
| PubChem | 878 | ||
| Рег. номер EINECS | 200-822-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | PB4375000 | ||
| ChEBI | 16007 | ||
| ChemSpider | 855 | ||
| Безопасность | |||
| Предельная концентрация | 0,006[4] | ||
| ЛД50 |
ЛД50: 60; 67 мг/кг |
||
| Токсичность | Весьма ядовит | ||
| Фразы риска (R) | R12, R23, R50/53 | ||
| Фразы безопасности (S) | S16, S25, S33,S60, S61 | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Метантио́л (метилмеркапта́н) CH3SH — простейший представитель гомологического ряда тиолов, бесцветный токсичный газ с сильным неприятным запахом, при малых концентрациях напоминающим запах гнилой капусты.
Свойства
[править | править код]Труднорастворим в воде, растворим в этаноле и диэтиловом эфире. Весьма огнеопасен. При высоких концентрациях негативно воздействует на центральную нервную систему. Порог ощущения запаха метантиола человеком при объемной концентрации 1 часть на миллион[6]. В газообразном виде тяжелее воздуха.[1][2]
Нахождение в природе
[править | править код]Метантиол образуется при различных процессах разложения сераорганических соединений, в первую очередь — при гниении белков, в состав которых входят серосодержащие аминокислоты — цистеин и метионин. Он находится также в испражнениях и кишечных газах человека и животных, придавая им вместе со скатолом и другими тиолами неприятный запах.
Синтез
[править | править код]В промышленности метантиол синтезируют из метанола и сероводорода, используя в качестве катализатора диоксид тория, нанесенный на оксид алюминия в количестве 5—12 %, или кобальт — диоксид тория, при температуре 316—468 °С.
Применение
[править | править код]Метантиол используется в производстве аминокислоты метионина, использующейся в качестве кормовой добавки, из акролеина .
На первой стадии присоединением метантиола к акролеину синтезируют 3-метилтиопропионовый альдегид:
который далее используется в качестве карбонильного компонента в синтезе Штреккера:
Метантиол применяется при синтезе пестицидов и фунгицидов.
Метантиол также применяется в качестве одорирующей добавки к природному газу, используемому в быту для обнаружения людьми аварийных утечек природного бытового газа по запаху[7].
Опасность
[править | править код]Метантиол ядовит, относится ко 2-му классу опасности. Максимальная разовая ПДК для атмосферного воздуха населенных мест составляет 0,006 мг/м3[8].
См. также
[править | править код]Примечания
[править | править код]- ↑ 1 2 Источник: https://fireman.club/inseklodepia/metilmerkaptan-metantiol/ Архивная копия от 27 сентября 2019 на Wayback Machine Метилмеркаптан (метантиол). Аварийная карточка
- ↑ 1 2 ГОСТ 30319.1-96 Газ природный. Методы расчета физических свойств. Дата обращения: 2 октября 2019. Архивировано 27 сентября 2019 года.
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0425.html
- ↑ ГН 2.1.6.2326-08 Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест. Дополнение N 4 к ГН 2.1.6.1338-03
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Devos, M; F. Patte, J. Rouault, P. Lafort, L. J. Van Gemert (1990). Standardized Human Olfactory Thresholds. Oxford: IRL Press. p. 101. ISBN 0-19-963146-8
- ↑ Schlager N., Weisblatt J., Newton D. E. Methyl Mercaptan — Chemical Compounds. — Thomson Gale. — 2006. — vol.2 — p. p. 455—457.
- ↑ Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест. Дополнение 4 к ГН 2.1.6.1338-03. Дата обращения: 24 июля 2017. Архивировано из оригинала 21 мая 2015 года.