Сульфат натрия: различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
Бубун2957 (обсуждение | вклад) Добавление информации Метки: через визуальный редактор с мобильного устройства из мобильной версии |
|||
| (не показано 56 промежуточных версий 42 участников) | |||
| Строка 1: | Строка 1: | ||
{{Вещество |
{{Вещество |
||
| картинка = Sodium sulfate.png |
| картинка = Sodium sulfate.png |
||
| картинка3D |
| картинка3D = |
||
| изображение = Sodium sulfate.jpg |
|||
| картинка малая = |
| картинка малая = |
||
| хим. имя = сульфат натрия, натрий сернокислый |
| хим. имя = сульфат натрия, натрий сернокислый |
||
| ⚫ | |||
| ⚫ | |||
| традиционные названия = [[глауберова соль]], [[тенардит]] |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| рац. формула = Na{{sub|2}}SO{{sub|4}} |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| кинематическая вязкость = |
| кинематическая вязкость = |
||
| теплоёмкость = |
| теплоёмкость = |
||
| энтальпия образования = −1387,9 |
| энтальпия образования = −1387,9 |
||
| теплота парообразования = |
| теплота парообразования = |
||
}} |
}} |
||
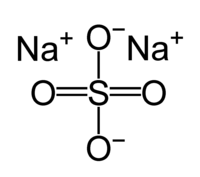
'''Сульфат натрия''', сернокислый натрий, Na<sub>2</sub>SO<sub>4</sub> — [[натрий|натриевая]] [[соль]] [[серная кислота|серной кислоты]]. |
'''Сульфат натрия''', сернокислый натрий, Na<sub>2</sub>SO<sub>4</sub> — [[натрий|натриевая]] [[соль]] [[серная кислота|серной кислоты]]. Это бесцветные [[кристаллы]], хорошо растворяющиеся в [[Вода|воде]], образует [[кристаллогидраты]], самый известный из них — [[Глауберова соль|декагидрат]], получивший традиционное название — «[[глауберова соль]]». Обладает низкой токсичностью. Относится к классу средних солей. Не путать с [[Гидрокарбонат натрия|питьевой содой]] — [[Гидрокарбонаты|гидрокарбонатом]] натрия, [[Кислые соли|кислой]] натриевой солью [[Угольная кислота|угольной кислоты]]. |
||
== Свойства == |
== Свойства == |
||
Бесцветные кристаллы. Безводный Na<sub>2</sub>SO<sub>4</sub> устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется [[кристаллогидрат]] Na<sub>2</sub>SO<sub>4</sub>·10H<sub>2</sub>O. |
Бесцветные кристаллы. Безводный Na<sub>2</sub>SO<sub>4</sub> устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии [[Вода|воды]] образуется [[кристаллогидрат]] Na<sub>2</sub>SO<sub>4</sub>·10H<sub>2</sub>O. |
||
* При высоких температурах восстанавливается до [[Сульфид натрия|сульфида натрия]] методом [[Карботермия|карботермии]] (нагреванием с [[Углерод|углем]]): |
|||
*: <chem>Na2SO4 + 2 C -> Na2S + 2 CO2 ^</chem> |
|||
* Раствор сульфата натрия реагирует с растворами солей [[барий|бария]] (например, [[хлорид бария|BaCl<sub>2</sub>]]), образуя нерастворимый [[сульфат бария]]: |
|||
*: <chem>BaCl2 + Na2SO4 -> BaSO4 v + 2 NaCl</chem> |
|||
== Нахождение в природе == |
== Нахождение в природе == |
||
В природе безводный сульфат натрия встречается в виде минерала [[тенардит]]а. Кристаллогидрат Na<sub>2</sub>SO<sub>4</sub>·10H<sub>2</sub>O образует минерал [[мирабилит]] ([[глауберова соль|глауберову соль]]). Встречаются также [[двойные соли]] сульфата натрия с другими сульфатами, например [[астраханит]] Na<sub>2</sub>SO<sub>4</sub>·MgSO<sub>4</sub>·4H<sub>2</sub>O, [[глауберит]] Na<sub>2</sub>SO<sub>4</sub>·CaSO<sub>4</sub>. Значительные количества сульфата натрия содержатся в [[рапа|рапе]] и донных отложениях солёных озёр хлорид-сульфатного типа и заливе [[Кара Богаз Гол|Кара-Богаз-Гол]]. В них при понижении температуры идёт реакция: |
В природе безводный сульфат натрия встречается в виде минерала [[тенардит]]а. Кристаллогидрат Na<sub>2</sub>SO<sub>4</sub>·10H<sub>2</sub>O образует минерал [[мирабилит]] ([[глауберова соль|глауберову соль]]). Встречаются также [[двойные соли]] сульфата натрия с другими сульфатами, например [[астраханит]] Na<sub>2</sub>SO<sub>4</sub>·MgSO<sub>4</sub>·4H<sub>2</sub>O, [[глауберит]] Na<sub>2</sub>SO<sub>4</sub>·CaSO<sub>4</sub>. Значительные количества сульфата натрия содержатся в [[рапа|рапе]] и донных отложениях солёных озёр хлорид-сульфатного типа и заливе [[Кара Богаз Гол|Кара-Богаз-Гол]]. В них при понижении температуры идёт реакция: |
||
2NaCl + MgSO<sub>4</sub> ⇆ MgCl<sub>2</sub> + Na<sub>2</sub>SO<sub>4</sub> |
: 2NaCl + MgSO<sub>4</sub> ⇆ MgCl<sub>2</sub> + Na<sub>2</sub>SO<sub>4</sub> |
||
В России крупнейшим производителем природного сульфата натрия является компания [[Кучуксульфат| |
В России крупнейшим производителем природного сульфата натрия является компания [[Кучуксульфат|ПАО «Кучуксульфат»]] — 600 тыс. тонн в год. |
||
== Получение == |
== Получение == |
||
Промышленный способ получения сульфата натрия — взаимодействие [[хлорид натрия|NaCl]] с [[серная кислота|H<sub>2</sub>SO<sub>4</sub>]] в специальных «сульфатных» печах при 500—550 °C; одновременно получается [[хлороводород]]. |
Промышленный способ получения сульфата натрия — взаимодействие [[хлорид натрия|NaCl]] с [[серная кислота|H<sub>2</sub>SO<sub>4</sub>]] в специальных «сульфатных» печах при 500—550 °C; одновременно получается [[хлороводород]]. |
||
: <chem>2 NaCl + H2SO4 -> Na2SO4 + 2 HCl</chem> |
|||
<math>\mathsf{2NaCl + H_2SO_4 \longrightarrow Na_2SO_4 + 2HCl}</math> |
|||
В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья. |
В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы [[Полезные ископаемые|природного сырья]]. |
||
Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика. |
Также сульфат натрия получается как отход (не имеющий запаха) в производстве [[Дихромат калия|хромпика]]. |
||
== Применение == |
== Применение == |
||
В мире большое количество сульфата натрия использовались ранее при производстве [[синтетическое моющее средство|синтетических моющих средств]], однако во многих странах в последние годы произошёл переход на концентрированные (компактные) [[стиральный порошок|стиральные порошки]], в которых сульфат либо не используется, либо используется в небольших количествах. В России производители стиральных порошков закупают более 300 |
В мире большое количество сульфата натрия использовались ранее при производстве [[синтетическое моющее средство|синтетических моющих средств]], однако во многих странах в последние годы произошёл переход на концентрированные (компактные) [[стиральный порошок|стиральные порошки]], в которых сульфат либо не используется, либо используется в небольших количествах. В России производители стиральных порошков закупают более 300 тысяч тонн сульфата натрия. |
||
Второе по количеству применение сульфата натрия — стекольное производство. Также это вещество используют в больших объёмах при получении [[целлюлоза|целлюлозы]] сульфатным методом, а также в [[Текстильная промышленность|текстильной]], [[кожевенная промышленность|кожевенной промышленности]] и в [[цветная металлургия|цветной металлургии]]. |
Второе по количеству применение сульфата натрия — стекольное производство. Также это вещество используют в больших объёмах при получении [[целлюлоза|целлюлозы]] сульфатным методом, а также в [[Текстильная промышленность|текстильной]], [[кожевенная промышленность|кожевенной промышленности]] и в [[цветная металлургия|цветной металлургии]]. |
||
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: |
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем [[сульфат магния]], многие предпочитают именно это средство по двум причинам: дешевизна и легкость фильтрации. |
||
В ещё меньших количествах ранее использовался в медицине и ветеринарии в качестве солевого [[слабительное|слабительного]] средства и как компонент в средствах для промывания носа. |
В ещё меньших количествах ранее использовался в медицине и ветеринарии в качестве солевого [[слабительное|слабительного]] средства и как компонент в средствах для промывания носа. |
||
Водные растворы сульфата натрия используются для лечения отравления растворимыми солями [[барий|бария]]. |
|||
Зарегистрирован в качестве [[Пищевые добавки|пищевой добавки]] '''E514'''. |
|||
Зарегистрирован в качестве [[Пищевые добавки|пищевой добавки]] '''E514'''.<br>Регулятор кислотности, используется как буферная добавка поддерживающая [[Водородный показатель|pH]] на определённом уровне<ref>{{Cite web |url=https://prodobavki.com/dobavki/E514.html |title=Сульфаты натрия<!-- Заголовок добавлен ботом --> |access-date=2019-02-02 |archive-date=2019-02-02 |archive-url=https://web.archive.org/web/20190202212234/https://prodobavki.com/dobavki/E514.html |deadlink=no }}</ref>. |
|||
== Физиологическое действие и указания по технике безопасности == |
|||
Сульфат натрия Na{{sub|2}}SO{{sub|4}} пожаро- и взрывобезопасен. По степени воздействия на организм человека натрий сернокислый относится к IV [[Класс опасности|классу опасности]] (малоопасные вещества) согласно ГОСТ 12.1.007-76. По токсикологии NFPA 704 сульфату натрия присвоена '''низшая''' [[токсичность]]. |
|||
== См. также == |
== См. также == |
||
* [[Глауберова соль]] |
* [[Глауберова соль]] |
||
== Примечания == |
|||
{{примечания}} |
|||
== Литература == |
== Литература == |
||
* ''Реми Г.'' Курс неорганической химии. Т.2. — М., 1966 |
* ''Реми Г.'' Курс неорганической химии. Т.2. — М., 1966 |
||
{{Навигация}} |
|||
== Ссылки == |
== Ссылки == |
||
{{Нормативный контроль}} |
|||
* [http://www.xumuk.ru/encyklopedia/2/2779.html Химик.ру] |
|||
{{Сульфаты}} |
|||
{{Соединения натрия}} |
|||
[[Категория:Сульфаты|Н]] |
[[Категория:Сульфаты|Н]] |
||
[[Категория:Пищевые добавки]] |
[[Категория:Пищевые добавки]] |
||
Текущая версия от 14:57, 1 октября 2024
| Сульфат натрия | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
сульфат натрия, натрий сернокислый |
| Традиционные названия | глауберова соль, тенардит |
| Хим. формула | Na2SO4 |
| Рац. формула | Na2SO4 |
| Физические свойства | |
| Состояние | белые гигроскопичные кристаллы |
| Молярная масса | 142,04 г/моль |
| Плотность | 2,68 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 883 °C |
| Энтальпия | |
| • образования | −1387,9 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 19,2 (20 °C), 42,3 (100 °C) |
| Классификация | |
| Рег. номер CAS | 7757-82-6 |
| PubChem | 24436, 516914 и 139036570 |
| Рег. номер EINECS | 231-820-9 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E514(i) и E514 |
| RTECS | WE1650000 |
| ChEBI | 32149 |
| ChemSpider | 22844 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат натрия, сернокислый натрий, Na2SO4 — натриевая соль серной кислоты. Это бесцветные кристаллы, хорошо растворяющиеся в воде, образует кристаллогидраты, самый известный из них — декагидрат, получивший традиционное название — «глауберова соль». Обладает низкой токсичностью. Относится к классу средних солей. Не путать с питьевой содой — гидрокарбонатом натрия, кислой натриевой солью угольной кислоты.
Свойства
[править | править код]Бесцветные кристаллы. Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10H2O.
- При высоких температурах восстанавливается до сульфида натрия методом карботермии (нагреванием с углем):
- Раствор сульфата натрия реагирует с растворами солей бария (например, BaCl2), образуя нерастворимый сульфат бария:
Нахождение в природе
[править | править код]В природе безводный сульфат натрия встречается в виде минерала тенардита. Кристаллогидрат Na2SO4·10H2O образует минерал мирабилит (глауберову соль). Встречаются также двойные соли сульфата натрия с другими сульфатами, например астраханит Na2SO4·MgSO4·4H2O, глауберит Na2SO4·CaSO4. Значительные количества сульфата натрия содержатся в рапе и донных отложениях солёных озёр хлорид-сульфатного типа и заливе Кара-Богаз-Гол. В них при понижении температуры идёт реакция:
- 2NaCl + MgSO4 ⇆ MgCl2 + Na2SO4
В России крупнейшим производителем природного сульфата натрия является компания ПАО «Кучуксульфат» — 600 тыс. тонн в год.
Получение
[править | править код]Промышленный способ получения сульфата натрия — взаимодействие NaCl с H2SO4 в специальных «сульфатных» печах при 500—550 °C; одновременно получается хлороводород.
В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья.
Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика.
Применение
[править | править код]В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств, однако во многих странах в последние годы произошёл переход на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах. В России производители стиральных порошков закупают более 300 тысяч тонн сульфата натрия.
Второе по количеству применение сульфата натрия — стекольное производство. Также это вещество используют в больших объёмах при получении целлюлозы сульфатным методом, а также в текстильной, кожевенной промышленности и в цветной металлургии.
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешевизна и легкость фильтрации.
В ещё меньших количествах ранее использовался в медицине и ветеринарии в качестве солевого слабительного средства и как компонент в средствах для промывания носа.
Водные растворы сульфата натрия используются для лечения отравления растворимыми солями бария.
Зарегистрирован в качестве пищевой добавки E514.
Регулятор кислотности, используется как буферная добавка поддерживающая pH на определённом уровне[1].
Физиологическое действие и указания по технике безопасности
[править | править код]Сульфат натрия Na2SO4 пожаро- и взрывобезопасен. По степени воздействия на организм человека натрий сернокислый относится к IV классу опасности (малоопасные вещества) согласно ГОСТ 12.1.007-76. По токсикологии NFPA 704 сульфату натрия присвоена низшая токсичность.
См. также
[править | править код]Примечания
[править | править код]- ↑ Сульфаты натрия. Дата обращения: 2 февраля 2019. Архивировано 2 февраля 2019 года.
Литература
[править | править код]- Реми Г. Курс неорганической химии. Т.2. — М., 1966



